Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одновременное измерение HDAC1 и HDAC6 активности в НеЬа клетки с помощью UHPLC-MS
В этой статье
Резюме
Нынешний метод служит для идентификации изоформы специфичные Ингибиторы гистоновых комплексы (HDAC) в клетки HeLa UHPLC-MS анализ нескольких субстратов. Это антитела, свободной метод разработан для отражения активности HDAC1 и HDAC6 в живых клеток окружающей среды, в отличие от одного изоформы клеток бесплатные анализы.
Аннотация
Поиск новых Ингибиторы гистоновых деацетилаз (ГДАЦ) имеет повышенный интерес в лекарственных препаратах. Избирательность изоформы был в центре внимания после утверждения romidepsin, класс я HDAC ингибиторов для терапии рака и клиническое исследование HDAC6-специфические ингибиторы множественной миеломы. Нынешний метод используется для определения ингибиторная активность соединений тест на HDAC1 и HDAC6 в клетках. Изоформы активность измеряется с помощью жидкостной хроматографии ультра-высокой производительности – масс-спектрометрия (UHPLC-МС) анализ конкретных субстратов, инкубировали с обработанных и необработанных НеЬа клетки. Этот метод имеет преимущество отражающие действие эндогенного HDAC в среде клетки, в отличие от свободных клеток биохимических анализов, проведенных на отдельных изоформ. Кроме того потому что он основан на количественной оценке синтетических субстратов, метод не требует признания антитела эндогенного ацетилированный белков. Он легко адаптируется к несколько клеточных линий и автоматизированный процесс. Этот метод уже оказался полезным в поиске HDAC6-селективные соединений в нейробласты. Представитель результаты отображаются здесь с стандартным HDAC ингибиторов трихостатин (неспецифические), MS275 (HDAC1-специфические), и tubastatin (HDAC6-специфические) с использованием клеток HeLa.
Введение
Гда принадлежат к семейству ферментов, возможность deacetylate гистонами в структуре хроматина. Они также имеют другие белковых субстратов в цитозоле и расположены в различных клеточных компартментов. В общей сложности 18 HDAC изоформ до настоящего времени были определены и были связаны с нескольких клеток механизмов, включая регулирование факторов транскрипции и экспрессии генов, а также сигнализации ячейки и транспорта1,2,3,4,5,6,7. Каталитического ингибиторы ГДАЦ появились как потенциальных лекарственных препаратов для терапии рака. Большинство ингибиторы ГДАЦ, в настоящее время одобрен FDA для лечения Т-клеточной лимфомы и множественной миеломы и ингибиторы ГДАЦ неспецифической, например vorinostat (Саха), belinostat и panobinostat8,9. Однако целый ряд побочных эффектов были связаны с Пан ингибиторы, и поиск для конкретных изоформы малых молекул является горячей темой в лекарственных химии и наркотики discovery. Соответственно, класс I (HDAC1-3 и HDAC8) селективный ингибитор romidepsin является уже утвержденных наркотиков10, HDAC6-специфические ингибиторы в настоящее время в клинических испытаниях, с повышенной терапевтический потенциал множественной миеломы11,12,13,14,15.
Скрининг анализов характеризовать HDAC ингибиторов основаны на инкубацию HDAC субстрата с источником ферментативный (один изоформы, ядерной экстракт или lysate клетки). Субстрат, как правило небольших пептидных последовательность, содержащую ацетил лизин остатков в сочетании с горные Флюорофор (например, кумарина), например N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (MAL)16. Различать изоформы конкретных мероприятий, отдельных свободных клеток с участием каждого изоформы необходимы и могут не отражать реальный изоформы активность в живых клетках. Изоформы специфических субстратов коммерчески доступны, такие как бензил (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (MOCPAC, HDAC1 конкретного субстрата) и (S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic кислота трет бутилового эфира (BATCP, HDAC6 конкретного субстрата) (рис. 1B). Однако, мульти субстрат смесь, содержащую мал, MOCPAC и BATCP для живых клеток не допустит обнаружения отдельных deacetylated продуктов флуориметрический измерения, учитывая, что они несут же горные Флюорофор.
Метод, описанный здесь позволяет для обнаружения и относительной количественная оценка каждого субстрата и его deacetylated продукта в НеЬа клетки с использованием мульти субстрат пробирного следуют UHPLC-ЭСИ-MS/MS анализ17. HDAC assay проводится на клетки HeLa для прямой идентификации HDAC ингибиторная активность и специфичность тест соединений на эндогенных гда. Существует акцент на HDAC1 и HDAC6, которые оцениваются одновременно. Для достижения этих ферментативные измерений в одном инкубации assay, смесь неспецифические и специфические субстраты HDAC добавляется обработанных и необработанных клетки HeLa, покрытием на 96-луночных тарелку. После инкубации шаг клетки являются лизированы выпустить субстратов и продукты их соответствующей реакции, которые разделены и обнаружить с помощью метода UHPLC-мс (рис. 1 c). Deacetylated мал, MOCPAC и BATCP субстратов продукция deacetylated мал (dMAL), deacetylated MOCPAC (dMOCPAC) и deacetylated BATCP (dBATCP), соответственно. Доза реакция кривых могут быть построены с активных соединений.
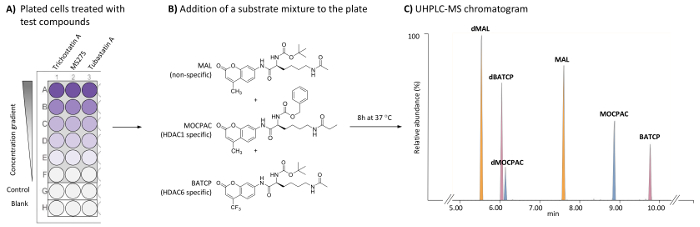
Рисунок 1: Общая схема на основе ячеек HDAC проба для выявления HDAC1 и HDAC6-специфичные ингибиторы UHPLC-MS анализ нескольких субстратов. (A) схема типичной 96-луночных пластины, содержащей лечение (тест соединения) и клетки HeLa неочищенные (управления), а также пустые ячейки бесплатно. (B) Химическая структура субстратов, добавляется как смесь (по 21 мкм) быть deacetylated путем эндогенного гда. (C) типичный UHPLC-MS Хроматограмма показаны вершин добавлена субстратов (MAL, MOCPAC и BATCP) и их deacetylated продуктов (dMAL, dMOCPAC и dBACTP, соответственно). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Access restricted. Please log in or start a trial to view this content.
протокол
1. клеточная культура
Примечание: Следующие шаги выполняются в стандартной культуры ткани капюшоном. Знакомство с стерильных ожидается.
- Культура клетки HeLa в 80% confluency в колбе культуры клеток T75 в MEM, дополнена 10% плода бычьим сывороточным, пенициллина G (100 ед/мл) и стрептомицин (100 мг/мл).
Примечание: Культуры клеток, лечение и лизис шаги проводятся под ламинарным потоком, с шагов инкубации клеток при 37 ° C, в атмосфере увлажненные 5% CO2 в стерильных условиях. - Вымыть клетки дважды с 5 мл DPBS, аспирационная DPBS и добавьте 1 mL реагента диссоциации клеток. Инкубируйте при 37 ° C за 5 мин до отсоединения клетки.
- Добавить 9 мл MEM питательной среды, тщательно Ресуспензируйте суспензию клеток и подсчитать количество ячеек с помощью Горяева.
- Регулировка плотности суспензии клеток до 6 x 104 клеток/мл в MEM.
- 100 мкл суспензии клеток для контроля и тестирования скважины стерильные, с плоским дном, культуры тканей лечение 96-луночных пластины (Рисунок 1A).
- 100 мкл MEM питательной среды, в пустой скважин 96-луночных пластины (рис. 1A).
- Инкубируйте 96-луночных пластины при 37 ° C в течение 24 ч.
Примечание: 24 ч инкубации это подходящее время для проверки эндогенного HDAC активность клеток HeLa. Различных типов клеток с неизвестным HDAC активности может понадобиться timecourse оценки управления клеток.
2. клеток лечение с испытания соединений и HDAC субстратов
- Аспирационная среднего из скважин 96-луночных пластины.
- 25 мкл 2 x тест соединения (например, трихостатин A, MS275 и tubastatin A) в MEM для тестирования скважины. 25 мкл MEM, управления и пустой скважин.
Примечание: Концентрация соединений теста является корректироваться предоставлять широкий спектр по крайней мере 5 финальный тест концентрации (одна концентрация на хорошо). Конечная концентрация ДМСО в составные теста не должна превышать 0,5% и должен быть одинаковым в каждой скважины, включая пробелы и элементы управления. Окончательный инкубации объем-50 мкл в колодец. A трихостатин проверяется на 5 концентрациях от 500 до 1,95 Нм (разбавления 1:4). MS275 и tubastatin A тестируются на 5 концентрациях от 8000 до 6.17 Нм (разбавления 1:6). Концентрация желаемого финального теста для каждого испытания комплекса должны определяться каждого отдельного пользователя, создавая кривой доза ответ. - 25 мкл смеси субстрата (42 µM ТЗА, 42 µM MOCPAC и 42 µM BATCP в мкм), для контроля и испытания скважин. 25 мкл MEM, пустой скважин.
Примечание: Конечная концентрация каждого субстрата-21 микрон. MOCPAC и BATCP различие между HDAC1 и HDAC6 активности, соответственно (рис. 1B). Когда никакой активности наблюдается с этих поверхностей, использование MAL потенциально может привести к идентификации деятельности против другой HDAC изоформы. - Инкубировать 96-луночных пластины при 37 ° C в течение 8 ч в увлажненные 5% CO2 инкубатора.
Примечание: Этот время инкубации подходит для НеЬа клетки и позволяет эндогенного HDAC взаимодействовать с синтетических субстратов. Различных клеточных линий может потребовать корректировки концентрации инкубации время и/или субстрат.
3. сотовый Lysis и Пробоподготовка для UHPLC-ЭСИ MS/MS
Предупреждение: Шаги подготовки образца использовать органические химические вещества, которые являются высоко горючих и токсичных путем вдыхания или проглатывания. Надевайте соответствующую личной защиты, таких как перчатки и защитные очки.
- 10 мкл 6 x RIPA буфера (разбавленный от 10 x RIPA буфера) дополнены ингибитор протеазы для каждой скважины 96-луночных пластины.
- Остановить реакции, добавив 160 мкл холодной Ацетонитрил для каждой скважины и смешивать, закупорить вверх и вниз.
Примечание: Держите Ацетонитрил в-20 ° C до этого шага. - Место пластину в морозильной камере-80 ° С за 10 мин.
- Снять пластину из морозильника и передачи 220 мкл содержание каждой скважины нестерильные, конические-(V-внизу) 96-луночных днище. Центрифуга пластину на 5000 x g и 4 ° C на 10 мин.
Примечание: Этот шаг направлен на устранение соли и белки. При необходимости, решения может быть переданы отдельным конические пробирок до центрифугирования или фильтруют через набор 96-луночных, 0,65 мкм PVDF фильтра плиты. До UHPLC анализа требуется успешное удаление осадка. - Перевести 200 мкл супернатант (или фильтрата) на плиту 96-луночных совместима с системой UHPLC и запечатать его с отслаивающейся, термосвариваемый фольги, используя герметик пластины.
Примечание: Избегайте закупорить гранул при удалении supernatants. Если UHPLC анализ не может быть выполнена сразу, пластины могут храниться при температуре 4 ° C максимум 24 часа до анализа.
4. UHPLC/МС МС анализ
- Подготовьте систему UHPLC, заполнив его с системой мобильных фазы (95% A:5% B):
A: H2O, ВЭЖХ класс, содержащий 0.1% муравьиной кислоты (подготовить 1 Л)
B: ацетонитриле, ВЭЖХ класс, содержащий 0.1% муравьиной кислоты (подготовить 1 Л).
Внимание: Мобильные этап содержит органических химических веществ, которые являются высоко горючих и токсичных путем вдыхания или проглатывания. Надевайте соответствующую личной защиты, таких как перчатки и защитные очки. - Место пластину 96-луночных в образец менеджер, содержащие пластину держателя. Выполнение примеров согласно условиям UHPLC-ЭСИ-MS/MS, приводятся в таблице 1.
Примечание: Каждый столбец аналитической 96-луночных плиты должны иметь один элемент управления хорошо и один пустой колодец (как показано на схеме пластина Рисунок 1A). Элементы управления являются представитель ферментативную активность 100% в строке протестированных клеток, в то время как пробелы существуют, чтобы проверить, обеспечивает ли источник MS последовательной фона. Необычные пики MS, обнаружены в данный бланк должен быть проверен для предотвращения изменения чувствительности MS.
5. анализ данных
- Интегрируйте площади пика каждого субстрата и его deacetylated продукта с соответствующим программным обеспечением интеграции UHPLC.
Примечание: Используйте параметры автоматической интеграции с сглаживание методом (среднее, размер окна 3 и количество гладких 2, например). С помощью хроматографических условий, предусмотренных в таблице 1, элюирование заказ dMAL (5,8 мин), dBATCP (6.0 мин), dMOCPAC (6,2 мин), мал (7.6 мин), MOCPAC (8,9 мин) и BATCP (9,8 мин), как показано на рисунке 1 c. - Для каждого субстрата Вычислите отношение площади пика (deacetylated/ацетилированные) в каждой хроматограммы (образцы испытания и контроль).
- Рассчитайте процент HDAC торможение каждого испытательного образца:
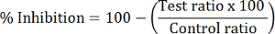
Примечание: HDAC1 торможения рассчитывается с помощью пик соотношение dMOCPAC/MOCPAC; HDAC6 торможения рассчитывается с dBATCP/BATCP. Соотношение dMAL/MAL может использоваться для выражения общего HDAC ингибирование.
Access restricted. Please log in or start a trial to view this content.
Результаты
Чтобы продемонстрировать применение метода для выявления неизбирательной и выборочной ингибиторов для HDAC1 (класс I) и HDAC6 (класс IIb), клетки НеЬа были относиться с известных стандартных соединений: трихостатин A (неизбирательной между HDAC1 и HDAC6)18, MS275 (HDAC1-селе?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Ингибирование HDAC является горячей темой в лекарственных препаратах, с текущей упором на HDAC6-селективных ингибиторов для рака терапии21. HDAC селективность обычно оценивается серия высокой пропускной способностью, клетки бесплатные анализы, которые намерены определить инги?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Авторы признают стоимость действий CM1406 (эпигенетическими химической биологии). Исследования в этой публикации была поддержана Фондом Пьер Мерсье.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10x RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
Ссылки
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs? Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- U.S. National Institutes of Health. Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215). , Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211).
- U.S. National Institutes of Health. Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012).
- U.S. National Institutes of Health. 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013).
- U.S. National Institutes of Health. Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015).
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935(2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -J., Velena, A., Lee, S. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. Sippl, W., Jung, M. , Wiley-VCH. (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. Evaluation of enzyme inhibitors in drug discovery. , Wiley. (2005).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены