JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
헬러의 HDAC1 및 HDAC6의 동시 측정 셀 사용 하 여 UHPLC MS
요약
현재 메서드 여러 기판의 UHPLC MS 분석에 의해 HeLa 세포에서 히스톤 deacetylases (HDAC)의 isoform 특정 억제제를 식별 하는 역할. 이것은 생활에서 HDAC1 및 HDAC6 활동을 반영 하기 위해 개발 된 항 체 없는 메서드를 단일 isoform 셀 무료 분석 달리 셀 환경.
초록
새로운 히스톤 deacetylase (HDAC) 억제제에 대 한 검색 증가 약물 발견에 대 한 관심입니다. Isoform 선택 romidepsin, 클래스의 승인부터 스포트 라이트에서 되었습니다 내가 HDAC 억제제 암 치료, 그리고 여러 발성에 대 한 HDAC6 전용 억제제의 임상 조사에 대 한. 현재 메서드는 HDAC1 및 HDAC6 셀에 테스트의 금지 활동을 결정 하는 데 사용 됩니다. Isoform 활동 초 고성능 액체 크로마토그래피-질량 분석 (MS UHPLC) 분석의 특정 기판 처리와 치료 HeLa 세포와 알을 품을 사용 하 여 측정 됩니다. 메서드는 환경 내에서 셀 셀 무료 생 화 확 적인 분석 실험 격리 isoforms에 달리 생 HDAC 활동 반영의 이점이 있다. 또한, 합성 기판의 정량화에 기반 하기 때문에 메서드는 생 acetylated 단백질의 항 체 인식이 필요 하지 않습니다. 그것은 쉽게 여러 셀 라인 및 자동화 된 프로세스에 적응입니다. 메서드는 이미 neuroblasts에서 HDAC6-선택적 화합물을 찾는 유용한 증명 했다. 대표 결과 표준 HDAC 억제제 trichostatin는 (일반적인), MS275 이전으로 여기에 표시 됩니다 (HDAC1 전용), 및 tubastatin (HDAC6-특정) 헬러 세포를 사용 하 여.
서문
HDACs 효소 chromatin 구조 내에서 히스톤 deacetylate 수의 가족에 속한다. 그들은 또한 다른 단백질 기판은 cytosol에서 있고 다양 한 셀 구획에 있습니다. 18 HDAC isoforms의 총 세포 신호 뿐만 아니라 녹음 방송 요인 유전자 발현의 규칙을 포함 하 여 몇 가지 셀 메커니즘에 관련 된 고1,2,3,,45,,67수송 지금까지 확인 된. HDAC 촉매 억제제는 암 치료에 대 한 잠재적인 치료 약물으로 떠오르고 있다. 현재 FDA에 의해 승인 대부분 HDAC 억제제 T-세포 림프 종 및 다 발성의 치료에 대 한 되며 vorinostat (사), belinostat, panobinostat,89등 일반적인 HDAC 저 해제. 그러나, 부작용의 시리즈 팬-억제제, 연관 된 고 isoform 특정 작은 분자에 대 한 검색의 약 화학과 약물 발견에 뜨거운 주제입니다. 따라서, 클래스 I (HDAC1-3와 HDAC8) 선택적 억제제 romidepsin는 이미 승인 된 약10, HDAC6 특정 억제제는 현재 임상 시험, 다중 골 수 종11,12,13,,1415에 증가 치료 잠재력.
HDAC 특성 분석 실험 심사 억제제 (단일 isoform, 핵 추출 물, 또는 세포 lysate) 효소 소스와 HDAC 기판의 외피에 근거한 다. 기판은 일반적으로 N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (말)16등 쪼갤 fluorophore (예: coumarin), 결합 틸 리 진 잔류물을 포함 하는 작은 펩 티 드 순서. Isoform 특정 활동을 구분 하기 위해 각 isoform를 포함 하는 별도 셀 무료 분석 필요 하 고 살아있는 세포에서 진짜 isoform 활동을 반영 하지 않을 수도 있습니다. Isoform 특정 기판 벤 질 등 상업적으로 사용할 수 있습니다 (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (MOCPAC, HDAC1 특정 기판)와 (S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic 산 tert-부 틸 에스테 르 (BATCP, HDAC6 특정 기판) (그림 1B). 그러나, 말을 포함 하는 다중 기판 혼합물, MOCPAC, 및 BATCP 살아있는 세포에 게 주어진 것입니다 허용 하지 개별 deacetylated 제품의 탐지 fluorometric 측정에 의해 그들은 동일한 쪼갤 fluorophore를 품는.
여기 설명 하는 방법을 검색 및 각 기판 및 UHPLC-ESI-MS/MS 분석17다음 멀티 기판 분석 결과 사용 하 여 헬러 세포에 그것의 deacetylated 제품의 상대적 정량화 할 수 있습니다. HDAC 분석 결과 HDAC 억제 활동의 및 내 인 성 HDACs에 시험 화합물의 특이성의 직접 식별 수 있도록 HeLa 세포에 실시 됩니다. 동시에 평가 되는 HDAC1 및 HDAC6에 초점이 이다. 위해 단일 외피 분석 결과에서 이러한 효소 측정, 비 및 특정 HDAC 기판의 혼합물 96 잘 접시에 도금 처리와 치료 HeLa 세포에 추가 됩니다. 인큐베이션 단계 세포는 기질 및 그들의 각각 반응 제품을 구분 되 고 UHPLC MS 메서드 (그림 1C)을 사용 하 여 검출 하 lysed 됩니다. 말, MOCPAC, 및 BATCP 기판의 deacetylated 제품 이다 deacetylated 말 (dMAL), deacetylated MOCPAC (dMOCPAC), 그리고 deacetylated BATCP (dBATCP), 각각. 복용량 응답 곡선 활성 화합물으로 만들 수 있습니다.
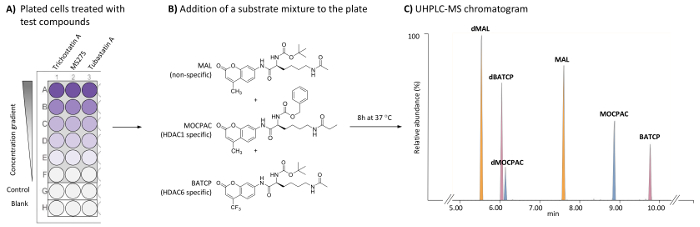
그림 1: 여러 기판의 UHPLC MS 분석에 의해 HDAC1 및 HDAC6 관련 억제제를 식별 하기 위해 셀 기반 HDAC 분석 결과 대 한 일반적인 구성표. 전형적인 96 잘 접시 포함 하는 치료 (시험 화합물)의 (A) 체계 및 치료 (제어) 헬러 세포 뿐 아니라 셀 무료 공백. (B) 기판 내 생 HDACs에 의해 deacetylated 혼합 (21 µ M 각)으로 추가의 화학 구조. (C) 추가 기판 (말, MOCPAC, 및 BATCP) 및 그들의 deacetylated 제품의 봉우리를 보여주는 전형적인 UHPLC-MS 크로마 (dMAL, dMOCPAC, 그리고 dBACTP, 각각). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
프로토콜
1. 세포 배양
참고: 다음 단계는 표준 조직 문화 후드에서 수행 됩니다. 메 마른 기술 친숙으로 예상 된다.
- 헬러 세포 10% 태아 둔감 한 혈 청, 페니실린 G 보충 MEM에 T75 셀 문화 플라스 크에서 80 %confluency 문화 (100 U/mL), 고 스 (100mg/mL).
참고: 셀 문화, 치료, 그리고 세포 단계 층 류, 5% CO2 메 마른 조건 하에서 습도 분위기에서 수행 하는 37 ° C에서 셀 인큐베이션 단계에서 수행 됩니다. - DPBS의 5 mL로 두 번 셀을 세척 하 고 발음 DPBS, 세포 분리 시 약의 1 mL을 추가. 셀을 분리 하려면 5 분 동안 37 ° C에서 품 어.
- MEM 문화 매체의 9 mL를 추가, 철저 하 게 셀 서 스 펜 션, resuspend 하 고는 hemocytometer를 사용 하 여 셀.
- 6 x 104 셀/ml MEM에 세포 현 탁 액의 밀도 조정 합니다.
- 100 µ L 셀 서 스 펜 션의 컨트롤을 추가 하 고 (그림 1A) 살 균, 평면-바닥, 조직 문화 취급 96 잘 접시의 우물을 테스트.
- 96 잘 접시 (그림 1A)의 빈 우물에 MEM 문화 매체의 100 µ L를 추가 합니다.
- 24 h 동안 37 ° C에 96 잘 접시를 품 어.
참고: 24 시간 보육 생 HDAC 활동 HeLa 세포에 대 한 테스트에 적합 한 시간 이다. 알 수 없는 HDAC 활동으로 다른 세포 유형 제어 셀 timecourse 평가 할 수 있습니다.
2. 세포 치료 테스트와 HDAC 기판
- 96 잘 접시의 우물에서 매체 발음
- 추가 테스트 화합물 x 2의 25 µ L (예를 들어, trichostatin, MS275, 및 tubastatin A) 웰 스를 테스트 하려면 메모리에. 제어 및 빈 우물에 MEM의 25 µ L를 추가 합니다.
참고: 테스트 화합물의 농도 이상 5 최종 테스트 농도 (1 농도 잘 당)의 범위를 제공 하기 위해 조정 될 것입니다. 복합 테스트에서 DMSO 최종 농도 0.5%를 넘지 말아야 한다 고에 공백 및 컨트롤을 포함 하 여 각 잘 동일 해야 합니다. 최종 부 화 볼륨 잘 당 50 µ L입니다. Trichostatin A 500에서 1.95에 이르기까지 5 농도에서 테스트 nM (희석 1:4). MS275 및 tubastatin A 8000에서 6.17에 이르기까지 5 농도에서 테스트 nM (1:6 희석). 원하는 최종 테스트 농도 복합 각 테스트에 대 한 복용량 응답 곡선을 작성 하 여 각 개별 사용자에 의해 결정 되어야 합니다. - 제어 및 테스트 웰을 기판 혼합물 (말, MOCPAC의 42 µ M 및 MEM에 BATCP의 42 µ M의 42 µ M)의 25 µ L를 추가 합니다. 빈 우물에 MEM의 25 µ L를 추가 합니다.
참고: 각 기판의 최종 농도 21 µ M. MOCPAC와 BATCP 각각 HDAC1와 HDAC6 활동 사이 구별 (그림 1B). 활동이 그 기판으로 관찰은, 말의 사용 다른 HDAC isoform에 대 한 활동의 식별 잠재적으로 발생할 수 있습니다. - 습도 5%에서 8 h 동안 37 ° C에 96 잘 접시를 품 어 CO2 배양 기.
참고:이 보육 시간 HeLa 세포에 적합 이며 생 HDAC 합성 기질 상호 작용을 수 있습니다. 다른 셀 라인 보육 시간 및 기질 농도 조정 필요할 수 있습니다.
3. 세포 세포의 용 해 및 UHPLC-ESI-MS/MS에 대 한 샘플 준비
주의: 샘플 준비 단계 높은 가연성 및 독성 섭취 또는 흡입에 의해 유기 화학 물질을 사용 합니다. 적절 한 개인 보호 장갑, 보호 안경 등을 착용 합니다.
- 6 x RIPA 버퍼 (10 x RIPA 버퍼에서 희석) 96 잘 접시의 각 음에 protease 억제제와 보충의 10 µ L를 추가 합니다.
- 각 우물에 감기 이기의 160 µ L을 추가 하 여 반응을 중지 하 고 아래로 pipetting으로 혼합.
참고:이 단계 전에-20 ° C에는 이기 유지. - 10 분-80 ° C 냉장고에 접시를 놓습니다.
- 접시를 냉장고에서 제거 하 고-살 균 원뿔 바닥 (V-아래) 96 잘 접시에 220 µ L의 각 콘텐츠를 전송. 5000 x g와 10 분 동안 4 ° C에서 격판덮개 원심
참고:이 단계는 단백질과 염 분 제거에서 목표로 합니다. 필요한 경우 솔루션은 원심 분리 전에 개별 원뿔 원심 분리기 튜브로 전송 하거나 96-글쎄, 0.65 μ m PVDF 필터 플레이트의 집합을 통해 필터링 수 있습니다. 침전의 성공적인 제거는 UHPLC 분석 전에 필요 합니다. - UHPLC 시스템 호환 96 잘 접시에 상쾌한 (또는 여과 액)의 200 µ L를 전송 하 고 peelable, heat-sealing 호 일 접시 마감재를 사용 하 여 그것을 봉인.
참고: 제거는 supernatants 때 펠 릿 pipetting 하지 마십시오. UHPLC 분석 즉시 수행할 수 없는 경우는 플레이트 분석까지 24 h의 최대 4 ° C에 저장할 수 있습니다.
4. UHPLC/MS-MS 분석
- 모바일 단계 시스템 (95% A:5 %B)으로 작성 하 여 UHPLC 시스템을 준비:
A: H2O, HPLC 급 포함 된 0.1% 개미 산 (준비 1 L)
B: 이기, HPLC 급, 0.1% 개미 산을 포함 (1 L 준비).
주의: 모바일 단계 높은 가연성 및 독성 섭취 또는 흡입에 의해 유기 화학 물질을 포함 합니다. 적절 한 개인 보호 장갑, 보호 안경 등을 착용 합니다. - 플레이트 홀더를 포함 하는 샘플 관리자에 96 잘 접시를 놓습니다. 표 1에 제공 된 UHPLC-ESI-MS/MS 조건에 따라 샘플을 실행 합니다.
참고: 모든 열 분석 96 잘 접시의 있어야 컨트롤 잘 한 빈 잘 (같이 접시 체계 그림 1A의). 컨트롤은 테스트 셀 라인에서 100% 효소 활동의 대표 공백 MS 소스 일관 된 백그라운드를 제공 하 고 있는지 여부를 확인 하는 동안. 주어진된 빈에서 발견 하는 특이 한 MS 봉우리 MS 감도 변화를 방지 하기 위해 조사 한다.
5. 데이터 분석
- 적절 한 UHPLC 통합 소프트웨어와 각 기판 및 그것의 deacetylated 제품의 최대 영역을 통합 합니다.
참고: 자동 통합 매개 변수를 사용 하 여 다듬기 방법 (평균, 창 크기 3, 및 2, 예를 들면 매끄러운 수). 표 1에 제공 된 컬럼에 조건 사용 하 여, 차입 순서는 dMAL (5.8 분), dBATCP (6.0 분), dMOCPAC (6.2 분), 말 (7.6 분), MOCPAC (8.9 분), 그리고 BATCP (9.8 분), 그림 1C에서 같이. - 각 기질에 대 한 (deacetylated/acetylated) 각 크로마 (테스트 및 컨트롤 샘플)에서 피크 지역 비율을 계산 합니다.
- 각 테스트 샘플의 백분율 HDAC 저해를 계산.
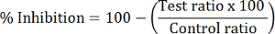
참고: HDAC1 저해 dMOCPAC/MOCPAC;의 피크 면적 비를 사용 하 여 계산 HDAC6 억제는 dBATCP/BATCP으로 계산 됩니다. 일반 HDAC 저해 표현 하 비율 dMAL/말을 사용할 수 있습니다.
결과
HDAC1에 대 한 비 선택 및 선택적 억제제를 식별 하는 방법의 응용 프로그램을 (종류 I)와 HDAC6 (클래스 IIb), HeLa 세포는 알려진된 표준 화합물으로 치료 했다: trichostatin A (비-선택적 HDAC1와 HDAC6 사이)18, MS275 (HDAC1-선택적 억제제)19및 tubastatin (HDAC6-선택적 억제제)20. 현재 방법 (그림 1)를 사용 하 여 IC
토론
HDAC 저해 약물 발견, 암 치료21HDAC6-선택적 억제제에 현재 초점에서 뜨거운 주제입니다. HDAC 선택도 일반적으로 개별 HDAC isoforms21으로 억제 효능을 결정 하는 높은 처리량, 셀 무료 분석 실험의 시리즈에 의해 평가 됩니다. 그러나, 억제제의 선택도 확인 되어야 합니다 또한 살아있는 세포에서 히스톤과 같은 내 생 단백질 기판의 acetylation 상태를 평가 하 여 (에 대 ...
공개
저자는 공개 없다.
감사의 말
저자 인정 비용 작업 CM1406 (Epigenetic 화학 생물학). 이 간행물에 보고 된 연구 피에르 메 르 시 재단에 의해 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10X RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
참고문헌
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs?. Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- . Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215) Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211)
- . Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012)
- . 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013)
- . Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015)
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935 (2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -. J., Velena, A., Lee, S., Sippl, W., Jung, M. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. , (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. . Evaluation of enzyme inhibitors in drug discovery. , (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유