Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Eş zamanlı ölçüm HDAC1 ve HDAC6 faaliyete HeLa hücreleri kullanarak UHPLC-MS
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mevcut Yöntem birden çok yüzeylerde UHPLC-MS analizi tarafından Histon uyku (HDAC) HeLa hücreleri izoformu özgü inhibitörleri tanımlanmasını sağlar. Bu yaşam HDAC1 ve HDAC6 etkinliği yansıtmak üzere geliştirilen bir antikor-Alerjik yöntemdir tek-izoformu boş hücre deneyleri aksine hücre çevre.
Özet
Yeni Histon deacetylase (HDAC) inhibitörleri ilaç keşif ilgi artan bir arayıştır. İzoformu seçicilik romidepsin, bir sınıf onay beri spot oldu ben HDAC inhibitörü kanser tedavisi ve HDAC6 özgü yavaşlatıcılar, Multipl Miyelom için klinik incelenmesi için. Mevcut yöntemi HDAC1 ve HDAC6 hücrelerde test bileşikler inhibitör etkinliğini belirlemek için kullanılır. İzoformu etkinlik ultra yüksek performanslı sıvı Kromatografi-Kütle spektrometresi (UHPLC-MS) analizi belirli yüzeylerde tedavi ve tedavi edilmezse HeLa hücreleri ile inkübe ölçülür. Yöntem boş hücre biyokimyasal testleri izole izoformlarının üzerinde yürütülen aksine hücre ortamında endojen HDAC etkinliği yansıtan bir avantaja sahiptir. Ayrıca, sentetik yüzeylerde miktar üzerinde temel aldığından, yöntem antikor tanıma endojen acetylated proteinlerin gerektirmez. Birden fazla hücre satır ve otomatik bir işlemin kolayca uyarlanabilir. Yöntem zaten neuroblasts içinde HDAC6-seçici bileşikler bulmada faydalı olmuştur. Temsilcisi sonuçları are göstermek burada standart HDAC inhibitörleri trichostatin ile bir (non-spesifik), MS275 (HDAC1 özel) ve tubastatin (HDAC6 özel) kullanarak HeLa hücreleri.
Giriş
HDACs enzim Histon Kromatin yapısı içinde deacetylate mümkün bir aileye ait. Onlar da diğer protein yüzeylerde sitozol içinde ve çeşitli hücre bölmeleri içinde bulunurlar. 18 HDAC izoformlarının toplam defa tespit edilmiştir ve transkripsiyon faktörleri ve gen ifadesinin yanı sıra hücre sinyallemesi düzenlenmesi de dahil olmak üzere birkaç hücre mekanizmaları ile ilgili ve1,2,3,4,5,6,7taşıma. HDAC katalitik inhibitörleri kanser tedavisi için potansiyel terapötik ilaç olarak ortaya çıkmıştır. Şu anda FDA tarafından onaylanmış çoğu HDAC inhibitörleri T hücreli Lenfoma ve multiple Miyelom tedavisi için ve non-spesifik HDAC inhibitörleri, vorinostat (SAHA), belinostat ve panobinostat8,9gibi. Ancak, yan etkileri bir dizi pan-inhibitörleri ile ilişkili olmuştur ve izoformu özgü küçük moleküller için arama tıbbi kimya ve ilaç bulma gelen sıcak bir konudur. Buna göre sınıf ı (HDAC1-3 ve HDAC8) selektif inhibitörü romidepsin olduğunu bir onaylanmış durumdaki ilaç10, HDAC6 özgü inhibitörleri şu anda klinik çalışmalarda, Multipl Miyelom11,12,13,14,15artan tedavi potansiyele sahip altında iken.
Deneyleri HDAC karakterize etmek için eleme inhibitörleri (tek izoformu, nükleer özü veya hücre lysate) enzimatik kaynağı olan bir HDAC substrat kuluçka temel alır. Belgili tanımlık substrate genellikle N-(4-methyl-7-aminocoumarinyl)-Nα-(t-butoxycarbonyl)-Nω-acetyllysineamide (MAL)16gibi bir yarilabilir fluorophore (Örneğin, coumarin) birleştiğinde bir asetil lizin kalıntı içeren bir küçük peptid sırası'dır. İzoformu özel etkinlikler arasında ayırt etmek için her izoformu içeren ayrı boş hücre deneyleri gerekli olan ve canlı hücreler gerçek izoformu etkinliğinde yansıtmıyor. İzoformu özel yüzeylerde Benzil gibi piyasada (S)-[1-(4-methyl-2-oxo-2H-chromen-7-ylcarbamoyl)-5-propionylaminopentyl]carbamate (MOCPAC, HDAC1 belirli substrat) ve (S)-[5-acetylamino-1-(2-oxo-4-trifluoromethyl-2H-chromen-7-ylcarbamoyl)pentyl]carbamic asit tert-butil ester (BATCP, HDAC6 belirli substrat) (şekil 1B). Onlar aynı yarilabilir fluorophore ayı verilen bu ancak, MAL içeren bir çok substrat karışımı, MOCPAC ve canlı hücreler için verilen BATCP deacetylated ürünlerin tek tespiti Fluorometrik ölçüm tarafından izin vermeyeceğim.
Burada açıklanan yöntemi algılama ve her yüzey ve deacetylated ürün UHPLC-ESI-MS/MS analiz17tarafından takip bir çok maddeyi tahlil kullanarak HeLa hücreleri içinde göreli miktar olanak sağlar. Bir HDAC tahlil doğrudan kimlik HDAC inhibitör etkinliği ve özgüllük test bileşikler endojen HDACs etkinleştirmek için HeLa hücreleri üzerinde yapılan. HDAC1 ve HDAC6, aynı anda değerlendirilir bir odak vardır. Bir tek kuluçka tahlil enzimatik Bu ölçümlerde elde etmek için non-spesifik ve belirli HDAC yüzeylerde karışımı bir 96-şey plaka üzerinde kaplama tedavi ve tedavi edilmezse HeLa hücreleri eklenir. Bir kuluçka adım hücreleri yüzeylerde ve ayrılır ve bir UHPLC-MS (şekil 1 c) yöntemiyle tespit onların anılan sıraya göre tepki ürünler serbest bırakmak için lysed. MAL, MOCPAC ve BATCP yüzeylerde deacetylated ürünleri deacetylated MAL (dMAL), deacetylated MOCPAC (dMOCPAC) ve deacetylated BATCP (dBATCP), sırasıyla vardır. Doz-yanıt eğrileri aktif bileşikler ile inşa edilebilir.
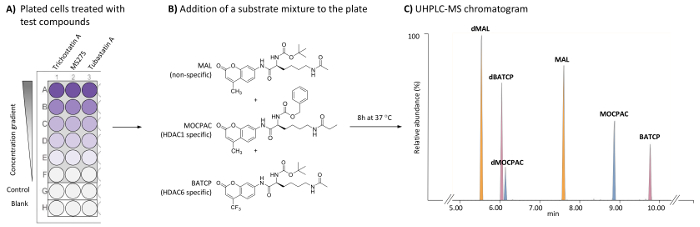
Şekil 1: HDAC1 ve HDAC6 özel inhibitörleri birden çok yüzeylerde UHPLC-MS analizi tarafından tanımlamak hücre tabanlı HDAC tahlil için genel düzeni. Tipik 96-şey plaka tedavi (test bileşikleri) içeren bir(a)düzeni ve tedavi edilmezse (kontrol) HeLa hücreleri yanı sıra boş hücre boşlukları. (B) kimyasal yapısı yüzeylerde endojen HDACs tarafından deacetylated için bir karışım (21 her µM) eklendi. (C) eklenen yüzeylerde (MAL, MOCPAC ve BATCP) ve deacetylated ürünlerini doruklarına gösterilen tipik UHPLC-MS Kromatografik (dMAL, dMOCPAC ve dBACTP, sırasıyla). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. hücre kültürü
Not: Standart doku kültürü mahallede aşağıdaki adımlar gerçekleştirilir. Steril tekniği ile aşinalık bekleniyor.
- HeLa hücreleri için %80 confluency % 10 fetal sığır serum, penisilin G takıma MEM bir T75 hücre kültür şişesi içinde kültür (100 U/mL) ve streptomisin (100 mg/mL).
Not: Hücre kültürü, tedavi ve lizis adımları %5 CO2 steril koşullarda oksijen bir ortamda gerçekleştirilen 37 ° C'de hücre kuluçka adımlarla laminar akış altında yapılmaktadır. - 5 mL DPBS de iki kez hücrelerle yıkama, DPBS Aspire edin ve hücre ayrılma reaktif 1 mL ekleyin. Hücreleri ayırmak 5 min için 37 ° C'de kuluçkaya.
- MEM kültür orta 9 mL ekleyin, iyice hücre süspansiyon resuspend ve bir hemasitometre kullanarak hücreleri saymak.
- 6 x 104 hücre/ml MEM içinde hücre süspansiyon yoğunluğunu ayarlayın.
- Hücre süspansiyon, 100 µL denetimine ekleyin ve bir steril, düz dipli, doku kültürü tedavi 96-şey plaka (şekil 1A) kuyu test.
- MEM kültür ortamının 100 µL 96-şey plaka (şekil 1A) boş wells için ekleyin.
- 96-şey plaka 24 h 37 ° C'de kuluçkaya.
Not: 24 h kuluçka HeLa hücreleri endojen HDAC etkinlik için test etmek için uygun bir zaman değil. Farklı hücre tipleri bilinmeyen HDAC aktivite ile kontrol hücreleri timecourse değerlendirilmesi gerekebilir.
2. hücre tedavisi ile Test bileşikleri ve HDAC yüzeylerde
- 96-şey plaka kuyulardan orta Aspire edin.
- 2 test bileşikler x 25 µL eklemek (örneğin, trichostatin A, MS275 ve tubastatin A) kuyu test etmek için MEM içinde. MEM 25 µL ve boş wells için ekleyin.
Not: Test bileşiklerin en az 5 son test konsantrasyonları (başına iyi bir konsantrasyon) bir dizi sağlamak için ayarlanacak bölgedir. Bileşik testinde DMSO son konsantrasyonu % 0.5 geçmemelidir ve boşluklar ve denetimler de dahil olmak üzere her şey aynı olmalıdır. İyi ücret 50 µL son kuluçka birimdir. Trichostatin A 500 1.95 için arasında değişen 5 konsantrasyonlarda test nM (1:4 seyreltme). MS275 ve tubastatin A test 8.000 6.17 için arasında değişen 5 konsantrasyonlarda nM (1:6 seyreltme). Her test bileşik için istenen son test konsantrasyon her bireysel kullanıcı tarafından bir doz-yanıt eğrisi oluşturma tarafından tespit edilmelidir. - Substrat karışımı (MAL, MOCPAC, 42 µM ve MEM BATCP 42 µM 42 µM) 25 µL kontrol ve test wells için ekleyin. MEM 25 µL boş wells için ekleyin.
Not: Her substrat son konsantrasyonu 21 µM. olduğunu MOCPAC ve BATCP sırasıyla HDAC1 ve HDAC6 etkinlik arasında ayrım (şekil 1B). Hiçbir etkinlik ile bu yüzeylerde gözlenen zaman MAL kullanımı başka bir HDAC izoformu karşı faaliyetlerin tanımlaması için yol açması olası. - 96-şey plaka için oksijen %5 8 h 37 ° C'de kuluçkaya CO2 kuluçka makinesi.
Not: Bu kuluçka süresi HeLa hücreleri için uygun ve endojen HDAC sentetik yüzeyler ile etkileşimine izin verir. Farklı hücre hatları kuluçka zaman ve/veya substrat konsantrasyonu ayarlamalar yapılması gerekebilir.
3. hücre lizis ve UHPLC-ESI-MS/MS için numune hazırlama
Dikkat: Son derece yanıcı ve yenmesi veya inhalasyon zehirli organik kimyasallar örnek hazırlık adımları kullanın. Eldiven ve koruyucu gözlük gibi uygun kişisel koruma giymek.
- 10 µL (10 x RIPA arabelleğinden seyreltilmiş) 6 x RIPA arabelleği her de 96-şey plaka proteaz inhibitörü ile takıma ekleyin.
- Her şey soğuk Asetonitril 160 µL ekleyerek reaksiyonu durdurmak ve yukarı ve aşağı pipetting tarafından karıştırın.
Not: Bu adım önce-20 ° C'de Asetonitril tutun. - Plaka 10 dk-80 ° C dondurucuya koyun.
- Ve her şey içeriğinin 220 µL bir non-steril, konik-alt (V-alt) 96-şey plaka için transfer dondurucudan plaka çıkarın. Plaka 5000 x g ve 4 ° C'de 10 dakika santrifüj kapasitesi.
Not: Proteinler ve tuzları kaldırma bu adımı amaçlamaktadır. Gerekirse, çözümler bireysel konik santrifüj tüpleri Santrifüjü önce transfer veya 96-şey, 0.65 µm PVDF filtre plakaları bir grup üzerinden filtre. Çökelti başarılı kaldırılması UHPLC analiz önce gereklidir. - UHPLC sistemi ile uyumlu bir 96-şey plaka içine süpernatant (veya filtrate) 200 µL transfer ve plaka sealer kullanarak soyulabilen, termo pişirme folyo folyo ile kapatın.
Not: granül supernatants kaldırırken pipetting kaçının. UHPLC analiz hemen gerçekleştirilemez, plaka en fazla 24 h 4 ° C'de analiz kadar saklanabilir.
4. UHPLC/MS-MS analizi
- UHPLC sistem mobil faz sistemiyle (%95 A:5% B) doldurarak hazırlayın:
A: %0,1 formik asit içeren H2O, HPLC-grade, (1 L hazırlamak)
B: Asetonitril, HPLC-grade, %0,1 formik asit içeren (1 L hazırlamak).
Dikkat: Mobil faz son derece yanıcı ve yenmesi veya inhalasyon zehirli organik kimyasallar içerir. Eldiven ve koruyucu gözlük gibi uygun kişisel koruma giymek. - 96-şey plaka plaka sahibi içeren örnek Yöneticisi yerleştirin. Tablo 1' de sağlanan UHPLC-ESI-MS/MS koşullara göre örneklerini çalıştırma.
Not: Analitik 96-şey plaka her sütun bir denetim iyi ve bir boş iyi ( şekil 1Aplaka düzeninde tasvir) olmalıdır. MS kaynak tutarlı arka plan sağlayan olup olmadığını kontrol etmek için boşlukları varken % 100 test edilmiş hücre kültürünü enzimatik aktivite temsilcisi denetimleridir. Verilen boş olarak algılanan alışılmadık MS doruklarına MS duyarlılık değişiklikleri önlemek için araştırılmalıdır.
5. veri analizi
- Her yüzey ve deacetylated ürün pik alanı uygun bir UHPLC entegrasyon yazılımı ile entegre.
Not: otomatik entegrasyon parametreleri düzeltme yöntemi (ortalama, pencere boyutu 3 ve 2, örneğin pürüzsüz sayısı) kullanın. Tablo 1' de sağlanan Kromatografik koşullar kullanarak, elüsyon dMAL (5,8 dk), dBATCP (6.0 dk), dMOCPAC (6.2 dk), MAL (7.6 dk), MOCPAC (8,9 dk) ve BATCP (9,8 dk), şekil 1 ciçinde tasvir sırasıdır. - Her substrat (acetylated deacetylated?) / her Kromatografik (test ve denetim örnekleri) en yüksek alan oranını hesaplamak.
- Her test örneği yüzde HDAC inhibisyonu Hesapla:
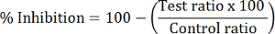
Not: HDAC1 inhibisyon dMOCPAC/MOCPAC pik alanı oranı kullanılarak hesaplanır; HDAC6 inhibisyon dBATCP/BATCP ile hesaplanır. Oranı dMAL/MAL genel HDAC inhibisyon ifade etmek için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Non-selektif ve selektif inhibitörü HDAC1 için tanımlayıcı uygulamanın yönteminin göstermek için (sınıf ı) ve HDAC6 (sınıf IIB), HeLa hücreleri bilinen standart bileşenleri ile tedavi: trichostatin A (non-selektif HDAC1 ve HDAC6 arasında)18, MS275 (HDAC1-selektif inhibitörü)19ve tubastatin (HDAC6-selektif inhibitörü)20. Mevcut yöntem (şekil 1) kullanarak, ŞA5...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
HDAC inhibisyon geçerli odaklı bir kanser tedavisi21HDAC6-selektif inhibitörü ilaç keşif sıcak bir konudur. HDAC seçicilik genellikle bireysel HDAC izoformlarının21doğru inhibitör etki gücüne belirlemek niyetinde yüksek üretilen iş, boş hücre deneyleri bir dizi tarafından değerlendirilir. Ancak, bir inhibitörü selectivity ayrıca canlı hücrelerde Histon gibi endojen protein yüzeylerde asetilasyon durumunu değerlendirerek onaylandığı takdirde (i...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Yazarlar maliyet eylem CM1406 kabul (epigenetik Kimya Biyoloji). Bu yayında bildirilen araştırma Pierre Mercier Vakfı tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| BATCP | Sigma-Aldrich | B4061 | |
| MAL | Sigma-Aldrich | SCP0168 | Synonym: BOC-Ac-Lys-AMC |
| MOCPAC | Sigma-Aldrich | M2195 | |
| MS275 | Sigma-Aldrich | EPS002 | |
| Trichostatin A | Sigma-Aldrich | T8552 | |
| Tubastatin A | Sigma-Aldrich | SML0044 | |
| Acetonitrile, HPLC grade | Fisher Scientific | 10660131 | |
| Formic acid, LC/MS grade | Fisher Scientific | 10596814 | |
| H2O, HPLC grade | distilled H2O filtered through a Milli-Q purification system | ||
| HeLa cells | ATCC | ATCC CRM-CCL-2 | |
| Cell dissociation reagent TrypLE Express | ThermoFisher Scientific | 12604013 | |
| DMSO, cell culture grade | Applichem | 146463 | |
| DPBS | ThermoFisher Scientific | 14190144 | |
| Fetal bovine serum | Biowest | S1810 | |
| MEM | ThermoFisher Scientific | 22561021 | |
| Penicillin-Streptomycin | Bioconcept | 4-01F00-H | |
| 10x RIPA buffer | Abcam | ab156034 | |
| SigmaFast protease inhibitor tablets | Sigma-Aldrich | S8820 | |
| 96-well plates, sterile, flat-bottom, tissue culture treated Corning | VWR | 29442-058 | |
| 96-well plates, non-sterile, V-bottom Corning | VWR | 29442-404 | used in the centrifugation step |
| 96-well plate, conical bottom, Nunc | ThermoFisher Scientific | 249944 | compatible with the Acquity UHPLC system |
| T75 cell culture flasks Corning | Sigma-Aldrich | CLS430641 | |
| Peelable heat sealing foil | Waters | 186002789 | |
| Acquity UPLC system | Waters | ||
| Eppendorf Centrifuge 5810 R | Fisher Scientific | 05-413-323 | |
| Integration software: MassLynx V4.1 | Waters | Catalog number not available | |
| Combi thermo-sealer SP-0669/240 | Waters | Catalog number not available | |
| Quattro micro API Tandem Quadrupole System | Waters | Catalog number not available |
Referanslar
- Arrowsmith, C. H., Bountra, C., Fish, P. V., Lee, K., Schapira, M. Epigenetic protein families: a new frontier for drug discovery. Nat Rev Drug Discov. 11 (5), 384-400 (2012).
- Henikoff, S., Greally, J. M. Epigenetics, cellular memory and gene regulation. Curr Biol. 26 (14), R644-R648 (2016).
- Kim, C., et al. HDAC6 inhibitor blocks amyloid beta-induced impairment of mitochondrial transport in hippocampal neurons. PLoS One. 7 (8), (2012).
- Kawaguchi, Y., et al. The deacetylase HDAC6 regulates aggresome formation and cell viability in response to misfolded protein stress. Cell. 115 (6), 727-738 (2003).
- Zhao, Y., et al. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 26 (7), 2782-2790 (2006).
- Berger, S. L. Histone modifications in transcriptional regulation. Curr Opin Genet Dev. 12 (2), 142-148 (2002).
- Simões-Pires, C., et al. HDAC6 as a target for neurodegenerative diseases: what makes it different from the other HDACs? Mol Neurodegener. 8 (7), 1-16 (2013).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone deacetylase inhibitors in clinical studies as templates for new anticancer agents. Molecules. 20 (3), 3898-3941 (2015).
- Manal, M., Chandrasekar, M. J., Gomathi Priya, J., Nanjan, M. J. Inhibitors of histone deacetylase as antitumor agents: A critical review. Bioorg Chem. 67, 18-42 (2016).
- Mack, G. S. To selectivity and beyond. Nat Biotech. 28 (12), 1259-1266 (2010).
- U.S. National Institutes of Health. Study of ACY-1215 alone and in combination with bortezomib and dexamethasone in multiple myeloma (ACY-1215). , Available from: https://clinicaltrials.gov/ct2/show/NCT01323751 (1211).
- U.S. National Institutes of Health. Study of ACY-1215 in combination with lenalidomide, and dexamethasone in multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT01583283 (2012).
- U.S. National Institutes of Health. 13ACY-1215 (ricolinostat) in combination with pomalidomide and low-dose dex in relapsed-and-refractory multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT01997840 (2013).
- U.S. National Institutes of Health. Study of ACY-241 alone and in combination with pomalidomide and dexamethasone in multiple myeloma. , Available from: https://clinicaltrials.gov/ct2/show/NCT02400242 (2015).
- Yee, A. J., et al. Ricolinostat plus lenalidomide, and dexamethasone in relapsed or refractory multiple myeloma: a multicentre phase 1b trial. Lancet Oncol. 17 (11), 1569-1578 (2016).
- Jung, M. Homogenous non-isotopic assays for histone deacetylase activity. Expert Opin Ther Pat. 13 (6), 935(2003).
- Zwick, V., Simões-Pires, C., Cuendet, M. Cell-based multi-substrate assay coupled to UHPLC-ESI-MS/MS for a quick identification of class-specific HDAC inhibitors. J Enzyme Inhibi Med Chem. 31 (1), 209-214 (2016).
- Khan, N., et al. Determination of the class and isoform selectivity of small-molecule histone deacetylase inhibitors. Biochem J. 409 (2), 581-589 (2008).
- Glaser, K. B., et al. Differential protein acetylation induced by novel histone deacetylase inhibitors. Biochem Biophys Res Commun. 325 (3), 683-690 (2004).
- Butler, K. V., et al. Rational design and simple chemistry yield a superior, neuroprotective HDAC6 inhibitor, tubastatin A. J Am Chem Soc. 132 (31), 10842-10846 (2010).
- Jung, M., Yong, K. -J., Velena, A., Lee, S. Cell-Based Assays for HDAC Inhibitor Hit Validation. Epigenetic Targets in Drug Discovery. Sippl, W., Jung, M. , Wiley-VCH. (2010).
- Milli, A., et al. Proteomic analysis of cellular response to novel proapoptotic agents related to atypical retinoids in human IGROV-1 ovarian carcinoma cells. J Proteome Res. 10 (3), 1191-1207 (2011).
- Zwick, V., et al. Synthesis of a selective HDAC6 inhibitor active in neuroblasts. Bioorg Med Chem Lett. 26 (20), 4955-4959 (2016).
- Ciossek, T., Julius, H., Wieland, H., Maier, T., Beckers, T. A homogeneous cellular histone deacetylase assay suitable for compound profiling and robotic screening. Anal Biochem. 372 (1), 72-81 (2008).
- Heltweg, B., Dequiedt, F., Marshall, B. L., Brauch, C., Yoshida, M., et al. Subtype selective substrates for histone deacetylases. J Med Chem. 47 (21), 5235-5243 (2004).
- Copeland, R. A. Evaluation of enzyme inhibitors in drug discovery. , Wiley. (2005).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır