A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
مقايسة تنحية نازعة لاكتات — طريقة بسيطة وموثوق بها لتحديد النشاط تنحية أوتوفاجيك الأكبر في خلايا الثدييات
In This Article
Summary
ويرد هنا بروتوكول بسيط وتم التحقق من صحتها جيدا لقياس النشاط تنحية أوتوفاجيك الأكبر في خلايا الثدييات. الأسلوب يستند على قياس نسبة اللاكتات نازعة (رابطة حقوق الإنسان) في سيديمينتابل خلية الكسور مقارنة بإجمالي المستويات الخلوية في رابطة حقوق الإنسان.
Abstract
أوتوفاجي السائبة تتميز بعزل أجزاء كبيرة من السيتوبلازم إلى الهياكل المزدوجة-membrane متعددة تسمى أوتوفاجوسوميس. ويرد هنا بروتوكول بسيط لرصد هذه العملية. وعلاوة على ذلك، يتم توفير النتائج النموذجية والتجريبية التحقق من صحة الأسلوب تحت ظروف حمل أوتوفاجي في أنواع مختلفة من خلايا الثدييات المستزرعة. خلال أوتوفاجي السائبة، تنحية أوتوفاجوسوميس سيتوسول، وذلك أيضا للذوبان البروتينات سيتوسوليك، جنبا إلى جنب مع غيرها من البضائع أوتوفاجيك. رابطة حقوق الإنسان هي مستقرة وعالية الإنزيم سيتوسوليك وفيرة، والقابلة للذوبان هو المعزول غير انتقائية في أوتوفاجوسوميس. ولذلك يعكس مقدار تنحية رابطة حقوق الإنسان مبلغ السائبة تنحية أوتوفاجيك. لتحديد كفاءة ودقة تنحية رابطة حقوق الإنسان في الخلايا، نحن نوظف بروتوكولا تجزئة المستندة إلى اليكتروديسروبشن الذي يفصل فعالية سيديمينتابل من سيتوسوليك رابطة حقوق الإنسان، تليها قياس النشاط الأنزيمي في سيديمينتابل الكسور مقابل عينات كامل الخلية. عزل أوتوفاجيك يتحدد بطرح نسبة سيديمينتابل رابطة حقوق الإنسان في الخلايا غير المعالجة من تلك الخلايا في المعالجة. ميزة الفحص تنحية رابطة حقوق الإنسان أنه يعطي مقياس كمي لعزل أوتوفاجيك من البضائع المحلية، بدلاً من الأساليب الأخرى أما تنطوي على التعبير حمل خارج الرحم المسابير تنحية أو مبطلات شبه كمي حماية تحليلات لعلامات أوتوفاجي أو مستقبلات.
Introduction
أوتوفاجي (اليونانية "الأكل الذاتي") عملية تطورية مصانة لتدهور رغوي/تعويض المواد داخل الخلايا. عند اكتشاف الجينات المرتبطة أوتوفاجي ("ATG")، وهامة أوتوفاجي في الخميرة والبشر، والتحقيق أوتوفاجي أن يلعب دوراً هاما في صحة الإنسان والمرض (اعترف بفضل جائزة نوبل في الطب أو الفيزيولوجيا لعام 2016 يوشينوري اوشومي)، أوتوفاجي قد تصبح بسرعة واحدة من العمليات الأكثر كثافة درس في خلية علم الأحياء1،2.
ماكرووتوفاجي (يشار إليه فيما يلي "أوتوفاجي") تتسم بالتوسع وقابلة للطي للغشاء داخل الخلايا سيستيرناي ("فاجوفوريس") في هياكل مختومة، مزدوج أو متعدد membrane ("أوتوفاجوسوميس") الذي عزل فعال المواد enwrapped من باقي السيتوبلازم. عند انصهار أوتوفاجوسوميس مع lysosomes، الغشاء أوتوفاجوسومال الداخلي والبضائع المنحاة المتدهورة والمعاد تدويرها. أوتوفاجوسوميس يمكن عزل المواد هيولى في عشوائية (غير انتقائية أوتوفاجي) وآداب الانتقائي (أوتوفاجي الانتقائي). أوتوفاجي الأكبر على الأرجح يمثل مزيجاً أوتوفاجي انتقائية وغير انتقائي.
في عام 1960 و 70 ("المورفولوجية عصر" البحوث أوتوفاجي)، وعزل أوتوفاجيك قيمت أساسا من خلال التحليلات ultrastructural. في ثمانينيات القرن الماضي وبداية تسعينيات القرن العشرين ('' مرحلة البيوكيميائية '') "كل سيجلين" وزملاء العمل – الذي درس أوتوفاجي في خلايا الكبد في الفئران الأولية – تطوير أساليب الأولى لقياس كمي تنحية أوتوفاجيك النشاط3. استخدام هذه الاختبارات، سيجلين تعريف ووصف مختلف الخطوات من4،أوتوفاجيك الليزوزومية المسار5، اكتشفت ويسك أمفيسومي6 (منتج الانصهار دخلول-أوتوفاجوسومي) وكان الأول من وصف دور الفسفرة البروتين في أوتوفاجي لائحة7. ومع ذلك، بعد اكتشاف أتجس في لعام 1990 ("عصر الجزيئية")، ووصف أول بروتين ATG8 الثدييات، سلسلة البروتينات المرتبطة microtubule 1A/1B-الضوء 3 (LC3) في عام 20008، استخدام البروتينات ATG كعلامات عملية أوتوفاجيك سرعان ما اكتسب شعبية، وتركت الطرق البيوكيميائية الأكبر سنا وأكثر مشقة. وفي الواقع، على مدى 18 عاماً الماضية ولطخة غربية وتحاليل مجهرية fluorescence LC3 أصبحت حد بعيد الأكثر شعبية (وفي كثير من الحالات فقط) وسيلة لدراسة أوتوفاجي في خلايا الثدييات. الميزة هي السهولة النسبية التي يمكن تنفيذ هذه الأساليب. العيب أن واحداً دراسة مكون عربة (LC3) بدلاً من البضائع أوتوفاجيك الفعلية. وهذا عيب خطير بدلاً من ذلك، نظراً للعلاقة بين الدول و/أو التمويه LC3 من خلال المسار مقابل عزل وتدفق البضائع غير واضح جداً. وفي الواقع، أننا أظهرنا أنه يمكن الحفاظ على تدفق البضائع السائبة في مستويات عالية في ظروف حيث يوجد لا التمويه LC3، على الرغم من وجود LC3 مترافق في خلايا9. وعلاوة على ذلك، أثبتنا أن أوتوفاجي الأكبر لا تتأثر بكفاءة LC3 نضوب، وبالتالي يرجح أن هو مستقل LC39. وقد أكد هذا الاستنتاج في وقت لاحق LC3 الدراسات المغلوب10،11، التي تشير أيضا إلى أن تعتمد على باركين ميتوفاجي (أوتوفاجي انتقائية من الميتوكوندريا) بشكل مستقل LC310،11 .
وباختصار، هناك واضحة تحتاج لفحوصات على أساس الشحن لمراقبة نشاط أوتوفاجيك. على النحو الأمثل ينبغي أن تكون مثل هذه الاختبارات على نطاق واسع المنطبقة ومحددة تحديداً جيدا، وسهلة لتنفيذ. على مدى السنوات القليلة الماضية لقد أحطنا اهتماما خاصا بمقايسة تنحية رابطة حقوق الإنسان، التي وضعتها "كل سيجلين" في ثمانينيات القرن الماضي12، ويستند إلى قياس نقل رابطة حقوق الإنسان سيتوسوليك إلى سيديمينتابل، أوتوفاجيك الخلية التي تحتوي على المنقبضة الكسور. رابطة حقوق الإنسان هو بروتين سيتوسوليك مستقر وقابل للذوبان بسهولة المحتبس المشترك عند فاجوفوريس لف البضائع هيولى. ولذلك تنحية من رابطة حقوق الإنسان مقياس عام لعزل أوتوفاجيك. رابطة حقوق الإنسان المتدهورة حصرا ب المسار أوتوفاجيك الليزوزومية12. وبالتالي، وجود مثبطات تدهور الليزوزومية، مثلاً، بافيلوميسين A1 (Baf)13، آثار العلاج التجريبي مباشرة تعكس التغييرات في نشاط تنحية أوتوفاجيك. نظراً لغياب مثبطات التدهور، يمكن قياس الأثر الصافي للتعديلات في تنحية رابطة حقوق الإنسان والتدهور.
مقايسة تنحية رابطة حقوق الإنسان المطبقة على نطاق واسع، حيث يعبر رابطة حقوق الإنسان عاليا وأوبيكويتوسلي في جميع أنواع الخلايا، ويمكن قياس مستويات رابطة حقوق الإنسان بدقة تحليل الأنزيمي14،15. غير أن البروتوكول الأصلي12 – أنشئت في خلايا الكبد في الفئران الأولية – بدلاً من ذلك يستغرق وقتاً طويلاً ويتطلب كمية عالية من ابتداء من المواد، فضلا عن تفريغ كهربائي مصنوعة خصيصا مكثف. على نحو تدريجي، ونحن قد تحولت تدريجيا المقايسة إلى طريقة سهلة ومرنة. أولاً، البروتوكول الأصلي تم تكييفها للاستخدام في خلايا الثدييات الأسطر16. وثانيا، كان الأسلوب كثيرا المصغرة3،9. ثالثا، تم القضاء على العديد من الخطوات في البروتوكول، بما في ذلك كثافة شاقة وسادة الخطوة17. مكن هذا في نفس الوقت تصغير أبعد من الأسلوب، من نقطة البداية الأصلية لاستخدام لوحة 10 سم كل عينة16 إلى استخدام بئر واحدة من صفيحة 12-جيدا كل عينة (أيحوالي 15-fold أقل بدءاً 17من المواد). ورابعاً، حددنا جهاز انهانسر تجارية التي يمكن أن تحل محل مكثف تفريغ كهربائي مصنوعة خصيصا17.
ويرد هنا لدينا البروتوكول الأكثر حداثة للمقايسة تنحية رابطة حقوق الإنسان، التي تشمل بعض التبسيطات مواصلة أسلوب مقارنة ب نشرها مسبقاً17 . وعلاوة على ذلك، يتم إظهار مجموعة من النتائج النموذجية التي تم الحصول عليها في عدد من أنواع مختلفة من الخلايا، والأهم من ذلك، يتم توفير عدة أسطر من التصديقات التجريبية لأسلوب استخدام ضربة قاضية الدوائية فضلا عن الجينية والنهج خروج المغلوب. لمخطط تدفق الإجمالي البروتوكول كله، انظر الشكل 1.
Access restricted. Please log in or start a trial to view this content.
Protocol
1-خلية البذر والعلاج
-
ثقافة الخلايا ملتصقة في قوارير زراعة الأنسجة2 75 سم في حاضنة هوميديفيد مع 5% CO2 في 37 درجة مئوية، واستخدام الثقافة الوسيلة المفضلة لنوع الخلية في السؤال. السماح للخلايا لتنمو حتى تصل إلى طبقة خلايا بالقرب من روافد.
ملاحظة: استخدام المتوسط RPMI 1640 تستكمل مع 10% مصل بقرى الجنين (FBS) لنكاب، HEK293، الماوس الليفية الجنينية (MEFs)، BJ، MCF-7، والخلايا RPE-1.- تغسل الخلايا مع 3 مل 37 درجة مئوية مخزنة الفوسفات المالحة (PBS)، الرقم الهيدروجيني 7.4. استبدال برنامج تلفزيوني مع 3 مل 0.25% (w/v) التربسين-اتهيلينيديامينيتيتراسيتاتي (يدتا)، واحتضان قارورة في حاضنة هوميديفيد مع 5% CO2 في 37 درجة مئوية حتى فصل الخلايا (2 – 5 دقيقة).
- ريسوسبيند الخلايا المنفصلة مع 7 مل الثقافة المتوسطة التي تحتوي على 10% FBS. مزيج قاسمة تعليق خلية 10 ميليلتر مع 10 ميليلتر 0.4% تريبان الأزرق في أنبوب ميكروسينتريفوجي، استخدام تلميح ماصة 0.5 – 20 ميليلتر. استخدام تلميح ماصة نفس فورا تعبئة شريحة دائرة عد الأصوات، وحساب الخلايا في عداد خلية الآلي.
-
إعداد مناسبة تمييع (راجع الملاحظة أدناه) من تعليق خلية من استخدام الخطوة 1.1.2 الثقافة المتوسطة التي تحتوي على 10% FBS، والبذور 1 مل تعليق خلية المخفف في كل بئر زراعة الأنسجة 12-جيدا باستخدام لوحة (المساحة السطحية ~3.8 سم2) العقيم تقنية. تسمح بالنمو في حاضنة هوميديفيد مع 5% CO2 في 37 درجة مئوية حين تم بلوغ كثافة الخلايا المطلوب، مثلاً، 60 – 90% في التقاء في موسم الحصاد.
ملاحظة: تتنوع تمييع المناسبة لتعليق الخلية التي سوف تعطي كونفلوينسي الخلايا المطلوب عند الحصاد من نوع الخلية إلى نوع من الخلايا، وكذلك وفقا للمدة ونوع من العلاجات التجريبية. وهكذا، وهذا يجب تجريبيا تقييم في كل حالة على حدة.- لإجراء التجارب على أن يكون كل تعامل وتحصد بعد بذر البذور 2.5 × 105 LNCaP، HEK293، أو MCF-7 الخلايا، 5 × 104 ميفس، 4 × 105 BJ أو 1.5 × 10 أيام 25 RPE 1 الخلايا في كل من لوحة 12-جيدا جيدا.
- للخلايا التي تلتزم بشكل فضفاض، معطف اللوحات مع نوع طلاء الموصى بها لنوع الخلية في السؤال. لخلايا LNCaP (و HEK293) استخدام ألواح مغطاة بطبقة بولي-د-يسين (PDL).
- تحقيقا لهذه الغاية، إضافة 500 ميليلتر PDL في 2.5 ميكروغرام/مل في العقيمة ح2س لكل بئر، واحتضان اللوحات في بيئة معقمة لمدة 30 دقيقة في درجة حرارة الغرفة (20-25 درجة مئوية). إزالة PDL بالشفط، وتغسل كل جيدا بإيجاز مع 1 مل العقيمة H2o.
ملاحظة: يتم خطوة 1.2.1 عموما، دون أي علاجات تجريبية. ومع ذلك، إذا كان أداء [رني]، قد يكون مناسب للبدء عكس تعداء مع بذر9.
-
إجراء علاجات تجريبية في الآبار مكررة أو ثلاث كل حالة.
- على سبيل المثال، تعامل الخلايا مع 50 نيوتن متر Torin1 mTOR-المانع، عموما كفاءة محفز لتنحية أوتوفاجيك، أو رهنا بالخلايا المجاعة الحادة المصل-والأحماض الأمينية بغسل الخلايا مع 1 مل إيرل خال من الأحماض الأمينية التي موازنة الملح المتوسطة الحل (ابس)، وبعد ذلك تبني الخلايا الموجودة في 1 مل ابس في حاضنة هوميديفيد مع 5% CO2 في 37 درجة مئوية.
- اترك مجموعة واحدة من الآبار دون علاج من أجل تحديد مستويات أساسية من سيديمينتابل رابطة حقوق الإنسان.
- إضافة كمية تشبع من بافيلوميسين المانع بعد تنحية A1 (Baf)3،13،،من1618 في غياب أو وجود علاجات تجريبية، ح 3-4 قبل الخلية الحصاد. احتضان الخلايا في حاضنة هوميديفيد مع 5% CO2 في 37 درجة مئوية.
- استخدام 100 نانومتر Baf LNCaP, HEK293, BJ، MCF-7 وخلايا RPE-1، و 10 نانومتر Baf ميفس.
- لإضافة العلاجات التجريبية التي لها مدة إلا 3 – 4 ح (مثل تلك الخطوة المتمثلة في 1.3.1 وعادة ما يكون)، معامل التراكم الأحيائي في نفس الوقت مع العلاجات. لم يعد العلاج التجريبي، الانتظار حتى ح 3-4 قبل موسم الحصاد، وإضافة 2 ميليلتر من علامة x 500 تتركز الأسهم Baf مباشرة في المتوسط.
- مزيج من التحريض اللوحة مباشرة بعد إضافة معامل التراكم الأحيائي. وفي هذه المرحلة أيضا يوصي إضافة مثبطات تنحية ماكرووتوفاجيك كعناصر التحكم، مثلاً، 10 ملم من عموم--فوسفوينوسيتيدي 3-كيناز (PI3K) المانع 3-ميثيل الأدنين (3MA)19، أو 10 ميكرون من فئة PI3K انتقائية الثالث مثبط 405 ريال سعودي20.
2-الخلية الحصاد وإعداد اليكتروديسروبشن
- في نهاية فترة العلاج، نضح المتوسطة مع الشفط وإضافة حل مفرزة 200 خلية ميليلتر (مسخن مسبقاً إلى 37 درجة مئوية) لكل بئر. احتضان عند 37 درجة مئوية حتى فصل الخلايا (عادة حوالي 5 دقائق).
ملاحظة: بينما يمكن استخدام 0.25% (w/v) التربسين-يدتا بدلاً من الحل مفرزة الخلية، هذا الأخير يحتوي على الدناز، مما يساعد على تقليل لزوجة الخلايا المنفصلة. طالما ويستنشق دقة المتوسطة، فإنه ليس من الضروري غسل الخلايا قبل إضافة الحل مفرزة يدتا التربسين أو خلية. - إضافة 500 ميليلتر درجة حرارة الغرفة (20-25 درجة مئوية) PBS، درجة الحموضة 7.4، الذي يحتوي على 2% (w/v) ألبومين المصل البقري (BSA) لكل بئر، وريسوسبيند الماصة حتى لا كتل الخلايا مرئية. نقل على الفور بتعليق خلية إلى 1.5 مل ميكروسينتريفوجي أنابيب على الجليد.
ملاحظة: ما لم يذكر خلاف ذلك، تنفيذ جميع الخطوات اللاحقة على الجليد. - الرواسب الخلايا باستخدام الطرد المركزي في 400 x ز لمدة 5 دقائق في 4 درجات مئوية.
- دقة نضح المادة طافية (بالشفط) ترك الكريات الخلايا الجافة كما قدر الإمكان.
- إضافة 400 السكروز 10% (w/v) ميليلتر (في عالي النقاوة ح2س) لكل أنبوبة.
3-غشاء البلازما اليكتروديسروبشن والانفصال من الكسور سيديمينتابل ومجموع الخلايا
- ريسوسبيند بيليه الخلية مع ماصة للحصول على تعليق خلية واحدة تقريبا، وأنه نقل إلى ومبومو انهانسر 4 مم.
ملاحظة: بيبيتينج صعودا ونزولاً ~ 10 – 15 مرة، استخدام تلميح ماصة ميليلتر 100 – 1,000، عادة ما تكون كافية. - وضع في ومبومو في اليكتروبوراتور موجه تحلل أسي، والاضطلاع بنبضه كهربائية واحدة 800 الخامس و 25 µF و 400 Ω؛ تنتج هذه الإعدادات نبض لمدة ~ 8 مللي ثانية.
-
استخدام تلميح ماصة جديدة لنقل ديسروبتاتي الخلية إلى أنبوب ميكروسينتريفوجي 1.5 مل تحتوي على 400 من محلول السكروز المثلج مخزنة فوسفات ميليلتر (الأدينوزين الصوديوم 100 مم، 2 مم ديثيوثريتول (DTT)، يدتا 2 مم، والسكروز 1.75%، درجة الحموضة 7.5)، ومزيج بإيجاز قبل بيبيتينج.
- اختياري: للتحقق من كفاءة البلازما غشاء اليكتروديسروبشن17، خلط 10 ميليلتر من ديسروبتاتي الخلية المخففة من الخطوة 3، 3 مع 10 ميليلتر 0.4 في المائة في أنبوب ميكروسينتريفوجي 1.5 مل تريبان الأزرق. نقل إلى غرفة الفرز والتحقق من أن النسبة المئوية للخلايا إيجابية تريبان الأزرق > 99%.
- تترك العينة في قاعة العد لمدة 30 دقيقة في درجة حرارة الغرفة (20-25 درجة مئوية)، والتحقق من أن النسبة المئوية للخلايا إيجابية تريبان الأزرق ظل > 99%.
- اختياري: للتحقق من اليكتروديسروبشن لم تكن قاسية جداً، فإنها قد لم تنقطع العضيات داخل الخلية، نفذ الخطوات 3، 1، 1-3 كما هو موضح أعلاه، ولكن استخدام مادة انطلاق أكبر (بئر من صفيحة 6-جيدا مع طبقة خلية المتلاقية ~ 80 ٪)، واستخدم 150 ميليلتر 10% السكروز في الخطوة 2, 5 و 150 ميليلتر محلول السكروز مخزنة الفوسفات دون القيمة في الخطوة 3، 3.
- استخدام ماصة لعناية طبقة 200 ميليلتر من الحل ديسروبتاتي خلية المخفف على رأس وسادة كثافة 1.2 مل من الفوسفات مخزنة 8% (w/v) الكثافة المتوسطة التدرج (على سبيل المثال، 8% نيكودينز، فوسفات الصوديوم 50 مم، السكروز 2.2 في المائة، 1 مم يدتا) في أجهزة الطرد مركزي في 2 مل أنبوب. الطرد المركزي في 20,000 x ز لمدة 45 دقيقة في 4 درجات مئوية في ميكروسينتريفوجي مع وظيفة وضع الناعمة (لتسريع لطيف والتباطؤ)، ووضع الأنابيب بعناية على الجليد.
- بعناية إزالة 60 ميليلتر من الكسر الأعلى ~ 200 ميليلتر، مع التأكد من عدم التقاط أي حل الكثافة المتوسطة التدرج، ونقل إلى أنبوب ميكروسينتريفوجي جديدة.
ملاحظة: يجب أن يتضمن سيتوسول النقاء استثنائية، يطلق عليه "ساب الخلية"21. - اختبار نقاء الكسر التي تم الحصول عليها في الخطوة أعلاه، عن طريق إجراء تحليلات لطخة غربية للبروتينات الواردة عضية، باستخدام التقنيات القياسية و المواد الهلامية المتدرجة 4 – 20%16.
- القيام على سبيل المثال immunoblotting كاثيبسين ب21، السيتوكروم ج، والبروتين إيزوميراز الميثيل، للتحقق من أن صدمة كهربائية في الخطوة 3، 2 لا عطلت lysosomes أو الميتوكوندريا أو هيولى، على التوالي، وإيمونوبلوت رابطة حقوق الإنسان للتحقق من وجود بروتين سيتوسوليك في ساب الخلية.
- في موازاة ذلك، إجراء إيمونوبلوتينج على مستخلصات البروتين مصنوعة من حل ديسروبتاتي خلية الإجمالي16 لتأكيد أن الأجسام المضادة المستخدمة يمكن الكشف عن البروتينات عضية الواردة التي يجري تقييم.
- اختياري: للتحقق من كفاءة البلازما غشاء اليكتروديسروبشن17، خلط 10 ميليلتر من ديسروبتاتي الخلية المخففة من الخطوة 3، 3 مع 10 ميليلتر 0.4 في المائة في أنبوب ميكروسينتريفوجي 1.5 مل تريبان الأزرق. نقل إلى غرفة الفرز والتحقق من أن النسبة المئوية للخلايا إيجابية تريبان الأزرق > 99%.
- كرر الخطوات من 3، 3، 1-3 لكل عينة.
- إزالة 550 ميليلتر من كل حل ديسروبتاتي الخلية المخففة (التي تم الحصول عليها في الخطوة 3، 3) إلى أنابيب ميكروسينتريفوجي 2 مل الذي يحتوي على 900 ميليلتر استثارة المثلج المخزن المؤقت (الأدينوزين الصوديوم 50 مم، 1 مم DTT ويدتا 1 مم والسكروز 5.9 في المائة، درجة الحموضة 7.5) تستكمل مع جيش صرب البوسنة 0.5% و 0.01 ٪ توين-20، ومزيج بإيجاز عن طريق بيبيتينج.
- أجهزة الطرد المركزي في س 18,000 ز لمدة 45 دقيقة في 4 درجات مئوية لإنتاج الكريات المحتوية على "رسابة رابطة حقوق الإنسان". دقة نضح المادة طافية (بالشفط) ترك الكريات جافة قدر الإمكان. وضع العينات في ثلاجة-80 درجة مئوية.
- نقل 150 ميليلتر من كل حل ديسروبتاتي الخلية المخففة (التي تم الحصول عليها في الخطوة 3، 3) إلى أنابيب جديدة، ووضع العينات في ثلاجة-80 درجة مئوية. استخدام هذه العينات لتحديد مستويات "إجمالي رابطة حقوق الإنسان" في الخلايا.
ملاحظة: عند هذه النقطة التجربة يمكن أن يكون مؤقتاً لطالما رغب.
4-رابطة حقوق الإنسان استخراج وقياس النشاط الأنزيمي رابطة حقوق الإنسان
- عينات "إجمالي رابطة حقوق الإنسان" (من الخطوة 3، 7) على الجليد وذوبان الجليد "رسابة رابطة حقوق الإنسان" (من الخطوة 3، 6).
- إضافة 300 ميليلتر لاستثارة المثلج المخزن المؤقت الذي يحتوي على 1.5% X-405 تريتون إلى "رابطة حقوق الإنسان الكلي" عينات (العائد نهائي تريتون X-405 تركيز 1%). قم بتدوير العينات على اسطوانة في غرفة باردة (4 – 8 درجة مئوية) لمدة 30 دقيقة.
- إضافة 750 ميليلتر من المخزن المؤقت لاستثارة المثلج مع 1% X-405 تريتون إلى "رابطة حقوق الإنسان رسابة" عينات، وريسوسبيند الكريات مع ماصة حتى يتم التوصل إلى حل متجانسة.
- الطرد المركزي العينات المأخوذة من الخطوة 4، 2 و 4-3 في 18,000 س ز لمدة 5 دقائق عند 4 درجة مئوية للرواسب أونديسولفيد الحطام الخلوية.
- مزيج 4 أجزاء ايميدازول الباردة 65 مم (درجة الحموضة 7.5)/0.75 بيروفات ملم مع جزء واحد من ايميدازول الباردة 65 مم (درجة الحموضة 7.5)/1.8 مم NADH للحصول على حل عمل مستقرة لمدة ثلاثة أسابيع على الأقل في 4 درجات مئوية.
- خلط 3 – 30 ميليلتر من سوبيرناتانتس من الخطوة 4، 4 مع 200 ميليلتر من الحل العامل خطوة 4.5.
- تحديد مقدار رابطة حقوق الإنسان بقياس النشاط الأنزيمي رابطة حقوق الإنسان كانخفاض نيكوتيناميد الأدنين dinucleotide (نموذج مخفضة) امتصاص (NADH) في 340 نيوتن متر عند 37 درجة مئوية مقارنة بمستوى تركيز رابطة حقوق الإنسان معروفة. إجراء قياسات امتصاص حتى رد فعل قد اقترب من الإنجاز، أي حتى امتصاص في 340 نانومتر لن يتغير مع مرور الوقت.
ملاحظة: هذا هو الأسلوب الكلاسيكي البيوكيميائية لقياس نشاط رابطة حقوق الإنسان. على الرغم من أن البروتوكول الحالي يقوم برد فعل على 37 درجة مئوية، فإنه يمكن أيضا إجراء في درجة حرارة الغرفة (20-25 درجة مئوية) والتي من المستحسن إذا كانت دليل أن تفعل. البروتوكول الحالي يستخدم أداة مولتياناليزير روبوتية، بطريقة إليه الذي يمزج بين العينات مع الحل العامل في صفيحة 96-جيدا، وتدابير امتصاص في 340 نيوتن متر عند 37 درجة مئوية كل 20 ثانية لمدة 3 دقائق. وبعد ذلك، يحسب البرنامج أداة تركيز رابطة حقوق الإنسان، كوحدات (U) وأعرب عن/L، بمقارنة منحدر القياسات امتصاص مع مرور الوقت بالمقارنة مع منحنى قياسي الحصول عليها عن طريق معايرة باستخدام معيار من رابطة حقوق الإنسان المعروفة التركيز. مجموعة الخطي للكشف بواسطة هذا النهج هو 30 – 1,500 U/l. وكبديل لذلك، توجد طائفة واسعة من مجموعات المتاحة تجارياً لقياس رابطة حقوق الإنسان. تستند بعض منها اقتران رد الفعل الأنزيمي لتوليد منتجات اللونية أو الفلورسنت، مما يتيح الكشف عن وسائل أخرى مما كانت الأشعة فوق البنفسجية، ومع النطاقات الأخرى الخطية للكشف عن.
5-حساب تنحية رابطة حقوق الإنسان
- حساب النسبة المئوية لرابطة حقوق الإنسان رسابة إلى مجموع رابطة حقوق الإنسان لكل عينة، أخذ تخفيف وأخذ العينات في الاعتبار:
رابطة حقوق الإنسان رسابة (%) =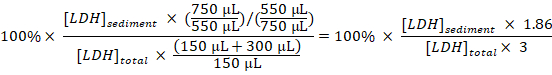
ملاحظة: خلال الخطوات 3.1 – 3.3 حوالي 50 ميليلتر من فقدت بسبب نقل داخل وخارج ومبومو انهانسر. ومن ثم، حساب من وجود ما مجموعة 750 ميليلتر (بدلاً من 800 ميليلتر) من ديسروبتاتي الخلية المخففة في الخطوة 3، 3. - النسبة المئوية لرابطة حقوق الإنسان رسابة التي تم الحصول عليها في العينات المأخوذة من الخلايا غير المعالجة (الخطوة 1.3.2) من النسبة المئوية لرابطة حقوق الإنسان رسابة الحصول على عينات من الخلايا المعالجة تجريبيا، والفجوة في وقت المعاملة مع معامل التراكم الأحيائي للحصول على النسبة المئوية لطرح المحتبس رابطة حقوق الإنسان كل ساعة في فترة أخذ العينات:
المحتبس رابطة حقوق الإنسان (%/h) =
Access restricted. Please log in or start a trial to view this content.
النتائج
استخدام البروتوكول الموصوفة هنا، نشاط تنحية أوتوفاجيك الأكبر في عدد من خطوط خلايا الثدييات المختلفة، بما في ذلك LAPC4، DU145، Huh7، PNT2A، هيلا، VCaP، H3122، Hec1A، MCF-7، G361، T47D، U2OS، PC3 الماوس الليفية الجنينية (MEFs)، RPE-1، وتم قياس الخلايا BJ، HEK293 ولنكاب. عزل بتقييم ظروف القاعدية (في المتوسط ك?...
Access restricted. Please log in or start a trial to view this content.
Discussion
ويمثل البروتوكول الموصوفة هنا في ملخص، طريقة موثوقة وقابلة للتطبيق على نطاق واسع لمراقبة نشاط تنحية أوتوفاجيك الأكبر في خلايا الثدييات. مقارنة بالأسلوب الأصلي12،16، نحن إزالة عدد من الخطوات غير الضرورية، وتبسيط العديد من الخطوات المتبقية، وأدخلت تقليص حجم...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وقد المؤلفون لا تضارب في المصالح.
Acknowledgements
كان هذا العمل دعم مالي من مجلس البحوث في النرويج وجامعة أوسلو، أندرس جهر مؤسسة، مؤسسة نانسن، والتركة في الذاكرة للأفغاني هنريك. ونشكر الدكتور نوبورو ميزُشيما ATG5 + + ميفس و ATG5--/--ميفس، الدكتور ماساكي كوماتسو ATG7 + + ميفس ATG7/ميفس، والدكتور شيزو أكيرا ATG9A + + ميفس و ATG9A/ميفس. ونشكر Sætre فرانك للمساعدة التقنية، والدكتور كل O. سيجلين للمناقشات البناءة بالمنهجية.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
References
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, Pt 3 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E. Methods of enzymatic analysis (2nd English ed). Bergmeyer, H. U. 2, Verlag Chemie. 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836(2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved