需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
乳酸脱氢酶螯合测定--一种简便、可靠的测定哺乳动物细胞中自噬性螯合活性的方法
摘要
本文介绍了一种简便、有效的测量哺乳动物细胞中大块自噬性螯合活性的协议。该方法以定量测定乳酸脱氢酶 (ldh) 在 sedimentable 细胞分数与总细胞 LDH 水平的比例。
摘要
大块自噬的特点是将大部分细胞质封存成双/多膜结构, 称为自噬体。这里介绍了一个用于监视此过程的简单协议。此外, 还提供了不同类型培养哺乳动物细胞在自噬诱导条件下的典型结果和实验验证。在大块自噬期间, 自噬体封存细胞质, 从而也可溶胞浆蛋白, 连同其他自噬性货物。乳酸脱氢酶是一种稳定、高度丰富的可溶性胞浆酵素, 无选择性地将其自噬体。因此, LDH 螯合的数量反映了散装自噬性封存的数量。为了有效、准确地测定细胞中 LDH 的封存, 我们采用了一种基于 electrodisruption 的分馏协议, 有效地将 sedimentable 与胞浆 ldh 分离, 其次是 sedimentable 酶活性的测定。分数与全细胞样本。自噬性螯合是通过从治疗细胞中减去未经处理细胞中 sedimentable LDH 的比例来确定的。LDH 螯合法的优点是它能定量测量内源性货物的自噬性封存, 而不是其他涉及螯合探针或半定量蛋白酶的异位表达的方法。自噬标记物或受体的保护分析。
引言
自噬 (希腊语为 "自我吃") 是一个进化保守的过程, 泡/溶酶体降解细胞内物质。在发现自噬相关的 ("ATG") 基因, 这是重要的是在酵母和人类的自噬, 并认识到自噬在人类健康和疾病中发挥重要作用 (承认2016诺贝尔医学或生理学奖, 以Ohsumi), 自噬已迅速成为细胞生物学1,2最强烈的研究过程之一。
Macroautophagy (以下简称 "自噬") 的特点是将胞内膜池 ("phagophores") 扩展和折叠成密封、双层或多膜结构 ("自噬体"), 有效地封存从细胞质的其余部分包裹材料。自噬体与溶酶体融合后, 内 autophagosomal 膜和螯合货物均被降解和回收。自噬体可以在随机 (非选择性自噬) 和选择性 (选择性自噬) 方式中封存细胞质材料。大块自噬很可能代表了非选择性和选择性自噬的混合。
在1960代和70代 (自噬研究的 "形态学时代"), 自噬性封存主要通过超微结构分析来评估。在1980代和开始的1990代 ("生物化学时代") 每 Seglen 和同事-谁研究了自噬在主要鼠肝细胞-开发了第一种方法定量测量自噬性封存活动3。使用这些化验, Seglen 定义和描绘了自噬性溶酶通路4,5的不同步骤, 发现和铸造 amphisome6 (endosome autophagosome 融合的产物), 是第一个描述蛋白质磷酸化在自噬规则7中的作用。然而, 在 ATGs 的发现以后在1990代 ("分子时代") 和第一个描述哺乳动物 ATG8 蛋白质, 微管伴生的蛋白质 1 a/1 b 光链子 3 (LC3) 在 2000年8, 使用 ATG 蛋白质作为标记为自噬性过程迅速获得普及, 并留下了更古老和更费力的生化方法。事实上, 在过去的18年中, LC3 的印迹和荧光显微分析已经成为目前为止最受欢迎的 (在许多情况下, 唯一的) 方法研究哺乳动物细胞的自噬。好处是这些方法的相对易用性可以进行。缺点是, 一个是研究车组件 (LC3) 而不是实际的自噬性货物。这是一个相当严重的劣势, 因为 LC3 的状态和/或通径与货物的封存和通量之间的关系是非常不清楚的。事实上, 我们已经表明, 尽管在细胞9中存在共轭 LC3, 但在没有 LC3 通量的情况下, 散装货物流量可以保持在高水平。此外, 我们证明了大体积自噬不受有效 LC3 损耗的影响, 因此很可能是 LC3-independent9。这一发现后来得到了10,11LC3 的研究证实, 这也表明, 依赖于 mitophagy (选择性自噬线粒体) 是独立的 LC310,11.
总而言之, 显然需要以货物为基础的化验来监测自噬性活动。最佳的这种化验应广泛适用, 定义明确, 易于执行。在过去的几年中, 我们对 LDH 螯合法的研究特别感兴趣, 这是在1980的12中由每 Seglen 开发的, 并以测量胞浆 ldh 为 sedimentable、自噬性液泡细胞的方法为基础。分数。乳酸脱氢酶是一种稳定的可溶性胞浆蛋白, 在 phagophores 包裹细胞质货物时易于相互隔离。因此, LDH 的封存是自噬性封存的一般措施。LDH 是完全退化的自噬性溶酶通路12。因此, 在酶抑制剂的存在,例如, bafilomycin A1 (生物滤池)13, 实验治疗效果直接反映了自噬性螯合活动的变化。在没有降解抑制剂的情况下, 可以测量 LDH 螯合和降解的改变的净效应。
乳酸脱氢酶螯合的测定是广泛适用的, 因为 ldh 是高度和无所不在表达的所有细胞类型, 和 LDH 水平可以准确地量化的酵素化验14,15。然而, 最初的协议12 -建立在原发鼠肝细胞-是相当耗时, 需要大量的启动材料以及一个定制的放电电容器。以循序渐进的方式, 我们已逐步将该检测转化为一种简便、通用的方法。首先, 原始的协议被适应了用于哺乳动物细胞线16。第二, 该方法实质上是缩小3,9。第三, 消除了协议中的几个步骤, 包括一个费力的密度缓冲步骤17。这同时使方法的进一步降尺度, 从最初的起点使用 10 cm 板材每样品16使用一个井从12井板材每样品 (即, 大约15倍较少开始材料)17。第四, 我们确定了一种商用电穿孔装置, 可取代自定义的放电电容器17。
在这里, 我们最新的乳酸脱氢酶封存试验的协议, 其中包括一些进一步简化的方法与以前发表的17相比, 提出。同时, 给出了一系列不同细胞类型的典型结果, 并给出了利用药理学和遗传击倒和剔除方法进行多行实验验证的方法。有关整个协议的总体流程方案, 请参见图 1。
研究方案
1. 细胞播种和治疗
-
培养黏附细胞在 75 cm2组织培养烧瓶在一个湿式孵化器与 5% CO2在37°c, 使用优选的培养基为有关的细胞类型。允许细胞生长, 直到它们到达接近汇合的细胞层。
注: 使用 RPMI 1640 培养基辅以10% 胎牛血清 (血清), 用于 LNCaP、HEK293、小鼠胚成纤维细胞 (MEFs)、BJ、MCF-7 和 RPE-1 细胞。- 用3毫升37摄氏度磷酸盐缓冲的生理盐水 (PBS) 冲洗细胞, pH 值为7.4。更换 PBS 与3毫升 0.25% (瓦特/v) 胰蛋白酶-ethylenediaminetetraacetate (EDTA), 并孵化瓶在一个湿润的孵化器与 5% CO2在37°c, 直到细胞分离 (2–5分钟)。
- 并用重悬7毫升培养基中含有10% 个血清的分离细胞。在离心管中混合10µL 细胞悬浮整除与10µL 0.4% 台盼蓝, 使用0.5–20µL 吸管尖。使用相同的吸管尖端立即填充计数室幻灯片, 并计算自动单元格计数器中的单元格。
-
使用含有10% 种血清的培养基, 并在12井组织培养板 (表面积 ~ 3.8 厘米2) 的每个井中使用无菌, 准备一个适当稀释 (见下文) 的细胞悬浮液1.1。2技术。允许生长在一个湿润的孵化器与 5% CO2在37°c, 直到达到所需的细胞密度,例如, 60–90% 汇合在收获。
注: 适当稀释的细胞悬浮, 将给予所需的细胞融合在收获将不同的细胞类型, 细胞类型, 以及根据时间和类型的实验治疗。因此, 在每种情况下都必须进行经验评估。- 对于将在播种后2天处理和收获的实验, 种子 2.5 x 105 LNCaP, HEK293 或 MCF-7 细胞, 5 x 104 MEFs, 4 x 105 BJ, 或 1.5 x 10 5 RPE-1 细胞在12井板的每个井。
- 对于松散粘附的单元格, 请在所讨论的单元格类型上涂上所推荐的涂层类型。对于 LNCaP (和 HEK293) 细胞使用涂覆聚 d-赖氨酸 (PDL) 的板材。
- 为此, 增加500µL PDL 在2.5 µg/毫升在不育 H2O 对每个井, 并且在无菌环境中孵化板材在室温下 (20–25°c)。用吸力去除 PDL, 用1毫升不育的 H2O 简单地洗涤每个井。
注意: 一般情况下, 步骤1.2.1 是在没有任何实验治疗的情况下完成的。然而, 如果执行 rna 干扰, 它可能是方便的开始反向转染与播种9。
-
在每一个条件下进行重复或三个井的实验治疗。
- 例如, 治疗细胞与50毫微米 mTOR 抑制剂 Torin1, 这通常是一个有效的诱导自噬性螯合, 或通过洗涤细胞与急性血清和氨基酸饥饿的1毫升氨基酸无酸厄尔的平衡盐溶液 (EBSS) 培养基, 然后在 5% CO2在37摄氏度的湿润孵化器中孵化1毫升 EBSS 的细胞。
- 留下一组未治疗的水井, 以确定 sedimentable LDH 的背景水平。
- 添加一个饱和量的后固位抑制剂 bafilomycin A1 (曝气生物滤池)3,13,16,18在缺乏或存在的实验治疗, 3–4 h 细胞前收获。孵化细胞在一个湿润的孵化器与 5% CO2在37摄氏度。
- 使用 100 nm 生物滤池 LNCaP, HEK293, BJ, MCF-7 和 RPE-1 细胞, 10 nm 生物滤池 MEFs。
- 对于只有 3–4 h (如步骤1.3.1 典型的例子) 的实验治疗, 同时添加曝气生物滤池处理。对于更长的实验治疗, 等到3-4 小时收获前, 并添加2µL 的500x 浓缩曝气生物滤料直接进入培养基。
- 在添加曝气生物滤池后立即搅拌板。在这一点上也可推荐添加 macroautophagic 螯合抑制剂作为控制,例如, 10 毫米的泛磷脂3激酶 (PI3K) 抑制剂 3-甲基腺嘌呤 (3MA)19, 或10µM 的选择性 PI3K 类 III。抑制剂 SAR-40520。
2. Electrodisruption 的细胞收获和制备
- 在治疗期结束时, 吸入培养基与吸力, 并添加200µL 细胞脱离解决方案 (预加热到37°c) 每井。孵育37摄氏度, 直到细胞分离 (通常约5分钟)。
注: 0.25% (w/v) 胰蛋白酶-EDTA 可代替细胞脱离溶液, 后者含有 DNase, 有助于降低分离细胞的粘度。只要培养基完全吸气, 在加入胰蛋白酶-EDTA 或细胞脱离溶液之前, 不需要清洗细胞。 - 添加500µL 室温 (20-25 °c) PBS, pH 7.4, 含 2% (瓦特/v) 牛血清白蛋白 (BSA) 每一个井, 并并用重悬与吸管, 直到没有细胞团簇是可见的。立即将细胞悬浮液转移到冰上的1.5 毫升离心管上。
注: 除非另有说明, 在冰上执行所有后续步骤。 - 通过离心 400 x g 5 分钟, 在4摄氏度沉积细胞。
- 彻底吸入上清液 (带吸力), 使细胞颗粒尽可能干燥。
- 添加400µL 10% (瓦特/v) 蔗糖 (在超纯 H2O) 到每管。
3. 血浆膜 Electrodisruption 分离 Sedimentable 和总细胞分数
- 并用重悬细胞颗粒与吸管获得近单细胞悬浮, 并将其转移到4毫米电穿孔试管。
注: 吹打10–15倍, 使用100–1,000 µL 吸管提示, 通常是足够的。 - 将试管在一个指数衰减波 electroporator, 并放电一个单一的电脉冲在 800 V, 25 µF, 400 Ω;这些设置产生一个8毫秒的脉冲。
-
使用新的吸管尖端转移细胞 disruptate 到一个1.5 毫升离心管, 其中包含400µL 冰-冷磷酸盐缓冲蔗糖溶液 (100 毫米磷酸钠, 2 毫米 dithiothreitol (德勤), 2 毫米 EDTA, 和1.75% 蔗糖, pH 7.5), 并简单地混合吹打.
- 可选: 为了验证高效的等离子膜 electrodisruption17, 在0.4% 毫升离心管中混合10µL 的稀释细胞 disruptate 从步骤3.3 到10µL 1.5 台盼蓝。转移到计数室, 并验证台盼蓝阳性细胞的百分比为 > 99%。
- 在室温下 (20–25°c) 将样品留在计数室中30分钟, 并验证台盼蓝阳性细胞的百分比保持在 > 99%。
- 可选: 为了验证 electrodisruption 是否过于苛刻, 即它没有扰乱胞内细胞器, 执行上述步骤 1.1–3.3, 但使用更大的起始材料 (井从6井板与80% 汇合细胞层),并使用150µL 10% 蔗糖在步骤2.5 和150µL 磷酸盐缓冲蔗糖溶液没有在步骤3.3。
- 在一个50毫升离心机中, 使用吸管在1.2 毫升密度缓冲液 (µL) 密度梯度介质 (g, 8% Nycodenz, 2.2% 毫米磷酸钠, 1 蔗糖, 2 毫米 EDTA) 上, 仔细200层稀释细胞 disruptate 溶液的顶部。管。离心机在 2万 x g为45分钟在4°c 在离心以软模式作用 (为温和的加速度和减速), 并且小心地把管子放在冰上。
- 小心去除60µL 的200µL 顶部分数, 确保不拿起任何密度梯度介质溶液, 并转移到一个新鲜的离心管。
注: 这应包含细胞质的特殊纯度, 称为 "细胞 sap"21。 - 通过使用标准技术和4–20% 梯度凝胶16, 测试在上述步骤中获得的分数的纯度, 通过对细胞器所含蛋白质进行印迹分析。
- 执行例如免疫印迹法蛋白酶 B21、细胞色素 c 和蛋白质二硫化物异构酶, 以验证步骤3.2 中的电击不会分别干扰溶酶体、线粒体或内质网, 应用免疫印迹乳酸脱氢酶检查细胞液中胞浆蛋白的存在。
- 同时, 对来自总细胞 disruptate 溶液16的蛋白质提取物进行免疫印迹法, 以确认所使用的抗体能检测到正在评估的胞器包含的蛋白质。
- 可选: 为了验证高效的等离子膜 electrodisruption17, 在0.4% 毫升离心管中混合10µL 的稀释细胞 disruptate 从步骤3.3 到10µL 1.5 台盼蓝。转移到计数室, 并验证台盼蓝阳性细胞的百分比为 > 99%。
- 对每个示例重复步骤3.1–3.3。
- 从每个稀释细胞 disruptate 溶液中除去550µL (在步骤3.3 中获得) 到2毫升离心管, 含900µL 冰泥沙缓冲器 (50 毫米磷酸钠, 1 毫米, 毫米 EDTA, 1 个蔗糖, pH 5.9%) 补充 7.5 BSA 和0.5%Tween-20, 并简单地混合吹打。
- 离心机在 1.8万 x g 45 分钟在4°c 生产含有 "沉淀 LDH" 的小球。彻底吸入上清液 (带吸力), 使小球尽可能干燥。把样品放在-80 摄氏度的冰箱里。
- 转移150µL 从每个稀释的细胞 disruptate 解答 (获得在步 3.3) 到新的管子, 并且放置样品在-80 °c 冷冻机。使用这些示例可以确定单元格中的 "总 LDH" 级别。
注意: 在这一点上, 实验可以暂停, 只要需要。
4. ldh 酶活性的提取和测定
- 解冻 "沉淀 ldh" (从步骤 3.6) 和 "总 LDH" 样品 (从步骤 3.7) 冰。
- 添加300µL 的冰冷泥沙缓冲液, 含有1.5% 的海卫 X-405 到 "总 LDH" 样品 (产生最终的海卫一 X-405 浓度 1%)。在冷室 (4–8°c) 的滚筒上旋转样品30分钟。
- 添加750µL 的冰冷泥沙缓冲器与1% 海卫 X-405 的 "沉淀 LDH" 样本, 并并用重悬颗粒与吸管, 直到达到均匀的解决办法。
- 离心机从步骤4.2 和4.3 的样品 1.8万 x g 5 分钟在4°c 到沉积难溶细胞碎片。
- 混合4个部分冷65毫米咪唑 (ph 7.5)/0.75 毫米丙酮酸与冷65毫米咪唑 (ph 7.5)/1.8 毫米 NADH 的一部分, 以获得一个工作解决方案, 稳定至少三周在4摄氏度。
- 混合3–30µL 的上清液从步骤4.4 与200µL 的步骤4.5 工作解决方案。
- 通过测定 ldh 酶活性, 测定 ldh 的含量, 当烟酰胺腺嘌呤二核苷酸 (还原型) (NADH) 吸光度在37摄氏度时, 与已知 LDH 浓度的标准相比, 其吸收率降低 340 nm。在反应接近完成之前进行吸光度测量,即直到 340 nm 的吸光度不再随时间变化。
注: 这是测定 LDH 活性的经典生化方法。虽然目前的协议执行的反应在37摄氏度, 它也可以执行在室温 (20–25°c), 这是可取的, 如果做手动分光光度法。目前的协议使用机器人 multianalyzer 仪器, 在一个自动化的方式混合样品与工作解决方案在一个96井板, 并衡量吸收率在 340 nm 37 °c 每二十年代3分钟。此后, 该仪器软件计算的浓度的 LDH, 表示为单位 (U)/L, 通过比较的吸收量测量的斜率相比, 通过校准获得的标准曲线与标准的已知 LDH浓度。这一方法的线性检测范围是 30–1,500 U/L。作为替代, 有各种各样的商业可用的试剂盒来测量 LDH 存在。其中一些是基于将酶反应与比色或荧光产物的生成相耦合, 使其他方法比紫外分光光度法检测, 以及其他线性检测范围。
5. 乳酸脱氢酶螯合的计算
- 计算每个样品的沉淀 ldh 对总 ldh 的百分比, 并考虑稀释和取样:
沉淀 LDH (%) =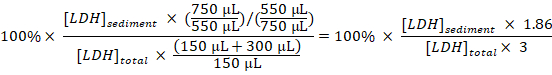
注: 在步骤3.1–3.3 大约50µL 丢失由于转移入和出电穿孔试管。因此, 计算从750µL (而不是800µL) 稀释细胞 disruptate 在步骤3.3。 - 减去未经处理的细胞 (步 1.3.2) 样品中获得的沉淀 ldh 的百分比, 从实验治疗细胞中获得的沉淀 ldh 的百分比, 除以曝气生物滤池的治疗时间, 以获得取样期间每小时隔离 LDH:
螯合 LDH (%/小时) =
结果
使用这里描述的协议, 大量自噬性螯合活动在许多不同的哺乳动物细胞系, 包括 LAPC4, DU145, Huh7, PNT2A, HeLa, VCaP, H3122, Hec1A, MCF-7, 小鼠胚胎成纤维细胞 (T47D), U2OS,HEK293、BJ 和 LNCaP 细胞进行了测量。在基本条件下 (在完全营养丰富的培养基中), 或者在急性饥饿的血清和氨基酸细胞 (一种真正的自噬诱导条件22) 下, 对螯合进行评估。结果表明, 在饥饿条件下?...
讨论
总之, 这里描述的协议是一种可靠和广泛适用的方法来监测哺乳动物细胞中的大块自噬性封存活动。与原来的方法12,16相比, 我们已经删除了一些不必要的步骤, 简化了几个剩余的步骤, 并引入了一个实质性的降尺度。因此, 该协议在成本和时间效率方面有了很大的改进, 与原始协议相比, 现在可以在不到一半的时间内处理相同数量的样本。对于24个样本, 步...
披露声明
作者没有利益冲突。
致谢
这项工作得到了挪威研究委员会、奥斯陆大学、安德斯 Jahre 基金会、南森基金会的资助, 以及纪念亨利霍曼的遗产。我们感谢郎水岛博士 ATG5+/+ MEFs 和 ATG5-/MEFs, 为 ATG7+/+ MEFs 和 ATG7-/MEFs, 并 Shizuo 博士为 ATG9A+/+ MEFs 和 ATG9A-/MEFs。我们感谢弗兰克 Sætre 的技术援助, 以及每 Seglen 博士为建设性的方法讨论。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
参考文献
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E., Bergmeyer, H. U. . Methods of enzymatic analysis (2nd English ed). 2, 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836 (2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。