A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
לקטט דהידרוגנאז פחמיות וזמינותו — שיטה פשוטה ואמינה לקביעת נפח פעילות פחמיות Autophagic בתאים בתרבית
In This Article
Summary
כאן מתואר פרוטוקול המאומת היטב ופשוט למדידת נפח פעילות פחמיות autophagic בתרבית של תאים. השיטה מבוססת על לכימות שחלקן של לקטט דהידרוגנאז (LDH) בחלקים תא sedimentable, לעומת סה כ רמות LDH הסלולר.
Abstract
תפזורת autophagy מאופיין על ידי פחמיות של חלקים גדולים של הציטופלסמה למבנים כפול/מולטי-membrane הנקרא autophagosomes. כאן מתואר פרוטוקול פשוט לעקוב אחר תהליך זה. יתר על כן, תוצאות טיפוסי ובדיקת ניסיוני של השיטה בתנאים בתדר autophagy מסוגים שונים בתרבית של תאים בתרבית הינם מסופקים. במהלך autophagy בתפזורת, autophagosomes sequester ציטוזול, ובכך גם חלבונים מסיסים cytosolic, לצד אחרים מטען autophagic. LDH הינה יציב מאוד אנזים cytosolic שופע, מסיסים שאינם סלקטיבי. מבודד לתוך autophagosomes. הכמות של LDH פחמיות ולכן משקף את כמות פחמיות autophagic בתפזורת. ביעילות ובדייקנות לקבוע LDH פחמיות בתאים, אנחנו מעסיקים פרוטוקול מבוסס electrodisruption fractionation המפריד ביעילות sedimentable LDH cytosolic, ואחריו מדידה של פעילות אנזימטי sedimentable שברים לעומת דגימות תאים שלמים. Autophagic פחמיות נקבע על ידי הפחתת שיעור sedimentable LDH בתאים לא מטופל מתאי שטופלו בתוך זה. היתרון של LDH פחמיות וזמינותו היא כי זה נותן מדד כמותי פחמיות autophagic של מטענים אנדוגני, לעומת שיטות אחרות גם לערב ביטוי חוץ רחמי של הגששים פחמיות או פרוטאז הכמותיים למחצה ניתוחים הגנה של סמנים autophagy או קולטנים.
Introduction
Autophagy (מיוונית "עצמי אוכל") היא תהליך ההכפלה אבולוציונית על השפלה vacuolar/lysosomal של חומר תאיים. על גילוי של גנים הקשורים autophagy ("ATG"), אשר חשובים עבור autophagy שמרים ובבני אדם, המימוש autophagy הזה משחק תפקיד משמעותי (הכיר בכך 2016 הנובל ברפואה או פיזיולוגיה כדי מחלה ובריאות האדם Yoshinori Ohsumi), autophagy הפך במהירות אחד מהתהליכים הכי בעוצמה למדה תא ביולוגיה1,2.
Macroautophagy (ןלהל "autophagy") הוא מאופיין על ידי ההרחבה, מתקפלים של קרום תאיים cisternae ("phagophores") לתוך חסומות, membrane כפול או ריבוי במבנים ("autophagosomes") sequester ביעילות חומר enwrapped משאר הציטופלסמה. על היתוך של autophagosomes עם lysosomes, קרום autophagosomal הפנימי ואת המטען מוחרמת מושפל, ממוחזר. Autophagosomes יכולים sequester חומר cytoplasmic אקראי (autophagy לא בררניים) והן נימוסים סלקטיבית (autophagy סלקטיבי). בתפזורת autophagy קרוב לוודאי מייצגת שילוב של autophagy לא בררניים, סלקטיבי.
ב שנות ה-60 וה-70 ("מורפולוגי עידן" autophagy מחקר), autophagic פחמיות הוערכה בעיקר באמצעות ניתוחים ultrastructural. בשנות השמונים ובתחילת שנות התשעים ("התקופה הביוכימי") לכל Seglen ועמיתים — מי למד autophagy בשנת החולדה הראשית hepatocytes — פיתח את השיטות הראשונות למדוד באופן כמותי את פעילות פחמיות autophagic3. באמצעות מבחני אלה, Seglen מוגדרת, מאופיין שלבים שונים של4,autophagic-lysosomal מסלול5גילה, טבע amphisome6 (התוצר של פיוז'ן אנדוזום-autophagosome), היה הראשון תאר את התפקיד של זירחון חלבונים ב autophagy בתקנה7. עם זאת, לאחר גילוי ATGs של 1990 ("התקופה מולקולרי"), אפיון חלבון ATG8 בתרבית של הראשון, חלבונים הקשורים microtubule 1A/1B-אור שרשרת 3 (LC3) ב- 20008, השימוש של חלבונים ATG כסמני עבור תהליך autophagic במהירות לפופולריות, שיטות ביוכימיות יותר מפרך ושנמצאת הושארו מאחור. למעשה, במהלך 18 השנים האחרונות, תספיג וניתוחים פלורסצנטיות מיקרוסקופיה של LC3 הפכו הפופולרי ביותר עד כה (ובמקרים רבים היחידה) פירושו של הלומדים autophagy בתאי יונקים. היתרון הוא הקלות שבה שיטות אלה יכול להתבצע. החיסרון הוא שזה הוא לומד מרכיב עגלה (LC3) במקום מטען autophagic בפועל. זה חיסרון די רציני, כי היחסים בין מדינות ו/או של שטף של LC3 דרך בשביל לעומת פחמיות, שטף של מטענים מאוד לא ברור. למעשה, אנחנו הראו כי שטף מטענים בצובר יכול להישמר ברמה גבוהה בתנאים שבו יש שטף LC3 אין, למרות נוכחותם של LC3 מצומדת ב9תאים. יתר על כן, אנו הפגינו autophagy בצובר הזה הוא לא מושפע על ידי דלדול LC3 יעיל, ולכן סביר שאינו תלוי-LC39. ממצא זה אושר מאוחר יותר על ידי LC3 מעלף מחקרים10,11, אשר גם עולה כי mitophagy תלויי-פרקין (autophagy סלקטיבי של המיטוכונדריה) היא עצמאית של LC310,11 .
לסיכום, יש ברור הצורך מבוסס-מטען מבחני לעקוב אחר פעילות autophagic. בצורה אופטימלית מבחני כזה צריך להיות בהרחבה ישימים, מוגדרים היטב וקל לביצוע. במהלך השנים האחרונות לקחנו את עניין מסוים וזמינותו פחמיות LDH, אשר פותחה על ידי לכל Seglen ב-198012, והיא מבוססת על מדידת ההעברה של cytosolic LDH כדי sedimentable, autophagic המכילים חלולית התא שברים. LDH הוא חלבון cytosolic יציב, מסיסים זה הוא ברצון משותפת מבודד כאשר phagophores שלכדו cytoplasmic מטענים. פחמיות של LDH לכן מדד כללי של פחמיות autophagic. LDH יורד באופן בלעדי על ידי שביל autophagic-lysosomal12. לפיכך, בנוכחות השפלה lysosomal מעכבי, למשל, bafilomycin A1 (Baf)13, טיפול ניסיוני השפעות ישירות לשקף שינויים בפעילות פחמיות autophagic. בהיעדרו של מעכבי השפלה, ניתן למדוד את השפעת שינויים ב- LDH פחמיות והשפלה נטו.
LDH פחמיות וזמינותו ישימה באופן כללי, כיוון LDH מאוד, ubiquitously מתבטא בכל סוגי התאים, LDH רמות ניתן לכמת במדויק על ידי מטוס14,assay אנזימטי15. עם זאת, המקורי פרוטוקול12 – נוסדה בשנת החולדה הראשית hepatocytes — היה במקום זמן רב והוא נדרש כמות גבוהה של החל בחומר, כמו גם קבל פריקה חשמלית בהזמנה אישית. באופן הדרגתיים, לנו יש בהדרגה הפך וזמינותו שיטה קלה ופסיביות. ראשית, הפרוטוקול המקורי הותאם לשימוש בתרבית של תאים שורות16. שנית, שיטת הפעולה היתה באופן משמעותי downscaled3,9. השלישי, מספר שלבים בפרוטוקול חוסלו, כולל כרית צפיפות מפרך בשלב17. זה מופעל בו זמנית של עוד יותר downscaling של השיטה, מנקודת ההתחלה המקורית של שימוש צלחת 10 ס מ לכל דגימה16 באמצעות לבאר בודדת מצלחת 12-טוב עבור דגימה (כלומר, כ 15-fold החל פחות חומר)17. רביעית, זיהינו מנגנון אלקטרופורציה מסחרי שיכול להחליף קבל פריקה חשמלית בהזמנה אישית17.
כאן מוצג שלנו פרוטוקול העדכנית ביותר של LDH פחמיות וזמינותו, הכולל כמה העבודה נוסף של השיטה לעומת ה-17 שפורסמו בעבר. יתר על כן, ערכה של טיפוסי התוצאות המתקבלות מספר סוגי התאים מוצג, חשוב, שורות מרובות של אימותים ניסיוניים של השיטה באמצעות נוקאאוט תרופתי, כמו גם גנטי וגישות נוק אאוט הינם מסופקים. לקבלת לסכימת הזרימה הכללית של פרוטוקול שלם, ראה איור 1.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. תא זריעה וטיפול
-
התרבות תאים חסיד ב- 75 ס מ2 תרביות רקמה מבחנות ב חממה humidified עם 5% CO2 ב 37 מעלות צלזיוס, תוך שימוש באמצעי תרבות מועדפת עבור סוג התא המדובר. מאפשרים לתאים לגדול עד שיגיעו שכבה תא בקרבת מקום ל- confluent.
הערה: השתמש בינוני RPMI 1640 בתוספת 10% עוברית שור נסיוב (FBS) LNCaP, HEK293, העכבר מתחלקים fibroblasts (MEFs), ג'יי, MCF-7, תאי RPE-1.- לשטוף את התאים עם 3 מ ל 37 ° C באגירה פוספט תמיסת מלח (PBS), pH 7.4. החלף את PBS 3 mL 0.25% (w/v) טריפסין-ethylenediaminetetraacetate (EDTA), דגירה. הבקבוק ב חממה humidified ב 5% CO2 ב 37 ° C עד התאים ניתוק (2-5 דקות).
- Resuspend התאים מנותקת 7 mL תרבות בינונית המכיל 10% FBS. מערבבים aliquot השעיה 10 µL תאים עם 10 µL 0.4% Trypan Blue בשפופרת microcentrifuge, באמצעות טיפ פיפטה 0.5 – 20 µL. שימוש בקצה פיפטה אותו למלא מיד שקופית קאמרית ספירה, ולספור התאים מונה הניתן תא אוטומטית.
-
להכין מתאים דילול (ראה הערה להלן) של התליה תא מלהשתמש שלב 1.1.2 תרבות בינוני המכיל 10% FBS וזרע 1 מ"ל של התא מדולל ההשעיה ב כל טוב של צלחת (שטח ~3.8 ס מ2) 12-ובכן תרביות רקמה באמצעות אספטי טכניקה. מאפשרים צמיחה חממה humidified עם 5% CO2 ב 37 ° C עד צפיפות התאים הרצויים הגיעה, למשל, 60 – 90% הנהרות-קציר.
הערה: דילול המתאים של התליה תא שתעניק את confluency התא הרצוי-קציר ישתנו מן סוג התא סוג התא, וכן על פי את משך וסוג ניסיוני טיפולים. לכן, זה חייב להיות מדעית מוערך בכל מקרה ומקרה.- לניסויים שהן שניהם התייחסו וקצרו 2 ימים לאחר זריעה, זרע 2.5 10x5 LNCaP, HEK293, או MCF-7 תאים, 5 x 104 MEFs, 4 x 105 BJ או 1.5 x 10 תאים5 RPE-1 מכל קידוח של צלחת 12-. טוב.
- עבור תאים ולהתבטא באופן רופף, מעיל הצלחות עם הסוג של ציפוי מומלץ עבור סוג התא המדובר. עבור תאים LNCaP (וגם HEK293) השתמש צלחות מצופה פולי-D-ליזין (PDL).
- לשם כך, הוסף 500 µL PDL ב 2.5 µg/mL סטרילי H2O מכל קידוח ולאחר דגירה הלוחות בסביבה סטרילית למשך 30 דקות בטמפרטורת החדר (20 – 25 ° C). להסיר את PDL עם השאיבה, ולשטוף היטב בקצרה עם 1 מ"ל סטרילי H2O.
הערה: בדרך כלל, שלב 1.2.1 נעשית ללא כל ניסיוני טיפולים. עם זאת, אם מבצע RNAi, יתכן נוח להתחיל של תרביות תאים הפוכה עם זריעה9.
-
לבצע טיפולים ניסיוניים בבארות כפולים או triplicate לכל תנאי.
- לדוגמה, מתייחסים התאים עם 50 nM של Torin1 מעכב mTOR, אשר בדרך כלל משרן יעיל של פחמיות autophagic, או נושא את התאים חריפה לרעב סרום, חומצת אמינו ע י שטיפת התאים עם 1 מ"ל של ארל נטול חומצה אמינית היא מאוזנת מלח בינוני פתרון (EBSS) ולאחר מכן דגירה תאי 1 מ"ל של EBSS ב חממה humidified עם 5% CO2 ב 37 º C.
- משאיר סט אחד של וולס לא מטופל כדי להגדיר רקע רמות של sedimentable LDH.
- להוסיף כמות saturating של bafilomycin פחמיות שלאחר מעכב A1 (Baf)3,13,16,18 היעדרות או נוכחות של טיפולים ניסיוניים, 3-4 שעות לפני תא קציר. דגירה התאים חממה humidified עם 5% CO2 ב 37 º C.
- שימוש 100 ננומטר Baf LNCaP, HEK293, ג'יי, MCF-7 ותאי RPE-1, ו- 10 ננומטר Baf עבור MEFs.
- עבור טיפולים ניסיוניים יש משך של רק 3-4 h (כמו אלה שלב החזרתם ב 1.3.1 יש בדרך כלל), הוסף Baf בו זמנית עם הטיפולים. עבור עוד טיפולים ניסיוניים לחכות עד 3-4 שעות לפני הקטיף, וכן להוסיף 2 µL של סימן x 500 מרוכז Baf המניה ישירות לתוך המדיום.
- מערבבים על ידי לזעזע את הצלחת מיד לאחר התוספת של Baf. בשלב זה הוא גם recommendable כדי להוסיף macroautophagic פחמיות מעכבי פקדים, למשל, 10 מ מ של פאן-phosphoinositide 3-קינאז (PI3K) מעכב 3-מתיל אדנין (3MA)19או 10 מיקרומטר של המחלקה PI3K סלקטיבי השלישי מעכב SAR-40520.
2. התא הקציר והכנה Electrodisruption
- בסוף תקופת הטיפול, תשאף המדיום עם השאיבה, ולהוסיף את הניתוק פתרון µL תא 200 (שחומם מראש ל- 37 ° C) כל טוב. דגירה ב 37 ° C עד התאים ניתוק (בדרך כלל בסביבות 5 דקות).
הערה: הואיל 0.25% (w/v) טריפסין-EDTA יכול לשמש במקום הפתרון ניתוק התא, שהשני מכיל DNase, אשר מסייע להפחית את צמיגות של התאים מנותקת. כל עוד המדיום ביסודיות aspirated, אין צורך לשטוף את התאים לפני תוספת של טריפסין-EDTA או תא פתרון ניתוק. - להוסיף 500 µL בטמפרטורת החדר (20-25 ° C) PBS, pH 7.4, המכיל 2% (w/v) אלבומין שור (BSA) על כל טוב, וכן resuspend עם פיפטה עד אין גושים תאים גלויים. להעביר מיד התליה תא ל 1.5 mL microcentrifuge צינורות על קרח.
הערה: אלא אם צויין אחרת, לבצע את כל הצעדים הבאים על קרח. - משקעים התאים על ידי צנטריפוגה ב x 400 g למשך 5 דקות ב 4 º C.
- ביסודיות וארוקן את תגובת שיקוע (עם השאיבה) לעזוב את כדורי תא יבש ככל האפשר.
- להוסיף 400 סוכרוז 10% (w/v) µL (ב- H הנדסה גנטית2O) כל שפופרת.
3. קרום פלזמה Electrodisruption והפרדה של שברים Sedimentable - וסה כתא
- Resuspend בגדר תא עם פיפטה כדי לקבל השעיה תא בודד ליד, להעביר אותו cuvette אלקטרופורציה 4 מ מ.
הערה: Pipetting שיהיה ~ 10-15 פעמים, באמצעות טיפ 100 – 1000 µL פיפטה, מספיקה בדרך כלל. - מניחים את cuvette electroporator גל דעיכה מעריכית, הפרשות דופק חשמלי יחיד-800 V, 25 µF וω 400; הגדרות אלה מייצרים דופק של משך ~ 8 ms.
-
להשתמש טיפ פיפטה חדש כדי להעביר את disruptate תא צינור microcentrifuge 1.5 mL המכיל 400 פתרון כקרח סוכרוז באגירה פוספט µL (100 מ מ נתרן monophosphate, dithiothreitol 2 מ מ (DTT), EDTA 2 מ מ ו- 1.75% סוכרוז, pH 7.5), ומערבבים בקצרה על ידי pipetting.
- אופציונלי: כדי לוודא קרום פלזמה יעיל electrodisruption17, לערבב 10 µL של disruptate התא מדולל מהשלב 3.3 עם 10 µL 0.4% Trypan Blue צינור microcentrifuge 1.5 mL. העברה לתא הספירה ולוודא כי הוא האחוז של תאים חיוביים Trypan Blue > 99%.
- להשאיר את הדגימה בתא ספירה למשך 30 דקות בטמפרטורת החדר (20 – 25 ° C), וודא כי אחוז תאים חיוביים Trypan Blue נותר > 99%.
- אופציונלי: כדי לוודא כי electrodisruption לא היה נוקשה מדי, כלומר, זה יש לא הפריע organelles תאיים, בצע את השלבים 1.1 – 3.3 כמתואר לעיל, אך השתמש בחומר המוצא גדול יותר (באר מצלחת 6-ובכן עם שכבת תאים confluent ~ 80%), ולהשתמש 150 µL 10% סוכרוז שלב 2.5 ו- 150 µL תמיסת סוכרוז באגירה פוספט ללא DTT בשלב 3.3.
- להשתמש על פיפטה כדי בזהירות שכבה 200 µL של הפתרון disruptate תא מדולל על גבי כרית צפיפות 1.2 מ של באגירה פוספט 8% (w/v) צפיפות בינונית מעבר צבע (למשל, 8% Nycodenz, 50 מ מ סודיום פוספט, 2.2% סוכרוז, 1 מ"מ EDTA) ומפרידה 2 מ שפופרת. צנטריפוגה ב 20,000 x g למשך 45 דקות ב 4 ° C ב- microcentrifuge עם פונקציית מצב רך (עבור עדין האצה והאטה) והניח בזהירות הצינורות על קרח.
- הסר בזהירות µL 60 של השבר ~ 200 µL העליון, מקפיד לא לאסוף כל פתרון הדרגתי בינוני צפיפות ולאחר להעביר צינור microcentrifuge טריים.
הערה: זה להכיל ציטוזול טוהר יוצאת דופן, כינה "תא sap"21. - מבחן הטוהר של השבר שהושג בשלב מעל, על ידי ביצוע ניתוחים תספיג של חלבונים הכילה-אברון, באמצעות טכניקות רגיל ו- 4 – 20% ג'ל הדרגתיות16.
- בצע immunoblotting לדוגמה עבור cathepsin B21, ציטוכרום c, וחלבון disulphide איזומראז, כדי לוודא כי הזרם החשמלי בשלב 3.2 יש לא שיבשו lysosomes, המיטוכונדריה או רשתית תוך-פלזמית, בהתאמה, ו- immunoblot עבור LDH כדי לוודא נוכחות של חלבון הצוף תא cytosolic.
- במקביל, מבצע immunoblotting תמציות חלבונים זני ה פתרון disruptate cell סך הכל16 כדי לאשר הנוגדנים בשימוש ניתן לזהות את החלבונים הכיל אברון זה הם המוערך.
- אופציונלי: כדי לוודא קרום פלזמה יעיל electrodisruption17, לערבב 10 µL של disruptate התא מדולל מהשלב 3.3 עם 10 µL 0.4% Trypan Blue צינור microcentrifuge 1.5 mL. העברה לתא הספירה ולוודא כי הוא האחוז של תאים חיוביים Trypan Blue > 99%.
- חזור על שלבים 3.1 – 3.3 עבור כל דגימה.
- להסיר 550 µL כל פתרון disruptate תא מדולל (שהושג בשלב 3.3) כדי microcentrifuge 2 mL צינורות המכיל 900 µL resuspension קר כקרח מאגר (50 מ מ נתרן monophosphate, 1 מ מ DTT, EDTA 1 מ"מ ו- 5.9% סוכרוז, pH 7.5) בתוספת BSA 0.5% ו- 0.01% Tween-20, מערבבים בקצרה על-ידי pipetting.
- צנטריפוגה ב 18,000 x g למשך 45 דקות ב 4 ° C כדי לייצר גללים המכיל "sedimented LDH". ביסודיות וארוקן את תגובת שיקוע (עם השאיבה) לעזוב את כדורי יבש ככל האפשר. מקם את הדגימות במקפיא-80 ° C.
- להעביר 150 µL כל פתרון disruptate תא מדולל (שהושג בשלב 3.3) צינורות חדשים, ולמקם את הדגימות במקפיא-80 ° C. להשתמש בדוגמאות אלה כדי לקבוע את רמות "סה כ- LDH" בתאים.
הערה: בשלב זה הניסוי ניתן להשהות עבור כל עוד הרצוי.
4. LDH החילוץ ומדידה של פעילות אנזימטי לקטט דהידרוגנאז
- להפשיר את "LDH sedimented" (מתוך שלב 3.6) ודוגמאות "סה כ- LDH" (מתוך שלב 3.7) על קרח.
- להוסיף 300 µL resuspension קר כקרח מאגר המכיל 1.5% טריטון X-405 ל- "LDH הכולל" דגימות (מניב ריכוז טריטון X-405 הסופי של 1%). לסובב את הדוגמאות על גלגלת בחדר קר (4 – 8 ° C) במשך 30 דקות.
- הוסף µL 750 המאגר הקר resuspension עם 1% טריטון X-405 ל- "sedimented LDH" דגימות, resuspend כדורי עם פיפטה עד פתרון הומוגני.
- Centrifuge דגימות מן שלב 4.2 ו- 4.3-x 18,000 g עבור 5 דקות ב 4 ° C כדי פסולת הסלולר משקעים undissolved.
- לערבב 4 חלקים מ מ 65 קר imidazole (pH 7.5)/0.75 פירובט מ מ עם חלק אחד של imidazole מ מ 65 קר (pH 7.5) / 1.8 מ"מ NADH להשגת פתרון עבודה יציב במשך שלושה שבועות לפחות ב 4 º C.
- מערבבים 3 – 30 µL של supernatants מ שלב 4.4 עם 200 µL של הפתרון עובד שלב 4.5.
- לקבוע את כמות LDH על ידי מדידת LDH פעילות אנזימטי כמו הירידה nicotinamide אדנין dinucleotide (טופס מופחתת) ספיגת (NADH)-340 nm ב 37 מעלות צלזיוס לעומת תקן עם ריכוז LDH ידוע. לבצע מדידות ספיגת עד התגובה פנה השלמה, דהיינו עד ספיגת-340 ננומטר כבר לא משתנה עם הזמן.
הערה: זוהי שיטת הביוכימי קלאסית כדי למדוד פעילות LDH. למרות בפרוטוקול הנוכחי מבצע את התגובה ב 37 מעלות צלזיוס, זה ניתן גם לבצע בטמפרטורת החדר (20 – 25 ° C), אשר מומלץ אם עושה ספקטרופוטומטר ידנית. בפרוטוקול הנוכחי משתמש מכשיר multianalyzer רובוטית, אשר באופן אוטומטי מתערבב דגימות עם הפתרון עובד בצלחת 96-ובכן, מודד את ספיגת-340 nm ב 37 ° C כל 20 s למשך 3 דקות. לאחר מכן, כלי התוכנה מחשבת את הריכוז של LDH, הביע כמו יחידות (U) / L, על-ידי השוואת השיפוע של המדידות ספיגת לאורך זמן בהשוואה עיקול רגיל מושגת באמצעות כיול עם תקן של LDH ידוע ריכוז. טווח לינאריות לזיהוי על-ידי גישה זו הוא 30 – 1,500 U/ל' כחלופה, קיים מגוון רחב של ערכות זמינים מסחרית כדי למדוד LDH. חלקם מבוססים על מצומדות אנזימטי לדור של ערכי צבע מוחלטים או פלורסנט מוצרים, המאפשרים זיהוי על ידי אמצעים אחרים מאשר ספקטרופוטומטר UV, ועם שאר הטווחים ליניארי של זיהוי.
5. חישוב של LDH פחמיות
- לחשב את אחוז LDH sedimented כדי LDH הכולל עבור כל דגימה, לוקח את דילולים ולדגום בחשבון:
LDH sedimented (%) =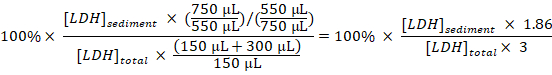
הערה: במהלך השלבים µL כ-50 3.1 – 3.3 זה איבדו בשל העברת את cuvette אלקטרופורציה וממנה. לפיכך, חישוב מהצורך סך של 750 µL (במקום 800 µL) של התא מדולל disruptate בשלב 3.3. - להפחית את אחוז LDH sedimented להשיג דגימות מתאי לא מטופל (שלב 1.3.2) מן האחוז של LDH sedimented להשיג דגימות תאים שטופלו ניסיוניים, הפער בזמן הטיפול עם Baf כדי לקבל את אחוז LDH מוחרמת לשעה בתקופת הדגימה:
. מבודד LDH (% / h) =
Access restricted. Please log in or start a trial to view this content.
תוצאות
באמצעות הפרוטוקול המתואר כאן, נפח פעילות פחמיות autophagic במספר קווים שונים בתרבית של תאים, כולל LAPC4, DU145, Huh7, PNT2A, הלה, VCaP, H3122, Hec1A, MCF-7, T47D, U2OS, PC3, G361, העכבר מתחלקים fibroblasts (MEFs), RPE-1. תאים HEK293, בי ג'יי ו LNCaP נמדדה. פחמיות היה מוערך בתנאים הבזליים (ב מלאה, עשירות בינוני), או בתאים בחריפות ב?...
Access restricted. Please log in or start a trial to view this content.
Discussion
לסיכום, הפרוטוקול המתואר כאן מייצג שיטה אמינה החלים נרחב כדי לעקוב אחר פעילות פחמיות autophagic בתפזורת בתאי יונקים. לעומת ה12,המקורי שיטת16, יש להסיר מספר צעדים מיותרים, פשוטה מספר השלבים הנותרים, ואנו הציג downscaling משמעותית. כתוצאה מכך, הפרוטוקול זה השתפר מאוד ביחס...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים יש אין ניגוד אינטרסים.
Acknowledgements
עבודה זו נתמכה כלכלית על ידי מועצת המחקר של נורבגיה, אוניברסיטת אוסלו, קרן Jahre אנדרס, קרן Nansen, המורשת לזכרו של הנריק Homan. אנו מודים ד ר Mizushima נובורו עבור ATG5 + / + MEFs ו- ATG5-/-MEFs, ד ר מסאקי Komatsu עבור ATG7 + / + MEFs ATG7/MEFs, ואת ד ר אקירה שיזואו עבור ATG9A + / + MEFs ו- ATG9A/MEFs. אנו מודים Sætre פרנק סיוע טכני, ד ר לכל O. Seglen על דיונים מועילים מתודולוגי.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
References
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, Pt 3 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E. Methods of enzymatic analysis (2nd English ed). Bergmeyer, H. U. 2, Verlag Chemie. 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836(2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved