このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
隔離の乳酸脱水素酵素試金-哺乳類細胞における一括 Autophagic 隔離活動を決定するシンプルで信頼性の高い方法
要約
ここで哺乳類細胞における一括 autophagic 貯留活性を測定する簡単なよく検証されたプロトコルが記述されています。メソッドは、sedimentable セル画総細胞 LDH レベルと比較して乳酸脱水素酵素 (LDH) の割合を定量化に基づいています。
要約
一括オートファジーは、ダブル/多 membrane 構造オートファゴソームと呼ばれる細胞質の大部分の隔離によって特徴付けられます。ここでこのプロセスを監視する単純なプロトコルを説明します。また、典型的な結果と各種培養細胞におけるオートファジー誘導下法の実験的検証を提供します。一括オートファジーの中にオートファゴソームは、細胞質、およびそれによりまた他のオートファジーの貨物と一緒に、可溶性細胞質蛋白質を隔離します。LDH は、安定と高い非選択的にオートファゴソームに隔離されます豊富な水溶性のゾル性細胞質酵素です。LDH 貯留量したがって一括 autophagic 貯留量が反映されます。Sedimentable 中の酵素活性の測定に続いて、ゾル性細胞質の LDH から sedimentable から効果的に分離分別の electrodisruption ベース プロトコルを用いて効率的かつ正確にセルで LDH 隔離の決定、全細胞サンプル対分数。オートファジーの隔離は、sedimentable その扱われた細胞から未処理細胞の LDH の割合を減算して決定されます。LDH 隔離アッセイの利点は、どちらかが隔離プローブまたは半定量的なプロテアーゼの異所性発現を含む他の方法ではなく、内因性の貨物のオートファジーの隔離の定量的測定を与えることオートファジーのマーカーや受容体の解析を保護。
概要
オートファジー (「自己を食べる」のギリシャ語) は、細胞内物質の液胞/ライソゾームの分解の進化保存されたプロセスです。酵母とヒトのオートファジーのために重要であるオートファジー関連 (「ATG」) 遺伝子の発見時に実現オートファジーは、人間の健康と病気 (2016年ノーベル医学・生理学によって認められる重要な役割を果たしています。大隅良典)、オートファジーは細胞生物学1,2で最も激しく学びのプロセスの 1 つになるすぐに。
Macroautophagy (以下「オートファジー」といいます) 延長で特徴づけられると効果的に隔離密閉、ダブル membrane の構造 (「オートファゴソーム」) に細胞内膜 cisternae ("phagophores") の折りたたみ、細胞質の残りの部分からそのただ中の材料。オートファゴソーム リソソームとの融合、時に内側 autophagosomal 膜と隔離の貨物は劣化や再生します。オートファゴソームは、ランダムな (非選択的オートファジー) と選択 (選択的オートファジー) マナーの両方で細胞質材料を隔離することができます。最も可能性の高い一括オートファジーは、非選択的、選択的オートファジーのミックスを表します。
1960 年代および 70 年代 (「形態」の時代オートファジー研究)、オートファジー隔離主に微細構造分析によって評価しました。1980 年代と 1990 年代 (「生化学的時代」) あたり Seglen と同僚の初め-初代ラット肝細胞でオートファジーを勉強した-定量的 autophagic 隔離アクティビティ3を測定する最初方法を開発しました。これらの試金を使用して、Seglen 定義しオートファジー ・ リソソーム経路4、5の異なるステップを特徴と、発見し amphisome6 (エンドソーム オートファゴソーム融合の製品) を鋳造し、初めてオートファジー規制7蛋白質のリン酸化の役割を説明します。ただし、1990 年代に ATGs (「分子時代」) の発見と哺乳類 ATG8 蛋白質の最初の特徴の後微小管結合蛋白質 1A 1B 光鎖 3 (LC3) の 2000年8、ATG タンパク質ためのマーカーとしての使用、オートファジーの古いより困難な生化学的置き去りになったプロセスはすぐに人気を得た。実際には、過去 18 年間、西部のしみ、LC3 の蛍光顕微鏡による解析で最も人気となっている (と多くの場合、唯一) 哺乳類細胞におけるオートファジーの勉強の手段。利点は、これらの方法を実施したことが比較的容易です。欠点は、1 つは実際のオートファジーの貨物ではなくカート コンポーネント (LC3) を勉強しています。これは、状態や隔離対経路を介して LC3 のフラックスと貨物のフラックスとの関係は非常に不透明なためより深刻な不利な点です。実際には、我々 はバルク貨物フラックスを条件下で高いレベルで保つことが、示されているセル9共役 LC3 の存在にもかかわらず、LC3 フラックスがないです。さらに、我々 はバルク オートファジー効率的 LC3 枯渇による影響はありません、したがって可能性が高い LC3 独立9を示した。この発見は後 LC3 ノックアウト研究10、11、パーキン依存 mitophagy (ミトコンドリアの選択的オートファジー) は LC310,11 の独立をも示すによって確認されています.
要約すると、明確な貨物に基づく試金 autophagic 活動を監視するために必要です。最適適用、明確、かつ簡単に実行、このような試金を広くする必要があります。最後の数年間で121980 年代にあたり Seglen によって開発された、sedimentable、autophagic 液胞を含む細胞へのゾル性細胞質の LDH の転送を測定に基づく LDH の隔離の試金に特に興味を採用して分数。LDH は、phagophores enwrap 細胞質の貨物と共同隔離が容易に安定した、水溶性ゾル性細胞質蛋白質であります。したがって、LDH の隔離です autophagic 隔離の一般的なメジャーです。オートファジー ・ リソソーム経路12LDH は低下のみ。したがって、ライソゾームの分解阻害剤バフィロマイシン A1などの存在下で (Baf)13日実験的治療の効果の直接 autophagic 隔離活動に変更を反映します。分解阻害剤がない場合は、LDH の隔離と劣化の変化の正味の効果を測定できます。
LDH はすべての細胞型で高度と普遍的表現され酵素アッセイ14,15によって LDH レベル、正確に定量化することができますので、LDH 隔離アッセイは広く適用可能で。しかし、元プロトコル12 -初代ラット肝細胞の確立、かなり時間がかかるは、開始材料としてカスタムメイド放電コンデンサーを大量を必要があります。段階的に徐々 に簡単で汎用性の高い方法にアッセイを変換している私たち。まず、元のプロトコルは哺乳類の細胞ライン16で使用用に脚色されました。第二に、メソッドは、大幅に縮小した3,9だった。第三に、プロトコルのいくつかの手順が排除された、手順17を骨の折れる密度クッションなど。これは同時に、さらにダウンスケー リング サンプル (すなわちより少ない約 15-fold を開始あたり 12 ウェル プレートから単一の井戸を使用してサンプル16あたり 10 cm の板を使用しての最初の出発点から、メソッドの有効になっています。素材)17。第四に、カスタムメイド放電コンデンサー17を置き換えることができます商業エレクトロポレーション機器を識別されます。
ここで LDH 隔離アッセイは、以前に公開された17と比較してメソッドのいくつかのさらなる簡略化が含まれています私たちの最新のプロトコルが表示されます。さらに、異なる種類の細胞の数で得られた典型的な結果のセットを表示すると、重要なは、薬理学的として遺伝子ノックダウンとノックアウト アプローチを用いた手法の実験的検証の複数行が提供されます。全体のプロトコルの全体フロー方式、図 1を参照してください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 細胞と治療
-
5% CO2問題のセル型の最寄りの培養液を使用して、37 ° c で加湿のインキュベーターで 75 cm2培養フラスコに細胞を付着。合流の近くの細胞層に達するまで成長する細胞を許可します。
注: を使用して、10% 牛胎児血清 (FBS) LNCaP HEK293、マウス萌芽期の繊維芽細胞 (MEFs) BJ の RPMI 1640 培 MCF-7、および網膜色素上皮 - 細胞。- 3 mL 37 ° C リン酸緩衝生理食塩水 (PBS)、pH 7.4 でセルを洗浄します。PBS に置き換えて 3 mL 0.25% (w/v) トリプシン-エチレンジアミン四酢酸 (EDTA)、セルをデタッチ (2-5 分) まで、37 ° C で 5% CO2と加湿のインキュベーターでフラスコを孵化させなさい。
- 10% を含む 7 mL 培養液中の剥離細胞を再懸濁します FBS。10 μ L で 10 μ L 細胞懸濁液因数をミックス 0.4 %0.5-20 μ L ピペット チップを用いた微量遠心チューブにトリパン ブルー。カウント チェンバー スライドをすぐに埋めるため同じピペット チップを使用し、自動化された細胞カウンターでセルをカウントします。
-
適切な準備希釈 1.1.2 のステップを使用してから細胞懸濁液の (下のメモを参照) 文化媒体含む 10 %fbs と種子無菌希釈セル中断 12 ウェル培養プレート (表面積 ~3.8 cm2) を使用しての各ウェル内の 1 mL技術。37 ° C で 5% CO2と加湿のインキュベーターで目的のセル密度に到達するまで、収穫の例えば、合流地点の 60-90% の成長を許可します。
メモ: セルの種類だけでなく、期間および実験的治療の種類によると、収穫目的のセル密度を与える細胞の懸濁液の適切な希釈がセル型から変動をします。したがって、これは経験的各場合で評価されなければなりません。- 実験の両方は扱われ、収穫 2 日後のシード、種子 2.5 x 105 LNCaP、HEK293、MCF 7 セル、5 × 104 MEFs、4 x 105 BJ、または 1.5 x 10 12 ウェル プレートの各ウェルに5 RPE 1 セル。
- 緩く付着細胞の細胞型の問題のため推奨コーティングの種類でプレートをコートします。LNCaP ・ HEK293 細胞ポリ-D-リジン (PDL) をコーティングしたプレートを使用します。
- そのために、各ウェル滅菌 H2O で 2.5 μ g/mL で 500 μ L PDL に追加し、室温 (20-25 ° C) で 30 分滅菌環境でプレートを孵化させなさい。吸引、PDL を取除き、洗浄も簡単に各 1 mL 滅菌 H2o.
注: 一般に、ステップ 1.2.1 は、任意の実験的治療することがなく行われます。しかし、RNAi を実行している場合、播種9逆トランスフェクションを開始する便利な場合があります。
-
帳票の写しの井戸 1 つの条件で実験的治療を実行します。
- 例えば、50 のセルを扱う一般にオートファジーの隔離の効率的な誘導または 1 ml のアミノ酸無料アールの細胞を洗浄することにより急性の血清およびアミノ酸飢餓のセルを対象 mTOR 阻害剤 Torin1 の nM のバランスソリューション (EBSS) 媒体を塩し、その後 37 ° C で 5% CO2と加湿のインキュベーターで EBSS の 1 mL の細胞をインキュベート
- Sedimentable LDH のバック グラウンド レベルを定義するために未処理井戸の 1 つのセットをままにします。
- 後隔離阻害剤バフィロマイシン A1 (Baf) の飽和量の追加有無実験的治療のセルの前に 3-4 時間で3,13,16,18収穫。37 ° C で 5% CO2と加湿のインキュベーターで細胞をインキュベートします。
- 使用 100 nM LNCaP、HEK293、BJ、MCF 7 と RPE 細胞の Baf と 10 nM MEFs 向け。
- 同時に治療で Baf のみ 3-4 h (のようなそれらでステップ 1.3.1 は通常ある) の期間を持つ実験的治療の追加。実験的治療になった収穫前に、3 4 h まで待つし、500 x の 2 μ L 媒体に直接 Baf 株式の集中を追加します。
- Baf の添加後すぐにプレートを攪拌して混ぜます。この時点でコントロール、例えば、パン ホスホイノシチド 3-キナーゼ (PI3K) 阻害剤 3-メチル アデニン (3 ma)19、10 mM または選択 PI3K クラス III の 10 μ M として macroautophagic 隔離阻害薬を追加する推奨もSAR 40520阻害剤。
2. 細胞の収穫と Electrodisruption のための準備
- 治療期間の終わりに、吸引中の吸引、200 μ L 細胞剥離液 (37 ° C に予熱) を各ウェルに追加します。セルをデタッチ (通常約 5 分) までは、37 ° C で孵化させなさい。
注: 0.25% (w/v) トリプシン-EDTA は、細胞剥離液の代わりに使用することがあります一方、後者が含まれます DNase には、剥離細胞の粘度を減らすことができます。媒体は吸気徹底的に限り、トリプシン EDTA または細胞の剥離溶液添加する前にセルを洗浄する必要はありません。 - 500 μ L 室温 (20-25 ° C) PBS、pH 7.4 では、各ウェルに 2% (w/v) ウシ血清アルブミン (BSA) を含むを追加し、細胞塊が表示されませんまでピペットで再懸濁します。すぐに氷の上 1.5 mL 容マイクロ チューブに細胞懸濁液を転送します。
メモ: 特記されない場合は、氷の上のすべての後続の手順を実行します。 - 土砂 4 ° C で 5 分間 400 × gで遠心分離によって細胞
- 徹底的に細胞ペレットをできるだけ乾燥させる (吸引)、上清を吸引します。
- 各チューブに 400 μ L 10% (w/v) スクロース (超純水 H2O) を追加します。
3. プラズマ膜 Electrodisruption と Sedimentable と合計細胞画分の分離
- 近い単一細胞懸濁液を取得するピペットで細胞ペレットを再懸濁し、4 mm エレクトロポレーション キュベットにそれを転送します。
注: ピペッティング上下 ~ 10-15 回、100-1,000 μ L ピペット チップを使用して通常十分です。 - キュヴェットを指数関数的減衰波遺伝子導入装置と 800 で単一電気パルス放電 V、25 μ F、400 Ω;これらの設定は、持続時間 〜 8 ms のパルスを生成します。
-
セル disruptate を 400 μ L 冷たいリン酸スクロース溶液 (100 mM ナトリウム一リン酸、2 mM ジチオトレイトール (DTT)、2 ミリメートルの EDTA、1.75% のサッカロース、pH 7.5)、1.5 mL 遠心チューブに転送する新しいピペット チップを使用し、簡単にミックスピペッティング。
- 省略可能: 効率的なプラズマ膜 electrodisruption17を確認するには、ミックス 10 μ L ステップ 3.3 から希薄セル disruptate の 10 μ L 0.4% トリパン ブルー 1.5 mL 遠心チューブに。カウントの商工会議所に転送し、トリパン ブルー陽性細胞の割合があることを確認 > 99%。
- 室温 (20-25 ° C) で 30 分のカウントの商工会議所にサンプルを残し、トリパン ブルー陽性細胞の割合が残っていることを確認してください > 99%。
- (省略可能)、electrodisruption は、あまりにも過酷されていない、それが細胞内オルガネラが中断されないことを確認、前述のように、手順 1.1-3.3 が大きい原料 (~ 80% コンフルエントの細胞層を 6 ウェル プレートからも) を使用して、手順 3.3 で DTT なしステップ 2.5 と 150 μ L ショ糖リン酸緩衝溶液中 150 μ L の 10% ショ糖溶液を使用します。
- 2 mL の遠心分離機のリン酸バッファー 8% (w/v) 密度勾配媒体 (例えば8 %nycodenz、50 mM リン酸ナトリウム、2.2% ショ糖、1 mM EDTA) の 1.2 mL 密度のクッションの上に希釈したセル disruptate ソリューションの慎重に層 200 μ L をピペットを使用します。チューブ。20,000 × g遠心機で 4 ° C の 45 分の (穏やかな加速、減速の)、ソフト ・ モード機能付きで遠心し、慎重に氷にチューブを入れてください。
- 作るの密度勾配の中のソリューションをピックアップし、新鮮な遠心管に転送しないようにしてください 〜 200 μ L のトップ画分の 60 μ L を慎重に取り外します。
注: これは、「細胞液"21と呼ばれる例外的な純度の細胞質を含める必要があります。 - 標準的な手法と 4-20% 勾配ゲル16を使用して細胞器官に含まれる蛋白質の西部のしみの分析を実行することによって上記の手順で得られた画分の純度をテストします。
- カテプシン B21シトクロム c とタンパク質ジスルフィド異性化酵素、3.2 で電気ショックが中断されないリソソーム、ミトコンドリアや小胞体、それぞれを確認するための immunoblot にたとえば免疫ブロットを実行します。LDH 細胞液のゾル性細胞質蛋白質の存在を確認します。
- 並行して、使用抗体がどう評価している細胞小器官に含まれるタンパク質を検出できることを確認する [集計] セルの disruptate ソリューション16から作られた蛋白質のエキスで免疫ブロットを実行します。
- 省略可能: 効率的なプラズマ膜 electrodisruption17を確認するには、ミックス 10 μ L ステップ 3.3 から希薄セル disruptate の 10 μ L 0.4% トリパン ブルー 1.5 mL 遠心チューブに。カウントの商工会議所に転送し、トリパン ブルー陽性細胞の割合があることを確認 > 99%。
- 各サンプルの手順 3.1-3.3.
- 900 μ L 冷たい再懸濁バッファー (50 mM ナトリウム一リン酸、1 mM DTT、1 mM EDTA および 5.9% のショ糖、pH 7.5) 0.01% と 0.5 %bsa を添加したを含む 2 mL 遠心チューブに (3.3 のステップで得られる) 各希釈セル disruptate ソリューションから 550 μ L を削除します。トゥイーン 20、および簡潔にでピペッティング ミックス。
- 18,000 × gで遠心するを生成する 4 ° C の 45 分のペレット"堆積 LDH"を含みます。徹底的にペレットをできるだけ乾燥させる (吸引)、上清を吸引します。-80 ° C のフリーザーにサンプルを配置します。
- (3.3 のステップで得られる) 各希釈セル disruptate ソリューションから新しい管に 150 μ L を転送し、-80 ° C のフリーザーにサンプルを配置します。セルに「LDH 総」レベルを決定するには、これらのサンプルを使用します。
注: この時点で実験を一時停止できるため必要な限り。
4. LDH 抽出と LDH 酵素活性の測定
- 雪解け (ステップ 3.6) から"堆積 LDH"と (ステップ 3.7) から氷の上の「LDH 総」サンプルです。
- 1.5% Triton X-405"総 LDH"サンプル (トリトン X-405 の最終濃度 1% の降伏) を含む冷たい再懸濁バッファーの 300 μ L を追加します。30 分の冷蔵室 (4-8 ° C) でローラーのサンプルを回転させます。
- 冷たい再懸濁バッファー 1% トリトン X-405"堆積 LDH"サンプルとの 750 μ L を追加し、均質なソリューションに到達するまでにピペットでペレットを再懸濁します。
- 不溶沈殿物細胞の残骸に 4.2 と 4.3 18,000 × g 4 ° C で 5 分間でのステップからサンプルを遠心します。
- 冷たい 65 mM のイミダゾールのミックス 4 の部分 (冷たい 65 mM のイミダゾール (pH 7.5) の 1 つの部分を持つ pH 7.5)/0.75 mM ピルビン酸/1.8 mM 4 ° C で、少なくとも 3 週間は安定した、実用的なソリューションを取得する NADH
- 上清 200 μ L で 4.5 の手順作業ソリューションの 4.4 ステップからの 3 – 30 μ L をミックスします。
- ニコチン酸アミドアデニンジヌクレオチド (還元型) の減少、LDH 酵素活性を測定することにより LDH の量を決定する (NADH) 吸光度 340 nm LDH 濃度が既知の標準と比較して 37 ° C で。反応、すなわち吸光度 340 まで完了に近づいているまで吸光度測定を実行 nm はもはや時間とともに変化します。
注: これは LDH 活性を測定する古典的な生化学的方法です。現在のプロトコルは、37 ° C で反応を行う、それも実行できます室温 (20-25 ° C) で手動による吸光光度法を行う場合であります。現在のプロトコルを使用して、ロボット multianalyzer の楽器は、自動化された方法で 96 ウェル プレートで実用的なソリューションとサンプルを混合し、340 で吸光度を測定する 37 ° C で nm 毎 20 秒 3 分で。その後、計測器ソフトウェア計算単位 (U) として表現される LDH 濃度 L、知られている LDH の標準校正を通じて得られた標準曲線と比較して時間をかけて吸光測定の斜面を比較することによって濃度。これにより検出の線形範囲は 30-1,500 U/l. です。代わりに、さまざまな LDH を測定する市販のキットが存在します。それらのいくつかはカップリング色または蛍光検出の他の線形範囲と紫外線吸光光度法より他の手段によって検出を有効にする製品の世代に酵素反応に基づいています。
5. LDH 隔離の計算
- 希釈を取って、考慮をサンプリング、各サンプルの総 LDH に堆積 LDH の割合を計算します。
堆積 LDH (%) =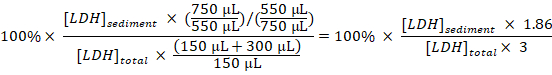
注: 手順中に 3.1 – 3.3 約 50 μ L はエレクトロポレーション キュベットの内外への転送のため失われます。したがって、手順 3.3 で希薄化後のセル disruptate の (800 μ L) ではなく 750 μ L の合計から計算します。 - Baf の割合を取得すると処理時間によって実験的に扱われた細胞、および分割からのサンプルで得られた沈殿の LDH の割合から未処理細胞 (ステップ 1.3.2) からサンプルで得られた沈殿の LDH の割合を減算します。サンプリング周期で時速 LDH を隔離します。
隔離 LDH (%/h) =
Access restricted. Please log in or start a trial to view this content.
結果
プロトコルを使用して記載、LAPC4、DU145、Huh7、PNT2A、hela 細胞、VCaP、H3122、Hec1A を含む、別の哺乳類の細胞ライン数の一括 autophagic 隔離活動 MCF 7 T47D、U2OS、PC3、G361、マウス萌芽期の繊維芽細胞 (MEFs)、網膜色素上皮-1LNCaP、BJ、HEK293 細胞を測定しました。隔離された (完全な栄養豊富な媒体) の基底条件下で査定や細胞における血清およびアミノ酸 ( bona fideオートフ...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
要約するは、ここで説明されているプロトコルは哺乳類セルの一括 autophagic 隔離アクティビティを監視する信頼性が高く、広く適用できるメソッドを表します。元法12,16と比較して、いくつかの不要なステップを削除、残りの手順のいくつかを簡略化して実質的なダウンスケー リング手法を導入します。結果として、プロトコルが大幅に効率に関?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は利害の対立があります。
謝辞
この作品は、ノルウェーの研究評議会、オスロ大学、Anders Jahre Foundation、ナンセン財団、ヘンリック ・ ホーマンのメモリで従来によって支えられた財政的に。我々 は、ATG5 の水島昇先生に感謝 + MEFs、ATG5/MEFs、ATG7 の小松雅明博士の + + + MEFs と atg 7生/MEFs、審良静男教授、ATG9A の + + MEFs と ATG9A/MEFs。建設的な方法論的議論のためのテクニカル サポートは、o. Seglen あたり博士フランク Sætre をありがちましょう。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
参考文献
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, Pt 3 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E. Methods of enzymatic analysis (2nd English ed). Bergmeyer, H. U. 2, Verlag Chemie. 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836(2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved