Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Laktat dehidrogenaz haciz tahlil — Toplu Autophagic haciz etkinliğini memeli hücreleri belirlemek için basit ve güvenilir Yöntem
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Memeli hücreleri toplu autophagic tutma etkinliği ölçmek için basit ve iyi doğrulanmış bir iletişim kuralı burada açıklanmıştır. Bu yöntem laktat dehidrogenaz (karaciğer) oranı miktarının toplam hücresel karaciğer düzeylere göre sedimentable hücre kesirler dayanır.
Özet
Toplu autophagy sitoplazma büyük bölümlerini haciz autophagosomes olarak adlandırdığı çift/multi-membrane yapılar ile karakterizedir. Bu işlem izlemek için basit bir protokol burada açıklanmıştır. Ayrıca, tipik sonuçları ve deneysel doğrulama yönteminin çeşitli kültürlü memeli hücreleri autophagy indükleyici koşullarda temin edilmektedir. Toplu autophagy sırasında sitozol ve böylece aynı zamanda diğer autophagic kargo yanında çözünen sitozolik protein autophagosomes çekilmek. Karaciğer bir istikrarlı ve son derece seçici olarak sigara autophagosomes gizlediği bol, çözünür sitozolik enzim var. Karaciğer haciz miktarını bu nedenle toplu autophagic haciz miktarını yansıtır. Verimli bir şekilde ve doğru bir şekilde karaciğer haciz hücreleri belirlemek için çalışan sayımız sitozolik karaciğer, ölçüm enzimatik sedimentable faaliyete ardından etkili sedimentable ayıran bir electrodisruption tabanlı ayırma iletişim kuralı Bütün hücre örnekleri karşı kesirler. Autophagic haciz sedimentable karaciğer içinde bu işlem görmüş hücreleri tedavi edilmezse hücrelerdeki oranı çıkarılarak belirlenir. Karaciğer haciz tahlil bu ya haciz probları veya yarı kantitatif proteaz ektopik ifade dahil diğer yöntemleri karşı endojen kargo autophagic haciz nicel bir ölçü verir avantajdır koruma analizleri autophagy işaretleri veya reseptörleri.
Giriş
Autophagy (Yunanca "kendi kendine yemek" için) hücre içi malzeme katmaninin/lizozomal bozulması için evrimsel korunmuş bir süreçtir. Autophagy Maya ve insanlar için önemli olan autophagy ile ilgili ("ATG") genlerin keşfi üzerine ve gerçekleşme bu autophagy insan sağlığı ve hastalıkları (2016 yılında Nobel Tıp veya Fizyoloji için tarafından kabul önemli bir rol oynar Yoshinori Ohsumi), autophagy hızla hücre biyoloji1,2en yoğun okudu işlemlerden biri haline gelmiştir.
(Bundan sonra "autophagy" anılacaktır) Macroautophagy genişleme karakterize ve katlama hücre içi membran cisternae ("phagophores"), etkili bir şekilde çekilmek en kapalı, çift veya çoklu membrane yapılar ("autophagosomes") sitoplazma geri enwrapped malzemesi. Organellerin ile autophagosomes füzyonu, iç autophagosomal membran ve münzevi kargo bozulmuş ve geri dönüşümlü. Autophagosomes rasgele (non-selektif autophagy) ve seçici (seçici autophagy) görgü sitoplazmik malzeme çekilmek olabilir. Toplu autophagy büyük olasılıkla a karıştırmak-in non-selektif ve seçici autophagy temsil eder.
1960 ve 70 's ("morfolojik dönemi" autophagy araştırma) autophagic haciz ultrastructural analizler esas olarak değerlendirildi. 1980 yılında ve başında 1990 ("biyokimyasal dönemi") başına Seglen ve iş arkadaşları — kim okudu birincil fare tetkikine autophagy — kantitatif autophagic haciz aktivitesi3ölçmek için ilk yöntemleri geliştirilmiştir. Bu deneyleri kullanarak, Seglen tanımlanan ve lizozomal autophagic yolu4,5farklı adımları ile karakterize, keşfetti ve amphisome6 (endosome-autophagosome füzyon ürün) icat ve ilk için protein fosforilasyon autophagy yönetmelik7rolünü açıklar. Ancak, ATGs ("moleküler dönemi") 1990'ın keşfi ve bir memeli ATG8 protein ilk karakterizasyonu sonra Mikrotubul ilişkili protein 1A/1B-hafif zincir 3 (LC3) 20008, ATG proteinler için işaretleyici olarak kullanımı autophagic süreci hızla popülerlik kazandı ve büyük ve daha zahmetli biyokimyasal Yöntemler geride. Aslında, son 18 yıldır, Batı leke ve floresan mikroskopi analizleri LC3 farkla en popüler hale gelmiştir (ve birçok sadece durumda) autophagy memeli hücrelerinde okuyan anlamına gelir. Bu yöntemler tarafından gerçekleştirilebilecek göreceli kolaylığı avantajdır. Bunu bir sepeti bileşeni (LC3) yerine gerçek autophagic kargo okuyor dezavantajdır. Devletler ve/veya LC3 akı karşı haciz yolu ile ve akı kargo arasındaki ilişki son derece belirsiz olduğundan oldukça ciddi bir dezavantaj, budur. Aslında, biz toplu kargo akı koşullar altında yüksek düzeyde muhafaza edilmesi göstermiştir hücreleri9konjuge LC3 varlığı rağmen hiçbir LC3 akı olduğu. Ayrıca, bu toplu autophagy verimli LC3 tükenmesi tarafından etkilenmez ve bu nedenle büyük olasılıkla LC3 bağımsız9gösterdi. Bu bulgu da Parkin bağlı mitophagy (mitokondri seçici autophagy) LC310,11 bağımsız olduğunu belirtmek LC3 knock-out çalışmalar10,11tarafından daha sonra doğrulanmıştır .
Özet olarak, açık bir işte deneyleri için kargo tabanlı autophagic etkinliğini izlemek gerekir. En iyi şekilde bu tür deneyleri geniş uygulanabilir, iyi tanımlanmış ve gerçekleştirmek kolay olmalıdır. Son birkaç yıl içinde biz 1980 's12' başına Seglen tarafından geliştirilmiş ve sitozolik karaciğer aktarmak sedimentable, autophagic çarpıtması içeren hücreye ölçme üzerinde dayanır karaciğer haciz tahlil özel bir ilgi almış kesirler. Karaciğer phagophores sitoplazmik kargo enwrap yükleyen kolayca ortak münzevi bir istikrarlı, çözünür sitozolik protein var. Haciz karaciğer, bu nedenle autophagic haciz genel bir ölçüsüdür. Karaciğer lizozomal autophagic yolu12tarafından özel olarak düşer. Böylece, huzurunda lizozomal bozulması inhibitörleri, Örneğin, bafilomycin A1 (Baf)13, deneysel tedavi etkileri doğrudan autophagic haciz etkinliğinde değişiklikleri yansıtmak. Bozulma inhibitörleri yokluğunda, karaciğer tutma ve yıkımı net etkisi ölçülebilir.
Karaciğer haciz tahlil geniş uygulanabilir, çünkü karaciğer son derece ve ubiquitously tüm hücre tiplerinde ifade edilir ve karaciğer düzeyleri doğru bir enzimatik tahlil14,15tarafından sayısal. Ancak, orijinal protokol12 — birincil fare tetkikine kurulan — oldukça zaman alıcı ve malzeme gibi bir ısmarlama elektrik deşarj kapasitör başlayan yüksek bir miktar gerekli. Step-wise bir şekilde yavaş yavaş kolay ve çok yönlü bir yöntem tahlil dönüştürdü. İlk olarak, özgün iletişim kuralını kullanmak üzere memeli hücre hatları16uyarlanmıştır. İkinci olarak, Yöntem önemli ölçüde downscaled3,9yaşındaydım. Üçüncü, zahmetli yoğunluğu hava yastığı da dahil olmak üzere17adım, protokol birkaç adımda elendi. Bu aynı anda bir daha da bir 10 cm tabak örnek16 başına 12-şey plaka (yaklaşık 15-fold daha az başlangıçyani, örnek başına tek bir kuyu kullanmaya kullanarak özgün başlangıç noktasından Yöntem downscaling etkin malzeme)17. Dördüncü olarak, özel yapım elektrik deşarj kapasitör17yerini alabilir bir ticari Elektroporasyon aparatı tespit edilmiştir.
Burada bizim en güncel iletişim kuralı ile karşılaştırıldığında daha önce yayımlanmış17 yönteminin bazı daha fazla basitleştirme içerir karaciğer haciz testin sunulur. Ayrıca, farklı hücre türleri bir dizi elde edilen tipik sonuçlar kümesi gösterilir ve önemlisi, farmakolojik hem de genetik nakavt ve nakavt yaklaşımları kullanarak yöntemi deneysel doğrulamaları birkaç satırlık sağlanmaktadır. İçin genel bir akış düzeni tüm iletişim kuralı bkz: Şekil 1.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. hücre tohum ve tedavi
-
Kültür 75 cm2 doku kültürü şişe oksijen kuluçka söz konusu hücre türü için tercih edilen kültür ortamı kullanarak 37 ° C'de % 5 CO2 yapışık hücreleri. Hücreleri bir birleşmesi yakınındaki hücre katmanı ulaşana kadar büyümeye izin.
Not etmek Kullanma ile % 10 fetal Sığır serum (FBS) LNCaP, HEK293, fare embriyonik fibroblastlar (MEFs), BJ, takıma RPMI 1640 orta MCF-7 ve RPE-1 hücreleri.- 3 mL 37 ° C fosfat tamponlu tuz çözeltisi (PBS), pH 7.4 hücrelerle yıkayın. PBS yerine 3 mL %0.25 (w/v) tripsin-ethylenediaminetetraacetate (EDTA) ve hücreleri (2-5 dk) ayırmak kadar oksijen kuluçka 37 ° C'de % 5 CO2 şişeye kuluçkaya.
- Müstakil hücreleri ile 7 mL kültür % 10 içeren orta resuspend FBS. 10 µL hücre süspansiyon aliquot ile 10 µL % 0,4 mix Trypan mavi bir microcentrifuge tüp 0,5-20 µL pipet ucu kullanarak. Hemen bir sayım odası slayt doldurmak için aynı pipet ucu kullanın ve bir otomatik hücre Counter hücreleri saymak.
-
Uygun bir hazırlamak seyreltme (aşağıdaki nota bakın) adım 1.1.2 kullanarak hücre süspansiyon kültür orta içeren %10 FBS ve tohum seyreltilmiş hücre süspansiyon 12-iyi doku kültürü plaka (yüzey alanı ~3.8 cm2) kullanarak her şey aseptik 1 mL tekniği. İstenen hücre yoğunluğu ulaşana kadar Örneğin, 60-%90 izdiham hasat, 37 ° C'de % 5 CO2 ile oksijen bir kuluçka büyüme sağlar.
Not: Uygun seyreltme istenen hücre confluency hasat verecek hücre süspansiyon hücre tipi hücre tipi yanı sıra süresi ve deneysel tedaviler türüne göre değişiklik gösterir. Böylece, bu ampirik olarak her durumda değerlendirildi gerekir.- Yapılacak deneyler için hem tedavi ve tohum, tohum 2.5 x 105 LNCaP, HEK293, veya MCF-7 hücreleri, 5 x 104 MEFs, 4 x 105 BJ veya 1.5 x 10 sonra 2 gün her şey 12-şey plaka5 RPE-1 hücrelerde hasat.
- Gevşek bağlı hücreler için söz konusu hücre tipi için önerilen kaplama türü ile tabakalar kat. LNCaP (ve HEK293) hücreler için poli-D-lisin ile (PDL) kaplamalı plakalar kullanın.
- Bu amaçla, her şey için 2,5 µg/mL steril H2O 500 µL PDL ekleyin ve plakaları, oda sıcaklığında (20-25 ° C) 30 dk için steril bir ortamda kuluçkaya. PDL emme kaldırmak ve her biri de kısaca 1 mL steril H2o yıkayın
Not: Genel olarak, herhangi bir deneysel tedaviler adım 1.2.1 yapılıyor. Ancak, RNAi gerçekleştirmek, bu ters bir transfection ile tohum9başlatmak uygun olabilir.
-
Koşul başına yinelenen veya onaylatılacak Wells deneysel tedaviler gerçekleştirmek.
- Örneğin, 50 hücrelerle tedavi genellikle autophagic haciz verimli bir uyarıcı olduğunu veya hücreleri 1 mL Earle amino asit içermeyen hücrelerle yıkayarak akut serum ve amino asit açlıktan ölecek konu mTOR inhibitörü Torin1 nM'ın dengeli Çözüm (EBSS) orta tuz ve daha sonra EBSS 1 mL oksijen kuluçka 37 ° C'de % 5 CO2 hücrelerinde kuluçkaya
- Sedimentable karaciğer arka plan düzeyleri tanımlamak için tedavi edilmezse Wells bir set bırakın.
- Sonrası haciz inhibitörü bafilomycin A1 (Baf) doyurarak bir miktar eklemek3,13,16,18 yokluğu veya varlığı deneysel tedaviler, hücre önce 3-4 h hasat. Hücreleri oksijen kuluçka 37 ° C'de % 5 CO2 kuluçkaya
- Kullanım 100 nM LNCaP, HEK293, BJ, MCF-7 ve 1 RPE hücrelerinin, Baf ve 10 nM Baf MEFs için.
- Sadece 3-4 h, (genellikle bu örneği içinde adım 1.3.1 varmış gibi) süresi olan deneysel tedaviler için ekleme Baf aynı anda tedaviler ile. Artık bu deneysel tedaviler için 3-4 h önce hasat beklemek ve bir 500 x 2 µL Baf stok doğrudan orta konsantre ekleyin.
- Hemen Baf eklenmesinden sonra plaka Tantanacı tarafından karıştırın. Bu noktada da macroautophagic haciz inhibitörleri denetimleri, Örneğin, pan-fosfoinositid 3-kinaz (PI3K) inhibitörü 3-Metil adenin (3MA)1910 mM ve seçici PI3K Sınıf III 10 µM eklemek için tavsiye inhibitörü SAR-40520.
2. hücre hasat ve Electrodisruption için hazırlık
- Tedavi süresi sonunda, orta emme Aspire edin ve her şey için 200 µL hücre dekolmanı çözümü (37 ° C-önceden ısıtılmış) ekleyin. Hücreleri (genellikle yaklaşık 5 dk) ayırmak kadar 37 ° C'de kuluçkaya.
Not: %0,25 (w/v) tripsin-EDTA hücre dekolmanı çözümü yerine kullanılabilir ise, ikinci DNaz, viskozite müstakil hücre azaltmaya yardım eder içerir. Orta iyice emişli sürece tripsin-EDTA veya hücre dekolmanı çözüm eklenmesi önce hücreleri yıkamak gerekli değildir. - Her şey için %2 (w/v) Sığır serum albumin (BSA) içeren 500 µL oda sıcaklığında (20-25 ° C) PBS, pH 7.4, eklemek ve pipet ile hiçbir hücre kümeleri görünür hale gelene kadar resuspend. Hemen hücre süspansiyon 1.5 mL microcentrifuge tüpler için buza aktarın.
Not: Aksi belirtilmedikçe, buz üstünde tüm sonraki adımları uygulayın. - Tortu hücreleri tarafından Santrifüjü 400 x g 4 ° C'de 5 min için de
- İyice süpernatant (ile emme) hücre topakları kadar mümkün olduğunca kuru bırakmak Aspire edin.
- 400 µL % 10 (w/v) sukroz (içinde ultrasaf H2O) her tüp için ekleyin.
3. plazma zarı Electrodisruption ve Sedimentable ve toplam hücre kesirler ayrılması
- Hücre Pelet çevre bir tek hücre süspansiyon elde etmek için bir pipet ile resuspend ve 4 mm Elektroporasyon küvet aktarın.
Not: alçalarak ~ 10-15 Pipetting zamanlarda, 100 – 1000 µL pipet ucu kullanarak genellikle yeterlidir. - Küvet bir üstel çürüme dalga electroporator yerleştirin ve tek elektrik nabzı 800 deşarj V, 25 µF ve 400 Ω; Bu ayarları ~ 8 ms süresi bir darbe üretmek.
-
Hücre disruptate 400 µL buz gibi fosfat tamponlu sükroz solüsyon (100 mM sodyum monofosfattır, 2 mM dithiothreitol (DTT), 2 mM EDTA ve %1.75 sukroz, pH 7.5) içeren 1.5 mL microcentrifuge tüp aktarmak için yeni bir pipet ucu kullanın ve tarafından kısa bir süre karıştırın Pipetting.
- İsteğe bağlı: verimli plazma zarı electrodisruption17doğrulamak için seyreltilmiş hücre disruptate adım 3.3 10 µL ile 10 µL % 0,4 mix Trypan mavi bir 1.5 mL microcentrifuge tüp. Aktarım sayım odasına ve Trypan mavi pozitif hücrelerinin yüzdesi olduğundan emin olun > % 99.
- Oda sıcaklığında (20-25 ° C) 30 dk için sayım odasında örnek bırakın ve Trypan mavi pozitif hücrelerinin yüzdesi kalmıştır doğrulayın > % 99.
- İsteğe bağlı: electrodisruption değil çok sert oldu, diğer bir deyişle, bu hücre içi organellerin bozulduğu, değil doğrulamak için adımları 1.1-3.3 yukarıda açıklandığı gibi ama daha büyük bir başlangıç materyali (6-şey plaka bir ~ %80 konfluent hücre katmanı ile bir kuyudan), kullanın ve 150 µL % 10 sükroz adım 2.5 ve 150 µL fosfat tamponlu sükroz çözüm DTT olmadan adım 3.3 kullanın.
- Bir pipet seyreltilmiş hücre disruptate çözümü fosfat tamponlu % 8 (w/v) yoğunluk gradient Orta (Örneğin, %8 Nycodenz, 50 mM sodyum fosfat, % 2.2 sukroz, 1 mM EDTA) 1.2 mL yoğunluğu yastık üstüne dikkatle µL katman 200 için bir 2 mL santrifüje kullanın Tüp. 20.000 x g için bir microcentrifuge 4 ° C'de 45 dk ile yumuşak modu görev (için nazik hızlanma ve yavaşlama), santrifüj kapasitesi ve dikkatle tüpler buza koy.
- 60 µL ~ 200 µL üst fraksiyonunun değil herhangi bir yoğunluk gradient orta çözüm kadar almak ve aktarmak için bir taze microcentrifuge tüp emin dikkatli bir şekilde çıkarın.
Not: Bu olağanüstü saflık, "hücre sap"21olarak adlandırdığı sitozol içermelidir. - Kesir saflığı proteinlerin standart teknikleri ve % 4-20 degrade jelleri16kullanarak organel yer alan, Batı leke analizleri gerçekleştirerek Yukarıdaki adımda elde test.
- Örneğin cathepsin B21, sitokrom c ve protein disülfür izomeraz, elektrik çarpması adım 3.2 organellerin, mitokondri veya endoplazmik retikulum, sırasıyla, kesintiye değil olduğunu doğrulamak için ve immunoblot için immunoblotting gerçekleştirmek Karaciğer hücre sap bir sitozolik protein varlığını doğrulamak için.
- Buna paralel olarak, immunoblotting kullanılan antikor değerlendirilir organel bulunan proteinler algılayabilir onaylamak için Toplam hücresini disruptate çözüm16 yapılan proteini özleri üzerinde gerçekleştirin.
- İsteğe bağlı: verimli plazma zarı electrodisruption17doğrulamak için seyreltilmiş hücre disruptate adım 3.3 10 µL ile 10 µL % 0,4 mix Trypan mavi bir 1.5 mL microcentrifuge tüp. Aktarım sayım odasına ve Trypan mavi pozitif hücrelerinin yüzdesi olduğundan emin olun > % 99.
- 3.1-3.3 her örnek için yineleyin.
- % 0.5 BSA ve % 0,01 ile 900 µL buz gibi resuspension arabellek (50 mM sodyum monofosfattır, 1 mM DTT, 1 mM EDTA ve % 5,9 sukroz, pH 7.5) içeren 2 mL microcentrifuge tüpler için her seyreltilmiş hücre disruptate çözümü (3.3 adımda elde edilen) 550 µL kaldırmak Ara-20 ve kısa bir süre ile pipetting karışımı.
- 4 ° C'de üretmek için 45 dk için 18.000 x g , santrifüj "posalı karaciğer" içeren unsurlardandır. İyice süpernatant (ile emme) granül mümkün olduğu kadar kuru bırakmak Aspire edin. Örnekleri-80 ° C dondurucuya koyun.
- 150 µL (3.3 adımda elde edilen) her seyreltilmiş hücre disruptate çözümü için yeni tüpler aktarmak ve örnekleri-80 ° C dondurucuya yerleştirin. Bu örnekler hücrelerdeki "Karaciğer toplam" düzeylerini belirlemek için kullanın.
Not: Bu noktada deneme için istenen sürece duraklatılmış.
4. karaciğer ayıklama ve karaciğer enzim aktivitesi ölçümü
- Tezcan (Kimden adım 3.6) "posalı karaciğer" ve "Karaciğer toplam" örnekleri (adım 3.7) buz üzerinde.
- Buz gibi resuspension arabelleği %1,5 "Toplam karaciğer" Triton X-405 örnekleri (verimli bir son Triton X-405 konsantrasyonu % 1) içeren 300 µL ekleyin. 30 dk soğuk oda (4-8 ° C) bir rulo üzerinde örnekleri döndürün.
- Buz gibi resuspension arabelleği %1 "Posalı karaciğer" Triton X-405 örnekleri ile 750 µL ekleyin ve homojen bir çözüm ulaşılana kadar granül bir pipet ile resuspend.
- Adım 4.2 ve 4.3 18.000 x g 4 ° C'de 5 min için de örnekleri undissolved tortu hücresel enkaz için santrifüj kapasitesi.
- Soğuk 65 mM imidazole parçalarını mix 4 (pH 7.5)/0.75 mM pyruvate soğuk 65 mM imidazole (pH 7.5) bir parçası ile / 1.8 mM NADH 4 ° C'de en az üç hafta boyunca stabil çalışan bir çözüm elde etmek için
- 3 – 30 µL adım 4.4 200 µL ile adım 4.5 çalışma çözüm supernatants, karıştırın.
- Karaciğer enzim aktivitesi Nikotinamid adenin dinükleotit (azaltılmış form) düşüş olarak ölçerek karaciğer miktarını (NADH) absorbans 340 nm bir standart olarak bilinen bir karaciğer konsantrasyon ile karşılaştırıldığında 37 ° C'de. Tepki tamamlama, yani 340 absorbans kadar yaklaştı kadar absorbans ölçümleri gerçekleştirmek nm artık zamanla değişir.
Not: Bu karaciğer etkinliği ölçmek için klasik biyokimyasal yöntemdir. Her ne kadar reaksiyon 37 ° C'de geçerli iletişim kuralı gerçekleştirdiği, bu da oda sıcaklığında (20-25 ° C), hangi el ile spectrophotometry yapıyor tavsiye edilir gerçekleştirilebilir. Geçerli iletişim kuralını kullanan otomatikleştirilmiş bir yolla örnekleri çalışan çözüm bir 96-şey plaka ile karışımları ve 340 absorbans ölçer bir robot multianalyzer enstrüman, 37 ° C nm'de her 20 s 3 dk için. Bundan sonra karaciğer, birimleri (U) olarak ifade edilen konsantrasyon enstrüman yazılım hesaplar / L, bilinen karaciğer bir standart ile kalibrasyon ile elde edilen bir standart eğrisine göre zaman içinde absorbans ölçümleri eğimi karşılaştırarak konsantrasyon. Bu yaklaşım tarafından algılamayı doğrusal dizi 30-1500 U/l. Alternatif olarak, çok çeşitli karaciğer ölçmek için piyasada kitleri adlı biri yok. Bazıları başka bir yöntemle UV spectrophotometry daha ve algılama doğrusal diğer aralıklar ile algılama etkinleştirme Renkölçer veya floresan ürünlerin üretimi için enzimatik reaksiyon kaplin temel alır.
5. karaciğer haciz hesaplanması
- Her örnek için dilutions almak ve dikkate örnekleme toplam karaciğer için posalı karaciğer yüzdesini hesaplamak:
Posalı karaciğer (%) =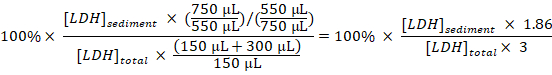
Not: adımları sırasında 3.1-3.3 yaklaşık 50 µL aktarımı içine ve dışına Elektroporasyon küvet nedeniyle kaybolur. Böylece, toplam 750 µL (yerine 800 µL) sahip olmaktan seyreltilmiş hücre disruptate adım 3.3'in hesaplayın. - Posalı karaciğer tedavi edilmezse hücrelerden (adım 1.3.2) posalı karaciğer tarafından Baf yüzdesini elde etmek için tedavi zamanla deneysel tedavi hücreleri ve bölmek örnekleri elde yüzdesi örneklerinden elde yüzdesi çıkarma münzevi karaciğer örnekleme döneminden saatte:
Münzevi karaciğer (% / h) =
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
İletişim kuralını kullanarak açıklanan burada, birkaç farklı memeli hücre satır, LAPC4, DU145, Huh7, PNT2A, HeLa, VCaP, H3122, Hec1A, dahil olmak üzere toplu autophagic haciz etkinliğinde MCF-7, T47D, U2OS, PC3, G361, fare embriyonik fibroblastlar (MEFs), RPE-1, HEK293, BJ ve LNCaP hücreleri ölçülür. Haciz (tam, besin açısından zengin ortamda) Bazal koşullar altında değerlendirilen veya hücrelerin içinde akut serum ve amino asitler (bir bona fide autophag...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Özetle, burada açıklanan protokol memeli hücreleri toplu autophagic haciz etkinliğini izlemek için güvenilir ve yaygın olarak uygulanabilir bir yöntem temsil eder. Orijinal yöntemi12,16için karşılaştırıldığında, biz gereksiz adımları bir dizi kaldırıldı, kalan adımları birkaç Basitleştirilmiş ve önemli downscaling tanıttı. Sonuç olarak, protokol maliyet ve zaman-verimliliği ile ilgili olarak, büyük ölçüde artırıldı ve ör...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar hiçbir çıkar çatışması var.
Teşekkürler
Bu eser mali Araştırma Konseyi Norveç, Oslo Üniversitesi, Anders Jahre Vakfı, Nansen Vakfı ve Henrik Homan anısına mirası tarafından desteklenmiştir. Biz Dr Noboru Mizushima ATG5 için teşekkür ederim +/ + MEFs ve ATG5-/-MEFs, Dr. Masaaki Komatsu ATG7 için +/ + MEFs ve ATG7/MEFs ve Dr. Shizuo Akira ATG9A için +/ + MEFs ve ATG9A/MEFs. Biz Frank Sætre teknik yardım ve Dr başına O. Seglen için yapıcı metodolojik tartışmalar için teşekkür ederim.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL and 2 mL microcentrifuge tubes | Eppendorf | 211-2130 and 211-2120 | |
| 12-well plates | Falcon | 353043 | |
| Accumax cell detachment solution | Innovative Cell Technologies | A7089 | Keep aliquots at -20 °C for years, and in fridge for a few months |
| Bafilomycin A1 | Enzo | BML-CM110-0100 | Dissolve in DMSO |
| BJ cells | ATCC | CRL-2522 | use at passage <30 |
| Bovine serum albumin (BSA) | VWR | 422361V | |
| Burker counting chamber | Fisher Scientific | 139-658585 | |
| Countess Cell Counting Chamber Slides | ThermoFisher Scientfic | C10228 | |
| Countess II Automated Cell Counter | ThermoFisher Scientfic | AMQAX1000 | |
| Cover glass for the Burker counting chamber | Fisher Scientific | 139-658586 | |
| Criterion Tris-HCl Gel, 4–20%, 26-well, 15 µL, 13.3 cm x 8.7 cm (W x L) | Bio-Rad | 3450034 | |
| DTT | Sigma-Aldrich | D0632 | |
| Earle's balanced salt solution (EBSS) | Gibco | 24010-043 | conatains 0.1% glucose |
| EDTA | Sigma-Aldrich | E7889 | |
| Electroporation cuvette (4 mm) | Bio-Rad | 1652088 | |
| Exponential decay wave electroporator | BTX Harvard Apparatus | EMC 630 | |
| Fetal bovine serum (FBS) | Sigma | F7524 | 10% final concentration in RPMI 1640 medium |
| HEK293 cells | ATCC | CRL-1573 | |
| Imidazole | Sigma-Aldrich | 56750 | Autoclave a 65 mM solution and keep in fridge for months |
| Incubator; Autoflow IR Direct Heat CO2 incubator | NuAire | NU-5510E | |
| Lipofectamine RNAiMAX Transfection Reagent | ThermoFisher | 13778150 | |
| LNCaP cells | ATCC | CRL-1740 | use at passage <30 |
| 3-Methyl Adenine (3MA) | Sigma-Aldrich | M9281 | Stock 100 mM in RPMI in -20 °C. Heat stock to 65 °C for 10 min, and use at 10 mM final concentration |
| Refridgerated Microcentrifuge | Beckman Coulter Life Sciences | 368831 | |
| Refridgerated Microcentrifuge with soft-mode function | Eppendorf | Eppendorf 5417R | |
| MRT67307 hydrochloride (ULKi) | Sigma-Aldrich | SML0702 | Inhibits ULK kinase activity. Dissolve in DMSO. |
| MaxMat Multianalyzer instrument | Erba Diagnostics | PL-II | |
| MCF7 cells | ATCC | HTB-22 | |
| NADH | Merck-Millipore | 1.24644.001 | |
| Nycodenz | Axis-Shield | 1002424 | |
| Opti-MEM Reduced Serum Medium | ThermoFisher | 31985062 | |
| Phosphate-buffered saline (PBS) | Gibco | 20012-019 | |
| Pipette tips 3 (0.5-20 µL) | VWR | 732-2223 | Thermo Fischer ART Barrier tips |
| Pipette tips (1-200 µL) | VWR | 732-2207 | Thermo Fischer ART Barrier tips |
| Pipette tips (100-1,000 µL) | VWR | 732-2355 | Thermo Fischer ART Barrier tips |
| Pipettes | ThermoFisher | 4701070 | Finnpipette F2 GLP Kit |
| Poly-D-lysine | Sigma-Aldrich | P6407-10X5MG | Make a 1 mg/mL stock solution in sterile H2O. This solution is stable at -20 °C for at least 1 year. |
| Pyruvate | Merck-Millipore | 1066190050 | |
| RPE-1 cells (hTERT RPE-1) | ATCC | CRL-4000 | |
| RPMI 1640 | Gibco | 21875-037 | |
| SAR-405 | ApexBio | A8883 | Inhibits phosphoinositide 3-kinase class III (PIK3C3). Dissolve in DMSO. |
| Silencer Select Negative Control #1 (siCtrl) | ThermoFisher/Ambion | 4390843 | |
| Silencer Select ATG9-targeting siRNA (siATG9A) | ThermoFisher/Ambion | s35504 | |
| Silencer Select FIP200-targeting siRNA (siFIP200) | ThermoFisher/Ambion | s18995 | |
| Silencer Select ULK1-targeting siRNA (siULK1) | ThermoFisher/Ambion | s15964 | |
| Silencer Select ULK2-targeting siRNA (siULK2) | ThermoFisher/Ambion | s18705 | |
| Silencer Select GABARAP-targeting siRNA (siGABARAP) | ThermoFisher/Ambion | s22362 | |
| Silencer Select GABARAPL1-targeting siRNA (siGABARAPL1) | ThermoFisher/Ambion | s24333 | |
| Silencer Select GABARAPL2-targeting siRNA (siGABARAPL2) | ThermoFisher/Ambion | s22387 | |
| Sodium phosphate monobasic dihydrate (NaH2PO4 • 2H2O) | Merck-Millipore | 1.06580.1000 | |
| Sodium phosphate dibasic dihydrate (Na2HPO4 • 2H2O ) | Prolabo | 28014.291 | |
| Sucrose | VWR | 443816T | 10% final concentration in water; filter through 0.45 µm filter and keep in fridge for months |
| Thapsigargin | Sigma-Aldrich | T9033 | Inhibits the SERCA ER Ca2+ pump. Dissolve in DMSO. |
| Triton X-405 | Sigma-Aldrich | X405 | 1% final |
| Trypan Blue stain 0.4% | Molecular Probes | T10282 | |
| Trypsin-EDTA (0.25% w/v Trypsin) | Gibco | 25200-056 | |
| Tween-20 | Sigma-Aldrich | P2287 | 0.01% final |
Referanslar
- Rubinsztein, D. C., Frake, R. A. Yoshinori Ohsumi's Nobel Prize for mechanisms of autophagy: from basic yeast biology to therapeutic potential. J R Coll Physicians Edinb. 46 (4), 228-233 (2016).
- Mizushima, N. The exponential growth of autophagy-related research: from the humble yeast to the Nobel Prize. FEBS Lett. 591 (5), 681-689 (2017).
- Seglen, P. O., et al. Macroautophagic cargo sequestration assays. Methods. 75, 25-36 (2015).
- Hoyvik, H., Gordon, P. B., Seglen, P. O. Use of a hydrolysable probe, [14C]lactose, to distinguish between pre-lysosomal and lysosomal steps in the autophagic pathway. Exp Cell Res. 166 (1), 1-14 (1986).
- Plomp, P. J., Gordon, P. B., Meijer, A. J., Hoyvik, H., Seglen, P. O. Energy dependence of different steps in the autophagic-lysosomal pathway. J Biol Chem. 264 (12), 6699-6704 (1989).
- Gordon, P. B., Seglen, P. O. Prelysosomal convergence of autophagic and endocytic pathways. Biochem Biophys Res Commun. 151 (1), 40-47 (1988).
- Holen, I., Gordon, P. B., Seglen, P. O. Protein kinase-dependent effects of okadaic acid on hepatocytic autophagy and cytoskeletal integrity. Biochem J. 284, Pt 3 633-636 (1992).
- Kabeya, Y., et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing. Embo j. 19 (21), 5720-5728 (2000).
- Szalai, P., et al. Autophagic bulk sequestration of cytosolic cargo is independent of LC3, but requires GABARAPs. Exp Cell Res. 333 (1), 21-38 (2015).
- Nguyen, T. N., et al. Atg8 family LC3/GABARAP proteins are crucial for autophagosome-lysosome fusion but not autophagosome formation during PINK1/Parkin mitophagy and starvation. J Cell Biol. , (2016).
- Pontano Vaites, L., Paulo, J. A., Huttlin, E. L., Harper, J. W. Systematic analysis of human cells lacking ATG8 proteins uncovers roles for GABARAPs and the CCZ1/MON1 regulator C18orf8/RMC1 in macro and selective autophagic flux. Mol Cell Biol. , (2017).
- Kopitz, J., Kisen, G. O., Gordon, P. B., Bohley, P., Seglen, P. O. Nonselective autophagy of cytosolic enzymes by isolated rat hepatocytes. J Cell Biol. 111 (3), 941-953 (1990).
- Bowman, E. J., Siebers, A., Altendorf, K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells. Proc Natl Acad Sci U S A. 85 (21), 7972-7976 (1988).
- Hadjivassiliou, A. G., Rieder, S. V. The enzymatic assay of pyruvic and lactic acids. A definitive procedure. Clin Chim Acta. 19 (3), 357-361 (1968).
- Bergmeyer, H. U., Bernt, E. Methods of enzymatic analysis (2nd English ed). Bergmeyer, H. U. 2, Verlag Chemie. 574-579 (1974).
- Engedal, N., et al. Modulation of intracellular calcium homeostasis blocks autophagosome formation. Autophagy. 9 (10), 1475-1490 (2013).
- Luhr, M., et al. A Simple Cargo Sequestration Assay for Quantitative Measurement of Nonselective Autophagy in Cultured Cells. Methods Enzymol. 587, 351-364 (2017).
- Mousavi, S. A., et al. Effects of inhibitors of the vacuolar proton pump on hepatic heterophagy and autophagy. Biochim Biophys Acta. 1510 (1-2), 243-257 (2001).
- Seglen, P. O., Gordon, P. B. 3-Methyladenine: specific inhibitor of autophagic/lysosomal protein degradation in isolated rat hepatocytes. Proc Natl Acad Sci U S A. 79 (6), 1889-1892 (1982).
- Ronan, B., et al. A highly potent and selective Vps34 inhibitor alters vesicle trafficking and autophagy. Nat Chem Biol. 10 (12), 1013-1019 (2014).
- Saetre, F., Hagen, L. K., Engedal, N., Seglen, P. O. Novel steps in the autophagic-lysosomal pathway. Febs j. 282 (11), 2202-2214 (2015).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
- Seglen, P. O., Overbye, A., Saetre, F. Sequestration assays for mammalian autophagy. Methods Enzymol. 452, 63-83 (2009).
- Hurley, J. H., Young, L. N. Mechanisms of Autophagy Initiation. Annu Rev Biochem. 86, 225-244 (2017).
- Thastrup, O., Cullen, P. J., Drobak, B. K., Hanley, M. R., Dawson, A. P. Thapsigargin, a tumor promoter, discharges intracellular Ca2+ stores by specific inhibition of the endoplasmic reticulum Ca2(+)-ATPase. Proc Natl Acad Sci U S A. 87 (7), 2466-2470 (1990).
- Kuma, A., et al. The role of autophagy during the early neonatal starvation period. Nature. 432 (7020), 1032-1036 (2004).
- Komatsu, M., et al. Impairment of starvation-induced and constitutive autophagy in Atg7-deficient mice. J Cell Biol. 169 (3), 425-434 (2005).
- Saitoh, T., et al. Atg9a controls dsDNA-driven dynamic translocation of STING and the innate immune response. Proc Natl Acad Sci U S A. 106 (49), 20842-20846 (2009).
- Gordon, P. B., Seglen, P. O. Autophagic sequestration of [14C]sucrose, introduced into rat hepatocytes by reversible electro-permeabilization. Exp Cell Res. 142 (1), 1-14 (1982).
- An, H., Harper, J. W. Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nat Cell Biol. 20 (2), 135-143 (2018).
- Fass, E., Shvets, E., Degani, I., Hirschberg, K., Elazar, Z. Microtubules support production of starvation-induced autophagosomes but not their targeting and fusion with lysosomes. J Biol Chem. 281 (47), 36303-36316 (2006).
- Velikkakath, A. K., Nishimura, T., Oita, E., Ishihara, N., Mizushima, N. Mammalian Atg2 proteins are essential for autophagosome formation and important for regulation of size and distribution of lipid droplets. Mol Biol Cell. 23 (5), 896-909 (2012).
- Øverbye, A., Sætre, F., Hagen, L. K., Johansen, H. T., Seglen, P. O. Autophagic activity measured in whole rat hepatocytes as the accumulation of a novel BHMT fragment (p10), generated in amphisomes by the asparaginyl proteinase, legumain. Autophagy. 7 (9), 1011-1027 (2011).
- Kominami, E., Hashida, S., Khairallah, E. A., Katunuma, N. Sequestration of cytoplasmic enzymes in an autophagic vacuole-lysosomal system induced by injection of leupeptin. J Biol Chem. 258 (10), 6093-6100 (1983).
- Rosado, C. J., Mijaljica, D., Hatzinisiriou, I., Prescott, M., Devenish, R. J. Rosella: a fluorescent pH-biosensor for reporting vacuolar turnover of cytosol and organelles in yeast. Autophagy. 4 (2), 205-213 (2008).
- Katayama, H., Kogure, T., Mizushima, N., Yoshimori, T., Miyawaki, A. A sensitive and quantitative technique for detecting autophagic events based on lysosomal delivery. Chem Biol. 18 (8), 1042-1052 (2011).
- Ogier-Denis, E., et al. A heterotrimeric Gi3-protein controls autophagic sequestration in the human colon cancer cell line HT-29. J Biol Chem. 270 (1), 13-16 (1995).
- Seglen, P. O., Gordon, P. B., Tolleshaug, H., Hoyvik, H. Use of [3H]raffinose as a specific probe of autophagic sequestration. Exp Cell Res. 162 (1), 273-277 (1986).
- Luhr, M., Sætre, F., Engedal, N. The Long-lived Protein Degradation Assay: an Efficient Method for Quantitative Determination of the Autophagic Flux of Endogenous Proteins in Adherent Cell Lines. Bio-protocol. 8 (9), e2836(2018).
- Ronning, O. W., Pettersen, E. O., Seglen, P. O. Protein synthesis and protein degradation through the cell cycle of human NHIK 3025 cells in vitro. Exp Cell Res. 123 (1), 63-72 (1979).
- Seglen, P. O., Grinde, B., Solheim, A. E. Inhibition of the lysosomal pathway of protein degradation in isolated rat hepatocytes by ammonia, methylamine, chloroquine and leupeptin. Eur J Biochem. 95 (2), 215-225 (1979).
- Seglen, P. O., Solheim, A. E. Valine uptake and incorporation into protein in isolated rat hepatocytes. Nature of the precursor pool for protein synthesis. Eur J Biochem. 85 (1), 15-25 (1978).
- Bauvy, C., Meijer, A. J., Codogno, P. Assaying of autophagic protein degradation. Methods Enzymol. 452, 47-61 (2009).
- Engedal, N., Seglen, P. O. Autophagy of cytoplasmic bulk cargo does not require LC3. Autophagy. 12 (2), 1-3 (2016).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır