A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
SA-β-Galactosidase القائم على فحص الفحص لتحديد الأدوية Senotherapeutic
* These authors contributed equally
In This Article
Summary
الحساسية الخلوية هي العامل الرئيسي في تطوير الأمراض المزمنة المرتبطة بالعمر. تحديد العلاجات التي تستهدف الخلايا المعمرة تظهر الوعد لتمديد الشيخوخة الصحية. هنا، نقدم اختبار جديد لفحص لتحديد senotherapeutics على أساس قياس الحساسية المرتبطة بيتا-Galactosidase النشاط في خلايا واحدة.
Abstract
الحساسية الخلية هي واحدة من السمات المميزة للشيخوخة المعروفة للتأثير سلبا على عمر صحي. الأدوية القادرة على قتل الخلايا المعمرة على وجه التحديد في ثقافة الخلايا، وتسمى senolytics، يمكن أن تقلل من عبء الخلايا المعمرة في الجسم الحي وتوسيع healthspan. وقد تم تحديد فئات متعددة من senolytics حتى الآن بما في ذلك مثبطات HSP90، مثبطات الأسرة BCL-2، piperlongumine، الببتيد مثبطة FOXO4 ومزيج من Dasatinib / Quercetin. الكشف عن SA-β-Gal في زيادة درجة الحموضة الليسوسومال هي واحدة من أفضل علامات تتميز للكشف عن الخلايا المعمرة. قياسات الخلايا الحية من senescence المرتبطة β-galactosidase (SA-β-Gal) النشاط باستخدام الركيزة الفلورسنت C12FDG في تركيبة مع تحديد رقم الخلية الإجمالي باستخدام الحمض النووي intercalating صبغ Hoechst يفتح إمكانية فحص الأدوية السيكوائية التي إما تقلل من النشاط الكلي SA-β-Gal عن طريق قتل الخلايا السينسنية (senolytics) أو عن طريق قمع SA-β-Gal وغيرها من الأنماط الظاهرية للخلايا السينسية (senomorphics). استخدام منصة عالية المحتوى الفلورسنت الحصول على الصور وتحليل يسمح لفحص سريع وعالية الإنتاجية من مكتبات المخدرات للآثار على SA-β-غال، مورفولوجيا الخلية ورقم الخلية.
Introduction
وصفت الحساسية الخلوية للمرة الأولى من قبل ليونارد هايفليك وبول مورهيد، الذي أظهر أن الخلايا الطبيعية لديها قدرة محدودة على الانتشار في الثقافة1. الخلايا السينسنتة تفشل في الانتشار على الرغم من وجود المواد الغذائية, عوامل النمو وعدم وجود تثبيط الاتصال, ولكن لا تزال نشطة التمثيل الغذائي2. وتعرف هذه الظاهرة باسم الحساسية المستنسخة ويعزى أساسا إلى تقصير التيلومير، على الأقل في الخلايا البشرية3. وقد أظهرت دراسات أخرى أن الخلايا يمكن أيضا أن تدفع إلى الخضوع للتخفيف استجابة لمحفزات أخرى، مثل الإجهاد الأنيكونوجيني (الأنكوجينية الناجمة عن الحساسية، OIS)، تلف الحمض النووي، والأدوية السامة للخلايا، أو التشعيع (الإجهاد الناجم عن الحساسية، SIS)4 , 5 , 6.ردا على تلف الحمض النووي، بما في ذلك تآكل التيلومير، والخلايا إما senesce، بدء نمو الخلايا غير المنضبط، أو الخضوع لالمبرمج إذا كان الضرر لا يمكن إصلاحه. في هذه الحالة ، يبدو أن الحساسية الخلوية مفيدة لأنها تعمل بطريقة قمعية للورم2. في المقابل، يتم زيادة الحساسية مع الشيخوخة بسبب تراكم الضرر الخلوي بما في ذلك تلف الحمض النووي. منذ الخلايا senescent يمكن أن تفرز السيتوكينات، metalloproteinases وعوامل النمو، ودعا النمط الظاهري الذي يرتبط بالحساسية (SASP)، وهذه الزيادة المعتمدة على العمر في الحساسية الخلوية وSASP يساهم في انخفاض الأنسجة التوازن و الشيخوخة في وقت لاحق. أيضا، ومن المعروف أن هذه الزيادة التي تعتمد على العمر في عبء الحساسية للحث على الأمراض الأيضية، وحساسية الإجهاد، ومتلازمات البروجريا، وضعف الشفاء7،8، وهو، في جزء منه، المسؤول عن العديد من العمر ذات الصلة الأمراض، مثل تصلب الشرايين، هشاشة العظام، انحطاط العضلات، تشكيل قرحة، ومرض الزهايمر9،10،11،12،13. القضاء على الخلايا المعمرة يمكن أن تساعد على منع أو تأخير خلل في الأنسجة وتمديد healthspan14. وقد تبين ذلك في نماذج الماوس المعدلة وراثيا14،15،16 وكذلك باستخدام الأدوية وتركيبات المخدرات التي تم اكتشافها من خلال كل من جهود فحص المخدرات وتحليل المعلوماتية الحيوية مسارات المستحثة على وجه التحديد في الخلايا السينسنت17،18،19،20،21،22. تحديد الأدوية العلاجية السيزوية المثلى، قادرة على الحد بشكل أكثر فعالية من عبء الخلايا المعمرة، هو خطوة هامة تالية في تطوير النهج العلاجية للشيخوخة الصحية.
تظهر الخلايا السينسية السمات الفينوتية والجزيئية المميزة، سواء في الثقافة أو في الجسم الحي. يمكن أن تكون علامات الحساسية هذه إما السبب أو نتيجة للتحريض الحساسية أو منتج ثانوي للتغيرات الجزيئية في هذه الخلايا. ومع ذلك، لم يتم العثور على علامة واحدة على وجه التحديد في الخلايا المعمرة. حاليا، المرتبطة بالحساسية β-galactosidase (SA-β-Gal) الكشف هو واحد من أفضل الأساليب ذات طابع وأنشئت على أساس خلية واحدة لقياس الحساسية في المختبر وفي الجسم الحي. SA-β-Gal هو هيدرولاس ليسوسومال مع النشاط الأنزيمي الأمثل في درجة الحموضة 4. قياس نشاطها في درجة الحموضة 6 ممكن لأن الخلايا المعمرة تظهر زيادة النشاط الليسوسومال23،24. بالنسبة للخلايا الحية ، يتم الحصول على زيادة درجة الحموضة اللايسومال عن طريق القلوية الليسوسومال مع مثبطات الفراغات H+-ATPase مثبطات بافيلوميسين A1 أو مثبطات التحمض الاندوسيومال الكلوروكين25،26. 5-Dodecanoylaminofluoressin Di-β-D-galactopyranoside (C12FDG) يستخدم كالركيزة في الخلايا الحية كما أنه يحتفظ المنتج المخطوف في الخلايا بسبب 12 الكربون lipophilic moiety25. الأهم من ذلك، لا يرتبط نشاط SA-β-Gal نفسه مباشرة مع أي مسار محدد في الخلايا المعمرة وليس من الضروري للحث على الحساسية. مع هذا الفحص، يمكن تحديد الخلايا المعمرة حتى في مجموعات الخلايا غير المتجانسة والأنسجة القديمة، مثل الخزعات الجلدية من الأفراد الأكبر سنا. كما تم استخدامه لإظهار وجود علاقة بين الحساسية الخلية والشيخوخة23 كما هو علامة موثوق بها للكشف عن الخلايا senescent في العديد من الكائنات والظروف27،28،29، 30. هنا، يتم وصف اختبار فحص SA-β-Gal عالي الإنتاجية استنادًا إلى الركيزة الفلورية C12FDG باستخدام الخلايا الليفية الجنينية الأولية للماوس (MEFs) مع شدة الأكسدة الناجمة عن الإجهاد والحساسية ومزاياه وعيوبه يتم مناقشتها. على الرغم من أن هذا الفحص يمكن أن يتم مع أنواع الخلايا المختلفة، واستخدام Ercc1نقص، وإصلاح الحمض النووي ضعف MEFs يسمح لتحريض أسرع من الحساسية في ظل ظروف الإجهاد التأكسدي. في الفئران، وانخفاض التعبير عن إصلاح الحمض النووي endonuclease ERCC1-XPF يسبب ضعف إصلاح الحمض النووي، والتراكم المتسارع لتلف الحمض النووي المحلي، وارتفاع ROS، الخلل الميتوكوندريا، وزيادة عبء الخلايا المعمرة، وفقدان وظيفة الخلايا الجذعية و الشيخوخة المبكرة، على غرار الشيخوخة الطبيعية31،32. وبالمثل، Ercc1-نقصMEFs الخضوع للسرعة أكبر في الثقافة17. ومن السمات الهامة لـ "الـ MEF" المناوئ ة أن كل بئر لديها خليط من الخلايا المعمرة وغير السينية، مما يسمح بإظهار واضح للآثار الخاصة بالخلايا. ومع ذلك، على الرغم من أننا نعتقد أن استخدام الإجهاد التأكسدي في الخلايا الأولية للحث على الحساسية هو أكثر فيزيولوجيا، وهذا الفحص يمكن أيضا أن تستخدم مع خطوط الخلايا حيث يتم حث الحساسية مع العوامل الضارة الحمض النووي مثل etoposide أو التشعيع.
Protocol
تمت الموافقة على استخدام الحيوانات من قبل لجنة سكريبس فلوريدا المؤسسية لرعاية الحيوانات واستخدامها.
1. توليد الأورام الليفية الجنينية (MEF) - 12-15 يوما
- عزل النوع البري وErcc1-/- MEFs من الفئران الإناث الحوامل في اليوم الجنيني 13 (E13) كما هو موضح سابقا33.
ملاحظة: يتم تنفيذ جميع الخطوات التالية في غطاء محرك السيارة زراعة الأنسجة في ظل ظروف العقيم واستخدام الأدوات المعقمة. - استئصال رأس الجنين فوق العينين.
- إزالة الأنسجة الحمراء (القلب والكبد) واستخدامها للكتابة الجينية إذا لزم الأمر.
- إعداد 500 مل من خليط 1:1 من دولبكو تعديل النسر المتوسط (DMEM) وF10 لحم الخنزير مع 10٪ مصل البقر الجنين، 1X الأحماض الأمينية غير الضرورية، البنسلين، والعقديات كوسيلة النمو وتسخينه تصل إلى 37 درجة مئوية لحوالي 15 دقيقة قبل كل استخدام. تخزين متوسط النمو عند 4 درجة مئوية.
- احتضان بقية الجنين مع 0.25٪ تريبسين / EDTA لمدة 10 دقيقة.
- يُقطّع الجنين إلى قطع 1 مم ويُنزل الأنسجة صعوداً وهبوطاً عدة مرات.
- إضافة 10 مل من النمو المتوسطة والأنسجة لوحة من جنين واحد لكل 10 سم قطرها خلية الثقافة لوحة (مرور 0).
- زراعة الخلايا في 37 درجةمئوية، 3٪ س 2، 5٪ CO2.
ملاحظة: فقط خلايا MEF إرفاق لوحات زراعة الأنسجة غير المغلفة في ظل هذه الظروف. - تغيير المتوسطة كل يوم في الممر 0 لإزالة الأنسجة غير المرفقة وشظايا الخلايا.
ملاحظة: اعتمادا على حجم الجنين ونوعية العزلة، وعادة ما تصل الخلية إلى الملاءمة بعد 2 إلى 3 أيام. - التجرب
- إزالة بعناية المتوسطة النمو وغسل الخلايا مع 10 مل من 1X PBS مرتين.
- إضافة 2 مل من 0.025٪ تريبسين / EDTA الحل للخلايا في لوحات قطرها 10 سم وحضانة في 37 درجة مئوية لمدة 2-3 دقيقة.
- تأكد من فصل الخلايا عن السطح عن طريق فحص الخلايا تحت المجهر.
- إنهاء الهضم التربسين عن طريق إضافة نفس الكمية من متوسط النمو.
- نقل الخلايا إلى أنبوب مخروطي وخلايا الطرد المركزي في 200 × ز لمدة 3 دقائق وتجاهل supernatant.
- إعادة تعليق الخلايا بعناية في وسط النمو الطازج، عد الخلايا وزرعها في لوحات جديدة في كثافة الخلية المتوقعة.
- للزراعة الفرعية غير senescent تقسيم الخلايا المترافقة 1:4 وتمتد لمرور آخر في 3٪ O2، 37 درجة مئوية لإنتاج المزيد من الخلايا (الممر 1).
ملاحظة: عند هذه النقطة يمكن الحفاظ على الخلايا في الثقافة أو تخزينها لاستخدامها في وقت لاحق في النيتروجين السائل، في cryovials التي تحتوي على ما يقرب من 1 مليون خلية لكل منها. كما توفر هذه الخطوة إمكانية توليد مجموعة مختلطة من الخلايا من الحيوانات المختلفة للحد من التباين الناجم عن تحليل الحيوانات الواحدة. - للحث على الحساسية الخلية، والبذور تقسيم الخلايا المترافقة من الممر 1 بنسبة 1:4 واحتضانلهم في 20٪ O2،37 درجة مئوية، 5٪ CO2 لمدة 3 أيام؛ هذه الظروف الثقافية هي الغلاف الجوي للأكسجين.
ملاحظة: زراعة الخلايا والكيسات الكيسية تحت تركيزات الأكسجين المحيطة يمكن أن ترفع علامات الحساسية الخلوية على وجه التحديد عندما يتم إعاقة إصلاح تلف الحمض النووي34،35،36. - كرر هذا الإجراء لمقاطع أخرى 2.
- لمراقبة الحساسية الخلوية، قياس الزيادة التدريجية في قطر الخلية وحجم الخلية خلال كل خطوة trypsinization باستخدام نظام عداد الخلية Coulter المتقدمة.
- تقييم الحد من انتشار الخلايا عن طريق تحديد تضاعف عدد السكان باستخدام المعادلة
PDT = (ر2-t 1)/3.32 x (سجل ن2 – سجل ن1)
ملاحظة: تم استخدام وقت مضاعفة السكان فقط للخلايا غير السينسية. - استخدام المرور المبكر البرية من نوع أو Ercc1-/- خلايا MEF التي تم الاحتفاظ بها في 3٪ O2،37 درجة مئوية، 5٪ CO2 كخلايا التحكم غير senescent.
2. فحص الفحص المرتبط بـ β-Gal - 2-3 أيام
- إعداد 10 مليون متر مربع حلول الأسهم في DMSO من جميع الأدوية التي سيتم اختبارها وتخزين aliquots في -80 درجة مئوية. لا تجميد ذوبان حلول الأسهم لأن هذا قد يقلل من نشاط المخدرات.
ملاحظة: هنا، تم استخدام مثبط HSP90 17DMAG كدواء senolytic قادرة على قتل الخلايا senescent على وجه التحديد17. - في يوم التجربة ذوبان aliquot، تمييع المخدرات في وسط الثقافة الطازجة وإضافة إلى الخلايا التي تحتوي على وسط مشروط بنسبة 1:1 لإنتاج التركيز النهائي في وسط النمو.
- استخدام 96 جيدا لوحات ما قبل التخفيف لتخفيف المسلسل وتركيبات المخدرات.
ملاحظة: بالنسبة لخلايا الـ MEF، تقرر تجريبياً أن تركيزات DMSO لا ينبغي أن تتجاوز 2% وينبغي أن يتم تضمين خلايا التحكم المعالجة بأعلى تركيزات DMSO المستخدمة في كل شوط. - البذور 5 × 103 الخلايا senescent أو 3 × 103 الخلايا غير senescent في بئر في 96 لوحات جيدا على الأقل 6 ح قبل العلاج في 100 ميكرولتر من النمو المتوسط والحضانة في 20٪ O2،37 درجة مئوية، 5٪ CO2.
ملاحظة: يجب أن تكون الخلايا حوالي 80٪ مترافق قبل العلاج. - استخدام الجدار الأسود / واضحة ثقافة الأنسجة السفلية، وتعامل 96 لوحات جيدا للحد من إشارة الفلورسنت عبر الحديث والخلفية.
ملاحظة: ومع ذلك، تم أيضاً اختبار لوحات واضحة بنجاح. - إضافة تخفيف المخدرات إلى خلايا MEF وحضانة لمدة 24 ساعة إلى48 ساعة تحت 20٪ س 2، 37 درجة مئوية، 5٪ CO2 الشروط.
- الحفاظ على الخلايا غير السينةتحت 3٪ O 2، 37 درجة مئوية، 5٪ CO2 الشروط.
- للقلوية الليسوسومية، قم بإعداد محلول بافيلوميسين A1 بمقدار 10 م، وعليكوت وحافظ على تجميده عند -20 درجة مئوية.
- لتحليل الفلورة من نشاط SA-β-Gal، إعداد 2 mM C12FDG حل الأسهم، وتخزين في -20 درجة مئوية، وحماية من الضوء.
- لحل العمل، وإعداد 100 μM C12FDG في وسط النمو في يوم التجربة.
ملاحظة: يجب تنفيذ كافة الخطوات (الحضانة) التي تنطوي على C12FDG في الظلام. - إزالة محلول المخدرات وغسل الخلايا 1 مرة مع 100 درجة مئوية من 1X PBS.
- حث القلوية الليسوسومال عن طريق المعالجة المسبقة الخلايا مع 90 درجة مئوية من 100 nM bafilomycinA1 الحل أعدت في ثقافة الخلايا الطازجة المتوسطة لمدة 1 ساعة في 20٪ O 2، 37 درجة مئوية، 5٪ CO2.
- إضافة 10 درجة مئوية من 100 μMC 12FDG حل العمل إلى وسط الثقافة (التركيز النهائي 10 μM).
- حضانة الخلايا لمدة 2 ساعة.
- إضافة 2 ميكرولتر من 100 ميكروغرام / مل Hoechst 33342 صبغ (التركيز النهائي 2 ميكروغرام / مل) إلى الثقافة والحضانة لمدة 20 دقيقة.
- إزالة وسائل الإعلام وإضافة 100 درجة مئوية من وسط النمو الطازجة.
3. كمية عالية المحتوى تحليل الصور الفلورية
- استخدام منصة عالية المحتوى الحصول على الصور الفلورية وتحليل للحصول على صور الفلورسنت من الخلايا في القناتين المناسبة لالتقاط Hoechst و C12FDG الفلورة (على سبيل المثال، DAPI وFITC قناة المسبقة، على التوالي).
ملاحظة: تتطلب بروتوكولات الاكتساب تعريف العديد من المتغيرات الخاصة بـ "التبيّاق". والغرض من بروتوكول الاقتناء هو التقاط عدد كاف من الصور الفلورية التي تركز على أعداد كافية من الخلايا لإجراء تحليل كمي في المراحل النهائية. - وضع بروتوكول تحليل مناسب عن طريق اختيار كل قناة وتحديد ما يؤهلك كسمة ذات أهمية في كل قناة، وذلك بتعديل معيار أو أكثر من المعايير الانتقائية.
- بالنسبة للنواة، استخدم مجموعات ما قبل التقسيم (مثل التجزئة النووية، تجزئة الحويصلة، تجزئة السيتوبلازم) التي تسمح بتحديد العضيات الخلوية على أساس معايير متعددة بما في ذلك المورفولوجيا والحجم والإشارة كثافه. تعديل هذه المعايير لتشمل النوى مع استبعاد الشظايا النووية والحطام الذي قد يكون لديه إشارة، ولكن، على سبيل المثال، كبيرة جدا أو صغيرة جدا بحيث لا يمكن أن تكون نواة.
- تحقق من الإشارة في قناة FITC التي هي الفلورة من C12FDG المُتَقَلِّب ويمثل مقدار النشاط المرتبط بـ β-galactosidase المرتبط بالحساسية في الخلايا.
ملاحظة: الخلايا السينسنت لديها نشاط أعلى المرتبطة بالحساسية β-galactosidase من الخلايا غير senescent; ومع ذلك، C12FDG الفلورة ستكون غير منفصلة ومستمرة، مما يستلزم وضع عتبة بين ما يعتبر C12FDG إيجابية وC12FDG خلية سلبية. - وباستخدام البرامج التحليلية المتاحة تجاريا، توليد عدد من الحالات التي تتداخل فيها منطقة محددة تحيط بالنواة (خلية مفترضة) مرة واحدة على الأقل مع قوات الدفاع الاتحادية من الرتبة جيم12فوق العتبة.
ملاحظة: البرنامج التحليلي تلقائياً بإنشاء عدد باستخدام ربط الهدف. هذا هو التعريف العملي للاختبار من خلية senescent، C12FDG إيجابية.
- تحليل جميع العينات في ثلاثة أضعاف مع 3-5 حقول لكل بئر ومتوسط القيم والانحرافات المعيارية التي يتم حسابها وفقا لذلك.
- حساب النسبة المئوية للخلايا المعمرة باستخدام الصيغة التالية:
الخلايا المعمرة (%) =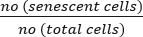 x 100
x 100
4. معايير التحقق من صحة التبيّن
- بالنسبة لجميع العينات تم حساب معامل التغيرات داخل وبين الاختلافات (%CVs) باستخدام الصيغة التالية:
السيرة الذاتية داخل القياس (n = 10 تكرارات مقاسة في تجربة واحدة) = x 100 (%)
x 100 (%)
فيما بين التجارب الذاتية (n = 5 تجارب مستقلة) = x 100 (%)
5 تجارب مستقلة) = x 100 (%) - لأغراض الفحص، تحديد قيمة Z'، وهي معلمة إحصائية لتقييم نوعية الفحص، من الخلايا المعالجة مع 200 nM رابامايسين لمدة 24 ساعة في 20٪ O2،37 درجة مئوية، 5٪ CO2 (مراقبة إيجابية للأدوية senotherapeutic) وغير المعالجة الخلايا المعمرة (التحكم السلبي).
ملاحظة: حُسبت قيمة Z وفقاً لـ Zhang et al.37. تشير قيم Z' بين 0.5 و1 إلى أنه يمكن استخدام الفحص لفحص المخدرات.
النتائج
يمكن الكشف عن نشاط SA-β-Gal في الخلايا التي يتم حثها على senesce بطرق مختلفة من الإرهاق التكراري، والإجهاد السمية الجينية والأكسدة، لتنشيط oncogene23،25،38. في النموذج الحالي باستخدام Ercc1-نقصالخلايا الليفية الجنينية الماوس، وظ...
Discussion
SA-β-Gal هو علامة حيوية محددة جيدا للوسن الخلوي ة التي اكتشفها في الأصل ديميري وآخرون. (1995) تبين أن الخلايا الليفية البشرية المعطرة قد زادت من نشاط SA-β-Gal عند اختبارها في درجة الحموضة 623 مقارنة بالخلايا المتكاثرة. وفي الوقت نفسه، في المختبر وفي الجسم الحي اتسياسي لSA-β-غال وقد أ?...
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد تم دعم هذا العمل من قبل المعهد الوطني للصحة المنح AG043376 (المشروع 2 والأساسية A، PDR; المشروع 1 وCore B, LJN) and AG056278 (Project 3 and Core A, PDR; and Project 2, LJN) وa grant from the Glen Foundation (LJN).
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Corning | 10-013-CV | medium |
| Ham's F10 | Gibco | 12390-035 | medium |
| fetal bovine serum | Tissue Culture Biologics | 101 | serum |
| 1x non-essential amino acids | Corning | 25-025-Cl | amino-acids |
| bafilomycin A1 | Sigma | B1793 | lysosomal inhibitor |
| C12FDG | Setareh Biotech | 7188 | b-Gal substrate |
| Hoechst 33342 | Life Technologies | H1399 | DNA intercalation agent |
| 17DMAG | Selleck Chemical LLC | 50843 | HSP90 inhibitor |
| InCell6000 Cell Imaging System | GE Healthcare | High Content Imaging System |
References
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Campisi, J., di Fagagna, F. D. Cellular senescence: when bad things happen to good cells. Nature Reviews Molecular Cell Biology. 8 (9), 729-740 (2007).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Zhu, J., Woods, D., McMahon, M., Bishop, J. M. Senescence of human fibroblasts induced by oncogenic Raf. Genes and Development. 12 (19), 2997-3007 (1998).
- Dimri, G. P., Itahana, K., Acosta, M., Campisi, J. Regulation of a senescence checkpoint response by the E2F1 transcription factor and p14(ARF) tumor suppressor. Molecular and Cellular Biology. 20 (1), 273-285 (2000).
- Michaloglou, C., et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature. 436 (7051), 720-724 (2005).
- Niedernhofer, L. J. Tissue-specific accelerated aging in nucleotide excision repair deficiency. Mechanisms of Ageing and Development. 129 (78), 408-415 (2008).
- Gitenay, D., et al. Glucose metabolism and hexosamine pathway regulate oncogene-induced senescence. Cell Death & Disease. 5, e1089 (2014).
- Erusalimsky, J. D., Kurz, D. J. Cellular senescence in vivo: its relevance in ageing and cardiovascular disease. Experimental Gerontology. 40 (8-9), 634-642 (2005).
- Kassem, M., Marie, P. J. Senescence-associated intrinsic mechanisms of osteoblast dysfunctions. Aging Cell. 10 (2), 191-197 (2011).
- Campisi, J., Andersen, J. K., Kapahi, P., Melov, S. Cellular senescence: A link between cancer and age-related degenerative disease. Seminars in Cancer Biology. 21 (6), 354-359 (2011).
- Golde, T. E., Miller, V. M. Proteinopathy-induced neuronal senescence: a hypothesis for brain failure in Alzheimer's and other neurodegenerative diseases. Alzheimers Research & Therapy. 1 (2), 5 (2009).
- Telgenhoff, D., Shroot, B. Cellular senescence mechanisms in chronic wound healing. Cell Death & Differentiation. 12 (7), 695-698 (2005).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Baker, D. J., et al. Naturally occurring p16-positive cells shorten healthy lifespan. Nature. , (2016).
- Childs, B. G., et al. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 354 (6311), 472-477 (2016).
- Fuhrmann-Stroissnigg, H., et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 8 (1), 422 (2017).
- Zhu, Y., et al. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging. 9 (3), 955-963 (2017).
- Zhu, Y., et al. Identification of a Novel Senolytic Agent, Navitoclax, Targeting the Bcl-2 Family of Anti-Apoptotic Factors. Aging Cell. , (2015).
- Zhu, Y., et al. The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. , (2015).
- Baar, M. P., et al. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 169 (1), 132-147 (2017).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature. , (2017).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences USA. 92 (20), 9363-9367 (1995).
- Itahana, K., Campisi, J., Dimri, G. P. Methods to detect biomarkers of cellular senescence: the senescence-associated beta-galactosidase assay. Methods in Molecular Biology. 371, 21-31 (2007).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-[beta]gal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Cahu, J., Sola, B. A sensitive method to quantify senescent cancer cells. Journal of Visualized Experiments. 78 (78), (2013).
- Collado, M., et al. Tumour biology: Senescence in premalignant tumours. Nature. 436 (7051), 642 (2005).
- Krishnamurthy, J., et al. Ink4a/Arf expression is a biomarker of aging. The Journal of Clinical Investigation. 114 (9), 1299-1307 (2004).
- Mishima, K., et al. Senescence-associated beta-galactosidase histochemistry for the primate eye. Investigative Ophthalmology, Visual Science. 40 (7), 1590-1593 (1999).
- Melk, A., et al. Expression of p16INK4a and other cell cycle regulator and senescence associated genes in aging human kidney. Kidney International. 65 (2), 510-520 (2004).
- Niedernhofer, L. J., et al. A new progeroid syndrome reveals that genotoxic stress suppresses the somatotroph axis. Nature. 444 (7122), 1038-1043 (2006).
- Wang, J., Clauson, C. L., Robbins, P. D., Niedernhofer, L. J., Wang, Y. The oxidative DNA lesions 8,5′-cyclopurines accumulate with aging in a tissue-specific manner. Aging Cell. 11 (4), 714-716 (2012).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. Journal of Visualized Experiments. (64), (2012).
- Jagannathan, L., Cuddapah, S., Costa, M. Oxidative stress under ambient and physiological oxygen tension in tissue culture. Current Pharmacology Reports. 2 (2), 64-72 (2016).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. J Assist Reprod Genet. 31 (10), 1259-1267 (2014).
- Robinson, A. R., et al. Spontaneous DNA damage to the nuclear genome promotes senescence, redox imbalance and aging. Redox Biology. 17, 259-273 (2018).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal Of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhao, H., Darzynkiewicz, Z. Biomarkers of cell senescence assessed by imaging cytometry. Methods in Molecular Biology. 965, 83-92 (2013).
- Yang, N. -. C., Hu, M. -. L. A fluorimetric method using fluorescein di-β-d-galactopyranoside for quantifying the senescence-associated β-galactosidase activity in human foreskin fibroblast Hs68 cells. Analytical Biochemistry. 325 (2), 337-343 (2004).
- Zhao, J., et al. Quantitative Analysis of Cellular Senescence in Culture and In Vivo. Current Protocols in Cytometry. 79, (2017).
- Capparelli, C., et al. CDK inhibitors (p16/p19/p21) induce senescence and autophagy in cancer-associated fibroblasts, "fueling" tumor growth via paracrine interactions, without an increase in neo-angiogenesis. Cell Cycle. 11 (19), 3599-3610 (2012).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. GammaH2AX as a molecular marker of aging and disease. Epigenetics. 5 (2), 129-136 (2010).
- Hewitt, G., et al. Telomeres are favoured targets of a persistent DNA damage response in ageing and stress-induced senescence. Nature Communications. 3, 708 (2012).
- Narita, M., et al. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 113 (6), 703-716 (2003).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging-Us. 5 (1), 37-50 (2013).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is β-Galactosidase Staining a Marker of Senescence in Vitro and in Vivo?. Experimental Cell Research. 257 (1), 162-171 (2000).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved