É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio de triagem à base de SA-β-galactosidase para a identificação de medicamentos Senoterapêuticos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A senescência celular é o fator-chave no desenvolvimento de patologias crônicas relacionadas à idade. A identificação da terapêutica que visam as células senescentes mostra a promessa de estender o envelhecimento saudável. Aqui, nós apresentamos um ensaio novo à tela para a identificação do senotherapeutics baseado na medida da atividade associada da senescência β-galactosidase em únicas pilhas.
Resumo
A senescência celular é uma das marcas de envelhecimento conhecidas por influenciar negativamente uma vida saudável. Drogas capazes de matar células senescentes especificamente na cultura celular, denominado senolíticos, pode reduzir a carga celular senescente in vivo e estender healthspan. Foram identificadas várias classes de senolíticos até à data, incluindo inibidores da HSP90, inibidores da família Bcl-2, piperlongumina, um peptídeo inibitório FOXO4 e a combinação de Dasatinib/quercetina. A detecção de SA-β-GAL em um aumento do pH lisossomal é um dos melhores marcadores caracterizados para a detecção de células senescentes. Medições de células ao vivo de atividade de β-galactosidase (SA-β-GAL) associada à senescência usando o substrato fluorescente C12FDG em combinação com a determinação do número total de células usando um corante de Hoechst de intercalação de DNA abre a possibilidade de tela para medicamentos senoterapêuticos que reduzem a atividade geral de SA-β-GAL por morte de células senescentes (senolíticos) ou suprimindo SA-β-GAL e outros fenótipos de células senescentes (senomorphics). O uso de uma plataforma de aquisição e análise de imagens fluorescentes de alto conteúdo permite a triagem rápida e de alta produtividade de bibliotecas de medicamentos para efeitos em SA-β-GAL, morfologia celular e número de células.
Introdução
A senescência celular foi descrita pela primeira vez por Leonard Hayflick e Paul Moorhead, que mostraram que as células normais tinham uma capacidade limitada de proliferar na cultura1. As células senescentes não proliferam apesar da presença de nutrientes, fatores de crescimento e falta de inibição de contato, mas permanecem metabolicamente ativos2. Esse fenômeno é conhecido como senescência replicativa e foi atribuído principalmente ao encurtamento do telômero, pelo menos nas células humanas3. Estudos adicionais mostraram que as células também podem ser induzidas a sofrer senescência em resposta a outros estímulos, como estresse oncogênico (senescência induzida por oncogenes, OIS), dano de DNA, drogas citotóxicas ou irradiação (senescência induzida por estresse, SIS)4 , 5. º , 6. em resposta a danos de DNA, incluindo a erosão do telômero, células ou senesce, iniciar o crescimento celular descontrolado, ou submeter-se a apoptose se o dano não pode ser reparado. Neste caso, a senescência da pilha parece ser benéfica porque actua em uma maneira supressiva do tumor2. Em contraste, a senescência é aumentada com o envelhecimento devido ao acúmulo de danos celulares, incluindo danos ao DNA. Desde que as pilhas senescentes podem secretar cytokines, metaloproteinases e fatores de crescimento, denominados o phenotype secretora senescência-associado (SASP), este aumento idade-dependente na senescência celular e no SASP contribui à homeostase diminuída do tecido e subsequentemente envelhecimento. Além disso, esse aumento dependente da idade na carga de senescência é conhecido por induzir doenças metabólicas, sensibilidade ao estresse, síndromes de progeria e cicatrização prejudicada7,8 e é, em parte, responsável pelas inúmeras doenças como aterosclerose, osteoartrite, degeneração muscular, formação de úlcera e doença de Alzheimer9,10,11,12,13. Eliminar as células senescentes pode ajudar a prevenir ou atrasar a disfunção tecidual e estender o Califórnia14. Isso tem sido demonstrado em modelos de camundongo transgênico14,15,16, bem como usando drogas senolíticas e combinações de drogas que foram descobertas através de ambos os esforços de triagem de drogas e análise Bioinformatica de vias induzidas especificamente em células senescentes17,18,19,20,21,22. A identificação de medicamentos senoterapêuticos mais ideais, capazes de reduzir de forma mais efetiva a carga celular senescente, é um passo importante no desenvolvimento de abordagens terapêuticas para o envelhecimento saudável.
As pilhas senescent mostram características fenotípicas e moleculars característicos, na cultura e in vivo. Estes marcadores da senescência podiam ser a causa ou o resultado da indução da senescência ou de um subproduto de mudanças moleculars nestas pilhas. No entanto, nenhum único marcador é encontrado especificamente em células senescentes. Atualmente, a detecção de β-galactosidase (SA-β-GAL) associada à senescência é um dos métodos mais caracterizados e estabelecidos com base em uma única célula para medir a senescência in vitro e in vivo. SA-β-GAL é uma hidrolase lisossomal com uma atividade enzimática ótima em pH 4. A mensuração de sua atividade em pH 6 é possível porque as células senescentes apresentam aumento da atividade lisossomal23,24. Para as células vivas, o aumento do pH lisossomal é obtido por alcalinização lisossomal com o inibidor vacuolar H+-ATPase bafilomicina a1 ou o inibidor da acidificação endossômica cloroquina25,26. 5-dodecanoylaminofluorescein di-β-D-galactopyranoside (C12FDG) é usado como substrato em células vivas, pois retém o produto clivada nas células devido à sua 12 fração lipofílica de carbono25. Importante, a atividade do SA-β-GAL própria não é conectada diretamente com nenhum caminho identificado em pilhas senescentes e não é necessário induzir a senescência. Com este ensaio, as células senescentes podem ser identificadas mesmo nas populações de células heterogêneas e nos tecidos de envelhecimento, como biópsias de pele de indivíduos mais velhos. Ele também tem sido usado para mostrar uma correlação entre a senescência celular e envelhecimento23 , pois é um marcador confiável para detecção de células senescentes em vários organismos e condições27,28,29, a 30. Aqui, um ensaio de triagem de SA-β-GAL de alta taxa de transferência baseado no substrato fluorescente C12FDG usando fibroblastos embrionários do mouse primário (mefs) com a senescência de células induzida por estresse oxidativo robusto é descrito e suas vantagens e desvantagens são discutidos. Embora este ensaio possa ser executado com tipos diferentes da pilha, o uso de Ercc1-deficiente, mefs danificado do reparo do ADN permite a indução mais rápida da senescência condições do stress oxidativo. Em camundongos, a expressão reduzida do reparo do DNA endonuclease ERCC1-XPF causa o reparo danificado do ADN, acumulação acelerada de dano endógeno do ADN, ROS elevados, deficiência orgânica mitochondrial, carga senescentes aumentada da pilha, perda da função da pilha de haste e envelhecimento prematuro, semelhante ao envelhecimento natural31,32. Similarmente, os MEFs Ercc1-deficientes submetem-se à senescência mais ràpida na cultura17. Uma característica importante do ensaio senescente de MEF é que cada poço tem uma mistura de células senescentes e não senescentes, permitindo a demonstração clara de efeitos específicos de células senescentes. No entanto, embora acreditemos que o uso de estresse oxidativo nas células primárias para induzir a senescência é mais fisiológico, este ensaio também pode ser usado com linhas celulares onde a senescência é induzida com agentes nocivos do DNA, como etoposide ou irradiação.
Protocolo
O uso de animais foi aprovado pelo Comitê institucional de cuidados e uso de animais da Scripps Florida.
1. geração de fibroblastos embrionários senescentes murinos (MEF) – 12-15 dias
- Isole o tipo selvagem e o Ercc1-/- mefs dos ratos fêmeas grávidos no dia embrionário 13 (E13) como descrito previamente33.
Nota: todas as etapas seguintes são executadas em uma capa da cultura do tecido circunstâncias assépticas e usando instrumentos estéreis. - Resect a cabeça do embrião acima dos olhos.
- Retire o tecido vermelho (coração e fígado) e use-os para genotipagem, se necessário.
- Prepare 500 mL de uma mistura de 1:1 de Dulbecco ' s Modified Eagle ' s Medium (DMEM) e de Ham ' s F10 com 10% de soro bovino fetal, 1x aminoácidos não essenciais, penicilina e estreptomicina como meio de crescimento e aqueça-o até 37 ° c por cerca de 15 min antes de cada utilização. Armazene o meio de crescimento em 4 ° c.
- Incubar o resto do embrião com 0,25% de tripsina/EDTA por 10 min.
- Mince o embrião em 1 mm peças e pipetar o tecido para cima e para baixo várias vezes.
- Adicionar 10 mL de meio de crescimento e tecidos de placa de um embrião por placa de cultura de células de 10 cm de diâmetro (passagem 0).
- Cultivar células a 37 ° c, 3% O2,5% co2.
Nota: apenas células MEF anexar a placas de cultura de tecido não revestidos nestas condições. - Mude o meio todos os dias na passagem 0 para remover os fragmentos não-anexados do tecido e da pilha.
Nota: dependendo do tamanho do embrião e da qualidade do isolamento, a célula geralmente atinge a confluência após 2 a 3 dias. - Tripsinização
- Retire cuidadosamente o meio de crescimento e lave as células com 10 mL de 1X PBS duas vezes.
- Adicionar 2 mL de uma solução de 0, 25% de Trypsin/EDTA às células em placas de 10 cm de diâmetro e incubar a 37 ° c por 2-3 min.
- Certifique-se de que as células são separadas da superfície inspecionando as células o microscópio.
- Termine a digestão do tripsina adicionando a mesma quantidade de meio de crescimento.
- Transfira as células para um tubo cônico e células centrífugas em 200 x g por 3 min e descarte o sobrenadante.
- Reressuscita as células cuidadosamente em meio de crescimento fresco, contagem de células e semente-los em novas placas na densidade da célula projetada.
- Para subcultivo não-senescente dividir células confluentes 1:4 e estender para outra passagem em 3% O2, 37 ° c para produzir mais células (passagem 1).
Nota: neste ponto as células podem ser mantidas em cultura ou armazenadas para uso posterior em nitrogênio líquido, em cryovials contendo aproximadamente 1 milhão células cada. Esta etapa também oferece a possibilidade de gerar um lote misto de células de diferentes animais para reduzir a variabilidade proveniente de uma única análise animal. - Para induzir a senescência celular, as células confluentes de separação de sementes da passagem 1 em uma proporção de 1:4 e incubar-los em 20% O2, 37 ° c, 5% co2 para 3 dias; Estas condições da cultura são atmosféricas para o oxigênio.
Nota: o cultivo de células e blastocistos concentrações de oxigênio ambiente pode elevar os marcadores de senescência celular especificamente quando o reparo de dano de DNA é prejudicado34,35,36. - Repita este procedimento para mais 2 passagens.
- Para monitorar a senescência celular, meça o aumento gradual no diâmetro da pilha e no volume da pilha durante cada etapa do tripsinização usando um sistema avançado do contador de pilha de Coulter.
- Avaliar a redução da proliferação celular pela determinação da duplicação da população (DP) utilizando a equação
PDT = (t2-t1)/3,32 x (log n2 – log n1)
Nota: o tempo de duplicação populacional só foi utilizado para células não senescentes. - Use o Wild-Type da passagem adiantada ou as pilhas de Ercc1-/- MEF que foram mantidas em 3% O2, 37 ° c, 5% co2 como pilhas non-senescent do controle.
2. ensaio de triagem de β-GAL associado senescente – 2-3 dias
- Prepare soluções de estoque de 10 mM em DMSO de todas as drogas a serem testadas e armazene alíquotas em-80 ° c. Não congelar-thaw soluções de ações, pois isso pode diminuir a atividade de drogas.
Nota: aqui, o inibidor HSP90 17DMAG foi usado como uma droga senolítica capaz de matar especificamente as células senescentes17. - No dia do experimento descongelar a alíquota, diluir as drogas em meio de cultura fresca e adicionar às células contendo meio condicionado em uma proporção de 1:1 para produzir a concentração final em meio de crescimento.
- Use placas de pré-diluição 96-well para diluições seriais e combinações de medicamentos.
Nota: para as células MEF, foi empiricamente determinado que as concentrações de DMSO não devem exceder 2% e as células de controle tratadas com as maiores concentrações de DMSO usadas devem ser incluídas em cada corrida. - Semente 5 x 103 células senescentes ou 3 x 103 células não senescentes por poço em 96 placas de poços pelo menos 6 h antes do tratamento em 100 μl de meio de crescimento e incubar a 20% O2, 37 ° c, 5% co2.
Nota: as células devem ser cerca de 80% confluentes antes do tratamento. - Use a parede preta/cultura inferior desobstruída do tecido, 96 placas bem tratadas para minimizar o conversa cruzada e o fundo do sinal fluorescente.
Nota: no entanto, placas claras também foram testadas com êxito. - Adicione diluições da droga às pilhas de MEF e incubar para 24 h a 48 h 20% O2, 37 ° c, 5% co2 circunstâncias.
- Mantenha as células não senescentes 3% O2, 37 ° c, 5% co2 condições.
- Para a alcalinização lisossomal, prepare uma solução de 10 mm de bafilomicina a1, alíquota e mantenha-se congelado a-20 ° c.
- Para a análise de fluorescência da atividade SA-β-GAL, prepare uma solução de 2 mM C12FDG Stock, armazene a-20 ° c e proteja-a da luz.
- Para a solução de trabalho, prepare 100 μM C12FDG em meio de crescimento no dia do experimento.
Nota: todas as etapas (incubação) envolvendo C12FDG devem ser executadas no escuro. - Retire a solução medicamentosa e lave as células 1 vez com 100 μL de 1X PBS.
- Induzir a alcalinização lisossomal por células de pré-tratamento com 90 μL de uma solução de bafilomicina a1 de 100 nM preparada em meio de cultura de células frescas por 1 hora a 20% O2, 37 ° c, 5% co2.
- Adicionar 10 μL de 100 μM C12FDG solução de trabalho para o meio de cultura (concentração final 10 μm).
- Incubar células por 2 h.
- Adicionar 2 μL de um corante 100 μg/mL Hoechst 33342 (concentração final 2 μg/mL) à cultura e incubar durante 20 min.
- Remova a mídia e adicione 100 μL de meio de crescimento fresco.
3. análise de imagem fluorescente de alto conteúdo quantitativo
- Use uma plataforma de aquisição e análise de imagem fluorescente de alto conteúdo para adquirir imagens fluorescentes das células nos dois canais apropriados para a captura de fluorescência Hoechst e C12FDG (por exemplo, predefinições de canal DAPI e FITC, respectivamente).
Nota: os protocolos de aquisição requerem a definição de várias variáveis que são específicas para o ensaio. O objetivo de um protocolo de aquisição é capturar um número adequado de imagens fluorescentes em foco de números suficientes de células para análise quantitativa a jusante. - Desenvolva um protocolo de análise apropriado selecionando cada canal e definindo, ajustando um ou mais critérios seletivos, o que qualifica como um recurso de interesse em cada canal.
- Para o núcleo, use os pré-conjuntos de segmentação (por exemplo, segmentação nuclear, segmentação de vesículas, segmentação por citoplasma) que permitirão a identificação de organelas celulares com base em vários critérios, incluindo morfologia, tamanho e sinal Intensidade. Ajustar estes critérios para incluir núcleos, excluindo fragmentos nucleares e detritos que podem ter um sinal, mas que são, por exemplo, muito grande ou muito pequeno para ser núcleos.
- Verifique o sinal no canal FITC que é a fluorescência de clivada C12FDG e representa a quantidade de atividade de β-galactosidase associada à senescência nas células.
Nota: as células senescentes têm maior atividade de β-galactosidase associada à senescência do que as células não senescentes; Entretanto, a fluorescência de C12FDG será não-discreta e contínua, necessitando o estabelecimento de um limiar entre o que é considerado um c12FDG-positivo e uma pilha de c12FDG-Negative. - Usando o software analítico disponível comercialmente, gere uma contagem de instâncias em que uma região definida ao redor do núcleo (uma célula presuntiva) sobrepôs pelo menos uma vez com um limite acima de C12FDG.
Observação: o software analítico gera automaticamente uma contagem usando a vinculação de destino. Esta é a definição prática do ensaio de uma célula senescente, C12FDG-positivo.
- Analise todas as amostras em triplicado com 3-5 campos por poço e valores médios e desvios padrão sendo calculados de acordo.
- Calcule a porcentagem de células senescentes usando a seguinte fórmula:
Células senescentes (%) =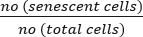 x 100
x 100
4. parâmetros de validação do ensaio
- Para todas as amostras foram calculados o coeficiente de variações intra e inter-Assay (% CVs) utilizando a seguinte fórmula:
CV intra-ensaio (n = 10 repetições mensuradas em um experimento) = x 100 (%)
= x 100 (%)
CV inter-Assay (n = 5 experimentos independentes) = x 100 (%)
x 100 (%) - Para fins de triagem, determinar o valor de Z ', um parâmetro estatístico para avaliar a qualidade de um ensaio, a partir de células tratadas com 200 nM rapamicina para 24 h em 20% O2, 37 ° c, 5% co2 (um controle positivo para medicamentos senoterapêuticos) e não tratada células senescentes (controlo negativo).
Nota: o valor de Z ' foi calculado de acordo com Zhang et al.37. Os valores de Z entre 0,5 e 1 indicam que um ensaio pode ser utilizado para a triagem de fármacos.
Resultados
A atividade de SA-β-GAL pode ser detectada em células induzidas a continuamente por várias formas de exaustão replicativa, estresse genotóxico e oxidativo, à ativação do oncogene23,25,38. No modelo atual utilizando células de fibroblastos embrionárias com deficiência de camundongo Ercc1, as condições de crescimento normoxicas (20% O2) foram suficientes para induzi...
Discussão
SA-β-GAL é um biomarcador bem definido para a senescência celular originalmente descoberta por Dimri et al. (1995) mostrando que os fibroblastos humanos senescentes aumentaram a atividade da SA-β-GAL quando analisados em pH 623 em comparação com as células proliferantes. Entretanto, os ensaios in vitro e in vivo para SA-β-GAL foram estabelecidos para diferentes tipos de células e tecidos25,39,...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo NIH Grants AG043376 (Project 2 e Core A, PDR; Projeto 1 e núcleo B, LJN) e AG056278 (projeto 3 e núcleo A, PDR; e projeto 2, LJN) e uma concessão da Fundação de Glenn (LJN).
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Corning | 10-013-CV | medium |
| Ham's F10 | Gibco | 12390-035 | medium |
| fetal bovine serum | Tissue Culture Biologics | 101 | serum |
| 1x non-essential amino acids | Corning | 25-025-Cl | amino-acids |
| bafilomycin A1 | Sigma | B1793 | lysosomal inhibitor |
| C12FDG | Setareh Biotech | 7188 | b-Gal substrate |
| Hoechst 33342 | Life Technologies | H1399 | DNA intercalation agent |
| 17DMAG | Selleck Chemical LLC | 50843 | HSP90 inhibitor |
| InCell6000 Cell Imaging System | GE Healthcare | High Content Imaging System |
Referências
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Campisi, J., di Fagagna, F. D. Cellular senescence: when bad things happen to good cells. Nature Reviews Molecular Cell Biology. 8 (9), 729-740 (2007).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Zhu, J., Woods, D., McMahon, M., Bishop, J. M. Senescence of human fibroblasts induced by oncogenic Raf. Genes and Development. 12 (19), 2997-3007 (1998).
- Dimri, G. P., Itahana, K., Acosta, M., Campisi, J. Regulation of a senescence checkpoint response by the E2F1 transcription factor and p14(ARF) tumor suppressor. Molecular and Cellular Biology. 20 (1), 273-285 (2000).
- Michaloglou, C., et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature. 436 (7051), 720-724 (2005).
- Niedernhofer, L. J. Tissue-specific accelerated aging in nucleotide excision repair deficiency. Mechanisms of Ageing and Development. 129 (78), 408-415 (2008).
- Gitenay, D., et al. Glucose metabolism and hexosamine pathway regulate oncogene-induced senescence. Cell Death & Disease. 5, e1089 (2014).
- Erusalimsky, J. D., Kurz, D. J. Cellular senescence in vivo: its relevance in ageing and cardiovascular disease. Experimental Gerontology. 40 (8-9), 634-642 (2005).
- Kassem, M., Marie, P. J. Senescence-associated intrinsic mechanisms of osteoblast dysfunctions. Aging Cell. 10 (2), 191-197 (2011).
- Campisi, J., Andersen, J. K., Kapahi, P., Melov, S. Cellular senescence: A link between cancer and age-related degenerative disease. Seminars in Cancer Biology. 21 (6), 354-359 (2011).
- Golde, T. E., Miller, V. M. Proteinopathy-induced neuronal senescence: a hypothesis for brain failure in Alzheimer's and other neurodegenerative diseases. Alzheimers Research & Therapy. 1 (2), 5 (2009).
- Telgenhoff, D., Shroot, B. Cellular senescence mechanisms in chronic wound healing. Cell Death & Differentiation. 12 (7), 695-698 (2005).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Baker, D. J., et al. Naturally occurring p16-positive cells shorten healthy lifespan. Nature. , (2016).
- Childs, B. G., et al. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 354 (6311), 472-477 (2016).
- Fuhrmann-Stroissnigg, H., et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 8 (1), 422 (2017).
- Zhu, Y., et al. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging. 9 (3), 955-963 (2017).
- Zhu, Y., et al. Identification of a Novel Senolytic Agent, Navitoclax, Targeting the Bcl-2 Family of Anti-Apoptotic Factors. Aging Cell. , (2015).
- Zhu, Y., et al. The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. , (2015).
- Baar, M. P., et al. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 169 (1), 132-147 (2017).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature. , (2017).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences USA. 92 (20), 9363-9367 (1995).
- Itahana, K., Campisi, J., Dimri, G. P. Methods to detect biomarkers of cellular senescence: the senescence-associated beta-galactosidase assay. Methods in Molecular Biology. 371, 21-31 (2007).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-[beta]gal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Cahu, J., Sola, B. A sensitive method to quantify senescent cancer cells. Journal of Visualized Experiments. 78 (78), (2013).
- Collado, M., et al. Tumour biology: Senescence in premalignant tumours. Nature. 436 (7051), 642 (2005).
- Krishnamurthy, J., et al. Ink4a/Arf expression is a biomarker of aging. The Journal of Clinical Investigation. 114 (9), 1299-1307 (2004).
- Mishima, K., et al. Senescence-associated beta-galactosidase histochemistry for the primate eye. Investigative Ophthalmology, Visual Science. 40 (7), 1590-1593 (1999).
- Melk, A., et al. Expression of p16INK4a and other cell cycle regulator and senescence associated genes in aging human kidney. Kidney International. 65 (2), 510-520 (2004).
- Niedernhofer, L. J., et al. A new progeroid syndrome reveals that genotoxic stress suppresses the somatotroph axis. Nature. 444 (7122), 1038-1043 (2006).
- Wang, J., Clauson, C. L., Robbins, P. D., Niedernhofer, L. J., Wang, Y. The oxidative DNA lesions 8,5′-cyclopurines accumulate with aging in a tissue-specific manner. Aging Cell. 11 (4), 714-716 (2012).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. Journal of Visualized Experiments. (64), (2012).
- Jagannathan, L., Cuddapah, S., Costa, M. Oxidative stress under ambient and physiological oxygen tension in tissue culture. Current Pharmacology Reports. 2 (2), 64-72 (2016).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. J Assist Reprod Genet. 31 (10), 1259-1267 (2014).
- Robinson, A. R., et al. Spontaneous DNA damage to the nuclear genome promotes senescence, redox imbalance and aging. Redox Biology. 17, 259-273 (2018).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal Of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhao, H., Darzynkiewicz, Z. Biomarkers of cell senescence assessed by imaging cytometry. Methods in Molecular Biology. 965, 83-92 (2013).
- Yang, N. -. C., Hu, M. -. L. A fluorimetric method using fluorescein di-β-d-galactopyranoside for quantifying the senescence-associated β-galactosidase activity in human foreskin fibroblast Hs68 cells. Analytical Biochemistry. 325 (2), 337-343 (2004).
- Zhao, J., et al. Quantitative Analysis of Cellular Senescence in Culture and In Vivo. Current Protocols in Cytometry. 79, (2017).
- Capparelli, C., et al. CDK inhibitors (p16/p19/p21) induce senescence and autophagy in cancer-associated fibroblasts, "fueling" tumor growth via paracrine interactions, without an increase in neo-angiogenesis. Cell Cycle. 11 (19), 3599-3610 (2012).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. GammaH2AX as a molecular marker of aging and disease. Epigenetics. 5 (2), 129-136 (2010).
- Hewitt, G., et al. Telomeres are favoured targets of a persistent DNA damage response in ageing and stress-induced senescence. Nature Communications. 3, 708 (2012).
- Narita, M., et al. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 113 (6), 703-716 (2003).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging-Us. 5 (1), 37-50 (2013).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is β-Galactosidase Staining a Marker of Senescence in Vitro and in Vivo?. Experimental Cell Research. 257 (1), 162-171 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados