このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
セノ治療薬同定のためのSA-β-ガラクトーシダーゼベーススクリーニングアッセイ
* これらの著者は同等に貢献しました
要約
細胞老化は、慢性加齢病理の発症における重要な因子である。老化細胞を標的とする治療薬の同定は、健康な老化を延長する約束を示す。ここでは、単一細胞における老化関連β-ガラクトシダーゼ活性の測定に基づくセノセラピューティクスの同定をスクリーニングするための新規アッセイを提示する。
要約
細胞老化は、健康寿命に悪影響を及ぼすと知られている老化の特徴の一つである。細胞培養において特異的に老化細胞を殺すことができる薬物は、セノリティックと呼ばくことができ、生体内の老化細胞の負担を軽減し、健康寿命を延ばすことができる。HSP90阻害剤、Bcl-2ファミリー阻害剤、ピペロングミン、FOXO4阻害ペプチドおよびダサチニブ/ケルセチンの組み合わせを含む複数のクラスのセノリティックスが同定されている。増加したリソソームpHでのSA-β-Galの検出は、老化細胞の検出のための最良の特徴付きマーカーの一つである。蛍光基質C12 FDGを用いて老化関連β-ガラクトシダーゼ(SA-β-Gal)活性のライブ細胞測定を、DNAインターカレートホエヒト色素を用いて全細胞数の決定と組み合わせることで、その可能性を開く。老化細胞の死化(セノリティクス)またはSA-β-Galおよび他の発せ子細胞(セノモルフィック)の他の現象を抑制することによって、全体的なSA-β-Gal活性を低下させるセノセラピューティクス薬のスクリーン。高含有量の蛍光画像取得および分析プラットフォームを使用することで、SA-β-Gal、細胞形態および細胞数に対する影響に対する薬物ライブラリーの迅速かつ高スループットスクリーニングが可能になります。
概要
細胞老化はレナード・ヘイフリックとポール・ムーアヘッドによって初めて説明され、正常細胞は培養1で増殖する能力が限られていることを示した。老化細胞は、栄養素、成長因子および接触阻害の欠如にもかかわらず増殖に失敗するが、代謝活性2のままである。この現象は複製性老化として知られており、主にテロメア短縮に起因し、少なくともヒト細胞3で起こった。さらなる研究は、細胞が発癌性ストレス(腫瘍遺伝子誘発老化、OIS)、DNA損傷、細胞傷害薬、または照射(ストレス誘発老化、SIS)などの他の刺激に応答して老化を受けるように誘導できることを示しています4,5,6.テロメア浸食を含むDNA損傷に対応して、細胞は老化、制御されていない細胞増殖を開始するか、損傷を修復できない場合はアポトーシスを受ける。この場合、細胞老化は腫瘍抑制的な方法2で作用するとして有益であると思われる。対照的に、老化はDNA損傷を含む細胞損傷の蓄積による老化と共に増加する。老化細胞はサイトカイン、メタロプロテイナーゼおよび成長因子を分泌することができるので、老化関連分泌表現型(SASP)と呼ばれる、この加齢依存性の増加は、細胞老化およびSASPの減少した組織恒常性に寄与し、その後、老化。また、老化負担のこの年齢依存的な増加は、代謝疾患、ストレス感受性、プロジェリア症候群、および治癒障害7、8を誘発することが知られており、部分的には、多数の加齢関連の原因であるアテローム性動脈硬化症、変形性関節症、筋変性症、潰瘍形成、およびアルツハイマー病9、10、11、12、13などの疾患。老化細胞を排除することは、組織機能不全を予防または遅延させ、健康寿命を延ばすのに役立ちます14.これは、トランスジェニックマウスモデル14、15、16だけでなく、薬物スクリーニングの努力とバイオインフォマティクス分析の両方を通じて発見されたセノリティック薬と薬物の組み合わせを使用して示されています。老化細胞17、18、19、20、21、22で特異的に誘導される経路。より最適なセノセラピューティクス薬を同定することは、老化細胞の負担をより効果的に軽減することができ、健康な老化のための治療アプローチの開発における重要な次のステップである。
老化細胞は、培養と生体内の両方で特徴的な色分性および分子的特徴を示す。これらの老化マーカーは、老化誘導の原因または結果またはこれらの細胞における分子変化の副産物である可能性がある。しかし、老化細胞では特異的に単一のマーカーは見つからない。現在、老化関連β-ガラクトーシダーゼ(SA-β-Gal)検出は、インビトロおよびインビボで老化を測定する最良の特徴付けおよび確立された単一細胞ベースの方法の1つである。SA-β-Galは、pH4で最適な酵素活性を有するリソソームヒドロラーゼである。老化細胞がリソソーム活性23、24の増加を示すので、pH6での活性の測定が可能である。生細胞の場合、増加したリソソームpHは、バクオールH+-ATPase阻害剤バフィロマイシンA1または内染染酸性化阻害剤クロロキン25、26を用いてリソソームアルカリ化によって得られる。5-ドデカノイラミノフレッセインDi-β-D-ガラクトピラノシド(C12FDG)は、その12炭素親油性部分25に起因する細胞内のク破物を保持するように生細胞の基質として使用される。重要なことに、SA-β-Gal活性自体は老化細胞で同定された経路と直接接続されず、老化を誘発する必要はない。このアッセイにより、老化細胞は、高齢者の皮膚生検などの異種細胞集団や老化組織においても同定することができる。また、いくつかの生物および条件27、28、29における老化細胞検出のための信頼できるマーカーであるとして、細胞老化と老化23との間の相関関係を示すために使用されている。 30.ここでは、強い酸化ストレス誘発細胞老化を有する一次マウス胚線維芽細胞(MEF)を用いた蛍光基質C12 FDGに基づく高スループットSA-β-Galスクリーニングアッセイとその長所と短所について説明する。が議論されています。このアッセイは、異なる細胞型で行うことができるが、Ercc1-欠乏、DNA修復障害MEFの使用は、酸化ストレスの条件下で老化のより迅速な誘導を可能にする。マウスでは、DNA修復エンドヌクレアーゼERCC1-XPFの発現の低下は、DNA修復の障害を引き起こし、内因性DNA損傷の蓄積の加速、ROSの上昇、ミトコンドリア機能障害、老化細胞負荷の増加、幹細胞機能の喪失および早期老化, 自然老化に似ています31,32.同様に、Ercc1-欠乏MEFは、培養17でより急速に老化を受ける。老化MEFアッセイの重要な特徴は、各ウェルが老化細胞と非老化細胞の混合物を有し、老化細胞特異的効果の明確なデモンストレーションを可能にすることである。しかし、一次細胞における酸化ストレスを利用して老化を誘発することはより生理学的であると考えていますが、このアッセイは、エトポシドや照射などのDNA損傷剤で老化が誘導される細胞株にも使用できます。
プロトコル
動物の使用は、スクリプスフロリダ機関動物ケアと使用委員会によって承認されました.
1. 老化マウス胚性線維芽細胞(MEF)の生成 – 12-15日
- 前述の33日に胎児13日目(E13)で妊娠中の雌マウスから野生型およびErcc1-/-MEFを分離する。
注:以下のすべてのステップは、無菌条件下で組織培養フード内で行われ、滅菌器具を使用しています。 - 胚の頭を目の上に切除する。
- 赤い組織(心臓と肝臓)を取り除き、必要に応じてジェノタイピングに使用します。
- ダルベッコの改変イーグルミディアム(DMEM)とハムのF10の1:1混合物の500 mLを10%の胎児ウシ血清、1x非必須アミノ酸、ペニシリン、ストレプトマイシンを成長培地として準備し、使用前に37°Cまで約15分間温めます。成長培地を4°Cに保存します。
- 胚の残りの部分を0.25%トリプシン/EDTAで10分間インキュベートします。
- 胚を1mmの部分にミンチし、ティッシュを上下に数回ピペットする。
- 直径10cmの細胞培養板につき1個の胚の増殖培地およびプレート組織の10mLを添加する(経積0)。
- 37 °C、3% O 2、5% CO2で細胞を培養します。
注:MEF細胞のみが、これらの条件下で非コーティングされた組織培養プレートに付着する。 - 非付着組織および細胞断片を除去するために、通路0で毎日培地を変更する。
注:胚の大きさと単離の質に応じて、細胞は通常2~3日後に合流に達する。 - トリプシン化
- 成長培地を慎重に取り出し、1x PBSの10mLで細胞を2回洗浄する。
- 直径10cmのプレートの細胞に0.025%トリプシン/EDTA溶液の2 mLを加え、37°Cで2~3分間インキュベートします。
- 顕微鏡下の細胞を検査して、細胞が表面から切り離されていることを確認してください。
- 同じ量の成長培地を加えてトリプシン消化を終了します。
- 細胞を円錐形のチューブと遠心分離機に200 x gで3分間移し、上清を捨てます。
- 新鮮な成長培地で細胞を慎重に再中断し、細胞をカウントし、投影された細胞密度で新しいプレートに種をまきます。
- 非老化サブ培養スプリットコンフルエント細胞1:4の場合、3%O2、37°Cで別の通路に拡張して、より多くの細胞を得る(経通路1)。
注:この時点で、細胞は培養中に維持されるか、または液体窒素で後で使用するために保存され、それぞれ約100万個の細胞を含むクライオビアルで保存することができます。このステップはまた、単一の動物分析から来る変動を減らすために、異なる動物から細胞の混合バッチを生成する可能性を提供します。 - 細胞老化を誘導するために、1:4の比率で通路1から結合細胞を分裂させ、20%O 2、37°C、5%CO2で3日間インキュベートする。これらの培養条件は、酸素のために大気中です。
注:周囲酸素濃度下での細胞および胚盤胞の培養は、DNA損傷修復が損なわれた場合に特に細胞老化のマーカーを上昇させることができる34、35、36。 - さらに 2 つの一節については、この手順を繰り返します。
- 細胞老化を監視するには、高度なコールター細胞カウンターシステムを使用して、各トリプシン化ステップ中の細胞径と細胞体積の徐々な増加を測定します。
- この方程式を用いて集団倍増(PD)の判定による細胞増殖の減少を評価する
PDT = (t2-t 1)/3.32 x (ログ n2 – ログ n1)
注:母集団倍増時間は、非老化細胞にのみ使用された。 - 3%O2、37°C、5%CO2を非老化対照細胞として保持した早期通過野生型またはErcc1-/-MEF細胞を用いる。
2. 老化関連β-Galスクリーニングアッセイ – 2-3日
- 検査対象のすべての薬剤のDMSOで10mMのストックソリューションを準備し、-80°Cでアリコートを保存します。これは、薬物の活性を減少させる可能性があるため、凍結解凍ストックソリューションをしないでください。
注:ここで、HSP90阻害剤17DMAGは、老化細胞17を特異的に殺すことができる血化薬として用いられた。 - 実験当日にアリコートを解凍し、新鮮な培地で薬剤を希釈し、1:1比で条件付き培地を含む細胞に添加し、増殖培地中の最終濃度を得る。
- シリアル希釈剤と薬剤の組み合わせには、96ウェルの希釈前プレートを使用してください。
注:MEF細胞の場合、DMSO濃度が2%を超えてはならないと経験的に決定し、使用される最も高いDMSO濃度で処理された制御細胞は、各実行に含めるべきであると考えました。 - 種子5 x 103センセーション細胞または3 x 103非老化細胞を96ウェルプレート当たり100μLの増殖培地で処理する前に少なくとも6時間、20%O2、37°C、5%CO2でインキュベートする。
注:細胞は、治療前に約80%のコンフルエントでなければなりません。 - 黒い壁/明確な底部組織培養を使用し、蛍光信号クロストークと背景を最小限に抑えるために96ウェルプレートを処理しました。
注:しかし、クリアプレートも正常にテストされています。 - MEF細胞に薬物希釈剤を加え、20%O2、37°C、5%CO2条件下で24時間~48時間インキュベートする。
- 非老化細胞を3%O 2、37°C、5%CO2条件以下に保つ。
- リソソームアルカリ化の場合は、10mMバフィロマイシンA1溶液、アリコートを調製し、-20°Cで凍結しておきます。
- SA-β-Gal活性の蛍光分析のために、2mM C12FDGストック溶液を調製し、-20°Cで保存し、光から保護する。
- 作動溶液の場合は、実験当日に成長培地に100μM C12FDGを調記します。
注:C12FDGを含むすべての(インキュベーション)ステップは、暗闇の中で実行する必要があります。 - 薬剤溶液を取り出し、1x PBSの100 μLで細胞を1回洗浄する。
- 20%O2、37°C、5%CO2で1時間新鮮な細胞培地で調製した100nMバフィロマイシンA1溶液の90μLを用いた細胞を前処理することによりリソソームアルカリ化を誘導する。
- 培養培地(最終濃度10μM)に10μM C12FDG作動溶液の10μLを添加します。
- 細胞を2時間インキュベートする。
- 100 μg/mL の 2 μL を培養に加え(最終濃度 2 μg/mL)、インキュベートを 20 分間行います。
- 培地を取り出し、100 μLの新鮮な成長培地を加えます。
3. 定量的高含有量蛍光画像解析
- 高含有量の蛍光画像取得および解析プラットフォームを使用して、HoechstおよびC12FDG蛍光の捕捉に適した2つのチャネル内の細胞の蛍光画像(それぞれDAPIおよびFITCチャネルプリセット)を取得します。
注: 取得プロトコルでは、アッセイに固有の複数の変数の定義が必要です。取得プロトコルの目的は、下流の定量分析のために十分な数の細胞の十分な数の焦点インフォーカス蛍光画像をキャプチャすることです。 - 各チャネルを選択し、1 つ以上の選択基準を調整して、各チャネルの関心のある機能として適格なものを定義して、適切な分析プロトコルを開発します。
- 核の場合は、形態、大きさ、信号などの複数の基準に基づいて細胞小器官の同定を可能にするセグメンテーションプリセット(例えば、核セグメンテーション、小胞セグメンテーション、細胞質セグメンテーション)を使用してください。強度。信号を持つ可能性がある核の破片や破片を除外しながら、これらの基準を調整しますが、例えば、核になるには大きすぎるか小さすぎます。
- 切断されたC12FDGからの蛍光であるFITCチャネル内のシグナルを確認し、細胞内の老化関連β-ガラクトシダーゼ活性の量を表す。
注:老化細胞は、非老化細胞よりも高い老化関連β-ガラクトーシダーゼ活性を有する;しかし、C12FDG蛍光は非離散的かつ連続的であり、C12FDG陽性とC12 FDG陰性細胞と見なされるものの間に閾値を確立する必要がある。 - 市販の分析ソフトウェアを使用して、核を囲む定義された領域(推定細胞)が少なくとも1回、しきい値C12FDGを超えると重なっているインスタンスの数を生成する。
注: 分析ソフトウェアは、ターゲットリンクを使用して自動的にカウントを生成します。これは、老化、C12FDG陽性細胞のアッセイの実用的な定義です。
- ウェルあたり 3 ~ 5 フィールドを使用して三つ三つ三つ中のすべてのサンプルを分析し、それに応じて計算される平均値と標準偏差を分析します。
- 次の式を使用して、老化細胞のパーセンテージを計算します。
老化細胞 (%) =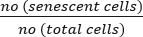 x 100
x 100
4. アッセイ検証パラメータ
- すべてのサンプルについて、変動のアッセイ係数(%CV)を以下の式で計算した。
アッセイ内 CV (n = 10 回の繰り返 しを 1 回の実験で測定) = x 100 (%)
しを 1 回の実験で測定) = x 100 (%)
アッセイ間 CV (n = 5 独立した実験) = x 100 (%)
独立した実験) = x 100 (%) - スクリーニング目的で、Zの値を決定し、アッセイの品質を評価する統計パラメータを、20%O 2、37°C、5%CO2(セノ治療薬の陽性対照)で24時間200nMラパマイシンで処理した細胞から、未処理老化細胞(陰性対照)。
注:Zの値は、Zhangら37に従って計算された。0.5と1の間のZの値は、アッセイが薬物スクリーニングに使用できることを示す。
結果
SA-β-Gal活性は、複製的な疲労、遺伝子毒性および酸化ストレスから、発癌活性化23、25、38まで様々な方法で老化するように誘導される細胞において検出することができる。Ercc1-欠損マウス胚線維芽細胞を用いた現行モデルでは、ノルモキシック増殖条件(20%O2)は、それらをいくつかの通路で?...
ディスカッション
SA-β-Galは、Dimriらによって最初に発見された細胞老化のための明確に定義されたバイオマーカーである。(1995)老化したヒト線維芽細胞が増殖細胞と比較してpH623でアッセイした場合のSA-β-Galの活性を増加させたことを示す。一方、SA-β-Galに対するインビトロおよびインビボアッセイは、異なる細胞型および組織25、39、40に対して確立されている。<...
開示事項
著者は何も開示していない。
謝辞
この作業は、NIH助成金AG043376(プロジェクト2とコアA、PDR;プロジェクト1とコアB、LJN)およびAG056278(プロジェクト3とコアA、PDR、プロジェクト2、LJN)とグレン財団(LJN)からの助成金。
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Corning | 10-013-CV | medium |
| Ham's F10 | Gibco | 12390-035 | medium |
| fetal bovine serum | Tissue Culture Biologics | 101 | serum |
| 1x non-essential amino acids | Corning | 25-025-Cl | amino-acids |
| bafilomycin A1 | Sigma | B1793 | lysosomal inhibitor |
| C12FDG | Setareh Biotech | 7188 | b-Gal substrate |
| Hoechst 33342 | Life Technologies | H1399 | DNA intercalation agent |
| 17DMAG | Selleck Chemical LLC | 50843 | HSP90 inhibitor |
| InCell6000 Cell Imaging System | GE Healthcare | High Content Imaging System |
参考文献
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Campisi, J., di Fagagna, F. D. Cellular senescence: when bad things happen to good cells. Nature Reviews Molecular Cell Biology. 8 (9), 729-740 (2007).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Zhu, J., Woods, D., McMahon, M., Bishop, J. M. Senescence of human fibroblasts induced by oncogenic Raf. Genes and Development. 12 (19), 2997-3007 (1998).
- Dimri, G. P., Itahana, K., Acosta, M., Campisi, J. Regulation of a senescence checkpoint response by the E2F1 transcription factor and p14(ARF) tumor suppressor. Molecular and Cellular Biology. 20 (1), 273-285 (2000).
- Michaloglou, C., et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature. 436 (7051), 720-724 (2005).
- Niedernhofer, L. J. Tissue-specific accelerated aging in nucleotide excision repair deficiency. Mechanisms of Ageing and Development. 129 (78), 408-415 (2008).
- Gitenay, D., et al. Glucose metabolism and hexosamine pathway regulate oncogene-induced senescence. Cell Death & Disease. 5, e1089 (2014).
- Erusalimsky, J. D., Kurz, D. J. Cellular senescence in vivo: its relevance in ageing and cardiovascular disease. Experimental Gerontology. 40 (8-9), 634-642 (2005).
- Kassem, M., Marie, P. J. Senescence-associated intrinsic mechanisms of osteoblast dysfunctions. Aging Cell. 10 (2), 191-197 (2011).
- Campisi, J., Andersen, J. K., Kapahi, P., Melov, S. Cellular senescence: A link between cancer and age-related degenerative disease. Seminars in Cancer Biology. 21 (6), 354-359 (2011).
- Golde, T. E., Miller, V. M. Proteinopathy-induced neuronal senescence: a hypothesis for brain failure in Alzheimer's and other neurodegenerative diseases. Alzheimers Research & Therapy. 1 (2), 5 (2009).
- Telgenhoff, D., Shroot, B. Cellular senescence mechanisms in chronic wound healing. Cell Death & Differentiation. 12 (7), 695-698 (2005).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Baker, D. J., et al. Naturally occurring p16-positive cells shorten healthy lifespan. Nature. , (2016).
- Childs, B. G., et al. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 354 (6311), 472-477 (2016).
- Fuhrmann-Stroissnigg, H., et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 8 (1), 422 (2017).
- Zhu, Y., et al. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging. 9 (3), 955-963 (2017).
- Zhu, Y., et al. Identification of a Novel Senolytic Agent, Navitoclax, Targeting the Bcl-2 Family of Anti-Apoptotic Factors. Aging Cell. , (2015).
- Zhu, Y., et al. The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. , (2015).
- Baar, M. P., et al. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 169 (1), 132-147 (2017).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature. , (2017).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences USA. 92 (20), 9363-9367 (1995).
- Itahana, K., Campisi, J., Dimri, G. P. Methods to detect biomarkers of cellular senescence: the senescence-associated beta-galactosidase assay. Methods in Molecular Biology. 371, 21-31 (2007).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-[beta]gal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Cahu, J., Sola, B. A sensitive method to quantify senescent cancer cells. Journal of Visualized Experiments. 78 (78), (2013).
- Collado, M., et al. Tumour biology: Senescence in premalignant tumours. Nature. 436 (7051), 642 (2005).
- Krishnamurthy, J., et al. Ink4a/Arf expression is a biomarker of aging. The Journal of Clinical Investigation. 114 (9), 1299-1307 (2004).
- Mishima, K., et al. Senescence-associated beta-galactosidase histochemistry for the primate eye. Investigative Ophthalmology, Visual Science. 40 (7), 1590-1593 (1999).
- Melk, A., et al. Expression of p16INK4a and other cell cycle regulator and senescence associated genes in aging human kidney. Kidney International. 65 (2), 510-520 (2004).
- Niedernhofer, L. J., et al. A new progeroid syndrome reveals that genotoxic stress suppresses the somatotroph axis. Nature. 444 (7122), 1038-1043 (2006).
- Wang, J., Clauson, C. L., Robbins, P. D., Niedernhofer, L. J., Wang, Y. The oxidative DNA lesions 8,5′-cyclopurines accumulate with aging in a tissue-specific manner. Aging Cell. 11 (4), 714-716 (2012).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. Journal of Visualized Experiments. (64), (2012).
- Jagannathan, L., Cuddapah, S., Costa, M. Oxidative stress under ambient and physiological oxygen tension in tissue culture. Current Pharmacology Reports. 2 (2), 64-72 (2016).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. J Assist Reprod Genet. 31 (10), 1259-1267 (2014).
- Robinson, A. R., et al. Spontaneous DNA damage to the nuclear genome promotes senescence, redox imbalance and aging. Redox Biology. 17, 259-273 (2018).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal Of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhao, H., Darzynkiewicz, Z. Biomarkers of cell senescence assessed by imaging cytometry. Methods in Molecular Biology. 965, 83-92 (2013).
- Yang, N. -. C., Hu, M. -. L. A fluorimetric method using fluorescein di-β-d-galactopyranoside for quantifying the senescence-associated β-galactosidase activity in human foreskin fibroblast Hs68 cells. Analytical Biochemistry. 325 (2), 337-343 (2004).
- Zhao, J., et al. Quantitative Analysis of Cellular Senescence in Culture and In Vivo. Current Protocols in Cytometry. 79, (2017).
- Capparelli, C., et al. CDK inhibitors (p16/p19/p21) induce senescence and autophagy in cancer-associated fibroblasts, "fueling" tumor growth via paracrine interactions, without an increase in neo-angiogenesis. Cell Cycle. 11 (19), 3599-3610 (2012).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. GammaH2AX as a molecular marker of aging and disease. Epigenetics. 5 (2), 129-136 (2010).
- Hewitt, G., et al. Telomeres are favoured targets of a persistent DNA damage response in ageing and stress-induced senescence. Nature Communications. 3, 708 (2012).
- Narita, M., et al. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 113 (6), 703-716 (2003).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging-Us. 5 (1), 37-50 (2013).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is β-Galactosidase Staining a Marker of Senescence in Vitro and in Vivo?. Experimental Cell Research. 257 (1), 162-171 (2000).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved