Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Senoterapötik Ilaçların tanımlanması için SA-β-Galactosidaz tabanlı tarama tahlili
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Hücresel senesans, Yaş ile ilgili kronik patolojilerin gelişiminde önemli bir faktördür. Parlak hücreleri hedefleyen terapinin tanımlanması, sağlıklı yaşlanmanın uzatılması için söz veriyor. Burada, tek hücrelerde senesans ilişkili β-galaktosidaz aktivitesinin ölçümüne dayalı senoterapötik teşhis için ekrana bir roman tahlil sunuyoruz.
Özet
Hücre yaşlanma olumsuz sağlıklı bir ömrünü etkileyen bilinen yaşlanma damgasını biridir. Özellikle hücre kültüründe, denir senolytikler, güçlü hücreleri öldürebilir ilaçlar, in vivo ve genişletmek healthspan içinde parlak hücre yükü azaltabilir. Senolytikler birden fazla sınıf HSP90 inhibitörleri, bcl-2 aile inhibitörleri, piperlongumine, bir FOXO4 inhibitör peptid ve Dasatinib/Quercetin kombinasyonu dahil olmak üzere bugüne kadar tespit edilmiştir. Daha yüksek bir lizozomal pH 'da sa-β-GAL tespiti, parlak hücrelerin tespiti için en iyi karakterize işaretliklere biridir. Canlı hücre ölçümleri ile ilişkili β-galaktosidase (SA-β-GAL) etkinliğini kullanarak floresan substrat C12fdg ile kombinasyon halinde toplam hücre numarasının belirlenmesi ile birlikte bir DNA enterkalasyon Hoechst boya imkanı açar (senolytics) ya da SA-β-Gal ve diğer fenotipleri (senomorfik) önleyici hücreleri öldürerek ya da genel SA-β-GAL etkinliğini azaltan senoterapötik ilaçlar için ekran. Yüksek içerik floresan görüntü edinme ve analiz platformu kullanımı SA-β-GAL, hücre Morfoloji ve hücre numarası üzerinde etkileri için ilaç kütüphaneleri hızlı, yüksek verim taraması için izin verir.
Giriş
Hücresel yaşlanma Leonard Hayflick ve Paul Moorhead, normal hücrelerin kültür1çoğalmak için sınırlı bir yeteneği olduğunu gösterdi tarafından ilk kez tanımlanmıştır. İnce hücreler besin varlığı, büyüme faktörleri ve temas inhibisyonu eksikliği rağmen çoğalırlar başarısız, ancak metabolik olarak aktif kalır2. Bu fenomen çoğaltıcı yaşlanma olarak bilinir ve ağırlıklı olarak telomer kısaltma atfedildi, en azından insan hücrelerinde3. Daha fazla çalışmalar, hücrelerin aynı zamanda diğer uyaranlara yanıt olarak, Onkojenik stres (onkojen indüklenen senesans, OIS), DNA hasarı, sitotokleş ilaçlar veya ışınlama (stres indüklenen yaşlanma, SIS)4 gibi senesans geçmesi indüklenmiş olabilir göstermiştir , 5 , 6. DNA hasarına yanıt olarak, telomer erozyonu dahil, hücreler ya senesce, kontrollü hücre büyümesini başlatmak, ya da hasar onarılamaz eğer apoptozis geçmesi. Bu durumda, hücre yaşlanma bir tümör bastırıcı şekilde davranır gibi yararlı görünüyor2. Bunun aksine, DNA hasarı da dahil olmak üzere hücresel hasar birikimi nedeniyle yaşlanma ile senesans artar. Sert hücreler sitokinleri, metalloproteinazlar ve büyüme faktörlerini salgılayan, yaşlılık ilişkili salgı fenotipi (SASP) olarak adlandırılan bu yana, hücresel senesans ve SASP bu yaş bağımlı artış azaltılmış doku homeostaz katkıda ve daha sonra yaşlanma. Ayrıca, yaşlılık yükü bu yaş bağımlı artış metabolik hastalıklar, stres hassasiyeti, Progeria sendromlar, ve7,8 iyileşme bozulmuş ve kısmen, çoğunlukla sorumlu olduğu bilinmektedir çok sayıda yaş ile ilgili hastalıklar, ateroskleroz gibi, osteoartrit, kas dejenerasyonu, ülser oluşumu, ve Alzheimer hastalığı9,10,11,12,13. Sertleşme hücrelerinin giderilmesi, doku fonksiyon bozukluğu önlemeye veya geciktirmeye ve healthspan14' e uzatmaya yardımcı olabilir. Bu transgenik fare modelleri14,15,16 yanı sıra hem ilaç tarama çabaları ve Biyoinformatik analizi ile keşfedilen senolitik ilaçlar ve ilaç kombinasyonları kullanarak gösterildi Özellikle senesans hücrelerde indüklenen yollar17,18,19,20,21,22. Daha optimal senoterapötik ilaçların belirlenmesi, daha etkili bir şekilde parlak hücre yükünü azaltabilir, sağlıklı yaşlanma için terapötik yaklaşımlar gelişiminde önemli bir sonraki adımdır.
Parlak hücreler, hem kültürde hem de in vivo karakteristik fenoipik ve moleküler özellikleri gösterir. Bu senesans belirteçleri ya neden ya da senesans indüksiyon sonucu ya da bu hücrelerde moleküler değişikliklerin bir yan ürün olabilir. Ancak, hiçbir tek Marker özellikle parlak hücrelerde bulunamadı. Şu anda, yaşlanma-ilişkili β-galaktosidaz (SA-β-GAL) algılama, en iyi karakterize ve kurulan tek hücreli temel yöntemlerle yaşlanma in vitro ve In vivo ölçmek için biridir. SA-β-GAL pH 4 ' de optimum enzimatik aktivite ile lizozomal hidrolaz 'dir. PH 6 ' da aktivitesini ölçmek mümkündür, çünkü senesans hücreler daha fazla lizozomal etkinliğini gösteriyor23,24. Yaşayan hücreler için, artmış lizozomal pH, vakolar H+-ATPaz inhibitörü bafilomisin a1 veya endozomal asitleştirme inhibitörü chlorokine ile lizozomal alkali ile elde edilir25,26. 5-dodecanoylaminofluorescein di-β-D-galaktopyranoside (C12FDG), 12 karbon lipophilik kısım25nedeniyle hücrelerde parçalanabilen ürün korur gibi yaşayan hücrelerde substrat olarak kullanılır. Daha da önemlisi, SA-β-GAL aktivitesinin kendisi, doğru bir şekilde herhangi bir yol ile doğrudan bağlı değildir ve senesans vermek için gerekli değildir. Bu tahlil ile, yaşlı bireylerin cilt biyopsileri gibi heterojen hücre nüfusu ve yaşlanma dokularında bile, düzensiz hücreler tespit edilebilir. Ayrıca, çeşitli organizmalar ve koşullarda27,28,29, parlak hücre algılama için güvenilir bir marker olarak hücre yaşlanma ve yaşlanma23 arasında bir korelasyon göstermek için kullanılmıştır 30' a kadar. Burada, yüksek verim sa-β-GAL tarama tahlil floresan substrat dayalı C12fdg birincil fare embriyonik fibroblastlar kullanarak (MEFS) sağlam oksidatif stres indüklenen hücre yaşlanma açıklanan ve avantajları ve dezavantajları ele alınmaktadır. Bu tahlil farklı hücre türleri ile yapılabilir rağmen, Ercc1-eksikliği kullanımı, DNA tamir MEFS oksidatif stres koşullarında daha hızlı senesans indüksiyon için izin verir. Farelerde, DNA onarımının azaltılmış ifadesi ERCC1-XPF bozulmuş DNA onarımı, endojen DNA hasarının hızlandırılmış birikimi, yükseltilmiş ROS, mitokondriyal disfonksiyon, artmış parlak hücre yükü, kök hücre fonksiyonunun kaybı ve erken yaşlanma, doğal yaşlanma benzer31,32. Benzer şekilde, Ercc1-eksikliği MEFS kültür17daha hızlı bir şekilde yaşlanma geçmesi. İnanılmaz MEF tahlil önemli bir özelliği, her iyi, parlak hücre spesifik etkileri net gösteri için izin, parlak ve non-parlak hücrelerin bir karışımı vardır. Ancak, biz primer hücrelerde oksidatif stres kullanımı daha fizyolojik olduğunu inanıyoruz rağmen, bu tahlil aynı zamanda yaşlanma DNA zararlı ajanlar etoposid veya ışınlama gibi indüklenen hücre hatları ile kullanılabilir.
Protokol
Hayvan kullanımı Scripps Florida kurumsal hayvan bakımı ve kullanım Komitesi tarafından onaylandı.
1. dölsel murin embriyonik fibroblast (MEF) üretimi – 12-15 gün
- Daha önce33açıklandığı gibi embriyonik gün 13 (E13) hamile kadın fareler vahşi tip ve Ercc1-/- MEFS izole.
Not: tüm aşağıdaki adımlar aseptik koşullarda ve steril aletler kullanılarak bir doku kültürü kaputu içinde gerçekleştirilir. - Embriyo kafasını gözlerinizin üstüne resekt.
- Kırmızı dokusu (kalp ve karaciğer) çıkarın ve gerekirse Genotipleme için kullanın.
- 500 mL, Dulbecco 'nun modifiye kartal Orta (DMEM) ve ham 's F10 ile% 10 fetal sığır serumu, 1x uçucu olmayan amino asitler, penisilin ve streptomisin büyüme ortamı olarak 1:1 karışımı hazırlayın ve her kullanmadan önce yaklaşık 15 dakika boyunca 37 °C ' ye kadar ısıtın. 4 °C ' de büyüme ortamını saklayın.
- 10 dakika boyunca% 0,25 tripsin/EDTA ile embriyonun geri kalanının inküyü.
- Embriyo 1 mm parça içine Mince ve birkaç kez yukarı ve aşağı doku pipet.
- 10 cm çapı hücre kültürü plaka başına bir embriyo büyüme orta ve plaka dokularının 10 mL ekleyin (geçiş 0).
- 37 °C ' de hücreleri yetiştirmek,% 3 O2, 5% Co2.
Not: sadece MEF hücreleri bu koşullar altında kaplı olmayan doku kültürü plakaları ekleyin. - Değiştirme orta her gün geçiş 0 bağlı olmayan doku ve hücre parçaları kaldırmak için.
Not: embriyonun boyutuna ve yalıtım kalitesinin bağlı olarak, hücre genellikle 2 ila 3 gün sonra konfluency ulaşmak. - Tripsinizasyon
- Büyüme ortamını dikkatle kaldırın ve hücreleri 10 mL 1x PBS ile iki kez yıkayın.
- 10 cm çap plakalı hücrelere 2 mL% 0,025 tripsin/EDTA çözeltisi ekleyin ve 37 °C ' de 2-3 dakika boyunca inküye yapın.
- Hücrelerin mikroskobun altındaki hücreleri inceleyerek yüzeyden ayrılmasını sağlayın.
- Büyüme orta aynı miktarda ekleyerek tripsin sindirim sonlandırmak.
- Hücreleri 3 dakika için 200 x g 'de konik bir tüp ve Santrifüjlü hücrelere aktarın ve süpernatant atın.
- Yeniden resuspend hücreleri dikkatle taze büyüme ortamında, saymak hücreler ve tohum onları yeni plakalar içinde öngörülen hücre yoğunluğu.
- Non-senesans alt ekimi Split confluent hücreleri 1:4 ve başka bir geçiş için uzatmak 3% O2, 37 °c daha fazla hücre verim (geçiş 1).
Not: Bu noktada hücreler ya kültürde muhafaza edilebilir veya sıvı azot daha sonra kullanmak için saklanan, kriyovials yaklaşık 1.000.000 hücreleri içeren her. Bu adım aynı zamanda tek hayvan analizinden gelen varyasyon azaltmak için farklı hayvanlardan hücre karışık bir toplu oluşturmak için imkanı sunuyor. - Hücre yaşlılığı, tohum bölünmüş konfluent hücrelerini 1:4 oranındaki geçiş 1 ' e kadar teşvik etmek ve onları% 20 O2, 37 °c, 5% Co2 ' ye 3 gün boyunca inküymek için; Bu kültür koşulları oksijen için atmosferik.
Not: ortam oksijen konsantrasyonları altında hücreler ve blastosist ekimi özellikle DNA hasar onarımı34,35,36özürlü olduğunda hücresel senesans belirteçleri yükseltedersin. - 2 daha fazla geçiş için bu yordamı tekrarlayın.
- Hücresel senescence izlemek için, gelişmiş Coulter hücre sayacı sistemi kullanarak her tripsinization adım sırasında hücre çapı ve hücre hacmi kademeli artış ölçmek.
- Denklem kullanarak nüfus ikiye katlama (PD) belirlenmesi ile hücre proliferasyonu azalma değerlendirmek
PDT = (t2-t1)/3,32 x (log n2 – log n1)
Not: nüfus iki katına zaman sadece olmayan-parlak hücreler için kullanıldı. - Erken geçiş Wild-Type veya Ercc1-/- MEF hücreleri% 3 O2, 37 °c, 5% Co2 olarak tutulmamış kullanımı olmayan-senesans kontrol hücreleri.
2. senesans ilişkili β-GAL tarama tahlil – 2-3 gün
- Test edilecek tüm ilaçların DMSO 'da 10 mM stok solüsyonu hazırlayın ve-80 °C ' de alquots 'u saklayın. Bu ilaçların etkinliğini azaltabilir gibi donma-çözülme stok çözümleri yok.
Not: burada, HSP90 inhibitörü 17DMAG özellikle parlak hücreler17öldürme yeteneğine sahip bir senolitik ilaç olarak kullanıldı. - Deney gün, aliquot çözüyor, taze kültür ortamında ilaçlar seyreltmek ve büyüme ortamında son konsantrasyon verim için bir 1:1 oranında şartlık orta içeren hücrelere ekleyin.
- Seri dilüsyonlar ve uyuşturucu kombinasyonları için 96-iyi ön seyreltme plakaları kullanın.
Not: MEF hücreleri Için, DMSO konsantrasyonlarının% 2 ' sini aşmaması ve kullanılan en yüksek DMSO konsantrasyonları ile tedavi edilen hücrelerin her çalıştırılmasına dahil edilmesi gereken ampirik olarak belirlenmiştir. - Tohum 5 x 103 senesans hücreler ya da 3 x 103 iyi tabakalar başına 96 iyi plakaları en az 6 h tedavi önce 100 μL büyüme orta ve Inkük 20% O2, 37 °c, 5% Co2.
Not: hücreler yaklaşık 80% tedavi öncesi confluent olmalıdır. - Floresan sinyal Crosstalk ve arka planı en aza indirmek için 96 iyi plakalar tedavi siyah duvar/Clear alt doku kültürü kullanın.
Not: ancak, açık plakalar da başarıyla test edilmiştir. - MEF hücrelerine ilaç dilüsyonları ekleyin ve 24 h için 48 h altında 20% O2, 37 °c,% 5 Co2 koşullar inkük.
- % 3 O2, 37 °c,% 5 Co2 koşulunda olmayan parlak hücreleri tutun.
- Lizozomal alkali için, 10 mm bafilomycin a1 solüsyonu hazırlayın, kısım ve-20 °c ' de donmuş tutun.
- SA-β-GAL aktivitesinin floresan analizi için 2 mM C12fdg Stock solüsyonu hazırlayın,-20 °c ' de saklayın ve ışıktan koruyun.
- Çalışma çözümü için, deneme gününde 100 μM C12fdg büyüme ortamına hazırlanın.
Not: C12fdg içeren tüm (Kuluçk) adımlar karanlıkta yapılmalıdır. - 100 μL 1x PBS ile ilaç çözümünü çıkarın ve hücreleri 1 kez yıkayın.
- % 20 O2, 37 °c, 5% Co2' de 1 saat boyunca taze hücre kültürü ortamında hazırlanan 100 Nm bafilomycin a1 çözeltisi 90 μL ile hücreleri ön tedavi ederek lizozomal alkali atıklaştırma.
- Kültür ortamına 10 μL 100 μM C12fdg çalışma çözümü ekleyin (son konsantrasyon 10 μM).
- Hücreleri 2 saat boyunca kulbe etme.
- Kültür için 2 μL 100 μg/mL Hoechst 33342 boya (son konsantrasyon 2 μg/mL) ekleyin ve 20 dakika boyunca inküye yapın.
- Medyayı çıkarın ve 100 μL taze büyüme ortamını ekleyin.
3. nicel yüksek içerik floresan görüntü analizi
- Hoechst ve C12FDG floresans (örneğin, DAPı ve FITC kanal hazır ayarları, sırasıyla) yakalama için uygun iki kanalda hücrelerin floresan görüntüleri elde etmek için yüksek içerik floresan görüntü edinme ve analiz platformu kullanın.
Not: edinme protokolleri, tahlil için spesifik olan çeşitli değişkenlerin tanımını gerektirir. Bir edinme protokolünün amacı, akım nicel analizi için yeterli sayıda hücre içinde yeterli sayıdaki odaklama floresan görüntüsünü yakalamakta. - Her kanal seçerek ve tanımlama, bir veya daha fazla seçici ölçüt ayarlayarak, her kanaldaki ilgi özelliği olarak niteleyen uygun bir analiz Protokolü geliştirin.
- Çekirdek için, bu kadar segmentasyon ön setleri kullanın (örneğin, nükleer segmentasyon, vezikül segmentasyon, sitoplazma segmentasyon) bu morfoloji dahil olmak üzere birden fazla ölçüt temelinde hücresel organel tanımlaması sağlayacak, boyutu, ve sinyal Yoğun -luğu. Bir sinyal olabilir, ama hangi, örneğin, çok büyük ya da çok küçük çekirdekler gibi nükleer parçaları ve enkaz hariç iken çekirdekleri dahil etmek için bu ölçütleri ayarlayın.
- Parçalanabilen C12fdg 'den floresans olan fitc kanalındaki sinyali kontrol edin ve hücrelerde senescence ilişkili β-galaktosidaz aktivitesinin miktarını temsil eder.
Not: parlak hücreler, daha yüksek bir yaşlılığı ilişkili β-galaktosidaz aktivitesine sahip olmayan-durgun hücrelerden; Ancak c 12fdg floresan, c 12 fdg-Positive ve c12fdg-negative hücre olarak düşünülür arasında bir eşik kurulması gerektiren,ayrık ve sürekli olmayan olacak. - Ticari olarak kullanılabilen analitik yazılımları kullanarak, çekirdeğin çevresindeki tanımlanmış bir bölgenin (varsayımsal bir hücre) üst eşik C12fdg ile en az bir kez örtüşmüş olduğu örneklerin sayısını üretir.
Not: analitik yazılım otomatik olarak hedef bağlama kullanarak bir sayım oluşturur. Bu bir senesans, C12fdg-pozitif hücre tahlil 's pratik tanımı.
- Her iyi ve ortalama değerleri ve standart sapmaları buna göre hesaplanır 3-5 alanları ile triplicate tüm örnekleri analiz edin.
- Aşağıdaki formülü kullanarak senesans hücrelerin yüzdesini hesaplayın:
Senesans hücreler (%) =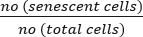 x 100
x 100
4. tahlil doğrulama parametreleri
- Tüm örnekler için-ve inter-tahlil varyasyonları katsayısı (% CVs) aşağıdaki formül kullanılarak hesaplanır:
Intra-assay CV (n = 10 tekrarlar bir denemede ölçülür ) = x 100 (%)
) = x 100 (%)
Inter-assay CV (n = 5 bağımsız deneyler) = x 100 (%)
x 100 (%) - Tarama amacıyla, Z ' değerini belirlemek, bir tahlil kalitesini değerlendirmek için bir istatistiksel parametre, ile tedavi hücrelerinden 200 nM Rapamycin 24 h için 20% O2, 37 °c, 5% Co2 (senoterapötik ilaçlar için olumlu bir kontrol) ve tedavi edilmemiş (negatif kontrol).
Not: Z ' değeri Zhang ve al.37göre hesaplanır. Z ' değerleri 0,5 ve 1 arasında bir tahlil ilaç taraması için kullanılabilir olduğunu gösterir.
Sonuçlar
SA-β-GAL aktivite çoğaltıcı tükenmesi, genotoksisik ve oksidatif stres, onkojen aktivasyonu için çeşitli şekillerde senesce indüklenen hücrelerde tespit edilebilir23,25,38. Geçerli modelde Ercc1-eksikliği fare embriyonik fibroblast hücreleri kullanarak, normoxic büyüme koşulları (20% O2) birkaç pasajlar için onları yetiştirdikten sonra hücre yaşlanma i...
Tartışmalar
SA-β-GAL, aslında dimri ve Al tarafından keşfedilen hücresel yaşlanma için iyi tanımlanmış bir biyomarker . (1995) pH 623 ' de proliferasyon hücrelerine göre değerlendirildiğinde, senesans insan fibroblastların sa-β-GAL aktivitesinin arttığını gösteriyor. Bu arada, In vitro ve In vivo tahlil için sa-β-GAL farklı hücre tipleri ve dokular için kurulmuştur25,39,40. Bu prot...
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Bu çalışma NıH hibe AG043376 (Proje 2 ve Core A, PDR tarafından desteklenmektedir; Proje 1 ve Core B, LJN) ve AG056278 (Proje 3 ve çekirdek A, PDR; ve proje 2, LJN) ve Glenn Vakfı (LJN) bir hibe.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM | Corning | 10-013-CV | medium |
| Ham's F10 | Gibco | 12390-035 | medium |
| fetal bovine serum | Tissue Culture Biologics | 101 | serum |
| 1x non-essential amino acids | Corning | 25-025-Cl | amino-acids |
| bafilomycin A1 | Sigma | B1793 | lysosomal inhibitor |
| C12FDG | Setareh Biotech | 7188 | b-Gal substrate |
| Hoechst 33342 | Life Technologies | H1399 | DNA intercalation agent |
| 17DMAG | Selleck Chemical LLC | 50843 | HSP90 inhibitor |
| InCell6000 Cell Imaging System | GE Healthcare | High Content Imaging System |
Referanslar
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Campisi, J., di Fagagna, F. D. Cellular senescence: when bad things happen to good cells. Nature Reviews Molecular Cell Biology. 8 (9), 729-740 (2007).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Zhu, J., Woods, D., McMahon, M., Bishop, J. M. Senescence of human fibroblasts induced by oncogenic Raf. Genes and Development. 12 (19), 2997-3007 (1998).
- Dimri, G. P., Itahana, K., Acosta, M., Campisi, J. Regulation of a senescence checkpoint response by the E2F1 transcription factor and p14(ARF) tumor suppressor. Molecular and Cellular Biology. 20 (1), 273-285 (2000).
- Michaloglou, C., et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature. 436 (7051), 720-724 (2005).
- Niedernhofer, L. J. Tissue-specific accelerated aging in nucleotide excision repair deficiency. Mechanisms of Ageing and Development. 129 (78), 408-415 (2008).
- Gitenay, D., et al. Glucose metabolism and hexosamine pathway regulate oncogene-induced senescence. Cell Death & Disease. 5, e1089 (2014).
- Erusalimsky, J. D., Kurz, D. J. Cellular senescence in vivo: its relevance in ageing and cardiovascular disease. Experimental Gerontology. 40 (8-9), 634-642 (2005).
- Kassem, M., Marie, P. J. Senescence-associated intrinsic mechanisms of osteoblast dysfunctions. Aging Cell. 10 (2), 191-197 (2011).
- Campisi, J., Andersen, J. K., Kapahi, P., Melov, S. Cellular senescence: A link between cancer and age-related degenerative disease. Seminars in Cancer Biology. 21 (6), 354-359 (2011).
- Golde, T. E., Miller, V. M. Proteinopathy-induced neuronal senescence: a hypothesis for brain failure in Alzheimer's and other neurodegenerative diseases. Alzheimers Research & Therapy. 1 (2), 5 (2009).
- Telgenhoff, D., Shroot, B. Cellular senescence mechanisms in chronic wound healing. Cell Death & Differentiation. 12 (7), 695-698 (2005).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Baker, D. J., et al. Naturally occurring p16-positive cells shorten healthy lifespan. Nature. , (2016).
- Childs, B. G., et al. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 354 (6311), 472-477 (2016).
- Fuhrmann-Stroissnigg, H., et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 8 (1), 422 (2017).
- Zhu, Y., et al. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging. 9 (3), 955-963 (2017).
- Zhu, Y., et al. Identification of a Novel Senolytic Agent, Navitoclax, Targeting the Bcl-2 Family of Anti-Apoptotic Factors. Aging Cell. , (2015).
- Zhu, Y., et al. The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. , (2015).
- Baar, M. P., et al. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 169 (1), 132-147 (2017).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature. , (2017).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences USA. 92 (20), 9363-9367 (1995).
- Itahana, K., Campisi, J., Dimri, G. P. Methods to detect biomarkers of cellular senescence: the senescence-associated beta-galactosidase assay. Methods in Molecular Biology. 371, 21-31 (2007).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-[beta]gal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Cahu, J., Sola, B. A sensitive method to quantify senescent cancer cells. Journal of Visualized Experiments. 78 (78), (2013).
- Collado, M., et al. Tumour biology: Senescence in premalignant tumours. Nature. 436 (7051), 642 (2005).
- Krishnamurthy, J., et al. Ink4a/Arf expression is a biomarker of aging. The Journal of Clinical Investigation. 114 (9), 1299-1307 (2004).
- Mishima, K., et al. Senescence-associated beta-galactosidase histochemistry for the primate eye. Investigative Ophthalmology, Visual Science. 40 (7), 1590-1593 (1999).
- Melk, A., et al. Expression of p16INK4a and other cell cycle regulator and senescence associated genes in aging human kidney. Kidney International. 65 (2), 510-520 (2004).
- Niedernhofer, L. J., et al. A new progeroid syndrome reveals that genotoxic stress suppresses the somatotroph axis. Nature. 444 (7122), 1038-1043 (2006).
- Wang, J., Clauson, C. L., Robbins, P. D., Niedernhofer, L. J., Wang, Y. The oxidative DNA lesions 8,5′-cyclopurines accumulate with aging in a tissue-specific manner. Aging Cell. 11 (4), 714-716 (2012).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. Journal of Visualized Experiments. (64), (2012).
- Jagannathan, L., Cuddapah, S., Costa, M. Oxidative stress under ambient and physiological oxygen tension in tissue culture. Current Pharmacology Reports. 2 (2), 64-72 (2016).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. J Assist Reprod Genet. 31 (10), 1259-1267 (2014).
- Robinson, A. R., et al. Spontaneous DNA damage to the nuclear genome promotes senescence, redox imbalance and aging. Redox Biology. 17, 259-273 (2018).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal Of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhao, H., Darzynkiewicz, Z. Biomarkers of cell senescence assessed by imaging cytometry. Methods in Molecular Biology. 965, 83-92 (2013).
- Yang, N. -. C., Hu, M. -. L. A fluorimetric method using fluorescein di-β-d-galactopyranoside for quantifying the senescence-associated β-galactosidase activity in human foreskin fibroblast Hs68 cells. Analytical Biochemistry. 325 (2), 337-343 (2004).
- Zhao, J., et al. Quantitative Analysis of Cellular Senescence in Culture and In Vivo. Current Protocols in Cytometry. 79, (2017).
- Capparelli, C., et al. CDK inhibitors (p16/p19/p21) induce senescence and autophagy in cancer-associated fibroblasts, "fueling" tumor growth via paracrine interactions, without an increase in neo-angiogenesis. Cell Cycle. 11 (19), 3599-3610 (2012).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. GammaH2AX as a molecular marker of aging and disease. Epigenetics. 5 (2), 129-136 (2010).
- Hewitt, G., et al. Telomeres are favoured targets of a persistent DNA damage response in ageing and stress-induced senescence. Nature Communications. 3, 708 (2012).
- Narita, M., et al. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 113 (6), 703-716 (2003).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging-Us. 5 (1), 37-50 (2013).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is β-Galactosidase Staining a Marker of Senescence in Vitro and in Vivo?. Experimental Cell Research. 257 (1), 162-171 (2000).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır