需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
SA-β-加拉基沙酶筛查检测,用于识别治疗药物
* 这些作者具有相同的贡献
摘要
细胞衰老是慢性年龄相关疾病发展的关键因素。针对衰老细胞的治疗药物的鉴定为延长健康衰老提供了希望。在这里,我们提出了一个新的测定,以筛选基于测量与衰老相关的β-加拉托西沙酶在单细胞中的异质疗法的识别。
摘要
细胞衰老是已知对健康寿命产生负面影响的衰老特征之一。能够专门杀死细胞培养中的衰老细胞的药物,称为溶酶,可以减轻体内的衰老细胞负担,延长健康范围。迄今为止,已经确定了多种溶血剂,包括HSP90抑制剂、Bcl-2系列抑制剂、管龙胺、FOXO4抑制肽和达萨替尼/克雷塞汀的组合。在增加的溶血球pH值下检测SA-β-Gal是检测衰老细胞的最佳特征标记之一。使用荧光基质C12FDG结合确定总细胞数,结合DNA间质化Hoechst染料对衰老相关β-乳糖酶(SA-β-Gal)活性的活细胞测量,为通过杀死衰老细胞(溶血)或通过抑制SA-β-Gal和其他衰老细胞表型(异形性)来降低整体SA-β-Gal活性的脱氧治疗药物的屏幕。使用高含量荧光图像采集和分析平台,可快速、高通量地筛选药物库,从而对SA-β-Gal、细胞形态和细胞数量产生影响。
引言
伦纳德·海夫利克和保罗·摩尔黑德首次描述了细胞衰老,他们表明正常细胞在培养中增殖的能力有限。尽管存在营养物质、生长因子和缺乏接触抑制,衰老细胞仍不能增殖,但仍然具有代谢活性2。这种现象被称为复制性衰老,主要归因于端粒缩短,至少在人类细胞3。进一步的研究表明,细胞也可以诱导进行衰老,以回应其他刺激,如致癌应激(致癌基因诱导衰老,OIS),DNA损伤,细胞毒性药物,或辐照(应力诱发衰老,SIS)4,5,6.为了应对DNA损伤,包括端粒侵蚀,细胞要么衰老,开始不受控制的细胞生长,或者在损伤无法修复时发生凋亡。在这种情况下,细胞衰老似乎是有益的,因为它以肿瘤抑制方式2。相反,由于细胞损伤的积累(包括DNA损伤),衰老会随着衰老而增加。由于衰老细胞可以分泌细胞因子、金属蛋白酶和生长因子,称为衰老相关分泌表型(SASP),这种年龄依赖性增加的细胞衰老和SASP有助于减少组织平衡和随后老化。此外,这种年龄依赖增加的衰老负担已知诱发代谢性疾病,压力敏感性,前列腺综合征,和受损的愈合7,8,并在一定程度上,负责与年龄相关的众多疾病,如动脉粥样硬化,骨关节炎,肌肉退化,溃疡形成,和阿尔茨海默氏病9,10,11,12,13。消除衰老细胞可以帮助预防或延缓组织功能障碍,延长健康范围14。这已经在转基因小鼠模型14,15,16以及通过使用溶血药物和药物组合,发现通过药物筛选努力和生物信息分析在衰老细胞17、18、19、20、21、22中专门诱导的通路。确定更优的脱压治疗药物,能够更有效地减轻衰老细胞负担,是开发健康衰老治疗方法的重要下一步。
在培养和体内,衰老细胞都表现出特征的型板和分子特征。这些衰老标记可能是衰老诱导的原因或结果,或者是这些细胞中分子变化的副产品。然而,在衰老细胞中没有特别的标记。目前,衰老相关β-乳糖酶(SA-β-Gal)检测是测量体外和体内衰老的最佳特征和既定单细胞方法之一。SA-β-Gal是一种溶酶体水解酶,在pH4时具有最佳酶活性。测量其活性在pH6是可能的,因为衰老细胞显示增加的细胞体活性23,24。对于活细胞,通过脂质体碱化获得增加的液化pH与真空H+-ATPase抑制剂巴菲洛霉素A1或内生菌酸化抑制剂氯奎因25,26。5-多地诺霉素二β-D-角质拉诺赛德(C12FDG)用作活细胞中的基质,因为它由于其12种亲碳性小鼠25而保留了细胞中的切块产物。重要的是,SA-β-Gal活性本身与在衰老细胞中识别的任何通路没有直接关系,也没有必要诱导衰老。通过这种测定,即使在异质细胞群和老化组织中,如老年人的皮肤活检,也可以识别衰老细胞。它也被用来显示细胞衰老和老化23之间的相关性,因为它是一个可靠的标志,在若干生物体和条件27,28,29衰老细胞检测, 30.在这里,描述了基于荧光基质C12FDG的高通量SA-β-Gal筛选测定,使用具有强氧应激诱导细胞衰老的原小鼠胚胎成纤维细胞(MEF)进行,其优缺点讨论。虽然这种测定可以在不同的细胞类型中进行,但使用Ercc1缺陷的DNA修复受损的MEF允许在氧化应激条件下更快速地诱导衰老。在小鼠中,脱氧核糖核酸修复内糖酶ERCC1-XPF的表达减少导致DNA修复受损,内源性DNA损伤加速积累,ROS升高,线粒体功能障碍,衰老细胞负担增加,干细胞功能丧失,过早衰老,类似于自然老化31,32。同样,Ercc1缺陷MEF在文化中发生衰老的速度更快17。衰老MEF测定的一个重要特征是,每口井都有衰老和非衰老细胞的混合物,可以清楚地显示衰老细胞特异性效应。然而,尽管我们认为在原发细胞中使用氧化应激诱导衰老更具有生理性,但是这种测定也可用于细胞系,其中衰老是用DNA破坏剂(如etoposide或辐照)诱导的。
研究方案
动物使用得到了斯克里普斯佛罗里达机构动物护理和使用委员会的批准。
1. 生成衰老鼠胚胎成纤维细胞 (MEF) = 12-15 天
- 在胚胎期13日(E13)从怀孕的雌性小鼠中分离野生型和Ercc1-/-MEFs,如前33所述。
注:以下所有步骤均在无菌条件下使用无菌仪器在组织培养罩中执行。 - 切除眼睛上方的胚胎头。
- 取出红色组织(心脏和肝脏),必要时使用它们进行基因分型。
- 制备Dulbeco的改性鹰介质(DMEM)和Ham的F10的1:1混合物,10%胎儿牛血清、1x非必需氨基酸、青霉素和链霉素作为生长介质,加热至37°C,每次使用前约15分钟。将生长介质储存在4°C。
- 用0.25%胰蛋白酶/EDTA孵育胚胎的其余部分10分钟。
- 将胚胎切成1毫米的碎片,并移液组织上下几次。
- 每10厘米直径细胞培养板(通道0)添加10mL的生长培养基和板组织一个胚胎。
- 在37°C,3%O 2,5%CO2培养细胞。
注:在这些条件下,只有MEF细胞附着在非涂层组织培养板上。 - 在通道0中每天更换介质,以去除非附着组织和细胞片段。
注:根据胚胎的大小和分离的质量,细胞通常在2至3天后达到汇合。 - 胰蛋白酶化
- 小心地取出生长介质,用10 mL的1x PBS洗涤细胞两次。
- 在直径10厘米的板中加入2 mL的0.025%胰蛋白酶/EDTA溶液,并在37°C下孵育2-3分钟。
- 通过检查显微镜下的细胞,确保细胞与表面分离。
- 通过添加相同量的生长介质来终止胰蛋白酶消化。
- 将细胞转移到锥形管和离心细胞在200 x g3分钟,并丢弃上清液。
- 在新鲜生长培养基中小心地重新悬浮细胞,以预计的细胞密度计算细胞并将其播种到新板中。
- 对于非衰老亚培养分裂汇合细胞1:4,并在3%O 2,37°C处延伸另一个通道以产生更多的细胞(通道1)。
注:此时,细胞既可以保存在培养中,也可以储存在液氮中,在冷冻室中,每个细胞中包含大约100万个细胞。这一步还提供了从不同动物中产生混合细胞的可能性,以减少来自单一动物分析的变异性。 - 为了诱导细胞衰老,种子以1:4的比例从通道1分裂汇合细胞,并在20%O 2,37°C,5%CO2孵育3天;这些培养条件对氧气是大气的。
注:在环境氧浓度下培养细胞和胚泡,在DNA损伤修复受损34、35、36时,会提升细胞衰老的标记物。 - 重复此过程,再重复 2 个段落。
- 要监测细胞衰老,请使用先进的库尔特细胞计数器系统测量每个胰蛋白酶化步骤中细胞直径和细胞体积的逐渐增加。
- 使用方程确定人口翻倍 (PD) 来评估细胞增殖的减少
PDT = (t2-t1)/3.32 x (日志 n2 = 日志 n1)
注:人口翻倍时间仅用于非衰老细胞。 - 使用早期通道野生型或Ercc1-/-MEF细胞,这些细胞被保持在3%O 2,37°C,5%CO2作为非衰老控制细胞。
2. 致感性相关β-Gal筛查测定 = 2-3天
- 在 DMSO 中制备 10 mM 库存溶液,以测试并储存在 -80°C 的等分物。不要冷冻解冻库存溶液,因为这可能会减少药物的活性。
注:在这里,HSP90抑制剂17DMAG被用作一种溶血药物,能够专门杀死衰老细胞17。 - 在实验解冻当天,在新鲜培养基中稀释药物,以1:1的比例向含有条件培养基的细胞中加入,以产生生长培养基的最终浓度。
- 使用96孔预稀释板进行连续稀释和药物组合。
注:对于MEF细胞,根据经验确定DMSO浓度不应超过2%,每次运行中应包含使用最高DMSO浓度的对照细胞。 - 种子 5 x 103衰老细胞或 3 x 103非衰老细胞,在 96 孔板中每孔中至少 6 小时,在 100 μL 的生长培养基中进行治疗,并在 20% O2、37 °C、 5% CO2下孵育。
注意:治疗前细胞应约80%的汇入。 - 使用黑壁/透明底组织培养,处理96孔板,以尽量减少荧光信号串扰和背景。
注:然而,透明板也已成功测试。 - 向MEF细胞中加入药物稀释剂,在20%O 2、37°C、5%CO2条件下孵育24小时至48小时。
- 将非衰老细胞保持在3%O 2,37°C,5%CO2条件下。
- 对于液化碱化,制备10mM巴菲洛霉素A1溶液,等分,并保持在-20°C冷冻。
- 对于 SA-β-Gal 活性的荧光分析,准备 2 mM C12FDG 库存溶液,储存在 -20°C,并防止光线照射。
- 对于工作溶液,在实验当天准备在生长介质中制备100μM C12FDG。
注:所有涉及 C12FDG 的(孵化)步骤应在黑暗中执行。 - 用100μL的1xPBS去除药物溶液和洗涤细胞1次。
- 通过在新鲜细胞培养基中制备的100 nM巴菲洛霉素 A1 溶液预处理细胞,在 20% O 2、 37 °C、 5%CO2下进行 1 小时诱导液化碱化。
- 在培养基中加入10μL的100μM C12FDG工作溶液(最终浓度10μM)。
- 孵化细胞2小时。
- 在培养基中加入 2 μL 的 100 μg/mL Hoechst 33342 染料(最终浓度 2 μg/mL),孵育 20 分钟。
- 去除介质并添加 100 μL 的新鲜生长介质。
3. 定量高含量荧光图像分析
- 使用高含量荧光图像采集和分析平台,在两个通道中获取适合捕获 Hoechst 和 C12FDG 荧光的两个通道中的细胞的荧光图像(例如,分别捕获 DAPI 和 FITC 通道预设)。
注: 采集协议需要定义特定于测定的几个变量。采集协议的目的是捕获足够数量的聚焦荧光图像,这些细胞数量足够,用于下游定量分析。 - 通过选择每个通道,并通过调整一个或多个选择性标准来定义每个通道中感兴趣的功能,从而制定适当的分析协议。
- 对于细胞核,使用如此分割预设(例如,核分割、囊泡分割、细胞质分割),从而允许根据多种标准(包括形态、大小和信号)识别细胞细胞器强度。调整这些标准,将核包括在内,同时排除核碎片和碎片,这些碎片和碎片可能具有信号,但例如,它们太大或太小,不能成为核。
- 检查FITC通道中信号,该通道是来自分离的C12FDG的荧光,表示细胞中与衰老相关的β-结节酶活性。
注:与非衰老细胞相比,衰老细胞具有更高的衰老相关酶活性;然而,C12FDG荧光是非离散和连续的,因此必须在被视为C12FDG阳性和C12FDG阴性细胞之间建立阈值。 - 使用市售的分析软件,生成围绕原子核的已定义区域(假定细胞)至少与高于阈值的 C12FDG 重叠一次的实例计数。
注:分析软件使用目标链接自动生成计数。这是测定对衰老C12FDG阳性细胞的实际定义。
- 分析三联体中的所有样本,每口井有 3-5 个字段,并相应地计算平均值和标准差。
- 使用以下公式计算衰老细胞的百分比:
致衰老细胞 (%)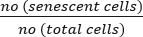 = x 100
= x 100
4. 测定验证参数
- 对于所有样本,使用以下公式计算所有样本的内检测系数 (%CV):
测定内 CV(n = 10 个重复在一个实验中 测量) = x 100 (%)
测量) = x 100 (%)
分差CV(n = 5个独立实验) = x 100 (%)
= x 100 (%) - 出于筛选目的,确定 Z' 值,这是一个用于评估检测质量的统计参数,从使用 200 nM 雷帕霉素治疗的细胞中,在 20%O 2、 37 °C、5% CO2(脱毛药物阳性对照)和未经治疗的细胞中治疗 24 小时衰老细胞(阴性对照)。
注:Z值是根据张等人37年计算的。Z' 值介于 0.5 和 1 之间,表示可用于药物筛查的测定。
结果
SA-β-Gal活性可以在从复制性衰竭、基因毒性和氧化应激到基因活化23、25、38等多种途径诱导衰老的细胞中检测到。在目前使用Ercc1-缺陷小鼠胚胎成纤维细胞的模型中,规范的细胞生长条件(20%O2)足以诱导细胞衰老后,培养他们几个通道。野生型MEF也经历衰老,但需要额外的通道在20%O2。
讨论
SA-β-Gal 是一种定义良好的细胞衰老生物标志物,最初由 Dimri等人发现。(1995) 表明,与增殖细胞相比,在pH 623测定时,衰老的人类成纤维细胞增加了SA-β-Gal的活性。同时,为不同细胞类型和组织建立了SA-β-Gal的体外和体内测定25、39、40。该协议中描述的基于荧光的单细胞方法测量活细胞中的SA-β-Gal,是影响细胞<...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NIH赠款AG043376(项目2和核心A,PDR;PDR;以及PDR;项目2和核心A;项目2;项目A;项目2;项目A;项目2;项目A;项目2;项目A;项目2;项目A;项目2;项目A;项目2;项目项目1和核心B、LJN和AG056278(项目3和核心A、PDR;项目2,LJN)和格伦基金会(LJN)的赠款。
材料
| Name | Company | Catalog Number | Comments |
| DMEM | Corning | 10-013-CV | medium |
| Ham's F10 | Gibco | 12390-035 | medium |
| fetal bovine serum | Tissue Culture Biologics | 101 | serum |
| 1x non-essential amino acids | Corning | 25-025-Cl | amino-acids |
| bafilomycin A1 | Sigma | B1793 | lysosomal inhibitor |
| C12FDG | Setareh Biotech | 7188 | b-Gal substrate |
| Hoechst 33342 | Life Technologies | H1399 | DNA intercalation agent |
| 17DMAG | Selleck Chemical LLC | 50843 | HSP90 inhibitor |
| InCell6000 Cell Imaging System | GE Healthcare | High Content Imaging System |
参考文献
- Hayflick, L., Moorhead, P. S. The serial cultivation of human diploid cell strains. Experimental Cell Research. 25, 585-621 (1961).
- Campisi, J., di Fagagna, F. D. Cellular senescence: when bad things happen to good cells. Nature Reviews Molecular Cell Biology. 8 (9), 729-740 (2007).
- Harley, C. B., Futcher, A. B., Greider, C. W. Telomeres shorten during ageing of human fibroblasts. Nature. 345 (6274), 458-460 (1990).
- Zhu, J., Woods, D., McMahon, M., Bishop, J. M. Senescence of human fibroblasts induced by oncogenic Raf. Genes and Development. 12 (19), 2997-3007 (1998).
- Dimri, G. P., Itahana, K., Acosta, M., Campisi, J. Regulation of a senescence checkpoint response by the E2F1 transcription factor and p14(ARF) tumor suppressor. Molecular and Cellular Biology. 20 (1), 273-285 (2000).
- Michaloglou, C., et al. BRAFE600-associated senescence-like cell cycle arrest of human naevi. Nature. 436 (7051), 720-724 (2005).
- Niedernhofer, L. J. Tissue-specific accelerated aging in nucleotide excision repair deficiency. Mechanisms of Ageing and Development. 129 (78), 408-415 (2008).
- Gitenay, D., et al. Glucose metabolism and hexosamine pathway regulate oncogene-induced senescence. Cell Death & Disease. 5, e1089 (2014).
- Erusalimsky, J. D., Kurz, D. J. Cellular senescence in vivo: its relevance in ageing and cardiovascular disease. Experimental Gerontology. 40 (8-9), 634-642 (2005).
- Kassem, M., Marie, P. J. Senescence-associated intrinsic mechanisms of osteoblast dysfunctions. Aging Cell. 10 (2), 191-197 (2011).
- Campisi, J., Andersen, J. K., Kapahi, P., Melov, S. Cellular senescence: A link between cancer and age-related degenerative disease. Seminars in Cancer Biology. 21 (6), 354-359 (2011).
- Golde, T. E., Miller, V. M. Proteinopathy-induced neuronal senescence: a hypothesis for brain failure in Alzheimer's and other neurodegenerative diseases. Alzheimers Research & Therapy. 1 (2), 5 (2009).
- Telgenhoff, D., Shroot, B. Cellular senescence mechanisms in chronic wound healing. Cell Death & Differentiation. 12 (7), 695-698 (2005).
- Baker, D. J., et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 479 (7372), 232-236 (2011).
- Baker, D. J., et al. Naturally occurring p16-positive cells shorten healthy lifespan. Nature. , (2016).
- Childs, B. G., et al. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 354 (6311), 472-477 (2016).
- Fuhrmann-Stroissnigg, H., et al. Identification of HSP90 inhibitors as a novel class of senolytics. Nature Communications. 8 (1), 422 (2017).
- Zhu, Y., et al. New agents that target senescent cells: the flavone, fisetin, and the BCL-XL inhibitors, A1331852 and A1155463. Aging. 9 (3), 955-963 (2017).
- Zhu, Y., et al. Identification of a Novel Senolytic Agent, Navitoclax, Targeting the Bcl-2 Family of Anti-Apoptotic Factors. Aging Cell. , (2015).
- Zhu, Y., et al. The Achilles' heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. , (2015).
- Baar, M. P., et al. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 169 (1), 132-147 (2017).
- Jeon, O. H., et al. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nature. , (2017).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences USA. 92 (20), 9363-9367 (1995).
- Itahana, K., Campisi, J., Dimri, G. P. Methods to detect biomarkers of cellular senescence: the senescence-associated beta-galactosidase assay. Methods in Molecular Biology. 371, 21-31 (2007).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-[beta]gal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Cahu, J., Sola, B. A sensitive method to quantify senescent cancer cells. Journal of Visualized Experiments. 78 (78), (2013).
- Collado, M., et al. Tumour biology: Senescence in premalignant tumours. Nature. 436 (7051), 642 (2005).
- Krishnamurthy, J., et al. Ink4a/Arf expression is a biomarker of aging. The Journal of Clinical Investigation. 114 (9), 1299-1307 (2004).
- Mishima, K., et al. Senescence-associated beta-galactosidase histochemistry for the primate eye. Investigative Ophthalmology, Visual Science. 40 (7), 1590-1593 (1999).
- Melk, A., et al. Expression of p16INK4a and other cell cycle regulator and senescence associated genes in aging human kidney. Kidney International. 65 (2), 510-520 (2004).
- Niedernhofer, L. J., et al. A new progeroid syndrome reveals that genotoxic stress suppresses the somatotroph axis. Nature. 444 (7122), 1038-1043 (2006).
- Wang, J., Clauson, C. L., Robbins, P. D., Niedernhofer, L. J., Wang, Y. The oxidative DNA lesions 8,5′-cyclopurines accumulate with aging in a tissue-specific manner. Aging Cell. 11 (4), 714-716 (2012).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. Journal of Visualized Experiments. (64), (2012).
- Jagannathan, L., Cuddapah, S., Costa, M. Oxidative stress under ambient and physiological oxygen tension in tissue culture. Current Pharmacology Reports. 2 (2), 64-72 (2016).
- Meuter, A., et al. Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen. J Assist Reprod Genet. 31 (10), 1259-1267 (2014).
- Robinson, A. R., et al. Spontaneous DNA damage to the nuclear genome promotes senescence, redox imbalance and aging. Redox Biology. 17, 259-273 (2018).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal Of Biomolecular Screening. 4 (2), 67-73 (1999).
- Zhao, H., Darzynkiewicz, Z. Biomarkers of cell senescence assessed by imaging cytometry. Methods in Molecular Biology. 965, 83-92 (2013).
- Yang, N. -. C., Hu, M. -. L. A fluorimetric method using fluorescein di-β-d-galactopyranoside for quantifying the senescence-associated β-galactosidase activity in human foreskin fibroblast Hs68 cells. Analytical Biochemistry. 325 (2), 337-343 (2004).
- Zhao, J., et al. Quantitative Analysis of Cellular Senescence in Culture and In Vivo. Current Protocols in Cytometry. 79, (2017).
- Capparelli, C., et al. CDK inhibitors (p16/p19/p21) induce senescence and autophagy in cancer-associated fibroblasts, "fueling" tumor growth via paracrine interactions, without an increase in neo-angiogenesis. Cell Cycle. 11 (19), 3599-3610 (2012).
- Coppe, J. P., Desprez, P. Y., Krtolica, A., Campisi, J. The senescence-associated secretory phenotype: the dark side of tumor suppression. Annual Review of Pathology. 5, 99-118 (2010).
- Mah, L. J., El-Osta, A., Karagiannis, T. C. GammaH2AX as a molecular marker of aging and disease. Epigenetics. 5 (2), 129-136 (2010).
- Hewitt, G., et al. Telomeres are favoured targets of a persistent DNA damage response in ageing and stress-induced senescence. Nature Communications. 3, 708 (2012).
- Narita, M., et al. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 113 (6), 703-716 (2003).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging-Us. 5 (1), 37-50 (2013).
- Severino, J., Allen, R. G., Balin, S., Balin, A., Cristofalo, V. J. Is β-Galactosidase Staining a Marker of Senescence in Vitro and in Vivo?. Experimental Cell Research. 257 (1), 162-171 (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。