A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
أسلوب في فيفو لتقييم حاجز القناة الهضمية-الدم والايض الكبد من منتجات الحجمية
In This Article
Summary
وصول المواد الغذائية، والايضات الحجمية والأدوية بالتداول يسيطر عليه حاجز الدم القناة الهضمية في (جب). يصف لنا طريقة مباشرة لقياس جب النفاذية في فيفو، الذي، على النقيض من الأساليب غير المباشرة المستخدمة عادة، هو تقريبا لا تتأثر وظائف الكبد والكلى.
Abstract
حاجز الدم القناة الهضمية في (جب) يتحكم في مرور المواد الغذائية ونواتج الأيض البكتيرية والعقاقير من التجويف المعوي إلى مجرى الدم. سلامة جب تشعر بالانزعاج في أمراض الجهاز الهضمي والقلب والأوعية الدموية والايض، مما قد يتسبب في وصول أسهل للمركبات النشيطة بيولوجيا، مثل الأمعاء البكتيرية والايضات، إلى مجرى الدم. وهكذا، قد تكون نفاذية جب علامة أمراض المعوية واكسترينتيستينال على حد سواء. وعلاوة على ذلك، تزايد تغلغل والايضات البكتيرية قد تؤثر على أداء الكائن الحي كامل.
هي أساليب شائعة لدراسة نفاذية جب المنجز السابقين فيفو. دقة تلك الأساليب محدودة، نظراً لأن أداء جب يعتمد على تدفق الدم المعوية. من ناحية أخرى، قد تكون متحيزة الأساليب استخداماً في فيفو بالكبد والكلى أداء، حيث تقوم هذه الأساليب على تقييم بول أو/وتركيزات الدم المحيطي من علامات خارجية. وهنا، نقدم مباشرة قياس النفاذية جب في الفئران باستخدام أسلوب في فيفو يستند المدخل الدم أخذ العينات، والذي يحافظ على تدفق الدم المعوية وهو تقريبا لا تتأثر وظيفة الكبد والكلى.
البولي يوريثان بالقسطرة تندس في الوريد البابي والاوردة أدنى الوريد الأجوف فقط أعلاه الكبد التقاء. يتم أخذ عينات الدم عند خط الأساس، وبعد إقامة علامة المحدد في جزء المرجوة من الجهاز الهضمي. هنا، فإننا نقدم العديد من التطبيقات لأسلوب بما في ذلك (1) تقييم نفوذية القولون للجمعية التونسية للأمهات، والأمعاء البكتيرية المستقلب، (2) تقييم لتطهير الكبد من الجمعية التونسية للأمهات، و (3) تقييم لمسار الدم الدم-الكبد-الطرفية مدخل القناة الهضمية للقناة الهضمية الأحماض الدهنية قصيرة السلسلة المشتقة من البكتيريا. وعلاوة على ذلك، يمكن استخدام البروتوكول أيضا لتعقب امتصاص الأمعاء والكبد للمخدرات أو لقياسات ضغط الدم المدخل.
Introduction
حاجز الدم القناة الهضمية (جب)، يعرف أيضا باسم الحاجز المعوي، هو نظام معقد متعدد الطبقات الذي يفصل التجويف القناة الهضمية من مجرى الدم بغية الحد من مرور المركبات الضارة بينما يسمح لامتصاص العناصر الغذائية1. وهو يتألف من ثلاث طبقات رئيسية: طبقة المخاط وظهاره والصفيحة بروبريا.
عوامل عديدة قد تؤثر على سلامتها والدالة جب2. فقد ثبت أن جب تشعر بالانزعاج في أمراض المعدة والأمعاء واكستراينتيستينال على السواء، بما في ذلك أمراض القلب والأوعية الدموية والايض3، مما قد يؤدي إلى ممر زيادة من نواتج الأيض البكتيرية الأمعاء إلى مجرى الدم4. قد تؤثر زيادة تغلغل من الأمعاء البكتيرية والايضات أداء الكائن الحي كامل. على سبيل المثال، تظهر الدراسات الأخيرة أثر كبير من نواتج الأيض البكتيرية، مثل indoles، H2S، والأحماض الدهنية قصيرة السلسلة (الهيئة)، وتريميثيلاميني ن-أكسيد، على نظام الدورة الدموية وظائف5،،من67 ،،من89. وأخيراً، اقترح أن زيادة نفاذية جب تكون بمثابة علامة على أمراض القلب والأوعية الدموية، والتمثيل الغذائي التي ترتبط بالتغيرات المورفولوجية والوظيفية في الأمعاء10. ولذلك، قد يكون تتبع مسار الدم الدم-الكبد-منهجية مدخل القناة الهضمية من نواتج الأيض البكتيرية من أهمية بالنسبة للعلوم الأساسية والسريرية على حد سواء.
الأساليب التجريبية المستخدمة عادة لتقييم نفاذية جب المنجز في المختبر باستخدام شرائح المعوية مستأصل، وأجزاء من الغشاء المخاطي، أو الأغشية الاصطناعية11،12. هو المساس بحقيقة أن الأداء السليم لجب يتطلب تدفق الدم المعوي المستمر بسبب دقة تلك الأساليب. من ناحية أخرى، تستند الأساليب المتاحة في فيفو تقييم البول أو الدم المحيطي تركيزات من علامات خارجية13. ومع ذلك، يتأثر تركيز البول والدم الطرفية الخارجية مركبات وظائف الكلي، أي معدل الترشيح الكبيبي والافراز الأنبوبي، فضلا عن التمثيل الغذائي في الكبد، أي أولاً تمرير الأيض. كل معلمات قد تختلف اختلافاً كبيرا بين مواضيع دراسة مستقلة عن الدالة جب.
وتصف هذه الورقة مباشرة قياس النفاذية جب في الفئران باستخدام عينات الدم المدخل. هذا الأسلوب في فيفو يحافظ على تدفق الدم المعوي، ويكاد لا يتأثر بوظيفة الكبد والكلى. وصف النهج الذي لا يستخدم عادة، ربما بسبب بعض الصعوبات المنهجية. يصف لنا بالتفصيل قسطرة الوريد البابي وأدنى الوريد الأجوف فقط فوق التقاء الوريد الكبدي. أخذ عينات من الدم من الوريد البابي وأدنى الوريد الأجوف يسمح تقييم تطهير جب النفاذية والكبد وكذلك تتبع مسار الدم الدم-الكبد-منهجية مدخل القناة الهضمية للجزيئات ذات الاهتمام، مثل الأمعاء البكتيرية نواتج الأيض أو الأدوية. ونقدم أيضا العديد من التطبيقات للأسلوب الذي تم اختباره في المختبر. وهذه تشمل تقييم نفوذية القولون للجمعية التونسية للأمهات، المستقلب البكتيرية الأمعاء، والتقييم لتطهير الكبد من الجمعية التونسية للأمهات، وتقييم لمسار الدم الدم-الكبد-منهجية مدخل القناة الهضمية للهيئة.
تقييم نفاذية حاجز الدم القناة الهضمية، ينبغي اتباع الخطوات التالية البروتوكول، بالترتيب: 1 (إدراج السطر للإدارات إينترينتيستينال)، 3 (قسطرة الوريد البابي)، 4 (أخذ عينات الدم الوريد البابي ), 6 (إقامة علامة نفاذية الأمعاء)، 4.
تقييم تطهير الكبد ومسار دم دم-كبد-منهجية مدخل القناة الهضمية، ينبغي اتباع الخطوات التالية البروتوكول، بالترتيب: 1 (إدراج السطر للإدارات إينتراينتيستينال)، 2 (الوريد الأجوف السفلي قسطرة)، 3 (قسطرة الوريد البابي)، 4 (أخذ عينات الدم من الوريد البابي)، 5 (أخذ عينات الدم من أدنى الوريد الأجوف)، 6 (إقامة علامة نفاذية الأمعاء)، 4، 5، 7 ( حساب إزالة الكبد).
Protocol
التجارب التي أجريت على الفئران الذكور كيوتو ويستار وفقا "الاتحاد الأوروبي" التوجيه 2010/63 المتعلق بحماية الحيوانات المستخدمة لأغراض علمية ووافقت عليها أنا "اللجنة المحلية لأخلاقيات علم الأحياء" في وارسو.
1-إدراج بند للإدارة إينتراينتيستينال
ملاحظة: ونقترح هنا الإدارة إينتراكولونيك علامة باستخدام قسطرة. أنه يجوز تعديله من قبل الإدارة عن طريق الفم أو تزقيمية مدتها على مستويات مختلفة من الجهاز الهضمي مثل المعدة أو العفج. تذكر أن استخدام الملابس الجراحية القابل للتصرف، بما في ذلك ثوب الجراحية وغطاء محرك السيارة والقفازات، وضمان اتباع احتياطات السلامة المتصلة بالأدوات الحادة المستخدمة في الجراحة (الإبر، إلخ) أثناء إجراءات 1-6.
- الحيوانات سريعة بين عشية وضحاها قبل الإجراء. تنفيذ كافة الإجراءات أثناء التخدير العام، أي، التي تم الحصول عليها بحقن يوريتان 1.5 غرام/كغ وزن الجسم القائمة تقييم سليم أنيسثيتيزاتيون بعدم وجود ردود الفعل بالبيبرال والقرنية، وبأسلوب تو-قرصه والذيل-رشة.
- استخدام قسطرة فولي طب أطفال (10F أو 8F) قسطرة colonic. وضع علامة على قسطرة للإشارة إلى الجزء الذي سيتم إدراجه في القولون (حوالي 8 سم).
- فحص منطقة الشرج ومحتوى البراز في المستقيم قبل إدخال القسطرة في القولون. في حالة وجود البراز، إفراغ المستقيم بتلفيق منطقة المستقيم.
- وضع مواد تشحيم (مثل الجليسرين أو الفازلين) على طول القسطرة. ترطيب فتحه الشرج والمناطق المحيطة بها مع زيوت التشحيم.
- أدخل القسطرة مع دليل أسلاك حوالي 8 سم من خلال المصرة الشرجية الخارجية. جعل حركات الأمام الخلف ودائرية بطيئة.
ملاحظة: التأكد من الحفاظ على مكان القسطرة بجس البطن أثناء إدخال القسطرة.
2-أدنى الوريد الأجوف قسطرة
- يحلق الفراء في الفخذ. تطهير الجلد بالكحول والبوفيدون اليود 3 مرات وتغطي منطقة الفخذ مع الستائر الجراحية بالتناوب.
- في محاولة ليشعر بنبض في شريان فخذي وقطع الجلد طوليا لطول حوالي 2.0 سم في المكان الذي يوجد فيه النبض محسوس.
- تشريح فآسيا والعضلات لتصور حزمة نيوروفاسكولار.
- تشريح الوريد فخذي من حزمة نيوروفاسكولار: الأعصاب أولاً، ثم شريان فخذي، ومن ثم على المنوال.
ملاحظة: كن حذراً أثناء التشريح لحزمة نيوروفاسكولار، نظراً لفروع صغيرة في الوريد الفخذي قد بسهولة يكون معطوباً، المنتجة للنزيف. - وضع الأربطة واثنين في الوريد الفخذي. غير عقده التعادل حتى الآن. الصيد ينتهي من حرف مزدوج الدانية مع حامل إبرة.
- سحب نهايات حرف مزدوج مع صاحب صعودا إغلاق الجزء الدانية الوريد بعناية. انتظر حتى يتم تعبئة الروح بالدم، وأن يعقدا قرانهما القاصي.
- إجراء شق صغير (ca. 1 مم) في الوريد بين عقده وحرف مزدوج الدانية، استخدام مقص ميكروسورجيكال. أدخل القسطرة باستخدام الملقط أو الإبرة مع نهاية المنحنى.
ملاحظة: ثقب في الوريد، واستخدام تلميح محني الإبرة كدليل للقسطرة. قم بفك حرف مزدوج الدانية أثناء إدخال القسطرة. أدخل القسطرة لسم 6 7.0. - تأمين القسطرة في السياق فخذي مع عقده الجراحية واحد اثنين. ربط حرف مزدوج الدانية كذلك.
- التحقق من السالكيه القسطرة بمحاولة سحب الدم بحقنه. شطف القسطرة مع 0.3 مل من المحلول الملحي هيبارينيزيد (100 وحدة/مل).
- إغلاق الجرح الجراحي مع اثنين من طبقات من غرز واحد.
3. قسطرة الوريد البابي
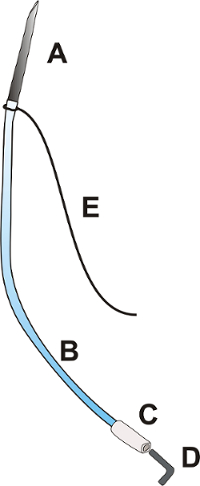
الشكل 1 : مدخل القسطرة. القسطرة المدخل يتكون من إبرة OD: 0.9 مم بطول حوالي 25.0 مم [A]، OD قسطرة البولي يوريثان مرنة: 0.025 "، طول نحو 100.0 ملم [ب]، تلميح البولي إثيلين مرنة للقسطرة OD: 0.040"، نحو 15.0 مم طويلة [ج]، سد [د]. ، وحرف مزدوج 3-0 بطول مم 100.0 [ه]. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
- إعداد مدخل القسطرة وفقا الرقم 1.
- إدراج قطع نهاية الإبرة (OD: 9 مم) إلى القسطرة البولي يوريثان OD: 0.025 ".
- ربط حرف مزدوج 3-0 عند تقاطع إبرة والقسطرة.
ملاحظة: ضمان الجزء أطول من حرف مزدوج طول 6 سم على الأقل. - إدراج نهاية القسطرة OD: 0.025 "إلى القسطرة البولي إثيلين OD: 0.040".
- إغلاق القسطرة مع المكونات المعدنية أو البلاستيكية.
- فتح البطن خط الوسط
- يحلق الفراء في البطن، وبدلاً من ذلك تطهير الجلد بالكحول والبوفيدون اليود 3 مرات، وتغطية المنطقة بالستائر الجراحية.
- قطع الجلد طوليا من الرهابه القص للسرة.
- قطع عضلات جدار البطن على طول الخط الأبيض.
- توسيع قطع روسترالي على شكل Y حيث تكون الغضروف xiphoid بين التخفيضات اثنين.
- تشريح الوريد البابي
- ترطيب مسحات الجراحية مع المالحة.
- اكستيريوريزي الحلقة الأعور وتصاعدي وعرضية القولون والأمعاء الدقيقة. وضع الأمعاء على الجانب الأيسر للكشف عن جذور مساريق.
ملاحظة: تغطي الأمعاء مع شاش مبلل مع الملحية الفسيولوجي لحماية الأمعاء من التجفيف. - كشف الوريد البابي، نقل بعناية الفصوص الكبدية للجانبين أو صعودا نحو الحجاب الحاجز مع مسحات ترطب.
- توطين الجزء من الوريد البابي الذي لا يغطي مع مساريق (في هيلوم كبدي، طويلة حوالي 5 مم) وتمرير حرف مزدوج 3-0 (15 سم) تحت الوريد البابي.
ملاحظة: لحماية الأنسجة من التلف أثناء وضع حرف مزدوج، بلل حرف مزدوج مع حل المحلول ملحي الفسيولوجي. - المشبك نهايات حرف مزدوج مع الملقط وتشديد عليه برفق لتثبيت السفينة.
- الإدراج وتحقيق الاستقرار للقسطرة
- تمرير الجزء أطول من حرف مزدوج للقسطرة المدخل تحت الجزء الحر من الوريد البابي وتسحبه حيث أن القسطرة يقع بجوار الوريد البابي.
- أدخل الإبرة في الوريد المساريقي العلوي العلوي 3 مم أسفل نقطة التقاء الوريد المساريقي العلوي العلوي والوريد البابي. اضغط الإبرة بزاوية 30 درجة، وبعد الدخول في هذا السياق، والحد من الزاوية ودفع الإبرة تقريبا أفقياً، بالتوازي مع الوريد البابي.
ملاحظة: إدراج إبرة لمدة ما يقرب من 6-7 ملم. وينبغي تشديد حرف مزدوج استقرار بلطف الوريد البابي أثناء إدخال القسطرة. - ضع 1-2 قطرات غراء الأنسجة في مكان حيث يتم إدخال الإبرة. إزالة مسحات التي تغطي الكبد.
- وضع الأمعاء إلى تجويف البطن.
- ترطيب الأمعاء مع المحلول الملحي حرارة أعلى وتغطية ذلك مع شاش معقم ترطب.
- تحقق من السالكيه القسطرة وشطف القسطرة مع 0.3 مل من المحلول الملحي هيبارينيزيد (100 وحدة/مل).
ملاحظة: الدم الوريدي باكفلووس تلقائياً بالقسطرة.
- إنهاء عملية جراحية
- بعد 5 دقائق، تحقق من لون الأمعاء وحركات تمعجية، تأكد من المحافظة على تدفق الدم السليم المساريقي العلوي.
- إغلاق تجويف البطن مع غرز 3: جدار الغشاء البريتوني مع طبقة داخلية في عضلات جدار البطن-خياطة مستمرة وقابلة للامتصاص؛ العضلات المتبقية من جدار البطن-خياطة مستمرة وقابلة للامتصاص؛ الجلد والنسيج تحت الجلد-خيوط مفردة وعدم الامتصاص.
ملاحظة: اكستيريوريزي الجزء القاصي من القسطرة حول السرة.
4-الوريد البابي الدم أخذ العينات
- عينة الدم الوريد البابي في بعض الأحيان ووفقا لبروتوكول الاختبار المحددة المستخدمة؛ انظر الجدول 1.
| بروتوكول قصيرة | بروتوكول طويل |
| t0 – الأساس (قبل الإدارة إينتراكولونيك) | t0 – الأساس (قبل الإدارة إينتراكولونيك) |
| تي1 – 5 دقائق بعد الإدارة إينتراكولونيك | تي1 – 30 دقيقة بعد الإدارة إينتراكولونيك |
| تي2 – 30 دقيقة بعد الإدارة إينتراكولونيك | t2 -60 دقيقة بعد الإدارة إينتراكولونيك |
الجدول 1: بوابة الدم بروتوكولات أخذ العينات لتقييم نفاذية الأمعاء.
ملاحظة: الفترة الزمنية بين أخذ عينات الدم على التوالي يعتمد أساسا على التوافر الأحيائي للمواد التي تم اختبارها وموقع الإدارة (القولون، المعدة، إلخ).
- فتح سد مدخل القسطرة واسمحوا تدفق الدم بحرية.
- استخدام المحاقن (vol. 2 مل) ولفظة OD إبرة: 0.9 مم-جمع أي أكثر من 0.7 مل دم.
- شطف القسطرة مع 0.3 مل من المحلول الملحي هيبارينيزيد (100 وحدة/مل) وإغلاق سد القسطرة.
5. أخذ عينات من الدم الأجوف فينا أدنى من
- عينة الدم أقل شأنا الوريد الأجوف في بعض الأحيان ووفقا لبروتوكول الاختبار المحددة المستخدمة؛ انظر الجدول 2.
| الوريد البابي | أدنى الوريد الأجوف |
| t0 – الأساس (قبل الإدارة إينتراكولونيك) | t0 – الأساس (قبل الإدارة إينتراكولونيك) |
| تي1 – 30 دقيقة بعد الإدارة إينتراكولونيك | تي1 – 30 دقيقة بعد الإدارة إينتراكولونيك |
الجدول 2: بروتوكول الدم أخذ العينات للقياس تطهير الكبد، وتتبع مسار الدم الدم-الكبد-منهجية مدخل القناة الهضمية.
- فتح قابس قسطرة أدنى الوريد الأجوف واسمحوا تدفق الدم بحرية.
- جمع أي أكثر من 0.7 مل دم باستخدام المحاقن (vol. 2 مل) وكسر إبرة OD: 0.9 ملم.
- شطف القسطرة مع 0.2-0.3 مل من هيبارينيزيد المالحة (100 وحدة/مل) وإغلاق سد القسطرة.
6-إدارة علامة نفاذية الأمعاء
- إزالة الأسلاك دليل، وتضخيم بالون قسطرة colonic، استخدام حجم كاف من الماء المعقم (عادة 1 مل ولكن حجم البالون الفعلية الاختيار قبل الإدراج).
ملاحظة: ينبغي أن لا يتجاوز قطرها بالون 1 سم. - وضع رأس الجرذ أسفل (الميل نحو 15 ٪) التقليل من خطر تدفق الحل التي تدار من القولون.
- إدارة المادة المختبرة ببطء (مثل trimethylamine، 100 مغ/كغ وزن الجسم) استخدام منفذ صرف في القسطرة colonic.
ملاحظة: لا تتجاوز حجم 0.75 مل الحل التي تدار وسرعة تغذية 0.5 مل/دقيقة لمنع تدفق الحل التي تدار من فتحه الشرج. - وبعد 10 دقائق تنكمش البالون القسطرة.
- عينة دم من الأجوف فينا أقل شأنا والوريد البابي ووفقا لبروتوكول الاختبار المحددة المستخدمة؛ انظر الجدول 1 والجدول 2.
- Euthanize الحيوان عن طريق الأسلوب المعتمد.
7-حساب لتطهير الكبد
- التعبير عن تطهير الكبد، فهم كاستخراج الكبد، بالفرق بين تركيز الدم المدخل وتركيز الدم أقل شأنا الوريد الأجوف أو بنسبة أدنى الوريد الأجوف لتركيز الدم المدخل، (1-(تركيز أدنى الوريد الأجوف /تركيز الوريد البابي)).
8-تقييم عينات الدم ن تركيز مادة الاختبار
- استناداً إلى مضمون الاختبار واختبار المنهجية، رهنا العينة الإجراءات المختبرية المناسبة (الطرد المركزي، و ما إلى ذلك). في البروتوكولات المقترحة، نقوم بتقييم الجمعية التونسية للأمهات/تماو وتركيز الهيئة باستخدام اللوني السائل إلى جانب الثلاثي-الرباعي الكتلي. وتجدون وصفاً مفصلاً للأسلوب في "مواد تكميلية".
النتائج
وقد قمنا بقياس جب النفاذية والكبد تطهير للجمعية التونسية للأمهات في الفئران بنجاح. لقد أظهرنا أن الفئران ارتفاع ضغط الدم لديها نقطتين زيادة نفاذية للجمعية التونسية للأمهات بالمقارنة مع الفئران نورموتينسيفي (الشكل 2)4. وفي دراسة أخرى نجد أن ت?...
Discussion
وصف مباشرة، في فيفو، تحتفظ طريقة قياس النفاذية جب شروط كلوسيتوفيسيولوجيكال في نظام الجهاز الهضمي (يحافظ على تدفق الدم المعوية)، وتقريبا لا يتأثر بوظيفة الكبد والكلى.
أن الخطوة الحاسمة لهذا الأسلوب هو إدخال القسطرة المدخل. وهذا يجب أن يتم بلطف وحزم في الوقت نفسه. نزيف خ?...
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
العمل معتمد من قبل وزارة العلوم والتعليم العالي جمهورية بولندا، منح الماس لا: DI2017 009247.
Materials
| Name | Company | Catalog Number | Comments |
| Needle OD: 9 mm | Becton Dickinson S.A. | 301300 | |
| Polyethylene catheter ID: 0.025", OD: 0.040" | Scientific Commodities, Inc. | #BB520-40 | |
| Polyethylene catheter ID: 0.012", OD: 0.025" | Scientific Commodities, Inc. | #BB520-25 | |
| C-Flex Tubing,Opaque White 1/50"ID x 1/12 " OD | Cole-Parmer Instrument Co. | 06424-59 | |
| Pediatric Foley catheter (size 10F or 8F) | Sigmed | 0000 80305 | |
| Surgical ligatures 3/0 | Yavo Sp. Z o.o. | P48JE | |
| Absorbable surgical sutures - Polyglactine 910 4/0 | KRUUSE Polska Sp. Zo.o. | 152336 | |
| Tissue glue - Loctite 454Cyanoacrylate Adhesive | Loctite | 1370127 | |
| Povidone iodine | EGIS Pharmaceuticals PLC | 4449 11 | |
| Heparin - Heparinium WZF | WZF Polfa S.A. | 02BK0417 | Dilute 10 times with physiological saline |
| Glycerin 86% | Laboratorium Farmaceutyczne Avena | 5.90999E+12 | Serves as a lubricant in colon catheterization |
| Xylocaine 2% | AstraZenca | 9941342 | |
| Urethane | Sigma-Aldrich (Merck) | U2500-500G | |
| Trimethylamine solution 45% | Sigma-Aldrich (Merck) | 92262-1L | |
| Syringes 2 mL | B.Braun Melsungen AG | 4606027V | |
| Saline 250 mL | Fraesenius Kabi Polska Sp. Z o.o. | 15LL707WL | |
| Surgical scissors, straight, length 115 mm, 4 1/2 "blunt ends | Braun | NS-010-115-PKM | |
| Artery forceps type Micro-Adson bent, length 140 mm 5 1/2 " | Braun | KN-008-140-ZMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp 0.7x0.55 | Braun | PO-001-007-ZMK | |
| Micro Scissors type Vannas, straight, lenght 85 mm, 3 3/8 " the length of the blades 6 mm | Braun | NO-010-085-PMK | |
| Towel clamps type Backhouse, lenght 130 mm, 5 1/8" | Braun | HO-128-130-PMK | |
| Needle holders, lenght 150 mm, 6" t=0.4 1/2 | Braun | IM-927-150-PZMK | |
| Delicate Scissors, lenght 110 mm , straight, 4 3/8” sharp | Braun | NO-052-110-PMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp | Braun | PO-022-001-PMK | |
References
- Camilleri, M., Madsen, K., Spiller, R., Greenwood-Van Meerveld, B., Verne, G. N. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 24 (6), 503-512 (2012).
- Keita, A. V., Soderholm, J. D. The intestinal barrier and its regulation by neuroimmune factors. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 22 (7), 718-733 (2010).
- Farhadi, A., Banan, A., Fields, J., Keshavarzian, A. Intestinal barrier: an interface between health and disease. Journal of Gastroenterology and Hepatology. 18 (5), 479-497 (2003).
- Jaworska, K., et al. Hypertension in rats is associated with an increased permeability of the colon to TMA, a gut bacteria metabolite. PloS one. 12 (12), e0189310 (2017).
- Fujii, H., Nakai, K., Fukagawa, M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 15 (2), 125-128 (2011).
- Tomasova, L., et al. Intracolonic hydrogen sulfide lowers blood pressure in rats. Nitric Oxide: Biology and Chemistry. 60, 50-58 (2016).
- Brahe, L. K., Astrup, A., Larsen, L. H. Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 14 (12), 950-959 (2013).
- Ufnal, M., et al. Trimethylamine-N-oxide: a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats. The Canadian Journal of Cardiology. 30 (12), 1700-1705 (2014).
- Huc, T., Nowinski, A., Drapala, A., Konopelski, P., Ufnal, M. Indole and indoxyl sulfate, gut bacteria metabolites of tryptophan, change arterial blood pressure via peripheral and central mechanisms in rats. Pharmacological Research. 130, 172-179 (2018).
- Ufnal, M., Pham, K. The gut-blood barrier permeability - A new marker in cardiovascular and metabolic diseases?. Medical Hypotheses. 98, 35-37 (2017).
- Le Ferrec, E., et al. In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Alternatives to Laboratory Animals: ATLA. 29 (6), 649-668 (2001).
- Bohets, H., et al. Strategies for absorption screening in drug discovery and development. Current Topics in Medicinal Chemistry. 1 (5), 367-383 (2001).
- Grootjans, J., et al. Non-invasive assessment of barrier integrity and function of the human gut. World Journal of Gastrointestinal Surgery. 2 (3), 61-69 (2010).
- Bielinska, K., et al. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition. 54, 33-39 (2018).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American journal of physiology. Gastrointestinal and Liver Physiology. 296 (6), G1151-G1166 (2009).
- Denno, D. M., et al. Use of the lactulose to mannitol ratio to evaluate childhood environmental enteric dysfunction: a systematic review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 Suppl 4, S213-S219 (2014).
- Lugea, A., Salas, A., Casalot, J., Guarner, F., Malagelada, J. R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 46 (4), 515-521 (2000).
- Bloemen, J. G., et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery. Clinical Nutrition. 28 (6), 657-661 (2009).
- Huc, T., et al. Colonic hydrogen sulfide produces portal hypertension and systemic hypotension in rats. Experimental Biology and Medicine. 243 (1), 96-106 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved