È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un metodo In Vivo per valutare la Gut-barriera e metabolismo epatico del Microbiota prodotti
In questo articolo
Riepilogo
L'accesso di nutrienti, microbiota metaboliti e farmaci per la circolazione è controllata dalla barriera intestinale-sangue (GBB). Descriviamo un metodo diretto per misurare la GBB permeabilità in vivo, che, contrariamente ai metodi indiretti comunemente usati, praticamente non è interessato dalle funzioni di fegato e rene.
Abstract
La barriera intestinale-(GBB) controlla il passaggio di nutrienti, metaboliti batterici e farmaci dal lume intestinale alla circolazione sanguigna. L'integrità GBB è disturbato nelle malattie gastrointestinali, cardiovascolari e metaboliche, che potrebbero facilitare l'accesso dei composti biologicamente attivi, quali metaboliti batterica dell'intestino, alla circolazione sanguigna. Così, la permeabilità della GBB può essere un indicatore di malattie extraintestinali ed intestinale. Inoltre, l'aumento della penetrazione dei metaboliti batterici può influenzare il funzionamento dell'intero organismo.
Metodi comunemente usati per studiare la permeabilità GBB sono eseguite ex vivo. L'accuratezza di tali metodi è limitata, poiché il funzionamento della GBB dipende dal flusso sanguigno intestinale. D'altra parte, metodi comunemente utilizzati in vivo possono essere prevenuti di fegato e rene prestazioni, come tali metodi si basano sulla valutazione di urina o / e le concentrazioni nel sangue periferico di marcatori esogeni. Qui, presentiamo una misura diretta della permeabilità GBB in ratti facendo uso di un metodo in vivo basato sull'anima portale di campionamento, che conserva il flusso sanguigno intestinale e praticamente non è influenzata dalla funzione epatica e renale.
I cateteri di poliuretano sono inseriti nella vena portale e vena cava inferiore appena sopra l'epatico vene confluenza. Sangue è provato al basale e dopo somministrazione di un marcatore selezionato in una parte del tratto gastrointestinale desiderata. Qui, presentiamo diverse applicazioni del metodo inclusi (1) valutazione della permeabilità del colon TMA, un metabolita batterica dell'intestino, (2) la valutazione della clearance epatica di TMA e (3) la valutazione di una via di sangue periferico-sangue-fegato intestino-portale del budello batteri-derivati di acidi grassi a catena corta. Inoltre, il protocollo può anche essere utilizzato per tenere traccia di assorbimento intestinale e metabolismo epatico dei farmaci o per misure di pressione sanguigna portale.
Introduzione
La barriera sangue-gut (GBB), noto anche come la barriera intestinale, è un complesso sistema multistrato che separa il lume intestinale dal flusso sanguigno al fine di limitare il passaggio di composti nocivi, consentendo l'assorbimento di sostanze nutritive1. Si compone di tre strati principali: la strato di muco, epitelio e lamina propria.
Numerosi fattori possono influenzare l' integrità e la funzione GBB2. È stato dimostrato che GBB è disturbato nelle malattie extraintestinali e gastrointestinali, tra cui malattie cardiovascolari e metaboliche3, che può portare a un maggiore passaggio di metaboliti batterica dell'intestino al flusso sanguigno4. Un aumento della penetrazione dei metaboliti batterici dell'intestino può influenzare il funzionamento dell'intero organismo. Ad esempio, gli studi recenti indicano un impatto significativo di metaboliti batterici, quali indoli, H2S, acidi grassi a catena corta (SCFA) e trimetilammina N-ossido, il sistema circolatorio funzioni5,6,7 ,8,9. Infine, è stato proposto che un aumento della permeabilità GBB può servire come un marcatore di malattie cardiovascolari e metaboliche che sono associati con alterazioni morfologiche e funzionali nell' intestino10. Pertanto, la via di sangue sangue-fegato-sistemico gut-portale dei metaboliti batterici di rilevamento può essere di interesse per le scienze di base e cliniche.
Comunemente utilizzati metodi sperimentali per la valutazione della permeabilità GBB sono eseguiti in vitro utilizzando segmenti intestinali resecati, frammenti di mucosa, o membrane artificiali11,12. La precisione di tali metodi è compromessa dal fatto che il corretto funzionamento del GBB richiede flusso sanguigno intestinale costante. D'altra parte, i metodi disponibili in vivo si basano sulla valutazione di urina o sangue periferico concentrazioni di marcatori esogeni13. Tuttavia, la concentrazione dell'urina e del sangue periferica di composti esogeni è influenzata dalla funzionalità renale, cioè, il tasso di filtrazione glomerulare e l'escrezione tubulare, nonché dal metabolismo epatico, cioè, metabolismo di primo passaggio. Entrambi i parametri possono differire notevolmente tra gli oggetti di studio indipendentemente dalla funzione GBB.
Questo articolo descrive una misura diretta della permeabilità GBB nei ratti mediante prelievo di sangue portale. Questo metodo in vivo mantiene il flusso sanguigno intestinale e praticamente non è influenzato dalla funzionalità epatica e renale. L'approccio descritto non è comunemente usato, possibilmente a causa di alcune difficoltà metodologiche. Descriviamo dettagliatamente il cateterismo della vena cava inferiore appena sopra la confluenza della vena epatica e della vena portale. Prelievo di sangue dalla vena portale e vena cava inferiore permette la valutazione della GBB permeabilità e fegato di liquidazione nonché rilevamento della via sangue sangue-fegato-sistemico gut-portale di molecole di interesse, come farmaci o metaboliti batterica dell'intestino. Siamo presenti anche diverse applicazioni del metodo che sono state testate nel nostro laboratorio. Questi includono la valutazione della permeabilità del colon per TMA, un metabolita batterico dell'intestino, una valutazione della clearance epatica di TMA e la valutazione di una via di sangue sangue-fegato-sistemico gut-portale di SCFA.
Per valutare la permeabilità della barriera emato-gut, dovrebbe essere seguita la procedura di protocollo seguenti, nell'ordine: 1 (inserimento della linea per le amministrazioni intraintestinal), 3 (cateterizzazione della vena portale), 4 (prelievo di sangue della vena portale ), 6 (somministrazione di un indicatore di permeabilità dell'intestino), 4.
Per valutare la clearance epatica e una via di sangue sangue-fegato-sistemico gut-portale, deve essere seguita la procedura di protocollo seguenti, nell'ordine: 1 (inserimento della linea per le amministrazioni intraintestinal), 2 (vena cava inferiore cateterizzazione), 3 (cateterizzazione della vena portale), 4 (prelievo di sangue della vena portale), 5 (prelievo di sangue della vena cava inferiore), 6 (somministrazione di un indicatore di permeabilità dell'intestino), 4, 5, 7 ( calcolo della clearance epatica).
Protocollo
Gli esperimenti sono stati effettuati su ratti maschi Wistar Kyoto secondo direttiva 2010/63 UE sulla protezione degli animali utilizzati a fini scientifici e sono stati approvati da I Comitato di bioetica locale a Varsavia.
1. inserimento della linea per l'amministrazione Intraintestinal
Nota: Qui vi proponiamo amministrazione intracolonic di un marcatore utilizzando un catetere. Può essere modificato da somministrazione orale o sonda gastrica a vari livelli del tratto digestivo per esempio dello stomaco o del duodeno. Ricordatevi di usare indumenti chirurgici monouso, compresi camice chirurgico, cappuccio e guanti e assicurarsi di seguire le precauzioni di sicurezza relazionate agli strumenti taglienti utilizzati in chirurgia (aghi, ecc.) durante le procedure 1-6.
- Animali veloci durante la notte prima della procedura. Tutte le procedure eseguite durante l'anestesia generale, cioè, ottenuta tramite l'iniezione di amputate corretta di uretano 1,5 g/kg bw i.p. Assess dalla mancanza di riflessi corneali e palpebrali e dal metodo punta- e coda-pizzico.
- Utilizzare un catetere di Foley pediatrico (10F o 8F) come un catetere Colico. Contrassegnare il catetere per indicare la parte che verrà inserita nel colon (circa 8 cm).
- Controllare la regione anale e il contenuto di feci nel retto prima di inserire il catetere nel colon. Se sgabello è presente, è possibile svuotare il retto di massaggiare la zona rettale.
- Mettere un lubrificante (ad es. glicerina o vaselina) lungo il catetere. Inumidire l'ano e i suoi dintorni con il lubrificante.
- Inserire il catetere con una guida del cavo circa 8 cm attraverso lo sfintere anale esterno. Fare movimenti lenti e circolari e avanti-indietro.
Nota: Continuare a controllare la posizione del catetere mediante palpazione addominale durante l'inserimento del catetere.
2. la cateterizzazione della Vena Cava inferiore
- Radere il pelo nell'inguine. Disinfettare la pelle con alcool e povidone iodio 3 volte e coprire la zona inguinale con teli chirurgici alternativamente.
- Prova a sentire il polso sull'arteria femorale e tagliare la pelle longitudinalmente per la lunghezza di circa 2,0 cm nel posto dove l'impulso è palpabile.
- Sezionare la gronda e muscoli per visualizzare il fascio neurovascolare.
- Sezionare la vena femorale da pacco neurovascular: nervi primi, quindi l'arteria femorale e la vena.
Nota: Fare attenzione durante la dissezione del fascio neurovascolare, poiché piccoli rami della vena femorale possono facilmente essere danneggiati, produrre sanguinamento. - Mettere due legature sulla vena femorale. Non legare i nodi ancora. Prendere le estremità della legatura prossimale con un porta-aghi.
- Estrarre con cautela il legatura si conclude con il supporto verso l'alto per chiudere la parte prossimale della vena. Attendere che la vena è riempita di sangue e legare il nodo distale.
- Praticare una piccola incisione (ca. 1 mm) sulla vena tra il nodo e la legatura prossimale, usando le forbici microsurgical. Inserire il catetere con una pinzetta o l'ago con l'estremità ricurva.
Nota: Forare la vena e utilizzare la punta dell'ago piegata come una guida per il catetere. Allentare la legatura prossimale durante l'inserimento del catetere. Inserire il catetere per 6-7.0 cm. - Fissare il catetere nella vena femorale con due singoli nodi chirurgici. Legare la legatura prossimale pure.
- Controllare la pervietà del catetere nel tentativo di prelevare il sangue con una siringa. Lavare il catetere con 0,3 mL della soluzione fisiologica eparinata (100 unità/mL).
- Chiudere la ferita chirurgica con due strati di singoli punti di sutura.
3. la cateterizzazione della vena portale
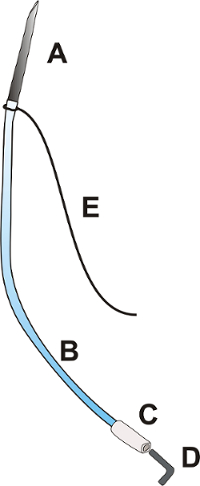
Figura 1 : Catetere portal. Il catetere portale è costituito da un ago OD: 0,9 mm con una lunghezza di circa 25,0 mm [A], OD un catetere flessibile in poliuretano: 0.025", lunghezza circa 100,0 mm [B], una punta flessibile in polietilene del catetere OD: 0.040", circa 15,0 mm lunga [C], una spina [D]. e una legatura 3/0 con una lunghezza di 100,0 mm [E]. Clicca qui per visualizzare una versione più grande di questa figura.
- Preparare il catetere portale secondo la Figura 1.
- Inserire l'estremità tagliata dell'ago (OD: 9 mm) nel catetere in poliuretano OD: 0.025".
- Legare la legatura 3/0 all'incrocio tra l'ago e il catetere.
Nota: Assicurarsi che la parte più lunga della legatura è almeno 6 cm di lunghezza. - Inserire l'estremità del catetere OD: 0.025" nel catetere polietilene OD: 0.040".
- Chiudere il catetere con una spina di metallo o di plastica.
- Laparotomia mediana
- Radere la pelliccia nell'addome, alternativamente disinfettare la pelle con alcool e povidone iodio 3 volte e coprire l'area con teli chirurgici.
- Tagliare la pelle longitudinalmente da xifoideo dello sterno all'ombelico.
- Tagliare i muscoli della parete addominale lungo la linea bianca.
- Espandere il taglio rostralmente a forma Y in modo che la cartilagine xifoide è tra i due tagli.
- Dissezione della vena portale
- Inumidire i tamponi chirurgici con soluzione fisiologica.
- Esternare il ciclo cieco, ascendente e colon trasverso e intestino tenue. Mettere l'intestino sul lato sinistro per esporre la radice del mesentery.
Nota: Coprire l'intestino con una garza inumidita con una soluzione fisiologica per proteggere l'intestino dall'essiccazione. - Per esporre la vena portale, muovere con cautela i lobi epatici ai lati o verso l'alto verso il diaframma con i tamponi inumiditi.
- Localizzare la parte della vena portale che non è coperto con il mesentere (nel hilum epatico, lunghi circa 5 mm) e passare la legatura 3/0 (15 cm di lunghezza) sotto la vena portale.
Nota: Per proteggere i tessuti da danni pur ponendo la legatura, inumidire la legatura con una soluzione fisiologica. - Fissare le estremità della legatura con il forcipe e serrare delicatamente per stabilizzare la nave.
- Inserimento e stabilizzazione del catetere
- Passare la parte più lunga della legatura del catetere portale sotto la parte libera della vena portale e tirarlo in modo che il catetere si trova proprio accanto alla vena portale.
- Inserire l'ago nella vena mesenterica superiore 3 mm sotto la giunzione della vena mesenterica superiore e la vena portale. Tenendo l'ago con un angolo di 30° e, dopo aver inserito nella vena, riduzione dell'angolo e far avanzare l'ago quasi orizzontalmente, in parallelo alla vena portale.
Nota: Inserire l'ago per una lunghezza di circa 6-7 mm. La legatura stabilizzante dovrebbe stringere con delicatezza la vena portale durante l'inserimento del catetere. - Applicare 1-2 gocce di colla del tessuto nel luogo dove l'ago è inserito. Rimuovere i tamponi che coprono il fegato.
- Rimettere l'intestino nella cavità addominale.
- Inumidire l'intestino con una soluzione salina riscaldata e coprire con garza sterile inumidito.
- Controllare la pervietà del catetere e lavare il catetere con 0,3 mL della soluzione fisiologica eparinata (100 unità/mL).
Nota: Sangue venoso spontaneamente ritorni nel catetere.
- Fine della chirurgia
- Dopo 5 minuti, controllare il colore di intestini e movimenti peristaltici, assicurarsi che il flusso di sangue mesenterico corretto venga mantenuto.
- Chiudere la cavità addominale con 3 punti di sutura: parete peritoneo con lo strato interno dei muscoli della parete addominale - un suturare assorbibile, continuo; restanti muscoli della parete addominale - un suturare assorbibile, continuo; pelle e tessuto sottocutaneo - singole suture non assorbibili.
Nota: Esternare la parte distale del catetere intorno all'ombelico.
4. vena portale campionamento del sangue
- Sangue della vena portale campione a volte secondo il protocollo di collaudo specifico utilizzato; vedere tabella 1.
| Protocollo corto | Protocollo lungo |
| t0 – linea di base (prima amministrazione intracolonic) | t0 – linea di base (prima amministrazione intracolonic) |
| t1 – 5 min dopo la somministrazione di intracolonic | t1 – 30 min dopo la somministrazione di intracolonic |
| t2 – 30 min dopo la somministrazione di intracolonic | t2 – 60 min dopo la somministrazione di intracolonic |
Tabella 1: Protocolli di campionamento di sangue di portale per la valutazione di permeabilità dell'intestino.
Nota: Il tempo tra il prelievo di sangue consecutivi dipende principalmente la biodisponibilità delle sostanze testate e nel sito di somministrazione (colon, stomaco, ecc.).
- Aprire il tappo di portale catetere e lasciare che il flusso di sangue liberamente.
- Uso siringa (vol. 2 mL) e smussare needle OD: 0,9 mm. raccogliere non più di 0,7 mL di sangue.
- Lavare il catetere con 0,3 mL di soluzione fisiologica eparinata (100 unità/mL) e richiudere il tappo del catetere.
5. inferior Vena Cava sangue campionamento
- Sangue della vena cava inferiore del campione a volte secondo il protocollo di collaudo specifico utilizzato; vedere la tabella 2.
| Vena portale | Vena cava inferiore |
| t0 – linea di base (prima amministrazione intracolonic) | t0 – linea di base (prima amministrazione intracolonic) |
| t1 – 30 min dopo la somministrazione di intracolonic | t1 – 30 min dopo la somministrazione di intracolonic |
Tabella 2: Protocollo di sangue di campionamento per la misurazione della clearance epatica e il sentiero di sangue sangue-fegato-sistemico gut-portale di monitoraggio.
- Aprire il tappo del catetere della vena cava inferiore e lasciar fluire il sangue liberamente.
- Raccogliere non più di 0,7 mL di sangue utilizzando la siringa (vol. 2 mL) e rotto OD ago: 0,9 mm.
- Lavare il catetere con 0.2-0.3 mL di eparinizzata (100 unità/mL) e richiudere il tappo del catetere.
6. l'amministrazione di un marcatore di permeabilità dell'intestino
- Rimuovere il filo guida e gonfiare il palloncino del catetere colica, con adeguato volume di acqua sterile (solitamente 1 mL ma controllare le dimensioni pallone reale prima dell'inserimento).
Nota: Il diametro del palloncino non deve superare 1 cm. - Posizionare la testa del ratto verso il basso (circa il 15% di inclinazione), per ridurre al minimo il rischio del deflusso della soluzione amministrato dal colon.
- Somministrare lentamente la sostanza testata (ad es. trimetilammina, 100 mg/kg bw) utilizzando una porta di drenaggio nel catetere colica.
Nota: Non superare il volume di 0,75 mL di soluzione somministrata e la velocità di avanzamento di 0,5 mL/min per impedire il deflusso della soluzione amministrato dall'ano. - Dopo 10 min, sgonfiare il palloncino del catetere.
- Sangue di campione dalla vena cava inferiore e la vena portale secondo il protocollo di collaudo specifico utilizzato; vedere tabella 1 e tabella 2.
- Eutanasia animale tramite metodo approvato.
7. calcolo della Clearance epatica
- Esprimere la clearance epatica, intesa come estrazione epatica, dalla differenza tra la concentrazione nel sangue portale e concentrazione nel sangue della vena cava inferiore o dal rapporto della vena cava inferiore alla concentrazione di sangue portale, (1 - (concentrazione di vena cava inferiore / concentrazione della vena portale)).
8. valutazione dei campioni di sangue n di sostanza concentrazione
- A seconda della sostanza in esame e la metodologia di prova, è necessario sottoporre il campione a procedure di laboratorio appropriati (centrifugazione, ecc.). Nei protocolli proposti, valutiamo TMA/TMAO e concentrazione di SCFA mediante cromatografia liquida accoppiata alla spettrometria di massa triplo quadrupolo. Si prega di trovare una descrizione dettagliata del metodo nel materiale supplementare.
Risultati
Con successo abbiamo misurato la clearance dei permeabilità e fegato GBB di TMA in ratti. Abbiamo dimostrato che i ratti ipertesi hanno una permeabilità aumentata del colon per TMA rispetto ai ratti normotesi (Figura 2)4. In un altro studio abbiamo trovato che l'assunzione di sale alta non influenzare la clearance di permeabilità e fegato GBB della TMA (Figura 3)14.
Discussione
Descritto, diretto in vivo, metodo per misurare la permeabilità GBB mantiene condizioni di closetophysiological nell'apparato gastrointestinale (mantiene il flusso sanguigno intestinale) e praticamente non è influenzata dalla funzionalità epatica e renale.
Il passaggio fondamentale di questa tecnica è l'inserimento del catetere portale. Questo deve essere fatto delicatamente e in modo decisivo allo stesso tempo. Un breve, lieve sanguinamento può verificarsi dalla puntura la corre...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Il lavoro è supportato dal Ministero della scienza e dell'istruzione superiore Repubblica di Polonia, Diamond concedere no: DI2017 009247.
Materiali
| Name | Company | Catalog Number | Comments |
| Needle OD: 9 mm | Becton Dickinson S.A. | 301300 | |
| Polyethylene catheter ID: 0.025", OD: 0.040" | Scientific Commodities, Inc. | #BB520-40 | |
| Polyethylene catheter ID: 0.012", OD: 0.025" | Scientific Commodities, Inc. | #BB520-25 | |
| C-Flex Tubing,Opaque White 1/50"ID x 1/12 " OD | Cole-Parmer Instrument Co. | 06424-59 | |
| Pediatric Foley catheter (size 10F or 8F) | Sigmed | 0000 80305 | |
| Surgical ligatures 3/0 | Yavo Sp. Z o.o. | P48JE | |
| Absorbable surgical sutures - Polyglactine 910 4/0 | KRUUSE Polska Sp. Zo.o. | 152336 | |
| Tissue glue - Loctite 454Cyanoacrylate Adhesive | Loctite | 1370127 | |
| Povidone iodine | EGIS Pharmaceuticals PLC | 4449 11 | |
| Heparin - Heparinium WZF | WZF Polfa S.A. | 02BK0417 | Dilute 10 times with physiological saline |
| Glycerin 86% | Laboratorium Farmaceutyczne Avena | 5.90999E+12 | Serves as a lubricant in colon catheterization |
| Xylocaine 2% | AstraZenca | 9941342 | |
| Urethane | Sigma-Aldrich (Merck) | U2500-500G | |
| Trimethylamine solution 45% | Sigma-Aldrich (Merck) | 92262-1L | |
| Syringes 2 mL | B.Braun Melsungen AG | 4606027V | |
| Saline 250 mL | Fraesenius Kabi Polska Sp. Z o.o. | 15LL707WL | |
| Surgical scissors, straight, length 115 mm, 4 1/2 "blunt ends | Braun | NS-010-115-PKM | |
| Artery forceps type Micro-Adson bent, length 140 mm 5 1/2 " | Braun | KN-008-140-ZMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp 0.7x0.55 | Braun | PO-001-007-ZMK | |
| Micro Scissors type Vannas, straight, lenght 85 mm, 3 3/8 " the length of the blades 6 mm | Braun | NO-010-085-PMK | |
| Towel clamps type Backhouse, lenght 130 mm, 5 1/8" | Braun | HO-128-130-PMK | |
| Needle holders, lenght 150 mm, 6" t=0.4 1/2 | Braun | IM-927-150-PZMK | |
| Delicate Scissors, lenght 110 mm , straight, 4 3/8” sharp | Braun | NO-052-110-PMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp | Braun | PO-022-001-PMK |
Riferimenti
- Camilleri, M., Madsen, K., Spiller, R., Greenwood-Van Meerveld, B., Verne, G. N. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 24 (6), 503-512 (2012).
- Keita, A. V., Soderholm, J. D. The intestinal barrier and its regulation by neuroimmune factors. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 22 (7), 718-733 (2010).
- Farhadi, A., Banan, A., Fields, J., Keshavarzian, A. Intestinal barrier: an interface between health and disease. Journal of Gastroenterology and Hepatology. 18 (5), 479-497 (2003).
- Jaworska, K., et al. Hypertension in rats is associated with an increased permeability of the colon to TMA, a gut bacteria metabolite. PloS one. 12 (12), e0189310 (2017).
- Fujii, H., Nakai, K., Fukagawa, M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 15 (2), 125-128 (2011).
- Tomasova, L., et al. Intracolonic hydrogen sulfide lowers blood pressure in rats. Nitric Oxide: Biology and Chemistry. 60, 50-58 (2016).
- Brahe, L. K., Astrup, A., Larsen, L. H. Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 14 (12), 950-959 (2013).
- Ufnal, M., et al. Trimethylamine-N-oxide: a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats. The Canadian Journal of Cardiology. 30 (12), 1700-1705 (2014).
- Huc, T., Nowinski, A., Drapala, A., Konopelski, P., Ufnal, M. Indole and indoxyl sulfate, gut bacteria metabolites of tryptophan, change arterial blood pressure via peripheral and central mechanisms in rats. Pharmacological Research. 130, 172-179 (2018).
- Ufnal, M., Pham, K. The gut-blood barrier permeability - A new marker in cardiovascular and metabolic diseases?. Medical Hypotheses. 98, 35-37 (2017).
- Le Ferrec, E., et al. In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Alternatives to Laboratory Animals: ATLA. 29 (6), 649-668 (2001).
- Bohets, H., et al. Strategies for absorption screening in drug discovery and development. Current Topics in Medicinal Chemistry. 1 (5), 367-383 (2001).
- Grootjans, J., et al. Non-invasive assessment of barrier integrity and function of the human gut. World Journal of Gastrointestinal Surgery. 2 (3), 61-69 (2010).
- Bielinska, K., et al. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition. 54, 33-39 (2018).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American journal of physiology. Gastrointestinal and Liver Physiology. 296 (6), G1151-G1166 (2009).
- Denno, D. M., et al. Use of the lactulose to mannitol ratio to evaluate childhood environmental enteric dysfunction: a systematic review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 Suppl 4, S213-S219 (2014).
- Lugea, A., Salas, A., Casalot, J., Guarner, F., Malagelada, J. R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 46 (4), 515-521 (2000).
- Bloemen, J. G., et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery. Clinical Nutrition. 28 (6), 657-661 (2009).
- Huc, T., et al. Colonic hydrogen sulfide produces portal hypertension and systemic hypotension in rats. Experimental Biology and Medicine. 243 (1), 96-106 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon