Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une méthode In Vivo pour l’évaluation de la barrière intestinale-sang et le métabolisme hépatique du microbiote produits
Dans cet article
Résumé
L’accès des nutriments, de métabolites de la microbiote et de médicaments pour la circulation est contrôlée par la barrière intestinale-(GBB). Nous décrivons une méthode directe pour mesurer le GBB perméabilité in vivo, qui, contrairement aux méthodes indirectes couramment utilisés, n’est pratiquement pas affecté par les fonctions hépatiques et rénales.
Résumé
La barrière intestinale-(GBB) contrôle le passage des nutriments, les métabolites bactériens et les médicaments de la lumière intestinale vers la circulation sanguine. L’intégrité GBB est perturbée dans les maladies gastro-intestinales, cardiovasculaires et métaboliques, qui peuvent entraîner un accès plus facile des composés biologiquement actifs, tels que les métabolites bactérienne intestinale, dans la circulation sanguine. Ainsi, la perméabilité de la GBB peut être un marqueur de maladies intestinales et extra-intestinal. En outre, la pénétration accrue des métabolites bactériens peut-être affecter le fonctionnement de l’organisme tout entier.
Les méthodes couramment utilisées pour l’étude de la perméabilité GBB sont effectués ex vivo. L’exactitude de ces méthodes est limitée, car le fonctionnement de la GBB dépend de la circulation sanguine intestinale. En revanche, les méthodes couramment utilisées en vivo pourraient être biaisées par le foie et les reins performances, car ces méthodes sont basées sur l’évaluation de l’urine ou / et des concentrations dans le sang périphérique des marqueurs exogènes. Nous présentons ici une mesure directe de la perméabilité GBB chez le rat en utilisant une méthode en vivo issue de sang portal d’échantillonnage, qui préserve la circulation sanguine intestinale et n’est pratiquement pas affectée par la fonction du foie et des reins.
Polyuréthane cathéters sont insérés dans la veine porte et la veine cave inférieure, juste au-dessus de la fonction hépatique veines confluence. Sang est prélevé au début et après l’administration d’un marqueur sélectionné dans une pièce désirée du tractus gastro-intestinal. Ici, nous présentons plusieurs applications de la méthode y compris (1) l’évaluation de la perméabilité du côlon pour TMA, un métabolite bactérienne intestinale (2) l’évaluation de la clairance hépatique de TMA et (3) l’évaluation d’une voie de sang sang-foie-périphérique gut-portail du tube digestif dérivé de bactéries les acides gras à chaîne courte. En outre, le protocole peut également être utilisé pour le suivi de l’absorption intestinale et métabolisme hépatique des médicaments ou pour les mesures de l’hypertension portale.
Introduction
La barrière intestinale-sang (GBB), également connu sous le nom de la barrière intestinale, est un système complexe multicouche qui sépare la lumière du tube digestif de la circulation sanguine afin de limiter le passage des composés nocifs tout en permettant l’absorption des éléments nutritifs1. Il se compose de trois couches principales : la couche de mucus, l’épithélium et la lamina propria.
De nombreux facteurs peuvent affecter l' intégrité et la fonction GBB2. Il a été démontré que les GBB est perturbée dans les maladies gastro-intestinales et extra-intestinal, y compris les maladies cardiovasculaires et métaboliques3, qui peut conduire à un passage accru des métabolites bactérienne intestinale sur la circulation sanguine4. Une pénétration accrue des métabolites bactérienne intestinale peut-être affecter le fonctionnement de l’organisme tout entier. Par exemple, des études récentes montrent une incidence importante de métabolites bactériens, tels que les indoles, H2S, acides gras à chaîne courte (AGCC) et triméthylamine N-oxyde, sur le système circulatoire fonctions5,6,7 ,8,9. Enfin, il a été proposé qu’une perméabilité accrue de GBB peut servir de marqueur des maladies cardiovasculaires et métaboliques qui sont associées à des altérations morphologiques et fonctionnelles dans les intestins de10. Par conséquent, suivi la voie intestinale-portail sang sang-foie-systémique des métabolites bactériens peut-être être d’intérêt pour les sciences fondamentales et cliniques.
Méthodes expérimentales couramment utilisées pour l’évaluation de la perméabilité GBB sont effectués in vitro à l’aide de segments intestinaux réséqués, fragments de muqueuse ou membranes artificielles11,12. L’exactitude de ces méthodes est compromise par le fait que le bon fonctionnement de la GBB exige la circulation sanguine intestinale constant. En revanche, les méthodes disponibles en vivo reposent sur l’évaluation de l’urine ou les concentrations de sang périphérique des marqueurs exogène13. Cependant, concentration périphérique de sang et d’urine des composés exogènes est influencée par la fonction rénale, par exemple, les taux de filtration glomérulaire et l’excrétion tubulaire, ainsi que par le métabolisme du foie, c'est-à-dire, d’abord passer le métabolisme. Ces deux paramètres peuvent différer significativement entre les sujets de l’étude indépendamment de la fonction GBB.
Cet article décrit une mesure directe de la perméabilité GBB chez les rats avec un prélèvement sanguin. Cette méthode en vivo préserve la circulation sanguine intestinale et n’est pratiquement pas influencée par la fonction du foie et des reins. L’approche décrite n'est pas couramment utilisé, peut-être à cause de certaines difficultés méthodologiques. Nous décrivons en détail le cathétérisme de la veine porte et la veine cave inférieure, juste au-dessus du confluent de la veine hépatique. Prélèvement de sang de la veine porte et la veine cave inférieure permet d’évaluation de la clairance de la perméabilité et le foie GBB ainsi que suivi de voie intestinale-portail sang sang-foie-systémique de molécules d’intérêt, tels que les métabolites bactérienne intestinale ou de médicaments. Nous présentons également plusieurs applications de la méthode qui ont été testées dans notre laboratoire. Il s’agit de l’évaluation de la perméabilité du côlon pour TMA, un métabolite bactérienne intestinale, évaluation de la clairance hépatique de TMA et évaluation d’une voie de sang sang-foie-systémique gut-portail du CSAF.
Afin d’évaluer la perméabilité de la barrière intestinale-sang, les opérations de protocole suivantes doivent être observées, dans l’ordre : 1 (insertion de la ligne pour les administrations intraintestinal), 3 (cathétérisme de la veine porte), 4 (veine porte les prélèvements sanguins ), 6 (administration d’un marqueur de perméabilité intestinale), 4.
Pour évaluer la clairance hépatique et une voie intestinale-portail sang sang-foie-systémique, les opérations de protocole suivantes doivent être observées, dans l’ordre : 1 (insertion de la ligne pour les administrations intraintestinal), 2 (veine cave inférieure cathétérisme), 3 (cathétérisme de la veine porte), 4 (prélèvement de sang de la veine porte), 5 (prélèvement de sang de veine cave inférieure), 6 (administration d’un marqueur de perméabilité intestinale), 4, 5, 7 () calcul de la clairance hépatique).
Protocole
Les expériences ont été réalisées sur des rats mâles Wistar Kyoto selon Directive 2010/63 UE sur la protection des animaux utilisés à des fins scientifiques et ont été approuvés par le Comité de bioéthique Local à Varsovie I.
1. insertion de la ligne pour l’Administration Intraintestinal
Remarque : Ici, nous vous proposons l’administration intracolique d’un marqueur à l’aide d’un cathéter. Il peut être modifié par l’administration par voie orale ou gavage à divers niveaux du tube digestif par exemple estomac ou du duodénum. N’oubliez pas d’utiliser des vêtements chirurgicaux jetables, y compris casaque, cagoule et gants et faire en sorte de suivre les consignes de sécurité liées aux outils tranchants utilisés en chirurgie (aiguilles, etc.) au cours de procédures 1 à 6.
- Animaux rapides pendant la nuit avant la procédure. Effectuez toutes les procédures pendant l’anesthésie générale, c'est-à-dire obtenue par injection d’uréthane 1,5 g/kg p.c. i.p. Assess bonne anesthetization par l’absence de réflexes palpébrales et cornéens et par méthode orteil-pincée et queue-pincée.
- Utiliser une sonde de Foley pédiatrique (10F ou 8F) qu’une sonde de colique. Marquer le cathéter pour indiquer la partie qui sera insérée dans le côlon (environ 8 cm).
- Vérifiez la région anale et le contenu des selles dans le rectum avant d’insérer le cathéter dans le côlon. Si les selles sont présents, vider le rectum en massant la zone rectale.
- Mettre un lubrifiant (par exemple de glycérine ou de vaseline) le long du cathéter. Humidifier l’anus et ses environs avec le lubrifiant.
- Insérer le cathéter avec un guide fil environ 8 cm à travers le sphincter anal externe. Faites des mouvements lents d’avant-arrière et circulaires.
Remarque : Gardez le contrôle sur l’emplacement du cathéter par palpation abdominale lors de l’insertion du cathéter.
2. cathétérisme de la veine cave inférieure
- Raser la fourrure dans l’aine. Vous pouvez également désinfecter la peau avec de l’alcool et povidone iode 3 fois et couvre la région de l’aine avec draps chirurgicaux.
- Essayez de prendre le pouls sur l’artère fémorale et couper la peau longitudinalement pour la longueur d’environ 2,0 cm de l’endroit où le pouls est palpable.
- Disséquer le fascia et les muscles afin de visualiser le paquet vasculo-nerveux.
- Disséquer la veine fémorale commune depuis le paquet vasculo-nerveux : premiers nerfs, puis l’artère fémorale et la veine.
Remarque : Soyez prudent au cours de la dissection du paquet vasculo-nerveux, étant donné que les petites branches de la veine fémorale peuvent facilement être endommagés, produisant des saignements. - Mettre deux ligatures sur la veine fémorale. Pourtant, ne nouez pas les noeuds. Attraper les extrémités de la ligature proximale avec un porte-aiguille.
- Tirez doucement les extrémités de la ligature avec le support vers le haut pour fermer la partie proximale de la veine. Attendre que la veine est remplie de sang et attacher le noeud distal.
- Faire une petite incision (env. 1 mm) sur la veine entre le noeud et la ligature proximale, à l’aide de ciseaux microchirurgicales. Insérer le cathéter à l’aide de la pince à épiler ou l’aiguille avec l’extrémité incurvée.
NOTE : Ponction de la veine et utilisez le bout plié de l’aiguille comme un guide pour le cathéter. Desserrer la ligature proximale lors de l’insertion du cathéter. Insérer le cathéter pendant 6 à 7,0 cm. - Fixer le cathéter dans la veine fémorale par deux nœuds chirurgicales simples. Attacher la ligature proximale ainsi.
- Vérifier la perméabilité du cathéter en tentant de tirer du sang avec une seringue. Rincer le cathéter avec 0,3 mL de la solution saline héparinée (100 unités/mL).
- Refermer la plaie chirurgicale avec deux couches de points simples.
3. cathétérisme de la veine porte
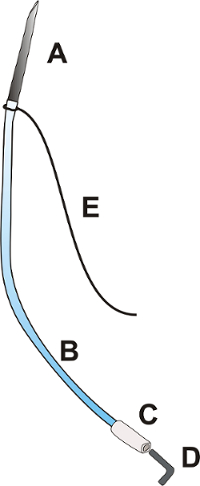
Figure 1 : Cathéter portail. Le cathéter portail est constitué d’une aiguille OD : 0,9 mm d’une longueur d’environ 25,0 mm [A], un cathéter en polyuréthane flexible OD : 0,025", longueur environ 100,0 mm [B], une pointe souple en polyéthylène du cathéter OD : 0,040 », environ 15,0 mm de long [C], un bouchon [D]. et une ligature 3/0 avec une longueur de 100,0 mm [E]. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Préparer le cathéter portail selon la Figure 1.
- Insérez l’extrémité coupée de l’aiguille (OD : 9 mm) dans le cathéter en polyuréthane OD : 0,025".
- Attacher la ligature 3/0 à la jonction de l’aiguille et le cathéter.
Remarque : Vérifiez que la plus longue partie de la ligature est au moins 6 cm de long. - Insérez l’extrémité du cathéter OD : 0,025" dans le cathéter de polyéthylène OD : 0,040".
- Fermer le cathéter avec un bouchon en métal ou en plastique.
- Laparotomie médiane
- Raser la fourrure dans l’abdomen, désinfecter la peau avec de l’alcool et povidone iode 3 fois alternativement et couvre la zone avec draps chirurgicaux.
- Couper la peau longitudinalement de la xiphoïde du sternum jusqu’au nombril.
- Couper les muscles de la paroi abdominale le long de la ligne blanche.
- Développez la coupe rostralement sous la forme de Y pour que le cartilage xiphoid est entre deux coupes.
- Dissection de la veine porte
- Humidifier les écouvillons chirurgicales avec du sérum physiologique.
- Extérioriser la boucle du caecum, ascendant et côlon transverse et l’intestin grêle. Mettre les intestins sur le côté gauche pour exposer la racine du mésentère.
NOTE : Couvrir les intestins avec de la gaze imbibé avec un sérum physiologique pour protéger les intestins de l’évaporation. - Pour exposer la veine porte, déplacer délicatement les lobes hépatiques sur les côtés ou vers le haut, vers le diaphragme et les écouvillons humidifiés.
- Localisez la partie de la veine porte qui n’est pas couvert par le mésentère (dans le hile hépatique, environ 5 mm de long) et passez la ligature 3/0 (15 cm de long) en vertu de la veine porte.
Remarque : Afin de protéger les tissus contre les dommages tout en plaçant la ligature, humidifier la ligature avec une solution de sérum physiologique. - Fixer les extrémités de la ligature avec une pince et serrer doucement pour stabiliser le navire.
- Insertion et stabilisation du cathéter
- Passez la plus longue partie de ligature du cathéter le portail en vertu de la partie libre de la veine porte et tirer de sorte que le cathéter est situé juste à côté de la veine porte.
- Introduire l’aiguille dans la veine mésentérique supérieure 3 mm au-dessous de la jonction de la veine mésentérique supérieure et la veine porte. Tenez l’aiguille à un angle de 30° et, après son entrée dans la veine, réduction de l’angle et avancer l’aiguille presque horizontalement, en parallèle à la veine porte.
Remarque : Insérez l’aiguille pour une longueur d’environ 6-7 mm. La ligature de stabilisation doit serrer légèrement la veine porte lors de l’insertion du cathéter. - Appliquer 1 à 2 gouttes de colle tissu à l’endroit où l’aiguille est insérée. Supprimer les écouvillons qui couvrent le foie.
- Replacer l’intestin dans la cavité abdominale.
- Humecter les intestins avec une solution saline réchauffée et couvrir avec une gaze stérile humide.
- Vérifier la perméabilité du cathéter et rincer le cathéter avec 0,3 mL de la solution saline héparinée (100 unités/mL).
Remarque : Le sang veineux spontanément les retours dans le cathéter.
- Fin de la chirurgie
- Après 5 minutes, vérifier la couleur des intestins et des mouvements péristaltiques, veillez à ce que le débit sanguin mésentérique adéquat soit maintenu.
- Fermer la cavité abdominale avec 3 mailles : mur péritoine avec la couche interne, les muscles de la paroi abdominale - une suture continue, absorbable ; autres muscles de la paroi abdominale - une suture continue, absorbable ; peau et tissu sous-cutané - sutures simples, non résorbables.
NOTE : Extérioriser la partie distale de la sonde autour du nombril.
4. veine d’échantillonnage de sang
- Sang de la veine porte échantillon parfois selon le protocole d’analyse spécifique utilisé ; Voir le tableau 1.
| Protocole court | Protocole long |
| t0 – départ (avant administration intracolique) | t0 – départ (avant administration intracolique) |
| t1 – 5 min après l’administration de colique | t1 – 30 min après l’administration de colique |
| t2 – 30 min après l’administration de colique | t2 – 60 min après l’administration de colique |
Tableau 1 : Portail sang les protocoles d’échantillonnage pour l’évaluation de la perméabilité intestinale.
NOTE : Le délai entre le prélèvement sanguin consécutives dépend principalement de la biodisponibilité des substances testées et le site d’administration (côlon, estomac, etc.).
- Ouvrir le bouchon de cathéter portail et permettent l’écoulement de sang librement.
- Seringue à usage (vol. 2 mL) et émoussé aiguille OD : 0,9 mm. recueillir pas plus de 0,7 mL de sang.
- Rincer le cathéter avec 0,3 mL de sérum physiologique hépariné (100 unités/mL) et refermer le purgeur de cathéter.
5. veine cave Cava prélèvements
- Sang de veine cave inférieure échantillon parfois selon le protocole d’analyse spécifique utilisé ; Voir le tableau 2.
| Veine porte | Veine cave inférieure |
| t0 – départ (avant administration intracolique) | t0 – départ (avant administration intracolique) |
| t1 – 30 min après l’administration de colique | t1 – 30 min après l’administration de colique |
Tableau 2 : Protocole de sang, prélèvement d’échantillons pour la mesure de la clairance hépatique et suivi la voie intestinale-portail sang sang-foie-systémique.
- Ouvrez le bouchon de cathéter de veine cave inférieure et laissez le flux sanguin librement.
- Recueillir pas plus de 0,7 mL de sang à l’aide de la seringue (vol. 2 mL) et cassé aiguille OD : 0,9 mm.
- Rincer le cathéter avec 0,2-0,3 mL d’héparine physiologique (100 unités/mL) et refermer le purgeur de cathéter.
6. l’administration d’un marqueur de la perméabilité intestinale
- Retirer le fil-guide et gonfler le ballonnet de la sonde colique, à l’aide d’un volume suffisant d’eau stérile (habituellement 1 mL mais taille réelle ballon cocher avant l’insertion).
NOTE : Le diamètre du ballon ne doit pas dépasser 1 cm. - Placez la tête de rat vers le bas (environ 15 % d’inclinaison) pour minimiser le risque de l’écoulement de la solution administrée dans le côlon.
- Administrer lentement la substance testée (p. ex. la triméthylamine, 100 mg/kg p.c.) à l’aide d’un port de drainage au cathéter colique.
Remarque : Ne pas dépasser le volume de 0,75 mL de la solution administrée et de la vitesse d’alimentation de 0,5 mL/min pour empêcher l’écoulement de la solution administrée de l’anus. - Après 10 min dégonfler le ballonnet de la sonde.
- Sang d’échantillon de la veine cave inférieure et la veine porte selon le protocole d’analyse spécifique utilisé ; Voir tableau 1 et tableau 2.
- Euthanasier un animal via la méthode approuvée.
7. calcul de la clairance hépatique
- Exprimer la clairance hépatique, comprise comme l’extraction hépatique, par la différence entre la concentration dans le sang portal et veine cave inférieure concentration dans le sang ou par le rapport entre la veine cave inférieure à la concentration dans le sang portal, (1 - (concentration de veine cave inférieure / concentration de la veine porte)).
8. évaluation des Substance Concentration sang n échantillons
- Selon la substance d’essai et de la méthodologie de test, soumettre l’échantillon à des procédures de laboratoire appropriés (centrifugation, etc.). Dans les protocoles proposés, nous évaluons TMA/TMAO et concentration CSAF chromatographie liquide couplée à la spectrométrie de masse à triple-quadrupolaire. Vous trouverez une description détaillée de la méthode matériel supplémentaire.
Résultats
Nous avons mesuré avec succès la GBB perméabilité et le foie d’apurement des TMA chez les rats. Nous avons démontré que les rats hypertendus ont une perméabilité accrue de deux points à TMA comparativement aux rats normotendus (Figure 2)4. Dans une autre étude, nous avons trouvé que cette forte consommation de sel n’affecte pas la clairance de la perméabilité et le foie GBB de TMA (Figure 3
Discussion
Le décrit en direct, in vivo, méthode pour mesurer la perméabilité GBB maintient des conditions closetophysiological dans le système gastro-intestinal (préserve la circulation sanguine intestinale) et n’est pratiquement pas influencée par la fonction du foie et des reins.
L’étape critique de cette technique est l’insertion du cathéter portail. Cela doit être fait doucement et de façon décisive en même temps. Un doux et court des saignements peuvent survenir de la co...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le travail est soutenu par le ministère des sciences et de la République de Pologne de l’enseignement supérieur, Diamond accorder no : DI2017 009247.
matériels
| Name | Company | Catalog Number | Comments |
| Needle OD: 9 mm | Becton Dickinson S.A. | 301300 | |
| Polyethylene catheter ID: 0.025", OD: 0.040" | Scientific Commodities, Inc. | #BB520-40 | |
| Polyethylene catheter ID: 0.012", OD: 0.025" | Scientific Commodities, Inc. | #BB520-25 | |
| C-Flex Tubing,Opaque White 1/50"ID x 1/12 " OD | Cole-Parmer Instrument Co. | 06424-59 | |
| Pediatric Foley catheter (size 10F or 8F) | Sigmed | 0000 80305 | |
| Surgical ligatures 3/0 | Yavo Sp. Z o.o. | P48JE | |
| Absorbable surgical sutures - Polyglactine 910 4/0 | KRUUSE Polska Sp. Zo.o. | 152336 | |
| Tissue glue - Loctite 454Cyanoacrylate Adhesive | Loctite | 1370127 | |
| Povidone iodine | EGIS Pharmaceuticals PLC | 4449 11 | |
| Heparin - Heparinium WZF | WZF Polfa S.A. | 02BK0417 | Dilute 10 times with physiological saline |
| Glycerin 86% | Laboratorium Farmaceutyczne Avena | 5.90999E+12 | Serves as a lubricant in colon catheterization |
| Xylocaine 2% | AstraZenca | 9941342 | |
| Urethane | Sigma-Aldrich (Merck) | U2500-500G | |
| Trimethylamine solution 45% | Sigma-Aldrich (Merck) | 92262-1L | |
| Syringes 2 mL | B.Braun Melsungen AG | 4606027V | |
| Saline 250 mL | Fraesenius Kabi Polska Sp. Z o.o. | 15LL707WL | |
| Surgical scissors, straight, length 115 mm, 4 1/2 "blunt ends | Braun | NS-010-115-PKM | |
| Artery forceps type Micro-Adson bent, length 140 mm 5 1/2 " | Braun | KN-008-140-ZMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp 0.7x0.55 | Braun | PO-001-007-ZMK | |
| Micro Scissors type Vannas, straight, lenght 85 mm, 3 3/8 " the length of the blades 6 mm | Braun | NO-010-085-PMK | |
| Towel clamps type Backhouse, lenght 130 mm, 5 1/8" | Braun | HO-128-130-PMK | |
| Needle holders, lenght 150 mm, 6" t=0.4 1/2 | Braun | IM-927-150-PZMK | |
| Delicate Scissors, lenght 110 mm , straight, 4 3/8” sharp | Braun | NO-052-110-PMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp | Braun | PO-022-001-PMK |
Références
- Camilleri, M., Madsen, K., Spiller, R., Greenwood-Van Meerveld, B., Verne, G. N. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 24 (6), 503-512 (2012).
- Keita, A. V., Soderholm, J. D. The intestinal barrier and its regulation by neuroimmune factors. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 22 (7), 718-733 (2010).
- Farhadi, A., Banan, A., Fields, J., Keshavarzian, A. Intestinal barrier: an interface between health and disease. Journal of Gastroenterology and Hepatology. 18 (5), 479-497 (2003).
- Jaworska, K., et al. Hypertension in rats is associated with an increased permeability of the colon to TMA, a gut bacteria metabolite. PloS one. 12 (12), e0189310 (2017).
- Fujii, H., Nakai, K., Fukagawa, M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 15 (2), 125-128 (2011).
- Tomasova, L., et al. Intracolonic hydrogen sulfide lowers blood pressure in rats. Nitric Oxide: Biology and Chemistry. 60, 50-58 (2016).
- Brahe, L. K., Astrup, A., Larsen, L. H. Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 14 (12), 950-959 (2013).
- Ufnal, M., et al. Trimethylamine-N-oxide: a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats. The Canadian Journal of Cardiology. 30 (12), 1700-1705 (2014).
- Huc, T., Nowinski, A., Drapala, A., Konopelski, P., Ufnal, M. Indole and indoxyl sulfate, gut bacteria metabolites of tryptophan, change arterial blood pressure via peripheral and central mechanisms in rats. Pharmacological Research. 130, 172-179 (2018).
- Ufnal, M., Pham, K. The gut-blood barrier permeability - A new marker in cardiovascular and metabolic diseases?. Medical Hypotheses. 98, 35-37 (2017).
- Le Ferrec, E., et al. In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Alternatives to Laboratory Animals: ATLA. 29 (6), 649-668 (2001).
- Bohets, H., et al. Strategies for absorption screening in drug discovery and development. Current Topics in Medicinal Chemistry. 1 (5), 367-383 (2001).
- Grootjans, J., et al. Non-invasive assessment of barrier integrity and function of the human gut. World Journal of Gastrointestinal Surgery. 2 (3), 61-69 (2010).
- Bielinska, K., et al. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition. 54, 33-39 (2018).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American journal of physiology. Gastrointestinal and Liver Physiology. 296 (6), G1151-G1166 (2009).
- Denno, D. M., et al. Use of the lactulose to mannitol ratio to evaluate childhood environmental enteric dysfunction: a systematic review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 Suppl 4, S213-S219 (2014).
- Lugea, A., Salas, A., Casalot, J., Guarner, F., Malagelada, J. R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 46 (4), 515-521 (2000).
- Bloemen, J. G., et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery. Clinical Nutrition. 28 (6), 657-661 (2009).
- Huc, T., et al. Colonic hydrogen sulfide produces portal hypertension and systemic hypotension in rats. Experimental Biology and Medicine. 243 (1), 96-106 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon