このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腸血液関門と微生物叢製品の肝代謝を評価するためのIn Vivo法
要約
栄養素、微生物叢代謝および循環に医薬品へのアクセスは、腸・血液関門 (GBB) によって制御されます。直接 GBB 透磁率、生体内で、一般的に使用される間接的な方法と対照をなして肝臓と腎臓の機能によって影響ほぼないされる測定法について述べる。
要約
腸血液関門 (GBB) は、血流に腸の内腔から栄養、細菌代謝産物や薬物の通過を制御します。GBB 整合性は、消化管、循環器・代謝疾患、血流に腸内細菌の代謝などの生理活性化合物の簡単にアクセス可能性がありますで妨げられます。したがって、GBB の透磁率および腸管外の疾患のマーカーがあります。さらに、細菌代謝産物の普及率の増加全体の生物の機能に影響があります。
GBB 透水性を研究するための一般的に使用されるメソッドは、実行前のヴィヴォです。これらのメソッドの精度には腸管の血流に依存、GBB の機能限界です。生体内で一般的に使用される方法が肝臓と腎臓の性能によってバイアスことがありますこれらのメソッドは、尿の評価に基づいているため、他の一方で、または/および外因性マーカーの血中濃度。腸管の血流を維持し、肝・腎機能によって事実上受けませんポータルの採血に基づく体内法を用いたラットの GBB 透水性の直接測定を紹介します。
門脈にポリウレタンのカテーテルが挿入され、肝のすぐ上下大静脈静脈の合流点。ベースライン時と消化管の必要な部分に選択したマーカーの投与後、血液をサンプリングします。ここでは、(1) TMA、腸内細菌の代謝産物、TMA の肝クリアランスの評価 (2) (3) 腸の腸ポータル血肝末梢血経路の評価コロンの透過性の評価を含むメソッドのいくつかのアプリケーションを提案します。細菌由来短鎖脂肪酸。さらに、プロトコルは、ポータル血圧の測定、消化管吸収と薬物の肝代謝を追跡するためにまた使用可能性があります。
概要
腸血液関門 (GBB) とも呼ばれる腸のバリアは、栄養素1の吸収を可能にしながら有害化合物の通過を制限するために血流から腸の内腔を分ける複雑な多層システムです。3 つの主要な層で構成されています: 粘液層、上皮と粘膜固有層。
多くの要因は、GBB の整合性と機能2に影響があります。GBB が心血管疾患や代謝疾患3,4血流に腸内細菌代謝産物の増加通路につながる可能性がありますを含む消化管および管外病気で妨げられることが示されています。腸内細菌代謝産物の普及率の増加は、全体の生物の機能に影響があります。たとえば、最近の研究は循環器系機能5,6,7 インドール、H2S、短鎖脂肪酸 (SCFA)、トリメチルアミン n-オキシドなどの細菌代謝産物の影響を表示します。、8,9。最後に、GBB 透過性を増加可能性があります腸10の形態的, 機能的変化に関連付けられている心血管疾患や代謝疾患のマーカーとして使用することが提案されている.したがって、両方の基本的な臨床科学の興味の細菌代謝産物の腸ポータル血肝臓全身血経路を追跡可能性があります。
GBB の透水性評価法の一般的利用実験的実行は体外切除腸管粘膜、または人工膜11,12の断片を使用しています。これらのメソッドの精度が、GBB の適切な機能が一定の腸の血流を必要とするという事実によって損なわれます。その一方で、生体内で利用できる方法は、外因性マーカー13の血中濃度や尿の評価に基づいています。しかし、外因性化合物の末梢血中及び尿中濃度は腎機能、すなわち、糸球体濾過率と尿細管排泄および肝臓の代謝によって影響を受けて、すなわち、最初に代謝を渡します。両方のパラメーターは、GBB とは無関係の研究被験者間大幅に異なる場合があります。
本稿では、門脈血サンプリングを用いたラットの GBB 透磁率の直接測定について説明します。この体内メソッドは、腸の血流を維持し、肝・腎機能に左右されない事実上。説明の方法は通常使用されません、おそらくいくつかの方法論の難しさのため。門脈・肝静脈の合流点のすぐ上の下大静脈カテーテルについて詳細に述べる.門脈と下大静脈から血液サンプリングにより GBB の透磁率と肝クリアランスの評価だけでなく、腸内細菌の代謝物や薬など、興味の分子の腸ポータル血肝臓全身血経路の追跡ができます。私たちの研究室でテストされたメソッドのいくつかのアプリケーションを提案する.TMA、腸内細菌の代謝産物、TMA の肝クリアランスの評価、SCFA の腸ポータル血肝臓全身血経路の評価コロンの透過性の評価が含まれます。
腸血液関門の透過性を評価する次のプロトコル手順に従ってください、順序: 1 (intraintestinal 政権の行挿入)、 3 (門脈カテーテル)、 4 (門脈血サンプリング)、 6 (腸の透過性マーカーの管理)、 4。
肝クリアランスと腸ポータル血肝臓全身血経路を評価する次のプロトコルの手順に従ってください、順序: 1 (intraintestinal 政権の行挿入)、 2 (下大静脈カテーテル検査) 3 (門脈カテーテル)、 4 (門脈血サンプリング)、 5 (下大静脈血サンプリング)、 6 (腸の透過性マーカーの管理)、 4、 5、 7 (肝クリアランスの計算).
プロトコル
実験は科学的な目的に使用される動物の保護に関する指令 2010年/63 EU によると雄 Wistar 京都ラットに対して行われ、私のワルシャワの地元倫理委員会で承認されました。
1. Intraintestinal 管理のための行の挿入
注:ここでカテーテルを使用してマーカーの intracolonic 管理を提案する.それは、経口投与または経口消化管など胃または十二指腸のさまざまなレベルで修正されるかもしれません。使い捨て外科衣類、手術ガウン、フード、手袋などを使用して、手順 1-6 中に手術(針等)で使用される鋭いツールに関連する安全上の注意に従うことを確認してください。
- 手順の前に夜通し高速動物。すなわち、眼瞼や角膜反射の欠如によって、つま先ピンチと尾ピンチによるウレタン 1.5 g/kg bw i. p. の査定の適切な anesthetization の注入によって得られる、全身麻酔中にすべての手順を実行します。
- 大腸カテーテルとして小児のフォーリー カテーテル (10 階または 8 階) を使用します。コロン (約 8 cm) に挿入される部分を示すためカテーテルをマークします。
- コロンにカテーテルを挿入する前に、肛門領域や直腸内の便コンテンツを確認します。便が存在する場合、直腸部をマッサージすることで直腸を空します。
- カテーテルに潤滑剤 (例えばグリセリンやワセリン) を置きます。肛門と潤滑剤とその周辺を湿らせます。
- 外肛門括約筋をガイド線約 8 cm カテーテルを挿入します。ゆっくり前後と円形の動きを作る。
注: にカテーテルを挿入しながら腹部の触診によってカテーテルの位置をチェックしてください。
2. 下大静脈カテーテル
- 脚の付け根の毛を剃る。交互 3 回アルコールとポビドン ヨードで皮膚を消毒して、外科用ドレープで脚の付け根の領域をカバー.
- 大腿動脈のパルスを感じるし、パルスの明白な場所に約 2.0 cm の長さの縦皮膚をカットしようとします。
- 筋膜と神経血管束を視覚化する筋肉を解剖します。
- 神経血管束から大腿静脈の解剖: 最初の神経そして大腿動脈および静脈。
注: は、大腿静脈の小さな枝が簡単に破損して、出血の生産以来神経血管束の解剖時に注意します。 - 大腿静脈に 2 つの合字を置きます。まだ結び目を結ぶことはありません。針ホルダー付け近位の合字の両端をキャッチします。
- 静脈近位部分の近くに上向きホルダー付き合端を慎重に引き出します。静脈は血液で満たされてまで待ち、遠位の結び目を作る。
- 小さな切開 (約1 mm) 結び目と近位の合字の間静脈に顕微鏡下のはさみを使用して。湾曲の端をピンセットや針を使ってカテーテルを挿入します。
注: 静脈を穿刺し、カテーテル用針の曲がった先端をガイドとして使用します。カテーテルを挿入する際、近位の合字を緩めます。6 7.0 cm のカテーテルを挿入します。 - 2 つの単一の外科ノットで大腿静脈にカテーテルを固定します。同様に近位の合字を結ぶ。
- 注射器で血液を描画しようとして、カテーテルの開存を確認してください。0.3 ml のヘパリン生理食塩水 (100 単位/ml) カテーテルをすすいでください。
- 単一の針の 2 つの層の手術創を閉じます。
3. 門脈カテーテル
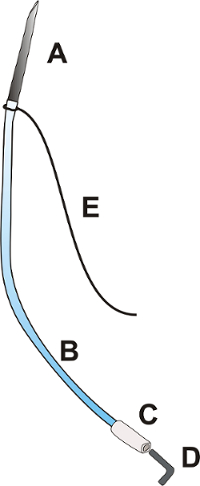
図 1: ポータル カテーテル。ポータルのカテーテルから成っている針外径: 長さ約 25.0 mm [A]、柔軟性のあるポリウレタン製カテーテル外径 0.9 mm: 0.025」、全長約 100.0 mm [B]、カテーテル外径の柔軟なプラスチック製のヒント: 0.040」、約 15.0 mm 長い [C] プラグイン [D]。、及び長さ 100.0 mm [E] の結紮 3/0。この図の拡大版を表示するのにはここをクリックしてください。
- 図 1によるとポータルのカテーテルを準備します。
- 針の切り口を挿入 (OD: 9 mm) ポリウレタン製カテーテル外径に: 0.025」。
- 合字の 3/0 針とカテーテルの交差点を結ぶ。
注: は、合字の長い部分が 6 cm 以上長いであることを確認します。 - OD のカテーテルの先端を挿入: 0.025"ポリエチレン カテーテル外径に: 0.040」。
- 金属またはプラスチック製のプラグでカテーテルを閉じます。
- 正中開腹
- 腹部の毛を剃る、交互 3 回アルコールとポビドン ヨードと皮膚の消毒し、手術用ドレープを使用して領域をカバーします。
- おへそを縦胸骨の剣状から皮膚をカットします。
- 白い線に沿って腹部壁の筋肉をカットします。
- 剣の軟骨 2 つのカットの間、Y の形で吻方カットを展開します。
- 門脈の解剖
- 生理食塩水で手術の綿棒を湿らせます。
- 盲腸、昇順し横行結腸と小腸ループを外在します。腸間膜のルートを公開する左側に腸を置きます。
注: は、乾燥から腸を保護するために生理食塩水で湿らせたガーゼで腸をカバーします。 - 門脈を公開するには、側面にまたは上向きに湿らせた綿棒で絞りに向けて慎重に肝葉に移動します。
- (肝門部、長さ約 5 mm) の腸間膜に覆われていない門脈の一部をローカライズし、門脈下合 3/0 (15 センチ) を渡します。
注意: 損傷から組織を保護する、合字を配置しながら、合字の生理食塩液を湿らせます。 - 合字の両端を鉗子でクランプし、船を安定させるために優しくそれを締めます。
- 挿入とカテーテルの安定化
- 門脈の無料部分の下ポータル カテーテルの合字の長い部分を渡すし、カテーテルは門脈のすぐ隣に位置するようにそれを引き出します。
- 上腸間膜静脈・門脈のジャンクションの下から 3 mm 上腸間膜静脈に針を挿入します。30 ° の角度で、静脈に入力した後、針を保持、角度を減らすため、ほぼ水平、門脈に平行に針を進めます。
注: は、約 6-7 mm の長さの針を挿入します。安定の合字はカテーテルを挿入しながら優しく門脈を強化すべきです。 - 組織接着剤、針が挿入される場所に 1-2 滴を適用します。肝臓をカバー綿棒を削除します。
- 腸を腹腔内に戻します。
- ウォーム アップの生理食塩液を腸を湿らせ、湿らせた滅菌ガーゼでカバーします。
- カテーテルの開存を確認し、0.3 ml のヘパリン生理食塩水 (100 単位/ml) カテーテルをすすいでください。
注: 静脈血カテーテルで逆流自発的に。
- 手術の終了
- 5 分後、腸の蠕動運動の色をチェック、適切な腸間膜血流が維持されていることを確認してください。
- 3 針と腹腔を閉じる: 壁の連続、吸収性縫合糸; - 腹壁筋の内側の層の腹膜腹壁 - 連続的な吸収性の縫合。 筋肉皮膚及び皮下組織の 1 つ、非吸収性縫合糸です。
注: は外在、へその周囲、カテーテルの遠位部です。
4. 門脈血サンプリング
- 使用する特定のテスト プロトコルに従って時サンプル門脈血表 1を参照してください。
| 短いプロトコル | 長いプロトコル |
| t0 -ベースライン (前 intracolonic 管理) に、 | t0 -ベースライン (前 intracolonic 管理) に、 |
| t1 -intracolonic 投与後 5 分 | t1 -intracolonic 投与後 30 分 |
| t2 -intracolonic 投与後 30 分 | t2 -intracolonic 投与後 60 分 |
表 1: ポータル血液サンプリング プロトコル腸の透磁率の評価のため。
注: 連続採血間隔テスト物質のバイオアベイラビリティと管理 (結腸、胃など) のサイトで主に依存します。
- ポータル カテーテル プラグを開き、血液の流れを自由にできます。
- 使用シリンジ (vol. 2 mL) および鈍い針外径: 0.9 mm。 0.7 mL 以上の血液を集めます。
- ヘパリン生理食塩水 (100 単位/ml) の 0.3 mL で洗い流してカテーテル プラグを閉じます。
5. 下大静脈血サンプリング
- 使用する特定のテスト プロトコルに従って時サンプル下大静脈血表 2を参照してください。
| 門脈 | 下大静脈 |
| t0 -ベースライン (前 intracolonic 管理) に、 | t0 -ベースライン (前 intracolonic 管理) に、 |
| t1 -intracolonic 投与後 30 分 | t1 -intracolonic 投与後 30 分 |
血肝クリアランス測定のためのサンプリングと腸ポータル血肝臓全身血経路の追跡のテーブル 2: プロトコル。
- 下大静脈カテーテル プラグを開き、血液の流れを自由にできます。
- 以上 0.7 mL のシリンジを用いた血液を収集 (vol. 2 mL)、針の外径が壊れて: 0.9 mm。
- 0.2 0.3 と洗い mL のヘパリン生理食塩水 (100 単位/ml) とカテーテル プラグを閉じます。
6. 消化管透過性マーカーの管理
- ガイドワイヤーし、滅菌水 (通常 1 mL ですが挿入する前にチェックの実際のバルーンのサイズ) の十分な量を使用して大腸のカテーテルのバルーンを膨らませます。
注: バルーン径が 1 cm を超えない。 - (傾斜約 15%) コロンから投与液の流出のリスクを最小限に抑えることをラットの頭を配置します。
- ゆっくりテスト物質を管理 (トリメチルアミンなど、100 mg/kg bw) 大腸カテーテルで排水ポートを使用します。
注: 管理ソリューションの 0.75 mL と肛門から投与液の流出を防ぐために 0.5 mL/分の送り速度の量を超えないようにします。 - 10 分後に、カテーテルのバルーンをしぼませます。
- サンプルを使用する特定のテスト プロトコルによると門脈下大静脈から血液表 1 と表 2を参照してください。
- 承認された方法で動物を安楽死させます。
7. 肝クリアランスの計算
- 肝クリアランスは、門脈血の濃度 (1 - (下大静脈濃度に下大静脈の比、門脈血中濃度と下大静脈血中濃度の違いによって肝抽出として理解を表現します。/門脈濃度))。
8. 試験物質濃度 n 血液サンプルの評価
- 被験物質と試験方法、に応じて適切な検査(遠心分離等)のサンプルを対象します。提案プロトコルでは、TMA/TMAO とトリプル四重極質量分析計、高速液体クロマトグラフィーを用いた SCFA 濃度を評価します。補足資料にメソッドの詳細な説明を見つけてください。
結果
我々 は正常にラットの TMA の GBB の透磁率と肝のクリアランスを測定しました。我々 は、正常血圧ラット (図 2)4と比較して TMA に増加コロン透水性がある高血圧ラットを実証しました。別の研究にその高い塩の取入口に TMA (図 3)14の GBB 透磁率および肝クリアランスは影響しませんを発見?...
ディスカッション
説明、直接、生体内で、GBB 透過性の測定方法を維持 closetophysiological 条件 (腸の血流を保持) 消化器系、肝臓や腎臓の機能に影響は事実上なかった。
この手法の重要なステップは、ポータルのカテーテルの挿入です。同時にこれがされる優しくそして断固とする必要があります。穏やかな、短い出血が正しく実行された; 門脈穿刺から生じるしかし、血管に針を挿入...
開示事項
著者が明らかに何もありません。
謝辞
仕事は、ポーランド共和国高等教育科学省でサポートされて、ダイヤモンド許可なし: DI2017 009247。
資料
| Name | Company | Catalog Number | Comments |
| Needle OD: 9 mm | Becton Dickinson S.A. | 301300 | |
| Polyethylene catheter ID: 0.025", OD: 0.040" | Scientific Commodities, Inc. | #BB520-40 | |
| Polyethylene catheter ID: 0.012", OD: 0.025" | Scientific Commodities, Inc. | #BB520-25 | |
| C-Flex Tubing,Opaque White 1/50"ID x 1/12 " OD | Cole-Parmer Instrument Co. | 06424-59 | |
| Pediatric Foley catheter (size 10F or 8F) | Sigmed | 0000 80305 | |
| Surgical ligatures 3/0 | Yavo Sp. Z o.o. | P48JE | |
| Absorbable surgical sutures - Polyglactine 910 4/0 | KRUUSE Polska Sp. Zo.o. | 152336 | |
| Tissue glue - Loctite 454Cyanoacrylate Adhesive | Loctite | 1370127 | |
| Povidone iodine | EGIS Pharmaceuticals PLC | 4449 11 | |
| Heparin - Heparinium WZF | WZF Polfa S.A. | 02BK0417 | Dilute 10 times with physiological saline |
| Glycerin 86% | Laboratorium Farmaceutyczne Avena | 5.90999E+12 | Serves as a lubricant in colon catheterization |
| Xylocaine 2% | AstraZenca | 9941342 | |
| Urethane | Sigma-Aldrich (Merck) | U2500-500G | |
| Trimethylamine solution 45% | Sigma-Aldrich (Merck) | 92262-1L | |
| Syringes 2 mL | B.Braun Melsungen AG | 4606027V | |
| Saline 250 mL | Fraesenius Kabi Polska Sp. Z o.o. | 15LL707WL | |
| Surgical scissors, straight, length 115 mm, 4 1/2 "blunt ends | Braun | NS-010-115-PKM | |
| Artery forceps type Micro-Adson bent, length 140 mm 5 1/2 " | Braun | KN-008-140-ZMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp 0.7x0.55 | Braun | PO-001-007-ZMK | |
| Micro Scissors type Vannas, straight, lenght 85 mm, 3 3/8 " the length of the blades 6 mm | Braun | NO-010-085-PMK | |
| Towel clamps type Backhouse, lenght 130 mm, 5 1/8" | Braun | HO-128-130-PMK | |
| Needle holders, lenght 150 mm, 6" t=0.4 1/2 | Braun | IM-927-150-PZMK | |
| Delicate Scissors, lenght 110 mm , straight, 4 3/8” sharp | Braun | NO-052-110-PMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp | Braun | PO-022-001-PMK |
参考文献
- Camilleri, M., Madsen, K., Spiller, R., Greenwood-Van Meerveld, B., Verne, G. N. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 24 (6), 503-512 (2012).
- Keita, A. V., Soderholm, J. D. The intestinal barrier and its regulation by neuroimmune factors. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 22 (7), 718-733 (2010).
- Farhadi, A., Banan, A., Fields, J., Keshavarzian, A. Intestinal barrier: an interface between health and disease. Journal of Gastroenterology and Hepatology. 18 (5), 479-497 (2003).
- Jaworska, K., et al. Hypertension in rats is associated with an increased permeability of the colon to TMA, a gut bacteria metabolite. PloS one. 12 (12), e0189310 (2017).
- Fujii, H., Nakai, K., Fukagawa, M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 15 (2), 125-128 (2011).
- Tomasova, L., et al. Intracolonic hydrogen sulfide lowers blood pressure in rats. Nitric Oxide: Biology and Chemistry. 60, 50-58 (2016).
- Brahe, L. K., Astrup, A., Larsen, L. H. Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 14 (12), 950-959 (2013).
- Ufnal, M., et al. Trimethylamine-N-oxide: a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats. The Canadian Journal of Cardiology. 30 (12), 1700-1705 (2014).
- Huc, T., Nowinski, A., Drapala, A., Konopelski, P., Ufnal, M. Indole and indoxyl sulfate, gut bacteria metabolites of tryptophan, change arterial blood pressure via peripheral and central mechanisms in rats. Pharmacological Research. 130, 172-179 (2018).
- Ufnal, M., Pham, K. The gut-blood barrier permeability - A new marker in cardiovascular and metabolic diseases?. Medical Hypotheses. 98, 35-37 (2017).
- Le Ferrec, E., et al. In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Alternatives to Laboratory Animals: ATLA. 29 (6), 649-668 (2001).
- Bohets, H., et al. Strategies for absorption screening in drug discovery and development. Current Topics in Medicinal Chemistry. 1 (5), 367-383 (2001).
- Grootjans, J., et al. Non-invasive assessment of barrier integrity and function of the human gut. World Journal of Gastrointestinal Surgery. 2 (3), 61-69 (2010).
- Bielinska, K., et al. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition. 54, 33-39 (2018).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American journal of physiology. Gastrointestinal and Liver Physiology. 296 (6), G1151-G1166 (2009).
- Denno, D. M., et al. Use of the lactulose to mannitol ratio to evaluate childhood environmental enteric dysfunction: a systematic review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 Suppl 4, S213-S219 (2014).
- Lugea, A., Salas, A., Casalot, J., Guarner, F., Malagelada, J. R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 46 (4), 515-521 (2000).
- Bloemen, J. G., et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery. Clinical Nutrition. 28 (6), 657-661 (2009).
- Huc, T., et al. Colonic hydrogen sulfide produces portal hypertension and systemic hypotension in rats. Experimental Biology and Medicine. 243 (1), 96-106 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved