Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
В естественных условиях метод для оценки барьер крови кишки и печени метаболизм микробиоты продукции
В этой статье
Резюме
Доступ питательных веществ, Микробиота метаболитов и лекарственных средств в оборот контролируется барьер крови Гут (GBB). Мы описываем прямой метод измерения GBB проницаемости в vivo, который, в отличие от широко используемых косвенные методы, практически не влияет на функции печени и почек.
Аннотация
Барьер крови Гут (GBB) контролирует прохождение питательных веществ, бактериальных метаболитов и наркотиков из просвета кишечника в кровь. В желудочно-кишечного тракта, сердечно-сосудистые и метаболические заболевания, которые могут привести к более легкий доступ биологически активных соединений, например кишечника бактериальной метаболитов, кровоток нарушается целостность GBB. Таким образом проницаемость GBB может быть маркер заболеваний кишечника и extraintestinal. Кроме того увеличение проникновения бактериальной метаболитов может повлиять на функционирование всего организма.
Часто используемые методы для изучения GBB проницаемости являются осуществляется ex vivo. Точность этих методов ограничено, потому что функционирование GBB зависит от кишечных кровотока. С другой стороны, часто используемых в vivo методов может быть предвзятым, печени и почек производительности, как эти методы основаны на оценке мочи или / и периферической крови концентраций экзогенного маркеров. Здесь мы представляем прямого измерения проницаемости GBB у крыс с помощью метода в естественных условиях на основе портала крови выборки, который сохраняет кишечных кровотока и практически не влияет на функцию печени и почек.
Полиуретановые катетеры вставляются в воротной вены и нижней полой вены чуть выше печеночные Вены слияния. Крови является пробы на базовом и после отправления выбранный маркер в нужную часть желудочно-кишечного тракта. Здесь мы представляем несколько применения метода, включая (1) Оценка проницаемости кишечника ТМА, кишечника бактериальной метаболит, (2) Оценка печени Распродажа ТМА и (3) оценки кишка портал крови печень периферической крови путь кишки бактерии производные короткими цепочками жирных кислот. Кроме того протокол может также использоваться для отслеживания кишечного поглощения и метаболизма печени наркотиков или для измерения портала артериального давления.
Введение
Гут крови барьер (GBB), также известный как кишечный барьер, является сложная многослойная система, которая отделяет просвета кишки от крови с целью ограничить проход вредных соединений обеспечивая поглощение питательных веществ1. Он состоит из трех основных слоев: слой слизи, эпителия и lamina propria.
Многочисленные факторы могут повлиять на целостность и функции GBB2. Было показано, что GBB нарушается в ЖКТ и extraintestinal заболеваний, включая заболевания сердечно-сосудистой и метаболической3, которые могут привести к повышенной проход кишечника бактериальной метаболитов в крови4. Увеличение проникновения бактериальной метаболитов кишки может повлиять на функционирование всего организма. Например недавние исследования показывают значительное влияние бактериальных метаболитов, таких как индолов, H2S, короткими цепочками жирных кислот (SCFA) и триметиламин N-оксида, системы кровообращения функции5,6,7 ,8,9. Наконец было предложено, что повышение проницаемости GBB может служить в качестве маркера метаболических и сердечно-сосудистых заболеваний, которые связаны с морфологических и функциональных изменений в кишечнике10. Таким образом отслеживание кишки портал крови и крови печень системный путь бактериальных метаболитов могут представлять интерес для фундаментальных и клинических наук.
Широко использованы экспериментальные методы для оценки GBB проницаемости, выполненных в пробирке с помощью резекции кишечника сегментов, фрагменты слизистой оболочки, или искусственных оболочек11,12. Тот факт, что надлежащее функционирование GBB требует постоянной кишечных кровотока нарушается точность этих методов. С другой стороны имеющиеся в vivo методы основаны на оценке мочи или периферической крови концентраций экзогенного маркеры13. Однако периферической крови и моче концентрации экзогенных соединений является влияние на функцию почек, т.е. скорости клубочковой фильтрации и трубчатых выведения, а также печени метаболизм, т.е., сначала пройти метаболизма. Оба параметра могут значительно различаться между субъектами исследования независимо от функции GBB.
Этот документ описывает прямого измерения проницаемости GBB у крыс с помощью портала крови. Этот метод в vivo сохраняет поток крови кишечника и практически не влияет на функции печени и почек. Описанный подход обычно не используется, возможно из-за некоторые методологические трудности. Мы подробно описать катетеризации портальной вены и нижней полой вены чуть выше впадения печеночной вены. Забор крови из воротной вены и нижней полой вены позволяет оценку Распродажа GBB проницаемость и печени, а также отслеживания кишки портал крови и крови печень системный путь молекул интереса, таких как кишечника бактериальной метаболитов или лекарства. Мы также присутствует несколько применения метода, которые были протестированы в нашей лаборатории. К ним относятся оценка проницаемости кишечника ТМА, кишечника бактериальной метаболит, оценки печени Распродажа ТМА и оценки кишка портал крови и крови печень системный путь SCFA.
Для оценки барьер крови гут проницаемости, следующие протокола следует выполнить шаги, в порядке: 1 (вставки линии для intraintestinal администраций), 3 (катетеризации портальной вены), 4 (забор крови воротной вены ), 6 (администрация маркера проницаемость кишечника), 4.
Чтобы оценить Распродажа печени и кишечнике портал крови и крови печень системный путь, следующие протокола следует выполнить шаги, в порядке: 1 (вставки линии для intraintestinal администраций), 2 (нижней полой вены катетеризация), 3 (катетеризации портальной вены), 4 (забор крови воротной вены), 5 (забор крови нижней полой вены), 6 (администрация маркера проницаемость кишечника), 4, 5, 7 ( расчет печени Распродажа).
протокол
Эксперименты проведены на крысах Wistar Киото согласно директиве 2010/63 ЕС о защите животных, используемых для научных целей и были одобрены я местный Комитет биоэтики в Варшаве.
1. вставки линии для Intraintestinal управления
Примечание: Здесь мы предлагаем intracolonic администрации с помощью катетера маркера. Это могут быть изменены путем перорального или кормления на различных уровнях пищеварительного тракта например желудка или двенадцатиперстной кишки. Помните, чтобы использовать одноразовые хирургические одежду, включая рукаву халата хирурга, капот и перчатки и обеспечить, чтобы следовать за меры безопасности, связанные с резким инструментов, используемых в хирургии (иглы, и т.д.) во время процедуры 1-6.
- Быстрых животных на ночь перед процедурой. Выполните все процедуры во время общей анестезии, т.е., полученные путем впрыска уретана 1,5 г/кг bw и.п. оценки надлежащего анестезии отсутствие рефлексов глазной и роговицы и методом мыс пинча и хвост пинча.
- Используйте педиатрических катетер Фоли (10F или 8F) как толстой катетер. Марк катетер указать ту часть, которая будет вставлена в толстой кишке (примерно 8 см).
- Проверьте анальной области и табурет содержание в прямой кишке перед вставкой катетер в ободочную кишку. Если стул, очистите прямую кишку массируя ректальной области.
- Положите смазки (например глицерин или вазелин) вдоль катетер. Смочите ануса и его окрестности с смазки.
- Вставьте катетер с руководство проволоку примерно 8 см через внешние анального сфинктера. Сделайте медленно вперед назад и вращательные движения.
Примечание: Держать на проверку расположения катетера при пальпации живота во время вводить катетер.
2. нижней полой вены катетеризации
- Бритье меха в пах. Попеременно дезинфицировать кожу с алкоголем и повидон йод 3 раза и охватывают области паха с хирургической драпировкой.
- Попробуйте почувствовать пульс на бедренной артерии и вырезать кожу продольно на длину около 2,0 см в том месте, где ощутима пульс.
- Вскрыть фасции и мышцы, чтобы визуализировать сосудисто-нервного пучка.
- Вскрыть бедренной вены от сосудисто-нервного пучка: первый нервов, потом бедренной артерии и Вены.
Примечание: Будьте внимательны во время диссекции сосудисто-нервного пучка, так как крошечные ветви бедренной вены легко могут быть повреждены, производить кровотечение. - Положите два лигатуры на бедренной вены. Еще не связать узлы. Поймать концы проксимальной лигатура с иглодержателя.
- Осторожно потяните концы лигатуры с держателем вверх, чтобы закрыть проксимальной части Вены. Подождите, пока Вену заполняется кровью и дистальной жениться.
- Сделать небольшой надрез (ОК. 1 мм) на ключе между узлом и проксимальной лигатур, используя микрохирургические ножницы. Вставьте с помощью пинцета или иглы с изогнутой конца катетера.
Примечание: Прокол Вены и использовать загнутым кончиком иглы в качестве руководства для катетера. Ослабьте проксимальной лигатура вставляя катетера. Вставьте катетер для 6-7.0 см. - Закрепите катетер в бедренной вены с двумя одного хирургических узлов. Галстук проксимальной лигатура также.
- Проверка проходимости катетера, пытаясь привлечь крови с помощью шприца. Промойте катетер с 0,3 мл физраствора гепаринизированным (100 единиц/мл).
- Закройте хирургической раны с двумя слоями один швов.
3. воротной вены катетеризации
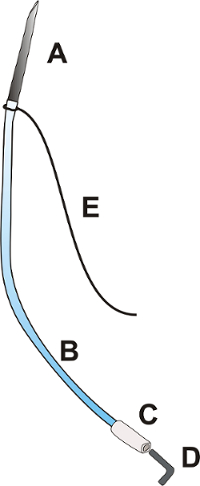
Рисунок 1 : Портал катетера. Портал катетер состоит из иглы OD: 0,9 мм с длиной около 25,0 мм [A], гибких полиуретановых катетер ОД: 0,025", длина около 100.0 мм [B], гибкие полиэтиленовые кончик катетера ОД: 0.040», около 15,0 мм длиной [C], вилки [D]. и вязью 3/0 с длиной 100,0 мм [E]. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Подготовьте портал катетер согласно рис.
- Вставьте конец среза иглы (OD: 9 мм) в полиуретановой катетер OD: 0,025".
- Галстук лигатура 3/0 на стыке иглы и катетера.
Примечание: Убедитесь, что больше частью лигатура находится по крайней мере 6 см длиной. - Вставьте конец катетера OD: 0,025" в полиэтиленовый катетер OD: 0.040".
- Закройте катетер с металлической или пластиковой заглушкой.
- Срединная лапаротомия
- Брить меха в животе, поочередно дезинфицировать кожу с алкоголем и повидон йод 3 раза и охватывают область с хирургической драпировкой.
- Вырежьте кожу продольно от мечевидного грудины до пупка.
- Сокращение мышц брюшной стенки вдоль белой линии.
- Разверните вырезать рострально в форме Y, так что xiphoid хряща между двумя разрезами.
- Рассечение воротной вены
- Смочите хирургические тампоны с saline.
- Неубранной цикла слепой кишки, восходящей и поперечно-ободочной кишки и тонкой кишки. Положите кишечника с левой стороны, предоставлять корень брыжейка.
Примечание: Кишечник накройте марлей, смоченной физиологического раствора для защиты кишечника от высыхания. - Подвергать воротной вены, тщательно перемещайте печеночная лопастями сторонам или вверх к диафрагма с смоченной тампоны.
- Локализовать в части воротной вены, которая не покрыта брыжейка (в печени рубчика, около 5 мм в длину) и передайте лигатура 3/0 (длиной 15 см) под воротной вены.
Примечание: Для защиты ткани от повреждения при размещении лигатура, смочите лигатура раствором физиологического раствора. - Закрепите концы лигатуры пинцетом и затяните его осторожно, чтобы стабилизировать судна.
- Вставки и стабилизации катетера
- Пройти больше частью портала катетер вязь под свободной части воротной вены и тянуть его, так что катетера расположен рядом с воротной вены.
- Вставьте иглу в верхней брыжеечных вен 3 мм ниже верхней брыжеечных вен и воротной вены. Удерживая иглу под углом в 30° и, после ввода в Вену, уменьшить угол и продвижения иглы почти горизонтально, параллельно воротной вены.
Примечание: Вставьте иглу для длиной около 6-7 мм. Стабилизирующее лигатура осторожно следует ужесточить воротной вены при вставке катетер. - Нанесите 1-2 капли клея ткани в месте, где игла вводится. Удаление тампонов, которые охватывают печени.
- Вернуть кишечника в брюшной полости.
- Смочите кишечника с подогретым физиологический раствор и накрыть смачивают стерильную марлю.
- Проверка проходимости катетера и промойте катетер с 0,3 мл физраствора гепаринизированным (100 единиц/мл).
Примечание: Венозной крови спонтанно backflows в катетер.
- Окончание операции
- После 5 минут Проверьте цвет кишечника и перистальтических движений, убедитесь, что надлежащее брыжеечных кровотока поддерживается.
- Закрыть брюшной полости с 3 строчки: стены брюшины с внутренний слой мышц брюшной стенки - непрерывный, рассасывающиеся шовные; остальные мышцы брюшной стенки - непрерывный, рассасывающиеся шовные; кожи и подкожной клетчатки - единый, не рассасывающиеся швы.
Примечание: Неубранной дистальной частью катетер вокруг пупка.
4. воротной вены кровь выборки
- Образец крови воротной вены иногда согласно конкретных испытаний протокол, используемый; приведены в таблице 1.
| Короткой протокола | Длинный протокол |
| t0 – базовой линии (до intracolonic администрация) | t0 – базовой линии (до intracolonic администрация) |
| t1 -5 мин после приема intracolonic | t1 -30 мин после приема intracolonic |
| t2 – 30 мин после приема intracolonic | t2 – 60 мин после приема intracolonic |
Таблица 1: Портал крови выборки протоколы для оценки проницаемость кишечника.
Примечание: Время между последовательными крови зависит главным образом от биодоступность проверенных веществ и сайт администрации (толстой кишки, желудка и т.д.).
- Открыть портал катетер вилку и пусть поток крови свободно.
- Использование шприцев (vol. 2 мл) и тупой иглой OD: 0.9 мм. собирать не более 0,7 мл крови.
- Промойте катетер с 0,3 мл физраствора гепаринизированным (100 единиц/мл) и закройте вилку катетера.
5. Нижний Vena Cava крови выборки
- Образец крови нижней полой вены иногда согласно конкретных испытаний протокол, используемый; приведены в таблице 2.
| Воротной вены | Нижней полой вены |
| t0 – базовой линии (до intracolonic администрация) | t0 – базовой линии (до intracolonic администрация) |
| t1 -30 мин после приема intracolonic | t1 -30 мин после приема intracolonic |
Таблица 2: Протокол крови выборки для печени Распродажа измерения и отслеживания кишки портал крови и крови печень системный путь.
- Откройте вилку катетер нижней полой вены и пусть поток крови свободно.
- Собирать не более 0,7 мл крови, с помощью шприца (vol. 2 мл) и сломанной иглы OD: 0,9 мм.
- Промойте катетер с 0,2-0,3 мл гепаринизированным физраствора (100 единиц/мл) и закрыть вилку катетера.
6. Администрация маркера проницаемость кишечника
- Извлеките проволочный направитель и надуть шар толстой катетер, используя адекватного объема стерильной воды (обычно 1 мл но проверить размер фактической шар до вставки).
Примечание: Диаметр шара не должна превышать 1 см. - Место крыса голову вниз (наклонение около 15%), для сведения к минимуму риска оттока управляемые решения от двоеточия.
- Медленно администрировать протестированных вещество (например триметиламин, 100 мг/кг bw) используя порт дренажа в толстой катетера.
Примечание: Не превышать объем 0,75 мл раствора управляемых и скорость подачи 0,5 мл/мин для предотвращения оттока управляемые решения от ануса. - После 10 минут дефлирования шар катетера.
- Образец крови из нижней полой вены и воротной вены согласно конкретных испытаний протокол, используемый; Смотрите в таблице 1 и таблице 2.
- Усыпить животных через утвержденным методом.
7. Расчет печени Распродажа
- Экспресс печени Распродажа, понимать как печеночная добыча, разница между портал крови концентрацию и нижней полой вены крови концентрацию или отношение нижней полой вены портала крови концентрации, (1 - (концентрация нижней полой вены / концентрация воротной вены)).
8. Оценка вещество концентрация n крови образцов
- В зависимости от испытываемого вещества и методологии испытаний при условии образца соответствующие лабораторные процедуры (центрифугирования, и т.д.). В предлагаемом протоколы мы оцениваем TMA/TMAO и SCFA концентрации с помощью жидкостной хроматографии в сочетании с тройной квадрупольного масс-спектрометрии. Вы можете найти подробное описание метода в дополнительном материале.
Результаты
Мы успешно измеряется GBB проницаемость и печени разминирование ТМА крыс. Мы продемонстрировали, что гипертензивные крысы имеют расширение толстой кишки проницаемость для TMA по сравнению с нормотензивных крыс (рис. 2)4. В другом исследовании...
Обсуждение
Описывается прямой, в естественных условиях, метод измерения проницаемости GBB поддерживает closetophysiological условий в системе желудочно-кишечного тракта (сохраняет поток крови кишечника) и практически не влияет на функции печени и почек.
Важнейшим шагом этой техники явл?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Работа поддерживается Министерством науки и высшего образования Республики Польша, Diamond Грант без: DI2017 009247.
Материалы
| Name | Company | Catalog Number | Comments |
| Needle OD: 9 mm | Becton Dickinson S.A. | 301300 | |
| Polyethylene catheter ID: 0.025", OD: 0.040" | Scientific Commodities, Inc. | #BB520-40 | |
| Polyethylene catheter ID: 0.012", OD: 0.025" | Scientific Commodities, Inc. | #BB520-25 | |
| C-Flex Tubing,Opaque White 1/50"ID x 1/12 " OD | Cole-Parmer Instrument Co. | 06424-59 | |
| Pediatric Foley catheter (size 10F or 8F) | Sigmed | 0000 80305 | |
| Surgical ligatures 3/0 | Yavo Sp. Z o.o. | P48JE | |
| Absorbable surgical sutures - Polyglactine 910 4/0 | KRUUSE Polska Sp. Zo.o. | 152336 | |
| Tissue glue - Loctite 454Cyanoacrylate Adhesive | Loctite | 1370127 | |
| Povidone iodine | EGIS Pharmaceuticals PLC | 4449 11 | |
| Heparin - Heparinium WZF | WZF Polfa S.A. | 02BK0417 | Dilute 10 times with physiological saline |
| Glycerin 86% | Laboratorium Farmaceutyczne Avena | 5.90999E+12 | Serves as a lubricant in colon catheterization |
| Xylocaine 2% | AstraZenca | 9941342 | |
| Urethane | Sigma-Aldrich (Merck) | U2500-500G | |
| Trimethylamine solution 45% | Sigma-Aldrich (Merck) | 92262-1L | |
| Syringes 2 mL | B.Braun Melsungen AG | 4606027V | |
| Saline 250 mL | Fraesenius Kabi Polska Sp. Z o.o. | 15LL707WL | |
| Surgical scissors, straight, length 115 mm, 4 1/2 "blunt ends | Braun | NS-010-115-PKM | |
| Artery forceps type Micro-Adson bent, length 140 mm 5 1/2 " | Braun | KN-008-140-ZMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp 0.7x0.55 | Braun | PO-001-007-ZMK | |
| Micro Scissors type Vannas, straight, lenght 85 mm, 3 3/8 " the length of the blades 6 mm | Braun | NO-010-085-PMK | |
| Towel clamps type Backhouse, lenght 130 mm, 5 1/8" | Braun | HO-128-130-PMK | |
| Needle holders, lenght 150 mm, 6" t=0.4 1/2 | Braun | IM-927-150-PZMK | |
| Delicate Scissors, lenght 110 mm , straight, 4 3/8” sharp | Braun | NO-052-110-PMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp | Braun | PO-022-001-PMK | |
Ссылки
- Camilleri, M., Madsen, K., Spiller, R., Greenwood-Van Meerveld, B., Verne, G. N. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 24 (6), 503-512 (2012).
- Keita, A. V., Soderholm, J. D. The intestinal barrier and its regulation by neuroimmune factors. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 22 (7), 718-733 (2010).
- Farhadi, A., Banan, A., Fields, J., Keshavarzian, A. Intestinal barrier: an interface between health and disease. Journal of Gastroenterology and Hepatology. 18 (5), 479-497 (2003).
- Jaworska, K., et al. Hypertension in rats is associated with an increased permeability of the colon to TMA, a gut bacteria metabolite. PloS one. 12 (12), e0189310 (2017).
- Fujii, H., Nakai, K., Fukagawa, M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 15 (2), 125-128 (2011).
- Tomasova, L., et al. Intracolonic hydrogen sulfide lowers blood pressure in rats. Nitric Oxide: Biology and Chemistry. 60, 50-58 (2016).
- Brahe, L. K., Astrup, A., Larsen, L. H. Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 14 (12), 950-959 (2013).
- Ufnal, M., et al. Trimethylamine-N-oxide: a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats. The Canadian Journal of Cardiology. 30 (12), 1700-1705 (2014).
- Huc, T., Nowinski, A., Drapala, A., Konopelski, P., Ufnal, M. Indole and indoxyl sulfate, gut bacteria metabolites of tryptophan, change arterial blood pressure via peripheral and central mechanisms in rats. Pharmacological Research. 130, 172-179 (2018).
- Ufnal, M., Pham, K. The gut-blood barrier permeability - A new marker in cardiovascular and metabolic diseases?. Medical Hypotheses. 98, 35-37 (2017).
- Le Ferrec, E., et al. In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Alternatives to Laboratory Animals: ATLA. 29 (6), 649-668 (2001).
- Bohets, H., et al. Strategies for absorption screening in drug discovery and development. Current Topics in Medicinal Chemistry. 1 (5), 367-383 (2001).
- Grootjans, J., et al. Non-invasive assessment of barrier integrity and function of the human gut. World Journal of Gastrointestinal Surgery. 2 (3), 61-69 (2010).
- Bielinska, K., et al. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition. 54, 33-39 (2018).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American journal of physiology. Gastrointestinal and Liver Physiology. 296 (6), G1151-G1166 (2009).
- Denno, D. M., et al. Use of the lactulose to mannitol ratio to evaluate childhood environmental enteric dysfunction: a systematic review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 Suppl 4, S213-S219 (2014).
- Lugea, A., Salas, A., Casalot, J., Guarner, F., Malagelada, J. R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 46 (4), 515-521 (2000).
- Bloemen, J. G., et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery. Clinical Nutrition. 28 (6), 657-661 (2009).
- Huc, T., et al. Colonic hydrogen sulfide produces portal hypertension and systemic hypotension in rats. Experimental Biology and Medicine. 243 (1), 96-106 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены