需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微生物肠道血屏障及肝脏代谢的体内评价方法
摘要
营养物质、微生物代谢物和药物进入血液循环的途径由肠道血屏障 (GBB) 控制。我们描述了一种直接测量体内 GBB 通透性的方法, 与常用的间接方法相比, 它几乎不受肝肾功能的影响。
摘要
肠道血屏障 (GBB) 控制养分、细菌代谢物和药物从肠道腔到血液的通道。GBB 完整性在胃肠道、心血管和代谢疾病中受到干扰, 这可能导致生物活性化合物 (如肠道细菌代谢物) 更容易进入血液。因此, GBB 的通透性可能是肠道和肠外疾病的标志物。此外, 细菌代谢物的渗透率增加可能影响整个机体的功能。
研究 GBB 通透性的常用方法是在体内进行。这些方法的准确性是有限的, 因为 GBB 的功能取决于肠道血流。另一方面, 通常使用的活体方法可能有偏见的肝脏和肾脏的表现, 因为这些方法是基于评估尿液或/和外周血浓度的外源标记。在这里, 我们提出了一种直接测量大鼠 GBB 通透性的方法, 采用基于门静脉采血的活体法, 可保持肠道血流, 几乎不受肝肾功能的影响。
聚氨酯导管插入门静脉和下腔静脉刚好高于肝静脉汇合处。血液在基线和被选择的标记的管理后被取样到胃肠道的所需部分。在这里, 我们提出了一些应用的方法, 包括 (1) 结肠通透性对 tma, 肠道细菌代谢物的评价, (2) tma 肝清除率的评价, 和 (3) 肠道门静脉血-肝-外周血通路的评价细菌衍生的短链脂肪酸。此外, 该协议还可用于跟踪药物的肠道吸收和肝脏代谢或门静脉血压测量。
引言
肠道血屏障 (GBB), 也被称为肠道屏障, 是一个复杂的多层系统, 分离肠道腔与血液, 以限制有害化合物的通过, 同时允许营养素的吸收1。它由三主要层组成: 粘液层、上皮和固有。
许多因素可能影响 GBB 的完整性和功能2。已经表明, GBB 在胃肠道和肠外疾病, 包括心血管和代谢疾病3, 这可能导致肠道细菌代谢物的通过增加到血液4的紊乱。肠道细菌代谢物的渗透增加可能影响整个机体的功能。例如, 最近的研究显示, 细菌代谢产物, 如吲哚, H2S, 短链脂肪酸 (欢迎) 和三甲胺 n-氧化物, 在循环系统功能5,6,7 显著影响,8,9。最后, 有人建议, 增加的 GBB 渗透率可以作为心血管和代谢疾病的标志, 与形态学和功能改变在肠道10。因此, 跟踪细菌代谢物的肠道门血-肝系统血液通路可能对基础和临床科学有兴趣。
常用的实验方法对 GBB 通透性进行体外检测, 使用切除肠段、粘膜片段或人工膜11、12。这些方法的准确性受到损害的事实, GBB 的正常运作需要恒定的肠道血流。另一方面, 可用的活体方法是基于对外源标记13的尿液或外周血浓度的评估。但是外源性化合物的外周血和尿液浓度受肾脏功能的影响,即肾小球滤过率和管状排泄, 以及肝脏代谢,即第一次代谢。两个参数在独立于 GBB 函数的研究对象之间可能有显著差异。
本文介绍了用门静脉采血法直接测定大鼠 GBB 通透性的方法。这种在体内的方法保留肠道血流, 几乎不受肝脏和肾脏功能的影响。所描述的方法并不常用, 可能是因为一些方法上的困难。我们详细描述了门静脉导管和下腔静脉在肝静脉汇合上方的插管。从门静脉和下腔静脉的血液取样允许评估 GBB 通透性和肝脏清除, 以及跟踪胃肠门血-肝系统血液通路的兴趣分子, 如肠道细菌代谢物或药物。我们还介绍了在我们的实验室测试的方法的几个应用。这些包括对 tma 的结肠通透性的评估, 肠道细菌代谢物, tma 的肝清除率的评价, 和欢迎的肠门血-肝-系统血通路的评价。
为了评估肠血屏障通透性, 应遵循以下协议步骤, 按顺序: 1 (插入 intraintestinal 管理线), 3 (门静脉导管), 4 (门静脉血取样), 6 (肠道通透性标记的管理), 4。
为了评估肝脏清除和肠道门血-肝系统的血液通路, 应遵循以下协议步骤, 按顺序: 1 (插入 intraintestinal 行政部门的行), 2 (下腔静脉导尿), 3 (门静脉导管), 4 (门静脉血采样), 5 (下腔静脉采血), 6 (胃肠通透性标记的管理), 4, 5, 7 (肝间隙的计算).
研究方案
根据指令2010/63 欧盟对用于科学目的的动物进行保护, 并经华沙当地生物伦理委员会批准, 对雄性京都大鼠进行了实验。
1. 插入 Intraintestinal 管理的线路
注意:在这里, 我们建议使用导管 intracolonic 管理标记。它可以通过口服或灌胃在消化道的不同级别 (如胃或十二指肠) 进行修改。切记使用一次性手术服, 包括手术服、兜帽和手套, 并确保遵守手术过程中使用的尖锐工具 (针头等) 的安全预防措施1-6。
- 快速动物在程序之前过夜。在全身麻醉过程中执行所有程序,即通过注射氨基甲酸酯1.5 克/千克 bw ip 评估适当的麻醉, 缺乏眼睑和角膜反射, 以及脚趾捏和尾捏法。
- 使用儿科导尿管 (10F 或 8F) 作为结肠导管。标记导管以指示将插入到冒号的部分 (大约8厘米)。
- 在直肠内插入导管前检查肛门区域和大便内容。如果大便存在, 通过按摩直肠区域清空直肠。
- 沿导管放置润滑剂 (如甘油或凡士林)。用润滑剂滋润肛门及其周围环境。
- 插入导管与导丝约8厘米通过外部肛门括约肌。缓慢向前-向后和圆周运动。
注意: 在插入导管时, 请通过腹部触诊检查导管的位置。
2. 下腔静脉导管术
- 在腹股沟剃毛。用酒精和聚维酮碘交替消毒皮肤3次, 用手术窗帘覆盖腹股沟区域。
- 试着感受股动脉的脉搏, 在脉搏可以触及的地方, 纵向切割2.0 厘米长的皮肤。
- 解剖筋膜和肌肉, 可视化神经血管束。
- 从神经血管丛中解剖股静脉: 第一神经, 然后是股动脉, 然后是静脉。
注意: 在神经血管丛的解剖时要小心, 因为股静脉的微小分支可能容易受损, 产生出血。 - 在股静脉上放两个连字。不要打结。用针座抓住近端连字的末端。
- 小心地将结扎端与支架向上拉, 以闭合静脉的近端部分。等待, 直到静脉充满血和绑远端结。
- 用显微外科剪刀在结和近端结扎之间的静脉上做一个小切口 (约1 毫米)。用镊子或带弯曲末端的针头插入导管。
注: 穿刺静脉和使用针的弯曲尖端作为导管的指南。插入导管时松开近端结扎。插入导管 6-7. 0 厘米。 - 用两个单独的手术结固定在股静脉导管。也要系上近端的结扎。
- 检查导管的通畅性, 尝试用注射器抽血。用0.3 毫升的肝素化盐水冲洗导管 (100 个单位/毫升)。
- 用两层单针闭合手术伤口。
3. 门静脉导管插管
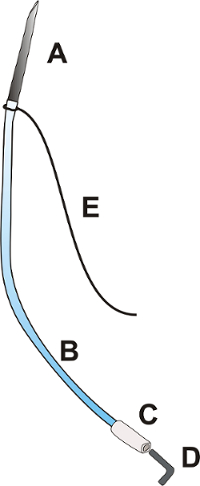
图 1: 门导管.门导管由针外径: 0.9 毫米, 长度约25.0 毫米 [a], 灵活的聚氨酯导管外径: 0.025 ", 长度约100.0 毫米 [B], 导管的挠性聚乙烯尖端外径: 0.040", 约15.0 毫米长 [C], 一个插头 [D], 以及长度为 100.0 mm [E] 的结扎3/0。请点击这里查看这个数字的更大版本.
- 根据图 1准备入口导管。
- 将针头的切割端 (外径: 9 mm) 插入聚氨酯导管外径: 0.025 "。
- 将结扎3/0 系在针头和导管的交界处。
注: 确保连字的较长部分至少为6厘米长。 - 插入导管末端外径: 0.025 "到聚乙烯导管外径: 0.040"。
- 用金属或塑料插头关闭导管。
- 中线剖腹手术
- 在腹部剃毛, 交替用酒精和聚维酮碘消毒皮肤3次, 并用手术窗帘覆盖该区域。
- 从胸骨的剑突到肚脐的纵向切割皮肤。
- 沿白线切割腹壁的肌肉。
- 展开 Y 形的切割 rostrally, 使剑突软骨介于两个切口之间。
- 门静脉解剖
- 用盐水滋润手术拭子。
- 取出的盲肠, 上升和横结肠, 小肠循环。将肠道放在左侧以暴露肠系膜的根部。
注: 用含生理盐水的纱布覆盖肠道, 防止肠道干燥。 - 要暴露门静脉, 小心地将肝裂片向两侧或向上移动到隔膜与湿润的拭子。
- 将不含肠系膜的门静脉的部分定位 (在肝门, 约5毫米长), 并通过在入口静脉的结扎 3/0 (15 厘米长)。
注意: 为了保护组织不受伤害, 同时放置结扎, 用生理盐水溶液滋润结扎。 - 用镊子夹住结扎端, 轻轻拧紧以稳定容器。
- 导管的插入和稳定
- 在门静脉的游离部分通过门导管的结扎的较长部分, 并拉它, 以便导管位于门静脉旁边。
- 将针头插入肠系膜上静脉与门静脉交界处3毫米的上肠系膜静脉。以30°的角度握住针头, 并在进入静脉后, 尽量减小角度, 并将针几乎水平地向前推进, 与门静脉平行。
注: 插入针的长度约为6-7 毫米。在插入导管时, 稳定结扎应轻轻收紧门静脉。 - 在插入针头的地方涂抹1-2 滴纸巾胶。取出覆盖肝脏的拭子。
- 把肠子放回腹腔。
- 用温热的盐水溶液滋润肠道, 用湿润的无菌纱布覆盖。
- 检查导管的通畅性, 用0.3 毫升的肝素化盐水冲洗导管 (100 个单位/毫升)。
注: 静脉血在导管内自发回流。
- 手术结束
- 5分钟后, 检查肠道的颜色和蠕动运动, 确保正确的肠系膜血流保持。
- 闭合腹腔与3针: 壁腹膜与内层腹壁肌肉-连续, 可吸收缝合;腹壁剩余肌肉-连续可吸收缝线;皮肤和皮下组织-单, 不可吸收缝线。
注意: 取出在肚脐周围的导管远端。
4. 门静脉血取样
- 根据所使用的特定测试协议, 有时对门静脉血液取样;见表 1。
| 短协议 | 长协议 |
| t0 -基线 (在 intracolonic 管理之前) | t0 -基线 (在 intracolonic 管理之前) |
| t1 -5 分钟后 intracolonic 管理 | t1 -30 分钟后 intracolonic 管理 |
| t2 -30 分钟后 intracolonic 管理 | t2 -60 分钟后 intracolonic 管理 |
表 1: 用于肠道通透性评估的门静脉采血方案。
注意: 连续血液取样之间的时间主要取决于测试物质的生物利用度和管理部位 (结肠, 胃等)。
- 打开门导管插头, 让血液自由流动。
- 使用注射器 (vol. 2 毫升) 和钝针外径: 0.9 毫米收集不超过0.7 毫升的血液。
- 用0.3 毫升肝素化盐水 (100 个单位/毫升) 冲洗导管, 然后关闭导管插头。
5. 下腔静脉血取样
- 根据所使用的特定测试协议, 有时取样下腔静脉血;见表 2。
| 门静脉 | 下腔静脉 |
| t0 -基线 (在 intracolonic 管理之前) | t0 -基线 (在 intracolonic 管理之前) |
| t1 -30 分钟后 intracolonic 管理 | t1 -30 分钟后 intracolonic 管理 |
表 2: 血液取样协议, 用于肝间隙测量和追踪肠门血-肝-系统血液通路。
- 打开下腔静脉导管塞, 让血液自由流动。
- 收集不超过0.7 毫升的血液使用注射器 (vol. 2 毫升) 和断针外径: 0.9mm。
- 用 0.2-0.3 毫升的肝素化盐水 (100 个单位/毫升) 冲洗导管并关闭导管插头。
6. 肠道渗透性标记的管理
- 取出导丝并充气结肠导管气球, 使用足够数量的无菌水 (通常为1毫升, 但在插入前检查实际气球大小)。
注: 球囊直径不应超过1厘米。 - 将鼠头向下 (倾角约 15%), 以最小化从结肠的管理的解决方案流出的风险。
- 使用结肠导管中的引流口缓慢管理经测试的物质 (例如三甲胺、100毫克/千克 bw)。
注意: 不要超过0.75 毫升的管理溶液的体积和0.5 毫升/分钟的喂食速度, 以防止从肛门的管理的解决方案流出。 - 10分钟后, 将导管气球收缩。
- 根据所使用的特定测试协议, 从下腔静脉和门静脉取样血液;见表1和表 2。
- 安乐死动物经批准的方法。
7. 肝间隙的计算
- 快速肝清除, 被理解为肝提取, 通过门血浓度和下腔静脉血浓度的差异或下腔静脉与门血浓度的比值 (1-(下腔静脉浓度/门静脉浓度))。
8. 测试物质浓度 n 血液样本的评估
- 根据测试物质和测试方法, 将样品以适当的实验室程序 (离心等) 为准。在建议的协议中, 我们使用液相色谱法和三重四极质谱法对 TMA/TMAO 和欢迎浓度进行评价。请在补充材料中找到该方法的详细描述。
结果
成功测定了大鼠 GBB 通透性和肝清除率。我们已经证明高血压大鼠与血压正常大鼠相比, 其结肠通透性增加到 TMA (图 2)4。在另一项研究中, 我们发现高盐摄入不会影响 TMA 的 GBB 通透性和肝间隙 (图 3)14。
测量粪便、门血和外周血中欢迎的浓度, 我们...
讨论
直接,在体内, 测量 GBB 渗透率的方法保持胃肠系统中的 closetophysiological 条件 (保留肠道血流), 几乎不受肝肾功能的影响。
这项技术的关键步骤是插入门导管。这必须在同一时间轻轻和果断地完成。轻微, 短出血可能发生从正确执行的门静脉穿刺;但是, 当针头插入容器时, 它会停止。持续出血表明门静脉穿孔。为便于导管插入, 门静脉应充分暴露。exteriorizing 肠后, 肠系膜?...
披露声明
作者没有什么可透露的。
致谢
这项工作得到了波兰科学和高等教育部的支持, 钻石赠款号: DI2017 009247。
材料
| Name | Company | Catalog Number | Comments |
| Needle OD: 9 mm | Becton Dickinson S.A. | 301300 | |
| Polyethylene catheter ID: 0.025", OD: 0.040" | Scientific Commodities, Inc. | #BB520-40 | |
| Polyethylene catheter ID: 0.012", OD: 0.025" | Scientific Commodities, Inc. | #BB520-25 | |
| C-Flex Tubing,Opaque White 1/50"ID x 1/12 " OD | Cole-Parmer Instrument Co. | 06424-59 | |
| Pediatric Foley catheter (size 10F or 8F) | Sigmed | 0000 80305 | |
| Surgical ligatures 3/0 | Yavo Sp. Z o.o. | P48JE | |
| Absorbable surgical sutures - Polyglactine 910 4/0 | KRUUSE Polska Sp. Zo.o. | 152336 | |
| Tissue glue - Loctite 454Cyanoacrylate Adhesive | Loctite | 1370127 | |
| Povidone iodine | EGIS Pharmaceuticals PLC | 4449 11 | |
| Heparin - Heparinium WZF | WZF Polfa S.A. | 02BK0417 | Dilute 10 times with physiological saline |
| Glycerin 86% | Laboratorium Farmaceutyczne Avena | 5.90999E+12 | Serves as a lubricant in colon catheterization |
| Xylocaine 2% | AstraZenca | 9941342 | |
| Urethane | Sigma-Aldrich (Merck) | U2500-500G | |
| Trimethylamine solution 45% | Sigma-Aldrich (Merck) | 92262-1L | |
| Syringes 2 mL | B.Braun Melsungen AG | 4606027V | |
| Saline 250 mL | Fraesenius Kabi Polska Sp. Z o.o. | 15LL707WL | |
| Surgical scissors, straight, length 115 mm, 4 1/2 "blunt ends | Braun | NS-010-115-PKM | |
| Artery forceps type Micro-Adson bent, length 140 mm 5 1/2 " | Braun | KN-008-140-ZMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp 0.7x0.55 | Braun | PO-001-007-ZMK | |
| Micro Scissors type Vannas, straight, lenght 85 mm, 3 3/8 " the length of the blades 6 mm | Braun | NO-010-085-PMK | |
| Towel clamps type Backhouse, lenght 130 mm, 5 1/8" | Braun | HO-128-130-PMK | |
| Needle holders, lenght 150 mm, 6" t=0.4 1/2 | Braun | IM-927-150-PZMK | |
| Delicate Scissors, lenght 110 mm , straight, 4 3/8” sharp | Braun | NO-052-110-PMK | |
| Anatomic forceps, lenght 95 mm, 3 3/4" sharp | Braun | PO-022-001-PMK |
参考文献
- Camilleri, M., Madsen, K., Spiller, R., Greenwood-Van Meerveld, B., Verne, G. N. Intestinal barrier function in health and gastrointestinal disease. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 24 (6), 503-512 (2012).
- Keita, A. V., Soderholm, J. D. The intestinal barrier and its regulation by neuroimmune factors. Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society. 22 (7), 718-733 (2010).
- Farhadi, A., Banan, A., Fields, J., Keshavarzian, A. Intestinal barrier: an interface between health and disease. Journal of Gastroenterology and Hepatology. 18 (5), 479-497 (2003).
- Jaworska, K., et al. Hypertension in rats is associated with an increased permeability of the colon to TMA, a gut bacteria metabolite. PloS one. 12 (12), e0189310 (2017).
- Fujii, H., Nakai, K., Fukagawa, M. Role of oxidative stress and indoxyl sulfate in progression of cardiovascular disease in chronic kidney disease. Therapeutic Apheresis and Dialysis: Official Peer-Reviewed Journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy. 15 (2), 125-128 (2011).
- Tomasova, L., et al. Intracolonic hydrogen sulfide lowers blood pressure in rats. Nitric Oxide: Biology and Chemistry. 60, 50-58 (2016).
- Brahe, L. K., Astrup, A., Larsen, L. H. Is butyrate the link between diet, intestinal microbiota and obesity-related metabolic diseases?. Obesity Reviews: An Official Journal of the International Association for the Study of Obesity. 14 (12), 950-959 (2013).
- Ufnal, M., et al. Trimethylamine-N-oxide: a carnitine-derived metabolite that prolongs the hypertensive effect of angiotensin II in rats. The Canadian Journal of Cardiology. 30 (12), 1700-1705 (2014).
- Huc, T., Nowinski, A., Drapala, A., Konopelski, P., Ufnal, M. Indole and indoxyl sulfate, gut bacteria metabolites of tryptophan, change arterial blood pressure via peripheral and central mechanisms in rats. Pharmacological Research. 130, 172-179 (2018).
- Ufnal, M., Pham, K. The gut-blood barrier permeability - A new marker in cardiovascular and metabolic diseases?. Medical Hypotheses. 98, 35-37 (2017).
- Le Ferrec, E., et al. In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Alternatives to Laboratory Animals: ATLA. 29 (6), 649-668 (2001).
- Bohets, H., et al. Strategies for absorption screening in drug discovery and development. Current Topics in Medicinal Chemistry. 1 (5), 367-383 (2001).
- Grootjans, J., et al. Non-invasive assessment of barrier integrity and function of the human gut. World Journal of Gastrointestinal Surgery. 2 (3), 61-69 (2010).
- Bielinska, K., et al. High salt intake increases plasma trimethylamine N-oxide (TMAO) concentration and produces gut dysbiosis in rats. Nutrition. 54, 33-39 (2018).
- Clarke, L. L. A guide to Ussing chamber studies of mouse intestine. American journal of physiology. Gastrointestinal and Liver Physiology. 296 (6), G1151-G1166 (2009).
- Denno, D. M., et al. Use of the lactulose to mannitol ratio to evaluate childhood environmental enteric dysfunction: a systematic review. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 59 Suppl 4, S213-S219 (2014).
- Lugea, A., Salas, A., Casalot, J., Guarner, F., Malagelada, J. R. Surface hydrophobicity of the rat colonic mucosa is a defensive barrier against macromolecules and toxins. Gut. 46 (4), 515-521 (2000).
- Bloemen, J. G., et al. Short chain fatty acids exchange across the gut and liver in humans measured at surgery. Clinical Nutrition. 28 (6), 657-661 (2009).
- Huc, T., et al. Colonic hydrogen sulfide produces portal hypertension and systemic hypotension in rats. Experimental Biology and Medicine. 243 (1), 96-106 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。