Method Article
تسلسل mRNA من الدم الكامل باستخدام التسلسل نانو
In This Article
Summary
نانو التسلسل هو تقنيه جديده تسمح بالتسلسل الفعال من حيث التكلفة في المواقع النائية والبيئات التي تفتقر إلى الموارد. هنا ، نقدم بروتوكولا لتسلسل mRNAs من الدم الكامل الذي يتوافق مع مثل هذه الظروف.
Abstract
ويمثل التسلسل في المواقع النائية والأوضاع التي تفتقر إلى الموارد تحديات فريدة. ويمكن استخدام التسلسل النانو بنجاح في ظل هذه الظروف ، وتم نشره في غرب افريقيا خلال الوباء الأخير لفيروس الإيبولا ، مما يسلط الضوء علي هذه الامكانيه. بالاضافه إلى مزاياه العملية (منخفضه التكلفة ، وسهوله نقل المعدات واستخدامها) ، توفر هذه التكنولوجيا أيضا مزايا أساسيه علي الجيل الثاني من نهج التسلسل ، ولا سيما طول القراءة طويل جدا ، والقدرة علي تسلسل مباشره RNA ، وتوافر البيانات في الوقت الحقيقي. دقه قراءه الخام اقل من مع منصات التسلسل الأخرى ، والتي تمثل الحد الرئيسي لهذه التكنولوجيا ؛ ومع ذلك ، يمكن تخفيف هذا جزئيا بواسطة عمق قراءه عاليه التي تم إنشاؤها. هنا ، نقدم بروتوكول متوافق مع المجال لتسلسل ترميز mRNAs ل نيمان-بيك C1 ، والذي هو مستقبلات الخلوية للفيروسات ebolaviruses ويشمل هذا البروتوكول استخراج الحمض النووي الريبي من عينات الدم الحيوانية ، تليها RT-PCR لإثراء الهدف ، والترميز ، واعداد المكتبة ، والتسلسل تشغيل نفسها ، ويمكن تكييفها بسهوله للاستخدام مع غيرها من الأهداف DNA أو RNA.
Introduction
التسلسل هو أداه قويه وهامه في البحوث البيولوجية والطبية الحيوية. هو يسمح تحليل من مورثات, تنوعات وراثيه, و [رنا] تعبير تشكيلات, ولذلك يلعب دور مهمة في التحقيق من انسانيه وامراض حيوانيه علي حد سواء1,2. Sanger التسلسل ، واحده من أقدم الطرق المتاحة للتسلسل الحمض النووي ، لا يزال يستخدم بشكل روتيني إلى هذا اليوم ، وكان حجر زاوية من البيولوجيا الجزيئية. علي مدي السنوات 50 الماضية ، تم تحسين هذه التكنولوجيا لتحقيق أطوال القراءة أكثر من 1,000 nt ودقه عاليه مثل 99.999%1. ومع ذلك ، التسلسل Sanger أيضا قيود. تسلسل مجموعه أكبر من العينات أو تحليل الجينوم كله مع هذا الأسلوب هو مضيعه للوقت ومكلفه1,3. وقد مكنتنا أساليب تسلسل الحمض النووي من الجيل الثاني (الجيل التالي) مثل 454 التسلسل الحراري وتكنولوجيا الومينا من خفض التكلفة وعبء العمل المطلوبين للتسلسل في العقد الماضي بدرجه كبيره ، وأديت إلى زيادة هائله في كميه معلومات التسلسل البيولوجي المتاحة4. ومع ذلك ، فان تشغيل التسلسل الفردي باستخدام هذه التكنولوجيات الجيل الثاني مكلفه ، والتسلسل في ظل الظروف الميدانية أمر صعب ، لان المعدات اللازمة هي ضخمه وهشه (مماثله لأجهزه تسلسل Sanger) ، وغالبا ما يكون يتم معايره وخدمه من قبل الموظفين المدربين خصيصا. أيضا ، بالنسبة للكثير من الجيل الثاني من التكنولوجيات قراءه أطوال محدوده نوعا ما ، والتي غالبا ما يجعل تحليل المعلوماتية الحيوية المصب من هذه البيانات الصعبة.
يمكن ان يكون التسلسل من الجيل الثالث باستخدام أجهزه التسلسل النانو بحجم الجيب (انظر جدول المواد) بديلا عن منصات التسلسل الثابتة هذه. في هذه الاجهزه يمر الحمض النووي الوحيد الذي تقطعت به السبل أو جزيء RNA من خلال نانو في وقت واحد مع التيار الأيوني الذي يقاس بعد ذلك بواسطة جهاز استشعار (الشكل 1). بما ان الحبل يخترق النانو, التشكيل من التيار ب ال [نوكليودس] حاضره في المسام في اي وقت محدده يكون كشفت, و[كمترتريكل] [رد-ترجم] داخل ال [نوكليوتيد] تسلسل5. وبسبب هذا المبدا التشغيلي ، يسمح التسلسل النانو لكل من توليد القراءات الطويلة جدا (بالقرب من 1 × 106 نوكليوديس6) وتحليل بيانات التسلسل في الوقت الحقيقي. ويمكن الكتابة بالشفرة عن طريق ربط متواليات النيوكليوتيد المحددة بالأحماض النووية في عينه ، مما يسمح بتحليل العينات المتعددة في تسلسل واحد ، التالي زيادة إنتاجيه العينات وخفض تكاليف العينة. ونظرا لقابليها العالية للنقل وسهوله استخدامها ، فقد استخدمت أجهزه التسلسل النانو بنجاح في الميدان خلال الوباء الأخير لمرض فيروس الإيبولا في غرب افريقيا ، مما يسلط الضوء علي ملاءمتها للانتشار السريع في المناطق النائية7 , 8-الآن
هنا ، ونحن وصف بروتوكول مفصل المتوافقة مع المجال للتسلسل الترميز mRNA لبروتين نيمان-بيك C1 (NPC1) ، وهو مستقبلات الدخول الملزمة للفيروسات الخيطية مثل الفيروسات الكترونيه ، وقد ثبت للحد من قابليه الأنواع هذه الفيروسات9,10. ويشمل البروتوكول استخراج الحمض الريبي النيبالي كله من عينات الدم ، والتضخيم محدده من NPC1 mRNA بواسطة RT-PCR ، والترميز من العينات ، واعداد المكتبة والتسلسل مع جهاز تسلسل نانو. ولا يمكن مناقشه تحليل البيانات بسبب محدوديه الحيز المكاني ، علي الرغم من ان بعض التوجيهات الاساسيه تقدم في النتائج التمثيلية ؛ ومع ذلك ، يحال القارئ المهتمة إلى المنشور السابق11 للحصول علي وصف أكثر تفصيلا لسير العمل الذي استخدمناه ، وكذلك للمنشورات الأخرى12،13،14 للحصول علي معلومات مفصله فيما يتعلق باداات التحليل المستخدمة في سير العمل هذا.
Protocol
وقد جمعت العينات بعد بروتوكول مجلس المراجعة المؤسسية لجامعه نجالا (NUIRB). IRB00008861/FWA00018924.
1. استخراج الحمض الريبي النيبالي من عينات الدم
- جمع 3 مل من الدم كله من الأنواع ليتم تحليلها في أنبوب جمع الدم معباه مع 6 مل من الحمض النووي/RNA استقرار كاشف (انظر جدول المواد) ومزيج من خلال عكس 5 مرات. تخزين عينه الدم لمده تصل إلى شهر واحد في 4 درجه مئوية.
- نقل محتويات أنبوب جمع الدم إلى أنبوب جمع 50 mL ، أضافه 120 μL من بروتينيه K ، وتخلط بواسطة vortexing ل 5 ليالي. احتضان العينة لمده 30 دقيقه في درجه حرارة الغرفة.
- أضف 9 مل من ايزوبروبانول إلى الخليط والدوامة لمده 5 ليالي.
- ضع خزانا علي عمود الدوران الخاص بتنقية الحمض الريبي النيبالي (انظر جدول المواد) وضع التجميع علي مشعب فراغ (انظر جدول المواد). أضافه خليط العينة في الخزان. تطبيق فراغ حتى كل السائل قد مرت من خلال العمود.
- بدلا من ذلك ، إذا لم يكن هناك مشعب فراغ متاح ، يمكن تمرير الدم من خلال العمود في أجزاء 700 μL بواسطة الطرد المتكررة ل 30 s في 12,000 x g مع التدفق من خلال التخلص من بين الخطوات طرد. ومع ذلك ، سيتطلب ذلك حوالي 26 طرد خطوه.
- وضع العمود الحمض النووي الريبي تنقيه تدور في أنبوب جمع وأضافه 400 μL DNA/RNA الاعداديه العازلة (انظر جدول المواد). الطرد المركزي في 12,000 x g ل 30 s وتجاهل تدفق من خلال.
- أضافه 400 μL من الحمض النووي/RNA غسل العازلة (انظر جدول المواد) إلى العمود ، الطرد المركزي في 12,000 x g ل 30 ثانيه وتجاهل تدفق من خلال.
- اخلط 5 μL من DNase I (1 U/μL) (انظر جدول المواد) مع 75 μl من الحمض النووي العازل الهضم (انظر جدول المواد) وأضافه الخليط إلى العمود. احتضان لمده 15 دقيقه في درجه حرارة الغرفة.
- أضافه 400 μL من الحمض النووي/RNA الاعداديه العازلة إلى العمود وأجهزه الطرد المركزي في 12,000 x g ل 30 s. تجاهل تدفق من خلال.
- غسل العمود مع 700 μL من الحمض النووي/RNA غسل العازلة وأجهزه الطرد المركزي في 12,000 x g ل 30 s. تجاهل تدفق من خلال.
- كرر الخطوة 1.9 مع 400 μL من الحمض النووي/RNA غسل العازلة والطرد المركزي في 12,000 x g لمده 2 دقيقه لأزاله جميع المتبقية غسل العازلة وتجفيف العمود. عند أزاله العمود من أنبوب التجميع ، تاكد من عدم البلل السفلي من العمود مع المخزن المؤقت في أنبوب التجميع.
-
وضع العمود في أنبوب الطرد المركزي 1.5 mL جديده وأضافه 70 μL من المياه الخالية من النيوداز. احتضان لمده 1 دقيقه في درجه حرارة الغرفة وأجهزه الطرد المركزي ل 30 s في 12,000 x g. خزنت ال [رنا] في-80 [ك] حتى استعمال بعيده (أو استعملت فورا).
- اختياري: لقياس الحمض الريبي النيبالي ، واتخاذ قسامه وتحديد التركيز باستخدام مقياس طيفي للاشعه فوق البنفسجية (انظر جدول المواد).
2. عكس النسخ من NPC1 mRNA إلى cDNA
- في أنبوب رد فعل 0.2 mL ، أضافه 8 μL من الحمض الريبي النيبالي القالب (1 pg إلى 2.5 ميكروغرام من الحمض الريبي النيبالي) و 1 μL كل من 10x DNase العازلة وانزيم DNase (انظر جدول المواد). احتضان في 37 درجه مئوية لمده 2 دقيقه. فيما بعد, طرد مركزي الرد فعل بإيجاز ووضعت هو علي جليد.
- أضف 4 ميكرولتر من المزيج الرئيسي لناسخ النسخ العكسي (انظر جدول المواد) و 6 μl من الماء الخالي من النيوداز إلى أنبوب التفاعل واخلطه برفق. احتضان رد الفعل في ثيرموسيكلير لمده 10 دقيقه في 25 درجه مئوية (للصلب التمهيدي) ، تليها 10 دقيقه في 50 درجه مئوية (للنسخ العكسي لل RNA). لتنشيط الانزيم ، احتضان لمده 5 دقائق في 85 درجه مئوية.
- نقل cDNA إلى جديد 1.5 mL أنبوب الطرد المركزي وتخزين في-80 درجه مئوية حتى مزيد من الاستخدام (أو استخدامها علي الفور).
3. تضخيم اطار القراءة المفتوحة NPC1
-
خطوه التضخيم الاوليه
- اعداد الهبوط PCR15،16 لتضخيم NPC1 cdna مع التمهيدي مجموعه 1 (انظر الجدول 1) ، وذلك باستخدام الساخنة بداية عاليه الدقة الحمض النووي البوليميرات (انظر جدول المواد) مع المخزن المؤقت رد الفعل المناسب في رد فعل 50 μl حجم مع 1 μL قالب. إذا كان ذلك ممكنا ، واعداد رد فعل علي الجليد أو في كتله بارده 4 درجه مئوية.
- احتضان رد الفعل في ثيرموسيكلير مع خطوه التشبع الاوليه من 30 ق في 98 درجه مئوية ، تليها 10 دورات مع التشبع في 98 درجه مئوية ل 10 ثانيه ، الصلب التمهيدي ل 20 s في 65 درجه مئوية ، وخفض درجه الحرارة بنسبه 0.5 درجه مئوية في دوره ، واستطاله لمده 1 دقيقه في 72 درجه مئوية. وبعد ذلك ، تشغيل 20 دورات اضافيه مع 10 ق في 98 درجه مئوية ، 20 ق في 60 درجه مئوية ، و 1 دقيقه في 72 درجه مئوية ، تليها خطوه استطاله النهائي من 5 دقائق في 72 درجه مئوية.
-
PCR تنقيه باستخدام الخرز المغناطيسي
- نقل 50 μL من PCR المنتج إلى 1.5 mL الحمض النووي-انخفاض ملزمه أنبوب رد الفعل (انظر جدول المواد). أعاده التعليق الخرز المغناطيسي (انظر جدول المواد) تماما عن طريق vortexing وأضافه 50 μl الخرز إلى رد فعل PCR. اخلط جيدا. احتضان العينة علي خلاط الدورية (انظر جدول المواد) لمده 5 دقائق في درجه حرارة الغرفة (في 15 دوره في الدقيقة).
- تدور بإيجاز أسفل العينة ووضع 1.5 mL أنبوب ميكروالطرد المركزي علي رف المغناطيسي (انظر جدول المواد) إلى بيليه الخرز المغناطيسي. انتظر حتى يتم توضيح ماده طافي تماما قبل المتابعة مع الخطوة التالية.
- يستنشق ماده طافي دون إزعاج بيليه حبه وتجاهل.
- ماصه 200 μL من 70 ٪ الايثانول في أنبوب التفاعل واحتضان لمده 30 ثانيه. يستنشق الايثانول دون إزعاج بيليه وتجاهل. كرر لما مجموعه اثنين من يغسل. تاكد من عدم ترك الايثانول. قد يكون من الضروري ان يستنشق أولا مع ماصه أكبر (علي سبيل المثال ، 1000 μL) ، ومن ثم لأزاله اي قطرات الايثانول المتبقية مع ماصه أصغر (علي سبيل المثال ، 10 μL).
- الهواء--تجفيف بيليه لمده 1 دقيقه في درجه حرارة الغرفة.
- أزاله أنبوب التفاعل من الرف المغناطيسي ، وأعاده تعليق بيليه في 30 μL من المياه الخالية من النيوداز واحتضان لمده 2 دقيقه في درجه حرارة الغرفة.
- وضع أنبوب رد الفعل مره أخرى علي رف المغناطيسي والانتظار حتى الخرز هي تماما التكوير.
- أزاله ماده طافي دون إزعاج بيليه ونقله إلى أنبوب رد فعل جديد 1.5 mL.
-
أضافه محولات الباركود بواسطة PCR المتداخلة
- اعداد 50 μL هبوط PCR مع بدء الساخنة عاليه الدقة الحمض النووي البوليميرات مع العازلة رد فعل 5x والتمهيدي مجموعه 2 (انظر الجدول 1). تتكون الإشعال في هذه المجموعة من منطقه محدده التسلسل الهدف للسماح بربط منتجات PCR التي تم إنشاؤها في الخطوة 3.2 (داخل التمهيدي مجموعه 1 تسلسل) ، فضلا عن تسلسل محول الذي يستخدم كهدف في رد فعل PCR الترميز اللاحق (راجع القسم 4). إذا كان ذلك ممكنا ، واعداد رد فعل علي الجليد أو في كتله بارده 4 درجه مئوية. استخدم 1 μL من المنتج PCR المنقي الذي تم اعداده في القسم 3.2 كقالب.
- احتضان مزيج رد الفعل في ثيرموسيكلير باستخدام خطوه التشبع الاوليه من 30 ق في 98 درجه مئوية ، تليها 10 دورات مع التشبع في 98 درجه مئوية ل 10 ثانيه ، الصلب التمهيدي ل 20 s في 65 درجه مئوية ، وخفض درجه الحرارة بنسبه 0.5 درجه مئوية لكل دوره ، واستطاله لمده 1 دقيقه في 72 درجه مئوية. في وقت لاحق ، احتضان رد فعل لدورات 30 اضافيه ل 10 ليالي في 98 درجه مئوية ، 20 ق في 71 درجه مئوية ، و 1 دقيقه في 72 درجه مئوية ، تليها خطوه استطاله النهائي من 5 دقيقه في 72 درجه مئوية.
- تنظيف المنتج PCR باستخدام الخرز المغناطيسي كما هو موضح في القسم 3.2.
4. الترميز من الرموز NPC1
- لكل منتج PCR التي تم إنشاؤها في القسم 3 ، اعداد رد فعل PCR الترميز في أنبوب رد فعل 0.2 mL باستخدام 50 μL من الحمض النووي لل الحامض الريبي الثنائية الثانية المزج الرئيسية 2 x (انظر جدول المواد) ، 1 μl من واحد من الإشعال الباركود من مجموعه الترميز PCR (انظر جدول المواد والجدول 2) ، و 1 μl من المنتج PCR المنقي من الخطوة 3-3-2 كقالب. أضافه 47 μL من المياه الحرة النيوداز للحصول علي الحجم النهائي من 100 μL.
- احتضان رد الفعل في ثيرموسيكلير في 95 درجه مئوية لمده 3 دقائق كمسخ الاوليه. وبعد ذلك ، تشغيل 15 دورات ل 15 ق في 95 درجه مئوية ، 15 ق في 62 درجه مئوية ، و 1.5 دقيقه في 65 درجه مئوية. كاستطالة النهائي ، احتضان رد الفعل في 65 درجه مئوية لمده 5 دقائق.
- تنقيه المنتج PCR كما هو موضح تحت 3.2 ، ولكن استخدام 100 μl من الخرز المغناطيسي و الوت في 30 μl من المياه الخالية من النيوداز.
- إذا كان ذلك ممكنا ، قم بقياس العينة باستخدام مقياس طيفي للاشعه فوق البنفسجية.
5. اعداد المكتبة
- الجمع بين كميه متساوية من الحمض النووي المشفر من كل عينه لما مجموعه 1 ميكروغرام من الحمض النووي في حجم 45 μL (إذا لزم الأمر ، أضافه المياه الخالية من النيوداز) في أنبوب رد فعل 0.2 mL. إذا لم يتوفر مقياس طيفي للاشعه فوق البنفسجية ، استخدم كميات متساوية من كل عينه. ل dA-المخلفات ، أضافه 7 μL من نهاية الاعداديه رد فعل العازلة (انظر جدول المواد) ، 3 μl من مزيج انزيم نهاية الاعداديه (انظر جدول المواد) ، و 5 μl من المياه الخالية من النيوداز. اخلطه برفق عن طريق تحريك الأنبوب.
- احتضان رد فعل لمده 5 دقائق في 20 درجه مئوية ، تليها 5 دقائق في 65 درجه مئوية في ثيرموسيكلير.
- تنقيه المنتج رد فعل كما هو موضح في القسم 3.2 ، ولكن استخدام 60 μl من الخرز المغناطيسي و الوت في 25 μl من المياه الخالية من النيوداز.
- اختياري: خذ 1 μl لقياس تركيز العينة باستخدام مقياس طيفي للاشعه فوق البنفسجية. وينبغي ان يكون المبلغ الإجمالي أكثر من 700 نانوغرام.
- الجمع بين 22.5 μl من الحمض النووي المنقي من الخطوة 5.3 مع 2.5 μl من محول 1d2 (انظر جدول المواد) و 25 μl من المزيج الرئيسي الحاد/TA يغاز (انظر جدول المواد) في جديد 1.5 mL الحمض النووي-منخفضه رد فعل ملزمه ، مزيج بلطف عن طريق الوخز ، وتدور لفتره وجيزة اسفل. احتضان لمده 10 دقيقه في درجه حرارة الغرفة.
- تنقيه المنتج رد فعل كما هو موضح في القسم 3.2 ، ولكن استخدام 20 μl من الخرز المغناطيسي ، وزيادة وقت الحضانة لربط الحمض النووي إلى 10 دقيقه ، وأداء خطوتين غسل مع 1 مل من الايثانول لكل منهما ، و الوت في 46 μl من المياه الخالية من النيوداز.
- الجمع بين 45 μl من رد فعل المنتج من الخطوة 5.6 مع 5 μl من مزيج محول الباركود (انظر جدول المواد) و 50 μl من المزيج الرئيسي الحاد/TA يغاز في أنبوب رد فعل ملزم الحمض النووي منخفضه. اخلطيه برفق بالوخز والاحتضان لمده 10 دقائق في درجه حرارة الغرفة.
- تنقيه المنتج رد فعل كما هو موضح في القسم 3.2 ، ولكن استخدام 40 μL من الخرز المغناطيسي ، والقيام اثنين من خطوات الغسيل مع 140 μL من ABB العازلة (انظر جدول المواد) بدلا من الايثانول ، أعاده تعليق الخرز عن طريق الوخز وبيليه علي رف المغناطيسي. Elute في 15 μL من المخزن المؤقت التملص (انظر جدول المواد). زيادة أوقات الحضانة للربط الاولي من الحمض النووي إلى الخرز وكذلك لخطوه التملص إلى 10 دقيقه. تخزين المنتج الناتج علي الجليد أو في 4 درجه مئوية حتى الاستخدام.
6. فحص جوده الخلية تدفق
- قم باجراء فحص الجودة علي خليه التدفق قبل الاستخدام. لهذه الغاية ، قم بتوصيل جهاز التسلسل بالكمبيوتر المضيف وافتح البرنامج.
- ادراج خليه تدفق (انظر جدول المواد) في جهاز التسلسل واختيار نوع الخلية تدفق من مربع محدد وتاكيد بالنقر المتاحة.
- انقر فوق التحقق من خليه التدفق في الجزء السفلي من الشاشة واختيار نوع الخلية تدفق الصحيح.
- انقر فوق بدء الاختبار لبدء فحص الجودة. مطلوب الحد الأدنى من 800 النشطة ثقوب في المجموع للخلية تدفق لتكون قابله للاستخدام.
7. تحميل خليه تدفق وبدء تشغيل التسلسل
- فتح غطاء المنفذ فتيله عن طريق تحريكه في اتجاه عقارب الاتجاه. تعيين ماصه P1000 إلى 200 μL وادراج طرف في منفذ فتيله. اضبط الماصة علي 230 μL مع الحفاظ علي الطرف في المنفذ الفتيلة ، لرسم المخزن المؤقت 20-30 μL وأزاله اي فقاعات الهواء.
- في جديد 1.5 mL الحمض النووي-منخفضه ملزمه رد فعل أنبوب اعداد مزيج فتيله من خلال الجمع بين 576 μL من RBF العازلة (انظر جدول المواد) مع 624 μl من المياه الخالية من النيوداز.
- ماصه بعناية 800 μL من مزيج فتيله المعدة في الميناء فتيله والانتظار 5 دقائق. رفع غطاء المنفذ عينه ، وماصه اضافيه 200 μL من مزيج فتيله المعدة في الميناء فتيله.
- ماصه 35 μL من RBF العازلة في جديده ، نظيفه 1.5 mL الحمض النووي المنخفض ملزم أنبوب رد فعل. مزيج جيدا الخرز ليسانس الحق (انظر جدول المواد) عن طريق التنضيد وأضافه 25.5 μl من الخرز إلى المخزن المؤقت rbf. أضافه 2.5 μL المياه الخالية من النيوداز و 12 μL من مكتبه الحمض النووي من الخطوة 5.8 وتخلط بواسطة الأنابيب.
- أضافه 75 μL من الخليط العينة في الأزياء قطره بطيئه إلى الخلية تدفق عبر منفذ العينة.
- استبدل غطاء المنفذ النموذجي ، واغلق المنفذ الفتيلة ، واغلق غطاء جهاز التسلسل.
- ضمن البرنامج ، تاكد من ان الخلية التدفق لا تزال متاحه ، وفتح تجربه جديده ، واعداد معلمات التشغيل عن طريق تحديد مجموعه المستخدمة. حدد الاتصال المباشر بالقاعدة. بدء تشغيل التسلسل بالنقر فوق بدء التجربة. استمر في تشغيل التسلسل حتى يتم جمع بيانات تجريبية كافيه.
النتائج
في تجربه تمثيليه لاختبار البروتوكول المعروض قمنا باستخراج الحمض الريبي النيبالي من 10 عينات دم مختلفه من خمسه أنواع الحيوانية (اي, 2 الافراد لكل نوع (الماعز, خروف, الخنازير, الكلبة, الماشية)) (الجدول 3). يمكن ان تختلف غله الحمض الريبي النيبالي والجودة التالية الاستخراج علي نطاق واسع ، وخاصه بسبب الاختلافات في معالجه العينات والتخزين. في تجربتنا التمثيلية ، لاحظنا تركيزات RNA بين 43 نانوغرام و 543 نانوغرام لكل μL (الجدول 3). أيضا, بعد التضخيم من قبل RT-PCR, تحليل هلام من PCR-1 وأظهرت المنتجات النتائج المختلفة (الشكل 2), مع عصابات أضعف بصوره ملحوظة لعينات BC01 و BC02 (كل من الماعز). وكانت هذه الاختلافات علي الأرجح بسبب الاختلافات في نوعيه العينة ، علي الرغم من ان الاختلافات في فعاليه PCR بسبب الاختلافات في الربط التمهيدي لجين NPC1 من الأنواع المختلفة لا يمكن استبعادها. غير ان هذه الاختلافات في كفاءه الغلة و/أو التضخيم لم تؤثر تاثيرا ملحوظا علي نتائج التسلسل العام. وعلاوة علي ذلك ، حدث منتج إضافي غير محدد من طراز PCR في عينه BC10 (الماشية). وخلافا للتسلسل Sanger ، فان هذه المنتجات غير المحددة لا تؤثر سلبا علي نتائج التسلسل النانو ، حيث يتم تجاهل هذه القراءات اثناء تعيين القراءات التي تم الحصول عليها إلى تسلسل مرجعي كجزء من تحليل البيانات.
قبل كل تشغيل التسلسل ، ينصح بشده فحص جوده الخلية تدفق لاستخدامها ، مع متطلبات الحد الأدنى من 800 المسام الاجماليه. في تجربتنا التمثيلية ، عاد هذا الاختيار الجودة 1,102 المسام المتاحة للتسلسل. وبما ان البيانات تقدم في الوقت الحقيقي ويمكن تحليلها علي الفور ، يمكن تعديل طول التسلسل الزمني للتطبيق الفردي (اي حتى يتم إنتاج بيانات تسلسل كافيه للتحليل المطلوب). في تجاربنا ، يتم تنفيذ تسلسل تشغيل عاده بين عشيه وضحيها ، وفي حاله تجربتنا التمثيلية حصلنا علي ما يقرب من 1,400,000 يقرا خلال هذا الشوط 14 ح.
اعتمادا علي نوع تحليل البيانات الذي سيتم تنفيذه ، يمكن ان يكون من المستحسن معالجه مجموعه فرعيه فقط من القراءات التي تم الحصول عليها. وفي حاله تجربتنا التمثيلية ، اختيرت مجموعه فرعيه من 10,000 قراءه لمزيد من التحليل. ولهذه الغاية ، تمت معالجه الملفات fastq التي تم إنشاؤها اثناء تشغيل التسلسل في بيئة اوبونتو 18.04 لتر ، و فكك باستخدام عصب v 3.0.3 مع المعلمات الأمثل لأزاله الترسبات من نانو تسلسل البيانات (الباركود-الذيل-طول 300 ، الباركود-خطا معدل 0.2 ، الباركود-الفجوة-عقوبة-1)12. بعد أزاله الترسبات ، يمكن القيام بقراءه الخرائط وإنشاء توافق الآراء باستخدام عدد من الاداات المختلفة ، ولكن مناقشه مفصله للجانب المعلوماتي الحيوي للتسلسل نانو يتجاوز نطاق هذه المخطوطة. ومع ذلك ، في حاله النتائج التمثيلية لدينا ، قراءه التعيين إلى تسلسل مرجعي تم تنفيذها باستخدام Geneious 10.2.3. من 10,000 يقرا تحليلها ، 5,457 أظهرت طولا بين 1,750 و 2,000 النيوبوتيديس ، الذي يطابق الاحجام المتوقعة لشظايا PCR تضخيمها كجزء من سير العمل لدينا (1,769 nt ، الشكل 3). لوحظت ذروه اضافيه في توزيع الطول من القراءات بين 250 إلى 500 النيوبوتيدس ، والتي يمكن ان تعزي إلى منتجات PCR غير محدده. سمح [ديدولتيبليكينغ] من يقرا التعيين من 87.6% من اليقرا إلى واحده من ال 10 الباركود/عينات يحلل (شكل 4). وتراوحت نسبه القراءات بالنسبة لكل الباركود من 3.4 ٪ للباركود 1 إلى 16.9 ٪ للباركود 10 ؛ ومع ذلك ، نظرا للعدد الكبير الإجمالي من يقرا هذا لا يزال يسمح توافق الآراء ذات مغزى يدعو مع عمق قراءه عاليه حتى بالنسبة لهذه مجموعات البيانات الباركود اقل وفره. وفي الواقع ، ادي تعيين القراءات المفروزة إلى تسلسل مرجعي من NPC1 إلى ما بين 31.7% (الباركود 2) و 100% (الباركود 7 و 8) من قراءه الخرائط إلى المرجع ، مما يعطي عمق قراءه أكثر من 90 يقرا في اي موضع لكل عينه. ثم يكون هذا أكثر من كافيه للسماح ثقة بتوافق الآراء قاعده الاتصال مع معدل خطا لا يستهان بها.
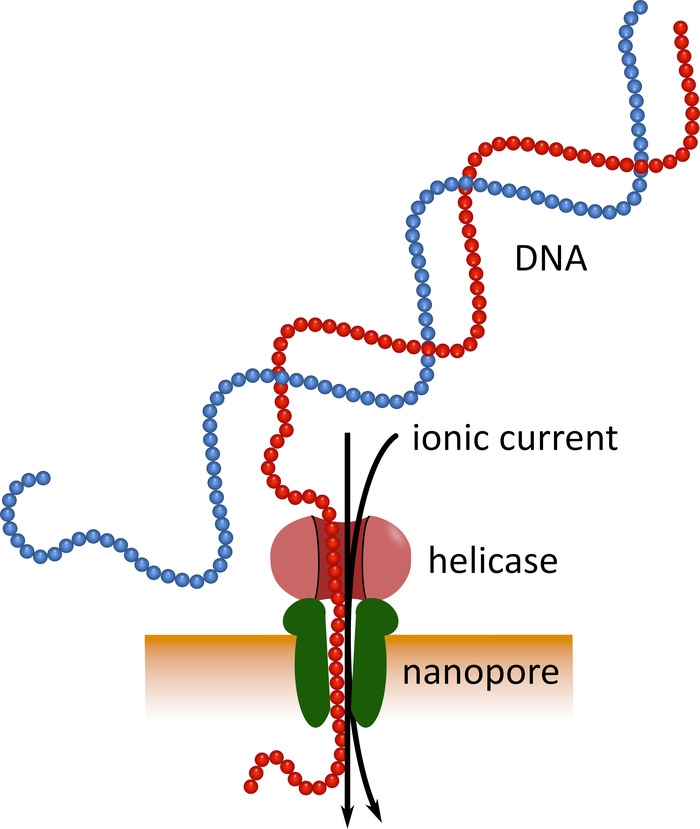
الشكل 1: التمثيل التخطيطي لتسلسل الحمض النووي باستخدام تكنولوجيا نانو. جزيء الحمض النووي الوحيد الذي تقطعت به السبل يمر عبر نانو جزءا لا يتجزا من غشاء مقاوم للكهرباء ، مع الحلزونية التي تنظم سرعه الانتقال. يمر التيار الأيوني في نفس الوقت عبر المسام ويقاس باستمرار. يتم الكشف عن التحويرات الحالية الناجمة عن النوكليودات الموجودة في المسام والعودة الحسابية مترجمه إلى تسلسل النوكليوتيد من حبلا الحمض النووي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
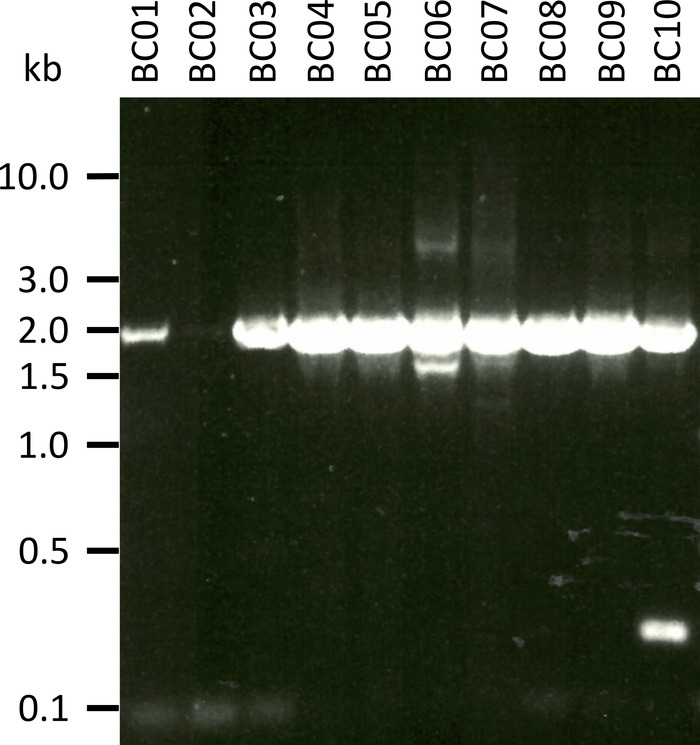
الشكل 2: تضخيم منتجات PCR من نيمان-بيك C1 من mRNA. تم عزل mRNA من الماعز (BC01 و 02) ، والأغنام (BC03 و 04) ، والخنازير (BC05 و 06) ، والكلبة (BC07 و 08) ، والماشية (BC09 و 10). تم فصل المنتجات PCR المتداخلة في هلام 0.8 ٪ الاغاروز في المخزن المؤقت تاي 1x (أعدت من 50x تاي العازلة: 242.28 غرام من قاعده تريس ، 57.1 ml من حمض الخليك الجليدية ، 100 مل من 0.5 م أدتا ، dH2O إلى 1 لتر ، وتعديل درجه الحموضة إلى 8.0) ل 45 دقيقه في 100 V وملطخه سايبر الأمن. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
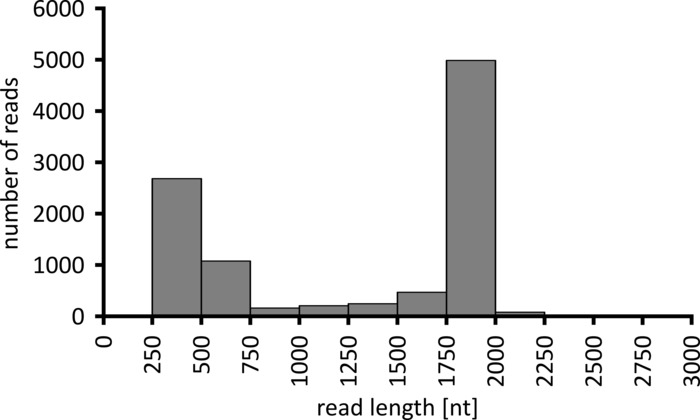
الشكل 3: التوزيع المقروء ل10,000 يقرا من التجربة التمثيلية. يتم الاشاره إلى عدد القراءات التي تم الحصول عليها والتي لها فتره طول معينه للقراءة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
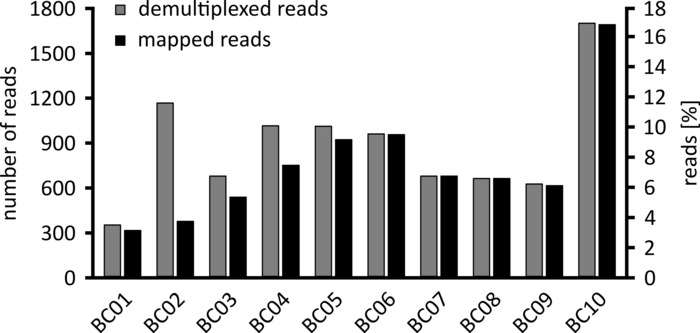
الشكل 4: توزيع القراءة بعد أزاله الترسبات. يتم عرض العدد والنسبة المئوية للقراءة (الرمادي) والقراءات المعينة (الأسود) لكل رمز شريطي. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الجدول 1: نظره عامه علي مجموعات التمهيدي المستخدمة. تم اجراء التضخيم الاولي للتسلسل المستهدف مع مجموعه التمهيدي 1. ثم تم استخدام مجموعه التمهيدي 2 لتضخيم المتداخلة وأضافه محول. يتم الاشاره إلى المحولات باللون الأحمر. الرجاء الضغط هنا لتحميل هذا الملف.
الجدول 2: نظره عامه علي تسلسل الباركود. واستخدمت الباركود الفردية لتحديد كل عينه متسلسلة. الرجاء الضغط هنا لتحميل هذا الملف.
الجدول 3: التركيزات التي تم الحصول عليها بعد استخراج عينات من الدم متسلسلة في التجربة التمثيلية. وتظهر تركيزات الحمض الريبي النيبالي لفردين من كل من الأنواع الخمسة ، ويشار إلى نسب الكثافة البصرية عند 260/280 نانومتر و 260/230 نانومتر. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
وعلي مدي العقدين الماضيين ، أصبح تسلسل العينات البيولوجية جانبا متزايد الاهميه من جوانب الدراسات في طائفه واسعه من مجالات المواضيع. وقد زاد تطوير نظم التسلسل من الجيل الثاني علي أساس تسلسل مجموعه كثيفه من ميزات الحمض النووي باستخدام دورات تكراريه من التلاعب الانزيمي والحصول علي البيانات المستندة إلى صوره1 زيادة كبيره في الانتاجيه مقارنه مع تقنيه التسلسل Sanger التقليدية ، ويسمح تحليل عينات متعددة فضلا عن مختلف أنواع الأحماض النووية في عينه معينه في التوازي4. ومع ذلك ، بالنسبة لمعظم أنظمه الجيل الثاني الشائعة الاستخدام ، يتم إنتاج القراءات القصيرة فقط ، وتعتمد كل الانظمه الاساسيه علي المعدات الحساسة والضخمة والمكلفة3،4.
وعلي النقيض من الجيل الثاني من منصات التسلسل ، فان جهاز التسلسل المستخدم في هذا البروتوكول يستند إلى التكنولوجيا النانوه. هنا جزيء الحمض النووي الوحيد الذي تقطعت به السبل يمر من خلال نانو ، مما ادي إلى تشكيل التيار الايونيه التي تتدفق أيضا من خلال نفس النانو ، والتي يمكن قياسها والعودة-ترجمت إلى استنتاج تسلسل جزيء الحمض النووي. ويضفي هذا النهج التسلسلي من الجيل الثالث عددا من المزايا علي النهج الأخرى. المزايا الرئيسية التي ترتبط مباشره بمبدا العمل الفريد لهذه التكنولوجيا هي طول القراءة طويلة جدا المنتجة (قراءه أطوال تصل إلى 8.8 x 105 وقد تم الإبلاغ عن النيوتيودس6) ، والقدرة علي تسلسل ليس فقط الحمض النووي ولكن أيضا [رنا] مباشره, اي كان مؤخرا برهنت ل [إنفلونزا] كامله مورثه17, والقدرة ان يحلل معطيات في [رل-تيم] بما ان هم يكون خلقت, اي يسمح [متاجينميميكس] سريعة اكتشاف الجراثيم ضمن دقائق18. المزايا العملية الاضافيه هي الحجم الصغير للغاية لجهاز التسلسل النانو ، مما يسمح باستخدامه في اي مختبر أو في البعثات الميدانية إلى المواقع النائية19،20، وانخفاض السعر بالمقارنة مع التسلسل الأخرى منصات. من حيث التكاليف الجارية ، مطلوب حاليا خليه تدفق جديده لكل تشغيل التسلسل ، مما يؤدي إلى تكاليف حوالي $1,100 لكل تشغيل للخلية تدفق والمكتبة اعداد الكواشف. ويمكن تخفيض هذه التكاليف في بعض الحالات عن طريق غسل وأعاده استخدام خليه التدفق ، أو عن طريق الترميز والتسلسل عينات متعددة في تشغيل واحد. أيضا ، يتم حاليا اختبار نوع جديد من خليه التدفق بواسطة عدد قليل من المختبرات ، والتي سوف تتطلب استخدام محول خليه تدفق (يسمي "flongle") ، وينبغي ان تقلل بشكل كبير من تدفق الخلية السعر التالي تشغيل التكاليف.
يبقي القصور رئيسيه من نانو تسلسل دقته, مع وحيد يقرا دقه في المدى من 83 إلى 86% يكون يفاد6,21,22, وكثير من الأخطاء يكون سببت بإدماج/حذف ( [ايندولس])5,21. ومع ذلك ، فان عمق القراءة العالية يمكن ان يعوض عن هذه الأخطاء ، واقترحت دراسة حديثه استنادا إلى الاعتبارات النظرية ان عمق القراءة من > 10 قد يزيد من الدقة العامة إلى > 99.8 ٪21. ومع ذلك ، ستكون هناك حاجه إلى مزيد من التحسينات في الدقة ، لا سيما إذا كان من المقرر اجراء التحليل علي مستوي جزيء واحد بدلا من التوصل إلى مستوي تسلسل توافقي. استخدام تكنولوجيا 1D2 كما هو موضح في هذا البروتوكول ، والذي يستند إلى أضافه 1d2 ومحولات الباركود (راجع القسم 5.5) التي تؤدي إلى كل من خيوط جزيء DNA واحد يجري تسلسلها من قبل نفس النانو ، والزيادات قراءه دقه لأنه يمكن استخدام المعلومات من كلا خيوط الحمض النووي لتحديد تسلسل. وعلاوة علي ذلك ، فان استراتيجية الحل البديل التي يمكن متابعتها من أجل الجمع بين مزايا التسلسل النانو (ولا سيما طول القراءة الطويل) مع الدقة العالية لتقنيات التسلسل الأخرى هي استخدام معلومات التسلسل النانو كسقالة ، وهو ثم مصقول باستخدام تسلسل البيانات من منصات أخرى6.
العامل الأكثر اهميه لنجاح البروتوكول المعروض هنا هو نوعيه العينة ، ولا سيما كميه ونوعيه الحمض الريبي المستخرج. التخزين السليم والاستخراج الفوري للمساعدة RNA في تحقيق العائد RNA كافيه. استخدام أنابيب جمع الدم المناسب يسمح لتخزين عينات الدم لمده تصل إلى شهر واحد ، ولكن تخثر الدم يمكن ان يكون مشكله ، وخاصه عندما يتم تخزين عينات في درجات حرارة مرتفعه ، والتي يمكن ان تكون الحالة في ظل ظروف الميدان. والخطوة الحاسمة الثانية هي تضخيم تسلسل الأهداف ، وخاصه في ظل الظروف الميدانية تفاعلات PCR غالبا ما تؤدي اقل بكثير من الظروف المختبرية القياسية7. ولتحقيق هذه الغاية ، فان التصميم التمهيدي الدقيق والتحسين أمر بالغ الاهميه للوصول إلى تضخيم قوي. بالاضافه إلى ذلك ، النهج pcr المتداخلة وهبوط pcr ، كما هو مستخدم في هذا البروتوكول ، يمكن ان تزيد كل من الخصوصية والحساسية لتضخيم الجينات المستهدفة4،7. والواقع ان تجربتنا في ليبريا وغينيا مع هذه التكنولوجيا المتداخلة كانت مطلوبه في الظروف الميدانية بعينات ميدانيه حتى بالنسبة لمجموعات التمهيدي التي سمحت بتضخيم الأهداف من العينات المختبرية وفي ظل الظروف المختبرية مع جولة واحده من PCR (7 والنتائج غير المنشورة).
وعلي النقيض من هذه الخطوات الأكثر اهميه ، فان اعداد المكتبة والتسلسل في حد ذاتهما إجراءات قويه إلى حد ما. غير انه في ظل الظروف الميدانية ، يمكن ان تكون المسائل العملية مثل توافر قطع معينه من المعدات مشكله. فعلي سبيل المثال ، هناك حاجه إلى مقياس طيفي للاشعه فوق البنفسجية لتحديد تركيزات الحمض النووي قبل اعداد المكتبة للعينات المشفرة. ومع ذلك ، إذا كان مثل هذا الجهاز لا تكون متاحه في ظل الظروف الميدانية ، يمكن ببساطه الجمع بين كميه متساوية من كل عينه لتشكل 45 μL المطلوبة لاعداد المكتبة ، مع الاختلافات في عينه مواد الإدخال ثم يجري التخفيف عاده من قبل كبير عدد القراءات. المثل ، فان الحاجة إلى الاتصال بالإنترنت لتشغيل التسلسل يمكن ان تكون مشكله ، علي الرغم من انه لم يعد من الضروري القيام بالاتصال الأساسي علي الإنترنت ولكن يمكن ان يتم ذلك محليا ؛ ومع ذلك ، يمكن أزاله هذه الضرورة تحت ظروف معينه من قبل الشركة المصنعة إذا لزم الأمر.
وباختصار ، يتيح البروتوكول المعروض تسلسلا منخفض التكلفة نسبيا في المواقع التي لا يمكنها الوصول إلى معدات التسلسل التقليدية ، بما في ذلك في المواقع النائية. هو يستطيع بسهوله كنت كيفت إلى اي هدف [رنا] أو [دنا], لذلك يسمح باحثات ان يجيب يتعدد اسئله احيائيه.
Disclosures
TH شارك في برنامج الوصول المبكر نانو تقنيات أكسفورد (ONT) العميل من 2014 إلى 2015 ، وتلقي أجهزه العميل وتدفق الخلايا لدراسة سابقه 7 التي تقوم بها المعاهد الوطنية للصحة ، الولايات الامريكيه ، مجانا أو بتكاليف مخفضه . وقد دعي من قبل ONT لتقديم جزء من هذا العمل في لندن الدعوة 2015 الاجتماع في لندن, المملكة العربية البريطانية, و ONT سيولي للنقل والاقامه. النسبة للعمل المعروض في هذه المخطوطة ، لم يتم الحصول علي اي فوائد (مثل الاجهزه أو الكواشف بتكلفه مخفضه ، وتكاليف السفر ، وما إلى ذلك) من ONT. AM ، KF و RS ليس لديهم اي شيء للكشف عن.
Acknowledgements
ويشكر المؤلفان اليسون غروسيث علي القراءة الناقدة للمخطوطة. وقد حظي هذا العمل بدعم مالي من الوزارة الاتحادية المانيه للاغذيه والزراعة استنادا إلى قرار اتخذه برلمان جمهوريه ألمانيا الاتحادية عن طريق المكتب الاتحادي للزراعة والاغذيه.
Materials
| Name | Company | Catalog Number | Comments |
| 1D2 adapter, barcode adapter mix, ABB buffer, elution buffer, RBF buffer, LBB beads | Oxford Nanopore Technologies | SQK-LSK308 | 1D² Sequencing Kit |
| Blood collection tube with DNA/RNA stabilizing reagent | Zymo Research | R1150 | DNA/RNA Shield - Blood Collection Tube |
| Blunt/TA ligase master mix | New England Biolabs | M0367S | Blunt/TA Ligase Master Mix |
| DNA-low binding reaction tube | Eppendorf | 30108051 | DNA LoBind Tube |
| DNase buffer and DNase | ThermoFisher Scientific | 11766050 | SuperScript™ IV VILO™ Master Mix with ezDNase™ Enzyme |
| Flow cell | Oxford Nanopore Technologies | FLO-MIN105.24 | flow cell R9.4 |
| Hot start high fidelity DNA polymerase | New England Biolabs | M0493L | Q5 Hot Start High-Fidelity DNA Polymerase (500 U) |
| Magnetic beads | Beckman Coulter | A63881 | Agencourt AMPure XP beads |
| Magnetic rack | ThermoFisher Scientific | 12321D | DynaMag-2 Magnet |
| Nanopore sequencing device | Oxford Nanopore Technologies | - | MinION Mk 1B |
| PCR barcoding kit | Oxford Nanopore Technologies | EXP-PBC001 | PCR Barcoding Kit I (R9) |
| Reverse transcriptase master mix | ThermoFisher Scientific | 11766050 | SuperScript™ IV VILO™ Master Mix with ezDNase™ Enzyme |
| RNA purification spin column, DNA/RNA prep buffer, DNA/RNA wash buffer, DNase I, DNA digestion buffer | Zymo Research | R1151 | Quick-DNA/RNA Blood Tube Kit |
| Rotating mixer | ThermoFisher Scientific | 15920D | HulaMixer Sample Mixer |
| Taq DNA polymerase | New England Biolabs | M0287S | LongAmp Taq 2x Master Mix |
| Ultra II End-prep kit | New England Biolabs | E7546S | NEBNext Ultra II End-Repair/dA-tailing Modul |
| UV spectrophotometer | Implen | - | NanoPhotometer |
| Vacuum manifold | Zymo Research | S7000 | EZ-Vac Vacuum Manifold |
References
- Shendure, J., Ji, H. Next-generation DNA sequencing. Nature Biotechnology. 26 (10), 1135-1145 (2008).
- Shendure, J., Lieberman Aiden, E. The expanding scope of DNA sequencing. Nature Biotechnology. 30 (11), 1084-1094 (2012).
- Liu, L., et al. Comparison of next-generation sequencing systems. Journal of Biomedicine and Biotechnology. 2012, 251364 (2012).
- Levy, S. E., Myers, R. M. Advancements in Next-Generation Sequencing. Annual Review of Genomics and Human Genetics. 17, 95-115 (2016).
- Lu, H., Giordano, F., Ning, Z. Oxford Nanopore MinION Sequencing and Genome Assembly. Genomics, Proteomics & Bioinformatics. 14 (5), 265-279 (2016).
- Jain, M., et al. Nanopore sequencing and assembly of a human genome with ultra-long reads. Nature Biotechnology. 36 (4), 338-345 (2018).
- Hoenen, T., et al. Nanopore Sequencing as a Rapidly Deployable Ebola Outbreak Tool. Emerging Infectious Diseases. 22 (2), 331-334 (2016).
- Quick, J., et al. Real-time, portable genome sequencing for Ebola surveillance. Nature. 530 (7589), 228-232 (2016).
- Carette, J. E., et al. Ebola virus entry requires the cholesterol transporter Niemann-Pick C1. Nature. 477 (7364), 340-343 (2011).
- Ndungo, E., et al. A Single Residue in Ebola Virus Receptor NPC1 Influences Cellular Host Range in Reptiles. mSphere. 1 (2), (2016).
- Martin, S., et al. A genome-wide siRNA screen identifies a druggable host pathway essential for the Ebola virus life cycle. Genome Medicine. 10 (1), 58 (2018).
- Roehr, J. T., Dieterich, C., Reinert, K. Flexbar 3.0 - SIMD and multicore parallelization. Bioinformatics. 33 (18), 2941-2942 (2017).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Kielbasa, S. M., Wan, R., Sato, K., Horton, P., Frith, M. C. Adaptive seeds tame genomic sequence comparison. Genome Research. 21 (3), 487-493 (2011).
- Don, R. H., Cox, P. T., Wainwright, B. J., Baker, K., Mattick, J. S. Touchdown' PCR to circumvent spurious priming during gene amplification. Nucleic Acids Research. 19 (14), 4008 (1991).
- Korbie, D. J., Mattick, J. S. Touchdown PCR for increased specificity and sensitivity in PCR amplification. Nature Protocols. 3 (9), 1452-1456 (2008).
- Keller, M. W., et al. Direct RNA Sequencing of the Coding Complete Influenza A Virus Genome. Scientific Reports. 8 (1), 14408 (2018).
- Greninger, A. L., et al. Rapid metagenomic identification of viral pathogens in clinical samples by real-time nanopore sequencing analysis. Genome Medicine. 7, 99 (2015).
- Castro-Wallace, S. L., et al. Nanopore DNA Sequencing and Genome Assembly on the International Space Station. Scientific Reports. 7 (1), 18022 (2017).
- Goordial, J., et al. In Situ Field Sequencing and Life Detection in Remote (79 degrees 26'N) Canadian High Arctic Permafrost Ice Wedge Microbial Communities. Frontiers in Microbiology. 8, 2594 (2017).
- Runtuwene, L. R., et al. Nanopore sequencing of drug-resistance-associated genes in malaria parasites, Plasmodium falciparum. Scientific Reports. 8 (1), 8286 (2018).
- Rang, F. J., Kloosterman, W. P., de Ridder, J. From squiggle to basepair: computational approaches for improving nanopore sequencing read accuracy. Genome Biology. 19 (1), 90 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved