Method Article
나노 포어 시퀀싱을 사용 하 여 전 혈에서 mRNA의 시퀀싱
요약
나노 기 공 시퀀싱은 원격 지에서 비용 효과적인 시퀀싱을 허용 하는 새로운 기술 이며 리소스 부족 설정입니다. 여기서, 우리는 이러한 조건과 호환 되는 전 혈에서 mRNAs의 시퀀싱을 위한 프로토콜을 제시 한다.
초록
원격 위치에서 시퀀싱 하 고 리소스가 부족 한 설정은 고유한 문제를 나타냅니다. 나노 기 공 시퀀싱은 이러한 조건 하에서 성공적으로 사용 될 수 있으며, 최근의 에볼라 바이러스 전염병 기간 동안 서 아프리카에 전개 되어이 가능성을 강조 하 고 있다. 실용적인 장점 (저비용, 장비 운송 및 사용 용이성) 외에도이 기술은 2 세대 시퀀싱 접근법, 특히 매우 긴 판독 길이, 직접 시퀀스 기능에 비해 근본적인 이점을 제공 합니다. 데이터의 실시간 가용성을 제공 합니다. 원시 판독 정확도는이 기술의 주요 한계를 나타내는 다른 시퀀싱 플랫폼 보다 낮습니다. 그러나,이는 높은 판독 깊이 생성에 의해 부분적으로 완화 될 수 있다. 여기서는에 볼 라 바이러스를 위한 세포 수용 체 인 니에만 픽 C1에 대 한 mRNAs 인코딩의 시퀀싱을 위한 필드 호환 프로토콜을 제시 합니다. 이 프로토콜은 동물 혈액 샘플 로부터 RNA의 추출을 포괄 하 고, 표적 농축, 바 코딩, 라이브러리 준비 및 시퀀싱 실행 자체에 대 한 RT-PCR에 이어서, 다른 DNA 또는 RNA 표적과 함께 사용 하기에 용이 하 게 적응 될 수 있다.
서문
시퀀싱은 생물학 및 생물 의학 연구에서 강력 하 고 중요 한 도구입니다. 게놈, 유전적 변이 및 RNA 발현 프로필의 분석을 가능 하 게 하 고, 따라서 인간 및 동물 질병 모두1,2의 조사에 중요 한 역할을 한다. 생거 염기 서 열 분석은 DNA 시퀀싱에 사용할 수 있는 가장 오래 된 방법 중 하나로, 지금도 일상적으로 사용 되 고 있으며, 분자 생물학의 코너 석입니다. 지난 50 년 동안이 기술은 1000 nt 이상의 읽기 길이와 99.999%1의 높은 정확도를 달성 하도록 개선 되었습니다. 그러나 생어 시퀀싱에도 한계가 있습니다. 이 방법으로 더 큰 샘플 세트 또는 전체 게놈의 분석을 시퀀싱 하는 것은 시간 소모적이 고 비용이 많이 드는1,3입니다. 454 고온 시퀀싱 및 일 루미나 기술과 같은 2 세대 (차세대) DNA 시퀀싱 방법은 지난 10 년간 시퀀싱에 필요한 비용과 작업 부하를 크게 줄일 수 있게 해 주며, 엄청난 증가를 초래 했습니다. 생물학적 서 열 정보의 양은 사용 가능한4. 그럼에도 불구 하 고, 이러한 2 세대 기술을 사용 하 여 실행 하는 개별 시퀀싱은 비싸고, 필드 조건 하에서의 시퀀싱은 부피가 크고 깨지기 쉬운 (생거 시퀀싱 장치와 유사) 하는 것이 어렵고, 종종 특수 교육을 받은 담당자가 교정 및 서비스를 받을 수 있습니다. 또한, 많은 2 세대 기술에 대 한 읽기-길이 오히려 제한, 종종 이러한 데이터의 다운스트림 생물 정보학 분석 하 게.
포켓 크기의 나노 포어 서 열 분석 장치를 사용한 3 세대 시퀀싱 ( 재료 표참조)은 이러한 확립 된 시퀀싱 플랫폼의 대 안으로 작용할 수 있습니다. 이 장치에서 단일 가닥 DNA 또는 RNA 분자는 센서에 의해 측정 되는 이온 전류로 동시에 나노 기공을 통과 합니다 (그림 1). 스트랜드가 나노 기공을 통과 함에 따라, 임의의 주어진 시간에 기 공 내에 존재 하는 뉴클레오티드에 의해 전류의 변조는 검출 되 고, 계산 된 역-뉴클레오티드 서 열5로 변환 된다. 이러한 작동 원리 때문에, 나노 포어 시퀀싱은 매우 긴 판독의 생성 (1 x 106 뉴클레오티드에 근접) 및실시간으로 시퀀싱 데이터의 분석을 모두 가능 하 게 한다. 바 코딩은 샘플의 핵 산에 정의 된 뉴클레오티드 서 열을 부착 하 여 단일 시퀀싱 실행에서 여러 샘플을 분석 할 수 있으므로 샘플 처리량을 증가 시키고 샘플 비용을 낮추는 것이 가능 합니다. 높은 휴대성과 사용 편의성으로 인해, 서 아프리카의 최근 에볼라 바이러스 질환에서 유행 하는이 분야에서 나노 포어 시퀀싱 장치가 성공적으로 사용 되어 원격 지역에 신속 하 게 배포할 수 있는 적합성을 강조 하 고 있습니다.7 , 8.
여기서, 우리는이 볼 라 바이러스와 같은 필로 바이러스에 대 한 오 니만 (NPC1) 단백질에 대 한이의 의무 항목 수용 체로 서,이를 위한 mRNA 엔코딩의 시퀀싱을 위한 상세한 필드 호환 프로토콜을 기술 하 고, 종 감수 성을 제한 하는 것으로 나타났다 이 바이러스는9,10. 이 프로토콜은 혈액 샘플에서 전체 RNA의 추출, RT-PCR에의 한 NPC1 mRNA의 특정 증폭, 샘플의 바 코딩, 라이브러리 준비 및 나노 포어 시퀀싱 장치를 사용한 시퀀싱을 포괄 합니다. 데이터 분석은 공간 제한으로 인해 논의 될 수 없지만, 일부 기본 방향은 대표적인 결과에 제공 됩니다. 그러나, 관심 있는 독자는 우리가 사용 하는 워크플로우에 대 한 보다 상세한 설명과 더불어,12,13,14 등의 자세한 정보를 위한 출판물에 대해서는 이전 출판11 을 참조 한다. 이 워크플로에 사용 된 분석 도구에 대 한 것입니다.
프로토콜
Njala 대학 기관 심사 위원회 (NUIRB) 프로토콜에 따라 샘플을 수집 하였다. IRB00008861/FWA00018924.
1. 혈액 샘플에서 RNA 추출
- 수 종 으로부터 3 mL의 전 혈을 모아서 DNA/RNA 안정화 시 약 6ml로 미리 채워진 혈액 채취 관으로 분석 하 고 ( 재료 표참조) 5 회 반전 시켜 섞어 줍니다. 4°c에서 1 개월까지 혈액 샘플을 보관 하십시오.
- 혈액 수집 튜브의 내용물을 50 mL 수집 튜브에 넣고, 프로 테이 나 제 K의 120 µ를 추가 하 고, 5 초 동안 볼 텍 싱에 의해 혼합 하 여 시료를 실 온에서 30 분 동안 배양 합니다.
- 5 초 동안 혼합물과 소용돌이에 9 mL의이 소 프로 판 올을 추가 하십시오.
- RNA 정제 스핀 칼럼 ( 재료 표참조) 위에 저장 고를 놓고 진공 매니폴드에 조립 합니다 ( 재질 표참조). 샘플 혼합물을 저장소에 추가 합니다. 모든 액체가 열을 통과할 때까지 진공을 적용 하십시오.
- 대안적으로, 진공 매니폴드를 사용할 수 없는 경우, 혈액은 원심 분리 단계 사이에서 폐기 된 흐름을 통해 12000 x g 에서 30 초 동안 반복 원심 분리 하 여 700 µ l 부분에서 칼럼을 통과할 수 있다. 그러나, 이것은 대략 26의 원심 분리 단계가 필요 합니다.
- RNA 정제 스핀 컬럼을 수집 튜브에 넣고 400 µ L DNA/RNA 준비 완충 액을 추가 하십시오 ( 재료 표참조). 30 초 동안 12000 x g 에서 원심 분리기를 통과 하 여 흐름을 제거 합니다.
- 400 µ L의 DNA/RNA 세척 완충 액 ( 재료 표참조)을 열에 추가 하 고 30 초 동안 12000 x g 에서 원심 분리기를 제거 하 고 흐름 통과를 버립니다.
- 75 µ L의 DNA 분해 완충 액 (재료 표 참조)을 사용 하 여 dnase I (1u/µ) 5 µ를 혼합 하 고 열에 혼합물을 추가 합니다. 실 온에서 15 분 동안 배양 합니다.
- 400 µ L의 DNA/RNA 준비 완충 액을 컬럼에 넣고 30 초 동안 12000 x g 에서 원심 분리기를 추가 합니다. 흐름을 무시 합니다.
- 700 µ L의 DNA/RNA 세척 완충 액으로 칼럼을 씻고 30 초 동안 12000 x g 에서 원심 분리기로 세척 합니다. 흐름을 무시 합니다.
- 1.9 단계를 반복 하 여 400 µ L의 DNA/RNA 세척 완충 액 및 원심 분리기를 2 분간 12000 x g 에서 모든 잔류 세척 완충 액을 제거 하 고 열을 건조 시켰다. 수집 튜브에서 컬럼을 제거 하는 경우, 컬럼 밑면을 수집 튜브의 버퍼와 함께 적시 지 않도록 하십시오.
-
새로운 1.5 mL 마이크로 원심 분리기 튜브에 컬럼을 넣고 뉴 클레 아 제 없는 물에 70 µ L을 추가 하십시오. 상 온에서 1 분 동안 배양 하 고, 12000 x g에서 30 초 동안 원심 분리기. 추가 사용 (또는 즉시 사용) 할 때까지-80 ° c에서 RNA를 보관 하십시오.
- 선택 사항: RNA를 정량화 하려면 분 취를 취하고 UV 분 광 광도 계 ( 재료 표참조)를 사용 하 여 농도를 결정 합니다.
2. cDNA에 NPC1 mRNA의 역 전사
- 0.2 mL 반응 튜브에 µ L의 템플릿 RNA (1pg ~ 2.5 µ g) 및 1 µ L 각각 10 x DNase 완충 액 및 DNase 효소를 추가 합니다 ( 재료 표참조). 2 분 동안 37 ° c에서 배양 한다. 이어서, 반응을 짧게 원심 분리 하 고 얼음 위에 놓습니다.
- 역방향 역전사 마스터 믹스의 4 µ L을 추가 하 고 ( 재료 표참조) 반응 관에 뉴 클레 아 제를 첨가 하지 않은 물 6 µ l을 넣고 부드럽게 섞어 줍니다. 25°c에서 10 분 동안 (프라이 머 어 닐 링을 위해) 열 사이 클론에서 반응을 배양 하 고, 50 ° c에서 10 분 (RNA의 역전사에 대해)을 수행 하였다. 효소를 비활성화 하려면 85 ° c에서 5 분 동안 배양 하십시오.
- CDNA를 새로운 1.5 mL 마이크로 원심 분리기 튜브로 이송 하 고 추후 사용 (또는 즉시 사용) 할 때까지-80 ° c에서 저장 한다.
3. NPC1 오픈 리딩 프레임의 증폭
-
초기 증폭 단계
- 50 µ l 반응에서 적절 한 반응 완충 액으로 열 개시 고 충실도 DNA 중 합 효소 ( 재료 표참조)를 사용 하 여 NPC1 cDNA를 프라이 머 세트 1과 함께 증폭 하는 터치 다운 PCR15,16 을 설정 1 µ L 템플릿이 있는 볼륨입니다. 가능 하면 얼음 또는 4°c의 멋진 블록에서 반응을 설정 하십시오.
- 98 ° c에서 30 s의 초기 변성 단계를 사용 하 여 서 모 반응 기에서 10 초 동안 98 ° c에서 변성을 갖는 10 사이클, 65 ° c에서 20 초에 대 한 프라이 머 소 둔을 하 고, 주기 당 0.5 ° c로 온도를 낮추고, 72에서 1 분 동안 연신 율을 배양 하였다. 이어서, 98 ° c에서 10 초, 20 초에서 60 ° c로 20 사이클을 추가로 실행 하 고, 72 ° c에서 1 분, 그리고 72 ° c에서 5 분의 최종 연신 율 단계를 수행 하였다.
-
자기 비드를 이용한 PCR 정제
- 전사 50 µ L의 PCR 산물을 1.5 mL DNA-저 결합 반응 관 ( 재료 표참조)에 넣습니다. 볼 텍 싱에의 한 자성 비드 ( 재료 표참조)를 철저히 소생 하 고 PCR 반응에 50 µ l 비드를 첨가 한다. 잘 섞어 주세요. 실 온 (15 rpm)에서 5 분간 회전 믹서에서 샘플을 배양 합니다 ( 재료 표참조).
- 샘플을 짧게 돌리고 마그네틱 비드를 펠 릿으로 1.5 mL 마이크로 원심 분리기 튜브를 자기 랙에 놓습니다 ( 재료 표참조). 다음 단계를 계속 하기 전에 상층 액이 완전히 명확히 될 때까지 기다리십시오.
- 비드 펠 렛을 교란 하지 않고 상층 액을 흡입 하 고 버리십시오.
- 피 펫 200 µ L의 70% 에탄올을 반응 관에 넣고 30 초 동안 배양 하였다. 펠 렛을 교란 하지 않고 에탄올을 흡 미 하 게 하 고 버리십시오. 총 2 개의 세척에 대해 반복 합니다. 에탄올이 남지 않았는지 확인 하십시오. 먼저 더 큰 파이 펫 (예: 1000 µ L)을 사용 하 여 더 작은 파이 펫 (예: 10 µ L)을 사용 하 여 남아 있는 에탄올 방울을 제거 해야 할 수 있습니다.
- 실 온에서 1 분 동안 펠 렛을 공기 건조 시킵니다.
- 마그네틱 랙에서 반응 튜브를 제거 하 고 뉴 클레 아 제 없는 물 30 µ L에 펠 렛을 소생 시킨 후 실 온에서 2 분 동안 배양 한다.
- 반응 튜브를 마그네틱 랙에 다시 놓고 구슬이 완전히 모 깎기 될 때까지 기다리십시오.
- 펠 렛을 방해 하지 않고 상층 액을 제거 하 고 새로운 1.5 mL 반응 튜브로 전달 합니다.
-
중첩 PCR에의 한 바코드 어댑터 추가
- 5 배 반응 완충 액과 프라이 머 세트 2를 사용 하 여 핫 스타트 고 충실도 DNA 중 합 효소로 50 µ L 터치 다운 PCR을 설정 합니다 ( 표 1참조). 이 세트의 프라이 머는 3.2 단계에서 생성 된 PCR 산물의 결합을 허용 하는 표적 서 열 특이 적 영역 (프라이 머 세트 1 서 열의 내부) 뿐만 아니라 후속의 바 코딩 PCR 반응에서 타겟으로 사용 되는 어댑터 서 열로 구성 된다 (섹션 4). 가능 하면 얼음 또는 4°c의 멋진 블록에서 반응을 설정 하십시오. 3.2 절에서 제조한 정제 된 PCR 산물의 1 µ L을 템플릿으로 사용 한다.
- 98 ° c에서 30 s의 초기 변성 단계를 사용 하 여 열 사이 클론에서 반응 혼합물을 배양 하 고, 10 초 동안 98 ° c에서 10 사이클, 프라이 머 소 둔을 하 여 65 ° c에서 20 초 동안 온도를 저하 시켜 주기 당 0.5 ° c , 72 ° c에서 1 분의 연신 율을 갖는다. 이어서, 98 ° c에서 10 초 동안 추가로 30 사이클 동안, 71 ° c에서 20 초 동안, 72 ° c에서 1 분 동안 반응 물을 배양 하 고, 72 ° c에서 5 분의 최종 연신 율 단계를 따른다.
- 3.2 항에 기재 된 바와 같이 자기 비드를 사용 하 여 PCR 산물을 정리 한다.
4. NPC1 앰 플 아이콘의 바 코딩
- 섹션 3에서 생성 된 각각의 PCR 산물에 대해, Taq DNA 중 합 효소 2x 마스터 믹스의 50 µ L을 사용 하 여 0.2 mL 반응 튜브의 바 코딩 PCR 반응을 설정 합니다 ( 재료 표참조), pcr 바 코딩 키트에서 바코드 프라이 머 중 하나의 2 µ l ( 재질 표 참조) c1 > 및 표 2), 3.3.2 단계에서 정제 된 PCR 산물의 1 µ l을 템플릿으로 한다. 47의 µ L을 추가 하 여 100 µ L의 최종 부피를 얻었다.
- 초기 변성으로 3 분 동안 95 ° c에서 열 사이 클론에서 반응을 배양 한다. 이어서, 95 ° c에서 15 초 동안 15 사이클을, 62 ° c에서 15 초, 65 ° c에서 1.5 분을 실행 합니다. 최종 연신 율로 서, 반응을 5 분 동안 65 ° c에서 배양 한다.
- 3.2이 하에 기재 된 PCR 산물을 정제 하 되, µ의 자성 비드와 엘 트를 뉴 클레 아 제 무-자유의 30lµ에 100을 사용 한다.
- 가능 하다 면 UV 분 광 광도 계를 사용 하 여 샘플을 정량화 하십시오.
5. 라이브러리 준비
- 0.2 mL 반응 튜브에 45 µ L (필요한 경우 뉴 클레 아 제를 첨가 하지 않은 물)의 부피에서 DNA의 총 1 µ g에 대 한 각각의 시료에서 바 코딩 DNA의 동량을 결합 한다. UV 분 광 광도 계를 사용할 수 없는 경우 각 샘플의 동일한 체적을 사용 하십시오. 다 꼬리의 경우에는 끝 준비 반응 완충 액의 7 µ L을 추가 하 고 ( 재료 표참조), 최종 준비 효소 믹스의 3 µ l 및 뉴 클레 아 제 무 첨가 물 5 µ l을 첨가 합니다. 튜브를 가볍게 두 드려 섞으 세요.
- 반응 물을 20 ° c에서 5 분 동안 배양 하 고, 열 사이 클론에서 65 ° c에서 5 분 후에.
- 3.2 절에 기재 된 바와 같이 반응 생성 물을 정제 하 고, µ l의 자성 비드와 엘 트로 뉴 클레 아 제를 사용 하지 않은 물 25의 µ를 60 이용 한다.
- 선택 사항: UV 분 광 광도 계를 사용 하 여 시료의 농도를 정량화 하려면 1 µ l을 복용 하십시오. 총 금액은 700 ng 이상 이어야 합니다.
- 5.3 단계에서 정제 된 dna의 22.5 µ l을 결합 하 여 µ의 1d2 어댑터 (재료 표 참조)와 25µ의 ll/TA 리가 제 마스터 믹스 (재료 표 참조)를 사용 하 여 새로운 1.5 mL DNA-저 결합 반응 튜브에 넣고 부드럽게 섞으 며 살짝 회전 2.5 시킵니다. 아래로. 실 온에서 10 분간 배양 합니다.
- 3.2 절에 기재 된 바와 같이 반응 산물을 정제 하 고 20 µ L의 자기 비드를 사용 하 되, DNA 결합을 10 분으로 하 여 배양 시간을 증가 시키고, 각각 1 mL의 에탄올과 함께 2 회 세척 단계를 수행 하 고 뉴 클레 아 제를 µ L-자유 수의 46.
- 5.6 단계에서 반응 제품의 45 µ l을 결합 하 여 µ의 바코드 어댑터 믹스 ( 재료 표참조)와 DNA-저 결합 반응 관에서 무딘/TA 리가 제 마스터 믹스의 50 µ l을 사용 합니다. 실 온에서 10 분간 가볍게 두 드려 섞으 세요.
- 3.2 절에 기재 된 바와 같이 반응 산물을 정제 하 고, 40 µ의 자기 비드를 사용 하 되, µ의 ABB 버퍼 (재료 표 참조) 140와 함께 2 워 쉬 단계를 수행 하 여 에탄올 대신에, 마그네틱 랙에 쓸 었을 때 비드를 소생 시킵니다. 용 출 완충 액의 15 µ L에 ( 재료 표참조). 용 출 단계를 위해 뿐만 아니라 비드에 DNA의 초기 결합을 위한 인큐베이션 시간을 10 분으로 증가 시킨다. 얻어진 생성 물을 사용 전까지 얼음 또는 4°c에서 저장 한다.
6. 플로우 셀의 품질 검사
- 사용 하기 전에 플로우 셀에서 품질 검사를 수행 하십시오. 이를 위해 시퀀싱 장치를 호스트 컴퓨터에 연결 하 고 소프트웨어를 엽니다.
- 플로우 셀 ( 재료 표참조)을 시퀀싱 장치에 삽입 하 고 선택기 상자에서 플로우 셀 유형을 선택 하 고 사용 가능을 클릭 하 여 확인 하십시오.
- 화면 하단의 플로우 셀 확인 을 클릭 하 고 올바른 플로우 셀 유형을 선택 하십시오.
- 테스트 시작 을 클릭 하 여 품질 검사를 시작 합니다. 플로우 셀을 사용할 수 있도록 최소 800 활성 나노 포어가 필요 합니다.
7. 플로우 셀 로드 및 시퀀싱 실행 시작
- 프라이 밍 포트 커버를 시계 방향으로 밀어서 엽니다. P1000 파이 펫을 200 µ L로 설정 하 고 팁을 프라이 밍 포트에 삽입 합니다. 프라이 밍 포트에 팁을 유지 하면서 파이 펫을 230 µ L로 조정 하 여 20-30 µ L 버퍼를 그리고 기포를 제거 하십시오.
- 새로운 1.5 mL DNA-저 결합 반응 관에서 RBF 완충 액의 576 µ L을 결합 하 여 프라이 밍 믹스를 준비 합니다 ( 물질 표참조), 뉴 클레 아 제 없는 물 624 µ l.
- 프라이 밍 포트에 준비 된 프라이 밍 믹스의 800 µ L을 조심 스럽게 파이 펫 팅 하 고 5 분 동안 기다리십시오. 샘플 포트 커버를 들어 올리고 준비 된 프라이 밍 믹스의 추가 200 µ L을 프라이 밍 포트에 파이 펫 합니다.
- 35의 RBF 완충 액 µ L을 새로운 깨끗 한 1.5 mL DNA 저 결합 반응 관으로 피 펫. 피 펫 팅으로 LLB 비드 ( 재료 표참조)를 철저히 혼합 하 고 rbf 버퍼에 비드의 25.5 µ l을 추가 하십시오. 5.8 단계에서 2.5 µ L 뉴 클레 아 제 없는 물과 DNA 라이브러리의 12 µ L을 추가 하 고 파이 펫 팅 하 여 섞어 줍니다.
- 샘플 포트를 통해 흐름 셀에 느린 적 하 방식으로 샘플 혼합물의 75 µ L을 추가 합니다.
- 샘플 포트 덮개를 교체 하 고 프라이 밍 포트를 닫은 후 시퀀싱 장치의 덮개를 닫습니다.
- 소프트웨어 내에서 플로우 셀을 계속 사용할 수 있는지 확인 하 고 새 실험을 열고 사용 된 키트를 선택 하 여 실행 매개 변수를 설정 합니다. 라이브 베이스 호출을 선택 합니다. 실험 시작을 클릭 하 여 시퀀싱 실행을 시작 합니다. 충분 한 실험 데이터가 수집 될 때까지 시퀀싱 실행을 계속 합니다.
결과
제시 된 프로토콜을 시험 하기 위한 대표적인 실험에서 우리는 5 종의 다른 혈액 샘플 로부터 RNA를 추출 하였다 (즉, 종 당 2 개인 (염소, 양, 돼지, 개, 가축)). RNA 수율 및 추출 품질은 특히 샘플 취급 및 저장의 차이로 인해 광범위 하 게 변할 수 있습니다. 우리의 대표적인 실험에서, 우리는 43 ng 사이의 RNA 농도와 µ L 당 543 ng를 관찰 하였다 (표 3). 또한, RT-PCR에 의해 증폭 한 후에, NPC-1 PCR 산물의 겔 분석은 샘플 BC01 및 BC02 (모두 염소)에 대해 현저히 약한 밴드와 함께 다양 한 결과 (도 2)를 보였다. 이러한 차이는 다른 종의 NPC1 유전자에 결합 하는 프라이 머의 차이로 인 한 PCR 효능의 차이를 배제할 수는 없지만, 샘플 품질의 차이로 인해 발생 가능성이 가장 높은 것 이다. 그러나, 이러한 수율 및/또는 증폭 효율의 차이는 전체 시퀀싱 결과에 현저 하 게 영향을 미치지 않았다. 또한, 샘플 BC10 (가축)에서 추가적으로 비 특이 적 PCR 산물을 발생 시켰다. 생어 시퀀싱과는 대조적으로, 이러한 비 특이 적 제품은 나노 포어 시퀀싱의 결과에 부정적으로 영향을 미치지 않으며, 이러한 판독 들은 데이터 분석의 일부로 서 얻어진 판독 들을 참조 서 열로 매핑하는 동안 폐기 된다.
각 시퀀싱 실행에 앞서, 사용 되는 플로우 셀의 품질 검사는 800 총 모 공의 최소 요구 사항과 함께 강력히 권장 됩니다. 우리의 대표적인 실험에서이 품질 검사는 시퀀싱에 사용할 수 있는 1102 모 공을 반환 했습니다. 데이터는 실시간으로 제공 되 고 즉시 분석 될 수 있기 때문에, 시퀀싱 실행의 길이는 개별 어플리케이션 (즉, 원하는 분석을 위해 충분 한 시퀀싱 데이터가 생성 될 때까지)에 대해 조정 될 수 있다. 우리의 실험에서, 시퀀싱 실행은 일반적으로 하룻밤에 수행 되 고, 우리의 대표적인 실험의 경우에 우리는 14 h 실행 하는 동안 약 140만 읽기를 얻었다.
수행 될 데이터 분석의 유형에 따라, 얻어진 판독의 서브셋만을 처리 하는 것이 바람직 할 수 있다. 대표적인 실험의 경우 추가 분석을 위해 1만 읽기의 하위 집합을 선택 했습니다. 이를 위해 시퀀싱 실행 중에 생성 된 fastq 파일은 Ubuntu 18.04 LTS 환경에서 추가로 처리 되었으며, 나노 포어 시퀀싱 데이터의 디 멀티플렉싱에 최적화 된 파라미터를 가진 flexbar v 3.0.3를 사용 하 여 디 멀티플렉싱 (바코드 테일 길이 300 바코드 오류율 0.2)12를 표시 하 고 있습니다. Demultiplexing 후, 읽기 매핑 및 합의 생성은 다 수의 다른 도구를 사용 하 여 수행 될 수 있지만, 나노 기 공 시퀀싱의 생물 정보학 측면에 대 한 자세한 논의는이 원고의 범위를 벗어납니다. 그러나, 우리의 대표 결과의 경우, 참조 시퀀스에 대 한 읽기 매핑은 Geneious 10.2.3를 사용 하 여 수행 되었다. 1만의 판독 분석 중, 5457는 우리 워크플로우의 일부로 증폭 된 PCR 단편에 대 한 예상 크기와 일치 하는 1750 및 2000 뉴클레오티드 사이의 길이를 보여주었다 (1769 nt, 그림 3). 판독의 길이 분포에서의 추가 피크는 250 내지 500 뉴클레오티드 사이에서 관찰 되었으며,이는 비 특이 적 PCR 산물에 기인 될 수 있다. 판독의 디 멀티플렉싱은 분석 된 10 개의 바코드/샘플 중 하나에 대 한 판독의 87.6%의 할당을 허용 하였다 (도 4). 각 바코드에 대 한 다중화 판독의 비율은 바코드 10의 3.4%에서 바코드 1에 대 한 16.9%입니다. 그러나, 전반적으로 많은 수의 판독으로 인해 이러한 낮은 풍부한 바코드 데이터 세트에 대해서도 높은 판독 깊이를 갖는 의미 있는 컨센서스 호출을 허용 했다. 실제로 NPC1의 참조 시퀀스로 정렬 된 읽기를 매핑하는 것이 참조에 대 한 읽기의 31.7% (바코드 2)와 100% (바코드 7 및 8) 사이에서 발생 하 여 각 샘플에 대해 어떤 위치에서 나 90 이상의 읽기 깊이를 제공 합니다. 이것은 무시할 수 있는 오류율로 자신감 있는 컨센서스 기반 통화를 허용 하기에 충분 합니다.
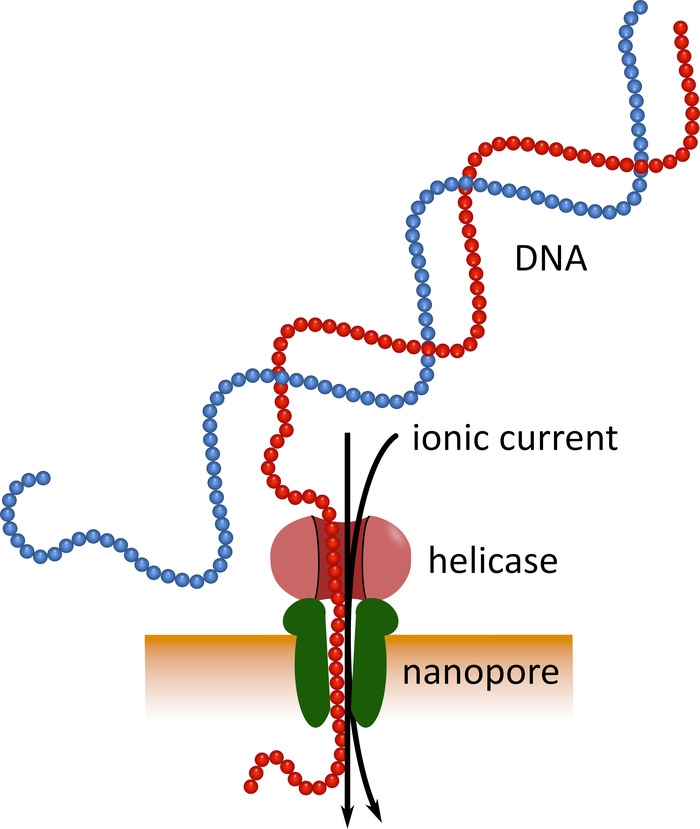
그림 1: 나노 포어 기술을 이용한 DNA 시퀀싱의 개략 표현. 단일 가닥 DNA 분자는 전기 저항 하는 막에 내장 된 나노 기공을 통과 하 여, 전환 속도를 조절 하는 헬 리 아 제와 함께. 이온 전류는 동시에 기공을 통과 하 고 지속적으로 측정 됩니다. 기 공 내에 존재 하는 뉴클레오티드에 의해 야기 된 전류의 변조는 DNA 가닥의 뉴클레오티드 서 열로 검출 되 고 계산 된 역 변환 된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
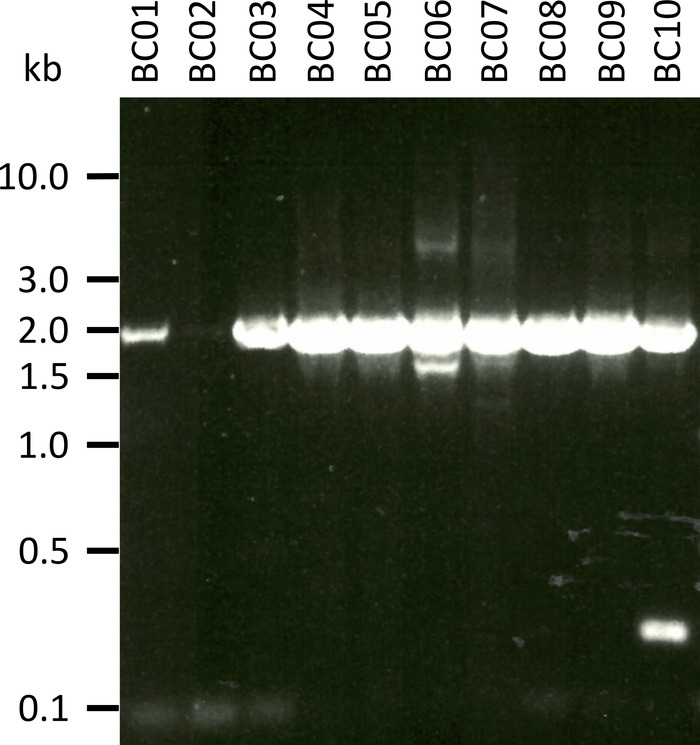
도 2: 니만의 PCR 산물의 증폭-mRNA 로부터 C1을 선택 한다. mRNA는 염소 (BC01 및 02), 양 (BC05 및 06), 개 (BC07 및 08) 및 가축 (BC09 및 10)에서 분리 되었다. 중첩 된 PCR 산물을 1x 태 버퍼에서 0.8% 아가 로스 겔 내에서 분리 하였다 (50 배의 버퍼에서 제조 됨: 트리 스 베이스 242.28 g, 빙하 아세트산 57.1, 100 mL의 0.5 M EDTA,dH 2o ~ 1 L, pH 조정 8.0에서 45 분) Sybr 안전. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
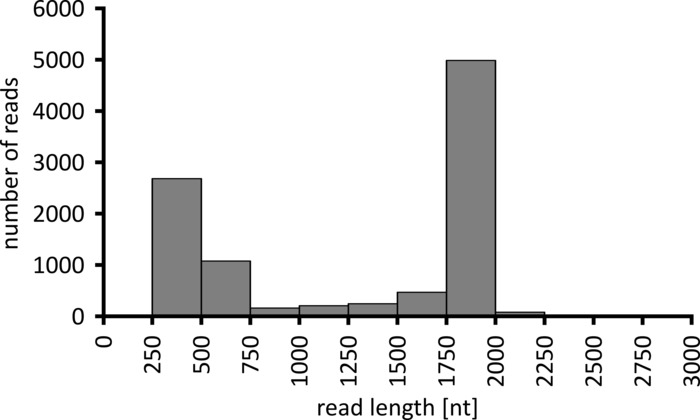
그림 3:1만의 읽기 길이 분포는 대표적인 실험에서 읽습니다. 지정 된 읽기 길이 간격이 있는 읽기 수가 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
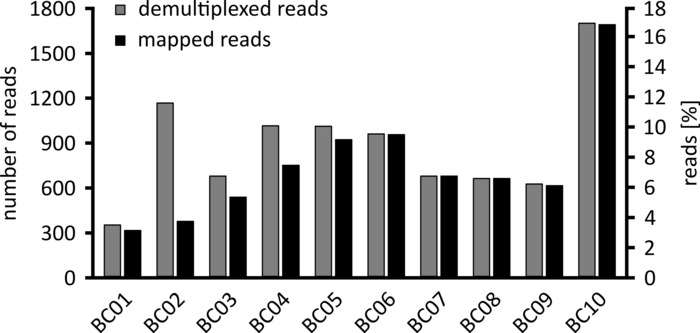
그림 4: 디 멀티플렉싱 후 판독의 분포. 각 바코드에 대 한 디 멀티플렉싱 (회색) 및 매핑된 읽기 (검은색)의 수와 비율이 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
표 1: 사용 된 프라이 머 세트의 개요. 표적 서 열의 초기 증폭은 프라이 머 세트 1과 함께 수행 하였다. 프라이 머 세트 2는 중첩 증폭 및 어댑터 첨가에 사용 하였다. 어댑터는 빨간색으로 표시 됩니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
표 2: 바코드 시퀀스 개요 각 시퀀싱 샘플을 식별 하기 위해 개별 바코드가 사용 되었습니다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
표 3: 대표적인 실험에서 시퀀싱 된 혈액 샘플에서 추출한 후 얻어진 RNA 농도. 각각의 5 종 으로부터 두 개인의 RNA 농도가 표시 되 고, 260/280 nm 및 260/230 nm에서의 광학 밀도의 비율이 표시 된다. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
지난 20 년 동안 생물학적 샘플의 시퀀싱은 광범위 한 주제 분야에서 연구의 중요성이 점차 커지고 있습니다. 효소 조작 및 이미지 기반 데이터 획득1 의 반복적인 주기를 이용한 고밀도 DNA 특징의 시퀀싱에 기초한 2 세대 염기 서 열 분석 시스템의 개발은 처리량을 획기적으로 증가 시켜 전통적인 생어 염기 서 열 분석 법은, 주어진 샘플에서 여러 샘플 뿐만 아니라 다양 한 핵 산 종을 병렬로4개 분석할 수 있게 한다. 그러나 대부분의 일반적으로 사용 되는 2 세대 시스템의 경우 짧은 읽기만 생성 되며 모든 플랫폼은 민감하고 부피가 크고 고가의 장비3,4에 의존 합니다.
2 세대 염기 서 열 분석 플랫폼과는 대조적으로,이 프로토콜에 사용 되는 시퀀싱 장치는 나노 공 극 기술을 기반으로 합니다. 여기에서 단일 가닥 핵 산 분자는 나노 기공을 통과 하 여, 또한 동일한 나노 기공을 통해 흐르는 이온 전류의 변조를 초래 하 고,이는 핵 산 분자의 서 열을 추론 하는 것으로 측정 및 역 번역 될 수 있다. 이 3 세대 시퀀싱 접근법은 다른 접근법에 비해 많은 장점을 부여 합니다. 이 기술의 고유 한 작동 원리와 직접적으로 관련 된 주요 이점은 생산 된 매우 긴 판독 길이 (최대 읽기 길이가6), DNA 뿐만 아니라 서 열 하는 능력을 8.8 x 10의5 뉴클레오티드가 보고 되었다 또한 RNA는 직접적으로 완전 한 인플루엔자 바이러스 게놈 (17)에 대해 입증 되었으며, 이들이 생성 되는 것과 같이 실시간으로 데이터를 분석 하는 능력을 가지 며,이는 몇 분 이내에 병원 체의 신속한 메타 아 젠 시 검출을 가능 하 게 한다 (18). 추가적인 실용적인 이점은 나노 기 공 시퀀싱 장치의 극히 작은 크기로, 원격 지19,20및 다른 시퀀싱에 비해 낮은 가격으로 모든 실험실 또는 현장 임무에서의 사용을 허용 합니다. 플랫폼. 실행 비용 측면에서, 현재 새로운 플로우 셀은 각 시퀀싱 실행에 필요 하며,이는 플로우 셀 및 라이브러리 준비 시 약에 대 한 실행 당 약 $1100의 비용을 초래 한다. 이러한 비용은 플로우 셀을 세척 및 재사용 하거나, 한 번의 실행으로 여러 샘플을 바코드 및 시퀀싱 하 여 일부 경우에 감소 될 수 있다. 또한, 플로우 셀의 새로운 유형은 현재 플로우 셀 어댑터 ("flongle" 라고 함)의 사용을 필요로 하 고, 크게 흐름 셀 가격 및 따라서 실행 비용을 절감 해야 합니다 실험실의 적은 수에 의해 베타 테스트 되고있다.
나노 기 공 염기 서 열 분석의 주요 단점으로는 정확도가 유지 되며, 83 ~ 86%의 범위에서 단일 판독 정확도는6,21,22로 보고 되 고 대부분의 부정확 한 삽입/삭제로 인 한 부정확성 ( 이는21. 그러나 높은 읽기 깊이는 이러한 부정확성을 보상할 수 있으며, 최근의 연구는 > 10의 깊이가 > 99.8%21의 전체 정확도를 높일 수 있다는 이론적 고려 사항을 기반으로 제안 했습니다. 그럼에도 불구 하 고, 정확도의 추가 개선은 필요 합니다, 분석은 컨센서스 순서 수준 보다는 오히려 단 하나 분자 수준에 수행 되는 경우에 특히. 본 프로토콜에서 설명 하는 1d 2 기술의 사용은 단일 DNA 분자의 두 가닥 모두 동일한 나노 기 공에 의해 시퀀싱 되는 결과를 초래 하는 1d2 및 바코드 어댑터 (섹션 5.5)의 추가를 기반으로 하 여, 판독 증가 두 DNA 가닥 으로부터의 정보는 순서 결정을 위해 사용 될 수 있기 때문에 정확도. 또한, 나노 기 공 염기 서 열 분석 (특히 긴 판독 길이)의 장점을 결합 하기 위해 다른 시퀀싱 기술의 보다 높은 정확도를 가지는 방법을 추구할 수 있는 해결 방법은 나노 기 공 염기 서 열 정보를 스 캐 폴드로 사용 하는 것 이며,이는 그런 다음 다른 플랫폼의 시퀀싱 데이터를 사용 하 여 연마6.
여기에 제시 된 프로토콜의 성공에 가장 중요 한 요인은 샘플 품질, 특히 추출 된 RNA의 양과 품질입니다. RNA의 적절 한 저장 및 신속한 추출은 적절 한 RNA 수율을 달성 하는 데 도움이 됩니다. 적절 한 혈액 채취 튜브를 사용 하면 최대 1 개월 동안 혈액 샘플을 보관할 수 있지만 혈액 응고는 특히 샘플이 고온에서 저장 될 때 필드 조건에서 케이스가 될 수 있습니다. 제 2 임계 단계는 표적 서 열의 증폭, 및 특정 현장 조건 하에서 PCR 반응은 종종 표준 실험실 조건 하에서 보다 적게 잘 수행 된다7. 이를 위해, 신중한 프라이 머 설계 및 최적화는 견고한 증폭을 달성 하는 데 가장 중요 합니다. 추가적으로,이 프로토콜에서 사용 되는 중첩 된 pcr 접근법과 터치 다운 pcr은 표적 유전자 증폭4,7의 특이성 및 감수 성을 모두 증가 시킬 수 있다. 실제로,이 기술을 가진 라이베리아와 기니에 있는 우리의 경험에는 실험실 견본에 게 서 그리고 실험실 조건 하에서 표적의 증폭을 허용한 프라이 머 세트를 위해 조차 필드 표본을 가진 필드 조건에서 중첩 된 프로토콜이 요구 되었습니다 PCR의 단일 라운드 (7 및 미 게시 결과).
이러한 더 중요 한 단계와 달리 라이브러리 준비 및 시퀀싱 실행 자체는 오히려 강력한 절차입니다. 그러나 현장 조건에서 특정 장비의 가용성과 같은 실질적인 문제는 문제가 될 수 있습니다. 예를 들어, 바코드 샘플의 라이브러리 준비 전에 DNA 농도를 결정 하기 위해 UV 분 광 광도 계가 필요 합니다. 그러나 이러한 장치를 현장 조건 하에서 사용할 수 없는 경우, 각 샘플의 동량을 결합 하 여 라이브러리 준비에 필요한 45 µ L을 구성 하 고 샘플 입력 재료의 차이를 확인 한 다음 일반적으로 대형 읽기 수입니다. 마찬가지로, 염기 서 열을 더 이상 온라인으로 수행 하지 않아도 되지만 로컬로 수행 될 수 있더라도 시퀀싱 실행을 위한 인터넷 연결의 필요성이 문제가 될 수 있습니다. 그러나, 필요한 경우 제조업체에 의해 특정 상황에서 이러한 필요성을 제거할 수 있습니다.
요약 하자면, 제시 된 프로토콜은 원격 위치를 포함 하 여 전통적인 시퀀싱 장비에 접근할 수 없는 위치에서 상대적으로 저비용 시퀀싱을 가능 하 게 합니다. 그것은 쉽게 모든 대상 RNA 또는 DNA에 적응 될 수 있다, 따라서 연구원은 수많은 생물학 질문에 대답 하는 허용.
공개
TH는 2014에서 2015에 옥스포드 나노 공 기술 (ONT) 미니 언 조기 액세스 프로그램에 참여 하 고, 미국 보건부에서 수행 하는 이전 연구 7 에 대 한 미니 언 장치 및 플로우 셀을 받았으며, 무료 또는 비용 절감 . 그는 ONT의 초청을 받아 런던, 영국에서 2015 회의를 하 고, 교통 및 숙박 시설에 대 한 ONT에 트를 부르 다. 이 원고에 제시 된 저작물의 경우, 혜택 (예: 비용 절감, 여행 보상 등의 하드웨어 또는 시 약)은 ONT에서 얻을 수도 없습니다. AM, KF 및 RS는 공개 할 것이 없습니다.
감사의 말
저자 들은이 원고를 비판적으로 읽는 것에 대해 앨리슨 그로 세스에 게 감사를 드립니다. 이 사업은 독일 연방 농림 부 (BMEL)에 의해 독일 연방 공화국의 농업 및 식량 (BLE)에 대 한 연방 정부의 결정에 따라 재정적으로 지원 되었다.
자료
| Name | Company | Catalog Number | Comments |
| 1D2 adapter, barcode adapter mix, ABB buffer, elution buffer, RBF buffer, LBB beads | Oxford Nanopore Technologies | SQK-LSK308 | 1D² Sequencing Kit |
| Blood collection tube with DNA/RNA stabilizing reagent | Zymo Research | R1150 | DNA/RNA Shield - Blood Collection Tube |
| Blunt/TA ligase master mix | New England Biolabs | M0367S | Blunt/TA Ligase Master Mix |
| DNA-low binding reaction tube | Eppendorf | 30108051 | DNA LoBind Tube |
| DNase buffer and DNase | ThermoFisher Scientific | 11766050 | SuperScript™ IV VILO™ Master Mix with ezDNase™ Enzyme |
| Flow cell | Oxford Nanopore Technologies | FLO-MIN105.24 | flow cell R9.4 |
| Hot start high fidelity DNA polymerase | New England Biolabs | M0493L | Q5 Hot Start High-Fidelity DNA Polymerase (500 U) |
| Magnetic beads | Beckman Coulter | A63881 | Agencourt AMPure XP beads |
| Magnetic rack | ThermoFisher Scientific | 12321D | DynaMag-2 Magnet |
| Nanopore sequencing device | Oxford Nanopore Technologies | - | MinION Mk 1B |
| PCR barcoding kit | Oxford Nanopore Technologies | EXP-PBC001 | PCR Barcoding Kit I (R9) |
| Reverse transcriptase master mix | ThermoFisher Scientific | 11766050 | SuperScript™ IV VILO™ Master Mix with ezDNase™ Enzyme |
| RNA purification spin column, DNA/RNA prep buffer, DNA/RNA wash buffer, DNase I, DNA digestion buffer | Zymo Research | R1151 | Quick-DNA/RNA Blood Tube Kit |
| Rotating mixer | ThermoFisher Scientific | 15920D | HulaMixer Sample Mixer |
| Taq DNA polymerase | New England Biolabs | M0287S | LongAmp Taq 2x Master Mix |
| Ultra II End-prep kit | New England Biolabs | E7546S | NEBNext Ultra II End-Repair/dA-tailing Modul |
| UV spectrophotometer | Implen | - | NanoPhotometer |
| Vacuum manifold | Zymo Research | S7000 | EZ-Vac Vacuum Manifold |
참고문헌
- Shendure, J., Ji, H. Next-generation DNA sequencing. Nature Biotechnology. 26 (10), 1135-1145 (2008).
- Shendure, J., Lieberman Aiden, E. The expanding scope of DNA sequencing. Nature Biotechnology. 30 (11), 1084-1094 (2012).
- Liu, L., et al. Comparison of next-generation sequencing systems. Journal of Biomedicine and Biotechnology. 2012, 251364 (2012).
- Levy, S. E., Myers, R. M. Advancements in Next-Generation Sequencing. Annual Review of Genomics and Human Genetics. 17, 95-115 (2016).
- Lu, H., Giordano, F., Ning, Z. Oxford Nanopore MinION Sequencing and Genome Assembly. Genomics, Proteomics & Bioinformatics. 14 (5), 265-279 (2016).
- Jain, M., et al. Nanopore sequencing and assembly of a human genome with ultra-long reads. Nature Biotechnology. 36 (4), 338-345 (2018).
- Hoenen, T., et al. Nanopore Sequencing as a Rapidly Deployable Ebola Outbreak Tool. Emerging Infectious Diseases. 22 (2), 331-334 (2016).
- Quick, J., et al. Real-time, portable genome sequencing for Ebola surveillance. Nature. 530 (7589), 228-232 (2016).
- Carette, J. E., et al. Ebola virus entry requires the cholesterol transporter Niemann-Pick C1. Nature. 477 (7364), 340-343 (2011).
- Ndungo, E., et al. A Single Residue in Ebola Virus Receptor NPC1 Influences Cellular Host Range in Reptiles. mSphere. 1 (2), (2016).
- Martin, S., et al. A genome-wide siRNA screen identifies a druggable host pathway essential for the Ebola virus life cycle. Genome Medicine. 10 (1), 58 (2018).
- Roehr, J. T., Dieterich, C., Reinert, K. Flexbar 3.0 - SIMD and multicore parallelization. Bioinformatics. 33 (18), 2941-2942 (2017).
- Li, H., et al. The Sequence Alignment/Map format and SAMtools. Bioinformatics. 25 (16), 2078-2079 (2009).
- Kielbasa, S. M., Wan, R., Sato, K., Horton, P., Frith, M. C. Adaptive seeds tame genomic sequence comparison. Genome Research. 21 (3), 487-493 (2011).
- Don, R. H., Cox, P. T., Wainwright, B. J., Baker, K., Mattick, J. S. Touchdown' PCR to circumvent spurious priming during gene amplification. Nucleic Acids Research. 19 (14), 4008 (1991).
- Korbie, D. J., Mattick, J. S. Touchdown PCR for increased specificity and sensitivity in PCR amplification. Nature Protocols. 3 (9), 1452-1456 (2008).
- Keller, M. W., et al. Direct RNA Sequencing of the Coding Complete Influenza A Virus Genome. Scientific Reports. 8 (1), 14408 (2018).
- Greninger, A. L., et al. Rapid metagenomic identification of viral pathogens in clinical samples by real-time nanopore sequencing analysis. Genome Medicine. 7, 99 (2015).
- Castro-Wallace, S. L., et al. Nanopore DNA Sequencing and Genome Assembly on the International Space Station. Scientific Reports. 7 (1), 18022 (2017).
- Goordial, J., et al. In Situ Field Sequencing and Life Detection in Remote (79 degrees 26'N) Canadian High Arctic Permafrost Ice Wedge Microbial Communities. Frontiers in Microbiology. 8, 2594 (2017).
- Runtuwene, L. R., et al. Nanopore sequencing of drug-resistance-associated genes in malaria parasites, Plasmodium falciparum. Scientific Reports. 8 (1), 8286 (2018).
- Rang, F. J., Kloosterman, W. P., de Ridder, J. From squiggle to basepair: computational approaches for improving nanopore sequencing read accuracy. Genome Biology. 19 (1), 90 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유