A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الفلورة الكمية في الموقع التهجين (FISH) والفلورة المناعية (IF) من منتجات جينية محددة في الخلايا المصابة KSHV
In This Article
Summary
نحن نصف بروتوكول باستخدام الفلورة في الموقع التهجين (FISH) لتصور RNAs الهربس الفيروسي متعددة داخل الخلايا البشرية المصابة lytically، إما في تعليق أو التمسك. يتضمن هذا البروتوكول تحديد كمية الفلورة التي تنتج نسبة النيوكليوسيتوبلازمية ويمكن تمديدها للتصور المتزامن للبروتينات المضيفة والفيروسية ذات الفلورة المناعية (IF).
Abstract
البصيرة الميكانيكية تصل من دراسة متأنية والقياس الكمي لRNAs محددة والبروتينات. يمكن التقاط المواقع النسبية لهذه الجزيئات الحيوية في جميع أنحاء الخلية في أوقات محددة مع الفلورة في الموقع التهجين (FISH) والفلورة المناعية (IF). أثناء عدوى فيروس الهربس الليتيك، يخطف الفيروس الخلية المضيفة للتعبير بشكل تفضيلي عن الجينات الفيروسية، مما يسبب تغييرات في مورفولوجيا الخلايا وسلوك الجزيئات الحيوية. وتتركز أنشطة اللتيك في المصانع النووية، وتسمى مقصورات النسخ المتماثل الفيروسي، والتي يمكن تمييزها فقط مع FISH وIF. هنا نقوم بوصف بروتوكول قابل للتكيف من الحمض النووي الريبي FISH وتقنيات IF لفيروس الهربس المرتبطبة بساركوما كابوسي (KSHV) الخلايا المصابة، على حد سواء الالتزام وتعليق. وتشمل الطريقة خطوات لتطوير oligonucleotides المضادة للشعور محددة، مزدوجة الحمض النووي الريبي الأسماك، RNA FISH مع IF، والحسابات الكمية من كثافة الفلورة. تم تطبيق هذا البروتوكول بنجاح على أنواع الخلايا المتعددة، والخلايا غير المصابة، والخلايا الكامنة، والخلايا اللاتيكية، والدورات الزمنية، والخلايا المعالجة بمثبطات لتحليل الأنشطة الصدغية لـ RNAs محددة والبروتينات من كل من المضيف البشري و KSHV.
Introduction
في المرحلة اللاإحتيابية (النشطة)، تخطف فيروسات الهربس الخلية المضيفة، مما يسبب تغييرات في مورفولوجيا الخلايا وتوطين الجزيئات البيولوجية، لإنتاج الفيرونات. قاعدة العمليات هي النواة، حيث يتم تكرار الجينوم الفيروسي الحمض النووي المزدوج الذين تقطعت بهم السبل وتعبئتها في قذيفة بروتين، ودعا كابسيد1. للبدء، يعبر الفيروس عن بروتيناته الخاصة، واختطاف الآلات المضيفة ومنع التعبير عن الجينات المضيفة غير الأساسية، وهي عملية تسمى تأثير إيقاف المضيف. يتم ترجمة غالبية هذا النشاط إلى محددة 4′,6-دياميديينو-2-فينيليندول (DAPI)-المناطق النووية الخالية من تسمى مقصورات النسخ المتماثل الفيروسي, تتألف من كل من البروتينات المضيفة والفيروسية, RNAs, والحمض النووي الفيروسي2. يتم إصلاح الخلية لتوفير مساحة وموارد لمقصورات النسخ المتماثل وبالتالي تجميع الغطاء الفيروسي. بمجرد خروج الكابسيد من النواة، فإن كيفية تغليف الكابسيد في السيتوبلازم لإنتاج جسيمات فيروسية مرتبطة بالغشاء، والمعروفة أيضًا باسم فيريون، غير واضحة. فهم التوطين والتحولات المكانية لكل من الجزيئات الحيوية المضيفة والفيروسية خلال المرحلة اللائوية يوفر رؤية ميكانيكية أعمق في ترتيب مقصورة النسخ المتماثل، وتأثير إيقاف المضيف، ومسار خروج الفيرون، وغيرها العمليات المتعلقة بالعدوى الفيروسية الهربسية والنسخ المتماثل.
حاليا أفضل طريقة للكشف عن ودراسة هذه التغييرات هو التصور من البروتينات وRNAs في الخلايا المصابة مع الفلورة المناعية (IF) والهجين الفلورسنت في الموقع (FISH)، على التوالي. استخدام مسار زمني مع هذه التقنيات يكشف عن توطين الجزيئات الحيوية في النقاط الرئيسية للمرحلة اللاتيك أو ببساطة، البيانات spatiotemporal. FISH وIF تكمل التقنيات البيوكيميائية الأخرى، مثل تثبيط عملية الخلوية (على سبيل المثال، تثبيط النسخ المتماثل الحمض النووي الفيروسي)، RT-qPCR (تفاعل البوليميراز سلسلة في الوقت الحقيقي)، تسلسل الحمض النووي الريبي، البقع الشمالية، الطيف الكتلي، النشاف الغربي، و تحليل إنتاج الحمض النووي الفيروسي، التي قد توفر صورة أكثر عالمية للأنشطة الخلوية.
قمنا بتطوير استراتيجيات الحمض النووي الريبي FISH لفحص منتجات الحمض النووي الريبي من جينات محددة وتحليل حسابي يحسب كميا نسبة النيوكليوسيتوبلازميك لمنتج جين معين. إعداد عينة, تعديلها من المنشورات السابقة من قبل Steitz والزملاء3,4, من السهل نسبيا ويمكن استخدامها لكل من الخلايا الملتصقة والمعلقة. البروتوكول أيضا قابل للتكيف للاستخدام المتزامن لاستراتيجيات الأسماك RNA متعددة (مزدوجة RNA FISH) أو RNA FISH مع استراتيجيات IF. إن وضع استراتيجية محددة للأسماك والأسماك أمر ينطوي على تحديات، ولكن الاقتراحات الرامية إلى تحسين النجاح مبينة. تحليل البيانات الموضحهنا هو كمية إذا تم استخدام الخرز الفلورسنت وعلامات قوية من حدود المقصورة ويقدم نظرة ثاقبة إضافية في الميكروغراف، البصيرة التي تزيل التحيز الملاحظة. تم تصميم البروتوكول المفصل لكل من الخلايا الكامنة والليسية المصابة بفيروس الهربس المرتبط بساركوما كابوسي (KSHV) ويمكن استخدامه مع الخلايا أو الخلايا غير المصابة بفيروسات الهربس الأخرى5. وتنطبق أساليب التكميم على الدراسات المتعلقة بالتحولات النووية أو إعادة التوطين بين المقصورات دون الخلوية في معظم الخلايا.
Protocol
1. تصميم الفلورة في الموقع (FISH) المضادة للحاسة oligonucleotides للكشف عن نسخة محددة من الهربس الفيروسي
- حدد 25 إلى 40 NT شرائح من تسلسل RNA من الفائدة وتحويل هاهية الإحساس. قد تحتوي استراتيجية FISH الناجحة من واحد إلى عشرة أو أكثر مختلفة المضادة للحاسة oligonucleotides. عند تحديد تسلسلات، خذ بعين الاعتبار ما يلي:
- إذا كان الحمض النووي الريبي من الفائدة يحتوي على منطقة تكرار فريدة من نوعها، ثم الاستفادة من هذه الميزة وتصميم oligonucleotide المضادة للتحسس لاستهداف تسلسل تكرار.
ملاحظة: Tycowski وزملاؤه5 تقديم مثال على هذه الاستراتيجية مع rhesus rhadinovirus (RRV) بوليدينيلاتيد النووية (PAN) RNA. - إذا كان الحمض النووي الريبي من الفائدة يحتوي على موقع معروف ملزمة للبروتين أو هيكل الجذعية حلقة، وتصميم oligonucleotides التي تجنب هذه المناطق.
- اعتمادا على أهداف التجارب، والنظر في تسلسل intronic وما إذا كان أو لا لتصميم oligonucleotide المضادة للشعور لذلك.
- إذا كان الحمض النووي الريبي من الفائدة يحتوي على منطقة تكرار فريدة من نوعها، ثم الاستفادة من هذه الميزة وتصميم oligonucleotide المضادة للتحسس لاستهداف تسلسل تكرار.
- إجراء تحليلات حسابية بسيطة على تسلسلات مضادة للتحسس المحدد لضمان خصوصية ملزمة وتقليل تجميع oligonucleotide المضادة للتحسس.
- يجب أن تكون التسلسلات حوالي 50٪ GC-الغنية (عالية guanine ومحتوى السيتوسين) ولها درجة حرارة ذوبان في نطاق 60 إلى 70 درجة مئوية.
- استخدم أداة محلل تسلسل لتحديد التسلسلات التي لا تُشكّل دبابيس الشعر ذات الذوبان في درجات الحرارة فوق 37 درجة مئوية، وهي درجة حرارة التهجين.
- إجراء البحث عن أدوات البحث عن المحاذاة المحلية الأساسية لمحاذاة النيوكليوتيدات من البنك الأهلي التجاري باستخدام إعداد "مشابه إلى حد ما" باستخدام إعداد "مشابه إلى حد ما". هذا البحث سوف تحدد فريدة من نوعها المضادة للإحساس oligonucleotides التي لن تربط على الأرجح إلى المضيف الأخرى أو النصوص الفيروسية.
ملاحظة: في حالة عدم توفر النسخ، قم بإجراء البحث BLAST مع تسلسلات الجينوم. ومن المثالي إذا أجريت عمليات البحث على تسلسل من الفيروس معزولة عن الخلايا المصابة المستخدمة في التجربة لأن سلالات البرية تميل إلى تنويع وتحتوي على مزيج من تسلسل من سلالات مختبر مختلفة.
- ترتيب oligonucleotides الحمض النووي النقي المقابلة للتسلسل المضادة للشعور التي تم التحقق منها حسابيا لتكون فريدة من نوعها ومن المرجح أن ربط إلى RNA الهدف. لا حاجة إلى إدخال تعديلات خاصة في oligonucleotides.
- اختبار oligonucleotides المضادة للشعور مصممة لخصوصية ملزمة من قبل FISH ووصمة عار الشمالية.
- باستخدام خط خلية غير مصاب من نفس الأنواع المضيفة (على سبيل المثال، 293T) ومن الناحية المثالية نفس نوع الخلية، إجراء عملية نقل مع بلازميد يعبر عن الحمض النووي الريبي من الاهتمام من المروج قوية (CMV، الفيروس المضخم للخلايا) واحد مع ناقلات فارغة (على سبيل المثال، pcDNA3). استخدام عنصر تحكم إيجابي للتغوط مثل التغوط المشترك مع GFP (بروتين الفلورسنت الأخضر) بلازميد (على سبيل المثال، pmaxGFP) أو المتجه الذي يحتوي على GFP.
ملاحظة: من المهم تجنب خطوط الخلايا التي تم تخليدها باستخدام فيروس الهربس إبشتاين بار فيروس (EBV) نظراً لوجود أوجه التشابه تسلسل بين فيروسات الهربس. - أداء FISH كما هو موضح في القسم 3 على كل من مجموعات من الخلايا مع oligonucleotides المضادة للشعور كما هو موضح في هذا البروتوكول. استنتاج المرشحين الناجحين من خلال مقارنة تجارب FISH مع الفردية، أزواج، أو مجموعات من oligonucleotides المضادة للشعور. استخدام مراقبة إيجابية لبروتوكول FISH مثل U2 snRNA (RNA النووية الصغيرة) FISH، موجودة في 500،000 نسخة لكل نواة الخلية البشرية6 (الجدول1).
- يجب أن تكون إشارة الفلورسنت محددة وقوية في الخلية التي تحتوي على الحمض النووي الريبي من الفائدة. تصميم إضافية مضادة للحاسة oligonucleotides لتعزيز الإشارة وإزالة oligonucleotides المضادة للشعور التي تربط غير محدد من النظر. يجب أن تكون قوة الإشارة فوق الخلفية والفلورة الذاتية.
- اختبار خصوصية ملزمة من قبل وصمة عار الشمالية.
- باستخدام خط خلية غير مصاب من نفس الأنواع المضيفة (على سبيل المثال، 293T) ومن الناحية المثالية نفس نوع الخلية، إجراء عملية نقل مع بلازميد يعبر عن الحمض النووي الريبي من الاهتمام من المروج قوية (CMV، الفيروس المضخم للخلايا) واحد مع ناقلات فارغة (على سبيل المثال، pcDNA3). استخدام عنصر تحكم إيجابي للتغوط مثل التغوط المشترك مع GFP (بروتين الفلورسنت الأخضر) بلازميد (على سبيل المثال، pmaxGFP) أو المتجه الذي يحتوي على GFP.
2. Oligonucleotide وإعداد الخلايا
- بعد تعليمات الشركة المصنعة، استخدم transferase الطرفية لتسمية oligonucleotides المضادة للشعور مع dioxigenin(DIG)-dUTP أو، إذا كان ملزما بقوة، مباشرة مع النيوكليوتيد الفلورسنت مثل اليكسا فلور 594-5-dUTP. بعد وضع العلامات، تنقية إضافية ليست ضرورية. مخزن المسمى oligonucleotides في -20 درجة مئوية تصل إلى عدة سنوات وفي رقائق القصدير إذا وصفت مباشرة لمنع تبييض الصور.
تحذير: يحتوي حل وضع العلامات على مادة سامة، cacodylate البوتاسيوم. التعامل مع ردود الفعل وضع العلامات مع القفازات.
ملاحظة: للحفاظ على الموارد، يمكن تسمية العديد من oligonucleotides مختلفة المضادة للتحسس في رد فعل واحد. يستخدم هذا البروتوكول وضع العلامات 3'-end. وضع العلامات الداخلية أمر صعب لأن المجموعة الكيميائية (على سبيل المثال، DIG أو الفلوروفور) يتم القبض عليها أو غير قادرة على دخول الموقع النشط لبوليميراز الحمض النووي. يمكن إجراء تجربة مع اثنين من RNAs مختلفة باستخدام oligonucleotides المضادة للحاسة والمضادة للحفر المناعية مع الفلوروفور مختلفة (على سبيل المثال، FITC (الفلورسين) أو اليكسا فلور 488 مع اليكسا فلور 594). - تمسك بالخلايا إلى شرائح ثماني غرف.
ملاحظة: تسمح الشرائح المكونة من ثماني غرف بعدة تجارب متزامنة مع تقليل الموارد الثمينة مثل الأجسام المضادة. بديل للشرائح ثماني غرف هو لوحة زراعة الأنسجة ستة جيدا مع الأغطية القياسية (22 مم × 22 مم) التي هي على حد سواء معقمة. وهناك ترتيب مماثل ممكن مع الأغطية الدائرية ولوحة ثقافة الأنسجة 24 جيدا. وبالنسبة لكليهما، قم بزيادة الأحجام المذكورة في هذا البروتوكول بمقدار 10-15 x (على سبيل المثال، 1.75 مل حل التهجين)، و4 x (على سبيل المثال، 600 ميكرولتر حل التهجين) على التوالي.- للخلايا الليستية الملتصقة، استخدم 1x تريبسين/ PBS عند 37 درجة مئوية و5% ثاني أكسيد الكربون لمدة 10 دقائق لتعليق الخلايا وتخفيفها إلى 60% من الملاءمة.
ملاحظة: وشملت خطوط الخلايا الملتصقة المستخدمة في تجارب FISH 293T، iSLK.2197،وخلايا iSLK-BAC368. - تطبيق 200 درجة مئوية من تعليق الخلية على كل غرفة من الشرائح العقيمة ثماني غرف والسماح لنمو البذور ل 12-24 ساعة في 37 درجة مئوية و 5٪ CO2. اضبط حسب الضرورة الخلايا البطيئة أو السريعة النمو وللخلايا التي تتلف بسهولة من قبل التربسين.
ملاحظة: الهدف هو أن يكون الخلايا متباعدة بالتساوي تعلق بقوة إلى الشريحة. النظر في تحفيز مرحلة اللطاسية بعد التصاق إذا كانت الخلايا اللاإهالة هشة. الاستنتاجات المستخلصة من التجارب مع خلايا iSLK محدودة9. - لخلايا التعليق الليتيك، قبل علاج ثماني غرف الشرائح مع 1:10 بولي L-يسين لمدة 5 دقائق تحت غطاء محرك السيارة ثقافة الأنسجة. ثم ترك الشرائح لتجف بين عشية وضحاها في درجة حرارة الغرفة أو 1 ساعة في 65 درجة مئوية. احتضان 800 ميكرولتر من الخلايا الليتيكية بتركيز 1 × 106 خلايا / مل مع الشرائح المحاطة لمدة 30 دقيقة إلى 1 ساعة عند 37 درجة مئوية و 5٪ CO2.
ملاحظة: سوف يستقر تعليق الخلايا في طبقة أحادية، والتمسك L-يسين بولي وبالتالي الخلايا الزائدة ليست مصدر قلق بالمقارنة مع الخلايا الملتصقة. الخلايا اللاتيكية التي تشكل مجموعات العنب، إذا كان ذلك ممكنا، ينبغي فصلها عن طريق دوامة لطيف أو الوسائل الكيميائية. ومن المسلم به أن أصحاب البلاغ لم ينجحوا كثيراً في هذه التوصيات في حالة خلايا اللتيك BJAB-RRV-GFP. إذا كانت الخلايا التعليق لا تلتزم بشكل جيد، والنظر في زيادة إما الوقت أو تركيز الحضانة L-يسين بولي.
- للخلايا الليستية الملتصقة، استخدم 1x تريبسين/ PBS عند 37 درجة مئوية و5% ثاني أكسيد الكربون لمدة 10 دقائق لتعليق الخلايا وتخفيفها إلى 60% من الملاءمة.
3. التثبيت، الفلورة المناعية (اختياري)، التهجين، والتصور من RNAs الفيروسية
- إزالة الوسائط والخلايا الزائدة. في جميع أنحاء هذا البروتوكول، واستخدام شفط فراغ لإزالة الحلول وmicropipetting لطيف لإضافة حلول.
ملاحظة: يمكن تقليل قوة الفراغ عن طريق وضع طرف ميكرومازيت 200 ميكرول على ماصة باستور الزجاج. استبدل طرف الميكرومازيت بين خطوات الغسيل لمنع التلوث. يجب أن يتم تنفيذ كل خطوة غسل بسرعة لأنه من الضروري أن الخلايا لا تجف أبدا. - على الفور، إصلاح الخلايا مع ما قبل المبردة 4٪ الفورمالديهايد / PBS (الفوسفات المخزنة مؤقتا المالحة) على الجليد لمدة 30 دقيقة.
- نفاذ الخلايا الثابتة مع 200 درجة مئوية من قبل المبردة 0.5٪ تريتون-X / PBS (الفوسفات المخزنة المالحة) لمدة 10 دقائق على الجليد أو 750 درجة مئوية من الإيثانول قبل المبردة 70٪ في 4 درجة مئوية لمدة 1 ساعة (دقيقة) إلى 7 د (كحد أقصى).
ملاحظة: جمع البروتين، ومجموع الحمض النووي الريبي، وعينات الحمض النووي الجينومي عند نقطة التثبيت لضمان الاتساق بين الصور والاختبارات البيوكيميائية. يتم تنفيذ جميع عمليات التمشين في جميع أنحاء هذا البروتوكول بنفس الطريقة ما لم ينص على خلاف ذلك. 70٪ الإيثانول يخفف الغراء بين الغرف والشريحة، مما يخفف من الفصل في وقت لاحق، ويوفر أيضا وقفة كبيرة في البروتوكول. ومع ذلك، استخدم فيلم البارافين حول شريحة الغرفة للحد من التبخر والتحقق من مستوى الإيثانول في كل غرفة حول كل 8 ساعة. أبعاد الخلية.
- نفاذ الخلايا الثابتة مع 200 درجة مئوية من قبل المبردة 0.5٪ تريتون-X / PBS (الفوسفات المخزنة المالحة) لمدة 10 دقائق على الجليد أو 750 درجة مئوية من الإيثانول قبل المبردة 70٪ في 4 درجة مئوية لمدة 1 ساعة (دقيقة) إلى 7 د (كحد أقصى).
- إزالة الغرف بعناية لمنع تكسير الشريحة. إذا كانت التجربة تتضمن الفلورة المناعية (IF) من البروتين الفيروسي أو المضيف مع جسم مضاد أولي متعدد الكلون، قم بإجراء IF كما هو موضح أدناه قبل الانتقال إلى RNA FISH. إذا كان الفلورة المناعية يستخدم جسم مضاد أساسي أحادي النسيلة، ثم إجراء الفلورة المناعية كما هو موضح في الخطوة 3.3.1 بعد الخطوة 3.11.
ملاحظة: استخدام جهاز إزالة جديدة أو واحدة مع القليل جدا من بقايا لاصقة المقدمة من قبل الشركة المصنعة وتخفيف بلطف الغرف قبالة لمنع الشريحة من تكسير. استخدام الإيثانول 70٪ ككاشف نفاذية لمدة 4 ح يقلل إلى حد كبير من احتمال تكسير. في حالة وجود صدع، مواصلة البروتوكول على الغرف التي لا تتأثر الكراك ونضع في اعتبارها ارتفاع معدل الأكسدة من الشرائح مختومة بشكل ناقص (أي انخفاض عمر التخزين).- شطف الخلايا مع قبل المبردة 1X PBS وكتلة مع قبل المبردة 4٪ BSA (الزلال المصل البقري) / 1X PBS لمدة 30 دقيقة في 4 درجة مئوية.
ملاحظة: استخدام BSA خلال هذا البروتوكول يحد من وضع العلامات غير محددة. - إزالة حظر الحل وحضانة الخلايا مع 1:200 أو آخر الأجسام المضادة الأولية متعددة النسيلة في 0.1٪ BSA / 1X PBS لمدة ساعة 1 في 4 درجة مئوية. ثم يغسل ثلاث مرات مع 1X PBS.
ملاحظة: تم استخدام جسم مضاد10 للكشف عن SSB/ORF6 (بروتين ربط الحمض النووي الفيروسي الذي تقطعت به السبل مرة واحدة) في 1:200 تخفيف. - احتضان الخلايا مع الأجسام المضادة الثانوية مع الفلوروفور متوافق مع الأجسام المضادة للكشف عن الأسماك لمدة 1 ساعة في 4 درجة مئوية. غسل ثلاث مرات مع 1X PBS. ثم إصلاح مع 4٪ الفورمالديهايد / 1X PBS لمدة 10-15 دقيقة وpermeabilize مع إما تريتون-X أو 70٪ الإيثانول كما هو موضح سابقا قبل الشروع في FISH. تغطية الشريحة مع احباط القصدير للحفاظ على إشارة الفلورسنت ومنع تبييض الصور.
- شطف الخلايا مع قبل المبردة 1X PBS وكتلة مع قبل المبردة 4٪ BSA (الزلال المصل البقري) / 1X PBS لمدة 30 دقيقة في 4 درجة مئوية.
- غسل الخلايا مع 2X SSC (سيترات الصوديوم المالحة) مرة واحدة ثم تطبيق 45 ميكرولتر من محلول التهجين تتكون من 50٪ فورماميد، 10٪ كبريتات dextran، 2X SSC، 0.1٪ BSA، 500 ميكروغرام / مل السلمون الحيوانات المنوية الحمض النووي، 125 ميكروغرام / مل E. القولونية tRNA، و 1 mM الفاناديل الريبوونوكليوسيد مجمعات. حضانة لمدة 1 ساعة في 37 درجة مئوية في غرفة الرطوبة التي يمكن أن تكون طبق بيتري 150 ملم مع مناديل معقمة مبللة.
ملاحظة: إعداد حل التهجين جديدة ساعة على الأقل قبل الاستخدام. إذابة كبريتات dextran في الماء أولا، دوامة في كثير من الأحيان وحضانة في حمام المياه 37 درجة مئوية. - حساب أن يكون التركيز المقترح من 25 μM oligonucleotides في 35-uL حل التهجين لكل غرفة. ضبط تركيز oligonucleotide المضادة للشعور حسب الحاجة. إضافة الماء المقطر إلى oligonucleotides لجعل حجم denaturation إلى 10 درجة مئوية.
ملاحظة: بعد رد فعل وضع العلامات، يتم تخزين oligonucleotides في محلول مروي يحتوي على 0.18 M cacodylate البوتاسيوم، 23 mM Tris-HCl، 0.23 ملغ / مل BSA، 4.5 مل CoCl2،18 mM EDTA، 2.7 mM K-الفوسفات، و 6.8 مليون قدم مربع، 45 ميكرومتر 2-Mercaptoethanol 0.02٪ تريتون X-100، و 2٪ الجلسرين. التركيزات عالية بما فيه الكفاية أن التخفيف مع الماء سوف تجلب محلول التناطور إلى تركيزات قريبة من 1X TE (10 MM Tris-HCl و 1 MM EDTA)، وهو معيار oligonucleotide denaturation العازلة. - تشويه حفر و / أو اليكسا فلور 594 المسمى oligonucleotides في 95 درجة مئوية لمدة 5 دقائق. ثم إضافة 35 درجة مئوية حل التهجين الطازجة لكل غرفة المقصود إلى oligonucleotides مشوه. إذا كان أداء الأسماك مزدوجة، قد تكون كل من مجموعات من oligonucleotides المضادة للشعور مشوهة وهجينة معا.
- قم بإزالة حل ما قبل التهجين ثم قم بإضافة حل التهجين الذي يحتوي على oligonucleotides المسمى إلى الخلايا. حضانة بين عشية وضحاها في غرفة الرطوبة في 37 درجة مئوية مع رقائق القصدير لحماية oligonucleotides الفلوروفور المسمى.
ملاحظة: يجب أن يكون الحضانة 10 ساعة على الأقل ولا يزيد عن 24 ساعة. - في اليوم التالي، يغسل الخلايا مرتين مع 2X SSC لمدة 10 دقيقة في 37 درجة مئوية ثم مرتين مع 1X SSC لمدة 10 دقيقة في 25 درجة مئوية.
- إصلاح الخلايا مع ما قبل المبردة 4٪ الفورمالديهايد / 1X PBS لمدة 10-15 دقيقة على الجليد. ثم غسل الخلايا مع PBS ثلاث مرات وpermeabilize لمدة 1 ساعة مع الإيثانول المبردة مسبقا 70٪ أو لمدة 10 دقيقة مع قبل المبردة 0.5٪ تريتون-X / 1X PBS في 4 درجة مئوية.
- احتضان الخلايا مع 1:200 المضادة للحفر FITC في قبل المبردة 0.1٪ BSA / 1X PBS لمدة 1 ساعة في 4 درجة مئوية. إزالة محلول الأجسام المضادة وغسل ثلاث مرات مع PBS 1X.
- إصلاح مع ما قبل المبردة 4٪ الفورمالديهايد / 1X PBS لمدة 10-15 دقيقة في 4 درجة مئوية ثم يغسل ثلاث مرات مع 1X PBS. إذا كان أداء الفلورة المناعية للبروتين المضيف أو الفيروسي مع الأجسام المضادة الأولية أحادية النسيلة، نفاذية الخلايا ومن ثم تنفيذ بروتوكول IF المبينة في الخطوة 3.3.1. خلاف ذلك المضي قدما إلى تلطيخ DAPI.
- احتضان الخلايا مع 0.4 ميكروغرام / مل DAPI في قبل المبردة 0.5٪ تريتون-X / 1X PBS لمدة 15 دقيقة على الجليد ثم يغسل ثلاث مرات مع 1X PBS.
- قم بتركيب الشرائح مع الخرز الفلورسنت (اختياري) ووسيلة التركيب. ثم ختم غطاء للشريحة مع طلاء الأظافر واضحة.
- باستخدام المجهر البؤري، جمع الصور من العينات في غضون ساعة إلى أسبوع من تنفيذ البروتوكول في التكبير 630x. تطبيق معاطف متعددة من طلاء الأظافر لختم زلة الغطاء وإطالة عمر الفلوروفور عن طريق الحد من معدل الأكسدة.
ملاحظة: لا تستخدم وسيطة تركيب تحتوي على DAPI. عند جمع الصور، قم بتضمين شريط المقياس على كل صورة للتحديد الكمي لاحقًا. حبات الفلورسنت بمثابة ضوابط من شدة الفلورة بين الشرائح والاستعدادات عينة11. الحصول على الصور في القسم الأوسط من الخلية للتحديد الكمي ثنائي الأبعاد (2D) في الخطوة 4.
4. القياس الكمي للصور FISH وIF لتسليط الضوء على التوطين تحت الخلوي وتحديد نسبة النيوكليوسيتوبلازمية من الفلورة
- إجراء تحليل الصورة على كومة تجميعها من مختلف الصور الفلورية الملطخة والمدمجة لضمان الاتساق. تعيين مقياس برنامج تحليل الصور باستخدام شريط المقياس المضمن عند تجميع الصور.
- لتحديد كثافة الفلورة عبر عدة قنوات، وفي إشارة إلى وصمة عار DAPI النووية، استخدم أداة خط ووظيفة رسم ملف تعريف. ثم قم بالإشارة إلى السطر بشكل دائم على نسخة من الصورة باستخدام علامات لا تعيق أو تؤثر على حكم المشاهد.
- وضع معايير لتوجيه حيث يتم رسم الخط مثل تتبع يلتقط مجموعة متنوعة من الميزات الطبوغرافية والقمم والوديان، على طول محور مركزي أو خط لا يجتاز المناطق المشبعة.
ملاحظة: هذه الآثار خط تصور الفلورة الخام في خلية وبالتالي تقتصر على مقارنات من مواقع وصمة عار، وليس كثافة. لمقارنة كثافة نفس وصمة عار بين الشرائح، والعلاجات، أو الاستعدادات، إضافة حبة الفلورسنت إلى الشريحة كتحكم داخلي أثناء الخطوة 3.13. يجب إضافة حبة الفلورسنت أثناء عملية التركيب وكشفها مع نفس الإعدادات على الليزر الإثارة وأنبوب المضاعف الضوئي (confocal).
- وضع معايير لتوجيه حيث يتم رسم الخط مثل تتبع يلتقط مجموعة متنوعة من الميزات الطبوغرافية والقمم والوديان، على طول محور مركزي أو خط لا يجتاز المناطق المشبعة.
- لتحديد مقدار التحول في التعريب تحت الخلية، وحساب نسب النيوكليوسيتوبلازمية من الخلايا التي تخضع لعلاجات مختلفة.
- قياس المنطقة وشدة الفلورة الخام لكل من النواة والسيتوبلازم باستخدام وصمة عار DAPI النووية لتعيين الحدود الداخلية. تشمل الضوابط النووية والسيتوبلازمية مثل الحمض النووي الريبي النووي (على سبيل المثال، KSHV PAN RNA) والحمض النووي الريبي السيتوبلازمي (على سبيل المثال، المضيف GAPDH mRNA). وعلاوة على ذلك، حساب كثافة الخلفية لثلاث مناطق تشبه الخلية ومتوسط القيم لكل بكسل أو ميكرومتر2.
ملاحظة: تميل قيم الكثافة إلى نقص الوحدات وبالتالي يتم استخدام مصطلح 'وحدات'. - قم بتطبيع قيم الكثافة الخام النووية والخلوية عن طريق تحديد متوسط الخلفية لنفس المنطقة أولاً ثم طرح تلك القيمة الفردية من الكثافة الخام للمنطقة.
- على سبيل المثال، نواة خلية B lytic لديها مساحة 133.4 ميكرومتر2 وكثافة الخام من 75976 وحدة في حين تم تحديد كثافة الخلفية لنفس إشارة الفلورسنت لتكون 0.67 وحدة لكل ميكرومتر2. وستكون الكثافة النووية الطبيعية
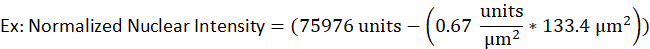
- على سبيل المثال، نواة خلية B lytic لديها مساحة 133.4 ميكرومتر2 وكثافة الخام من 75976 وحدة في حين تم تحديد كثافة الخلفية لنفس إشارة الفلورسنت لتكون 0.67 وحدة لكل ميكرومتر2. وستكون الكثافة النووية الطبيعية
- أدخل القيم في المعادلة التالية.

ملاحظة: عناصر تحكم الحساب هذا للتغييرات في المنطقة الفرعية. يمكن للحث اللتيك وعلاجات المخدرات تكبير النواة أو تغيير حجم الخلية، على التوالي. - لتفسير النتائج، قم بإنشاء قطعة خفقة مربع. وسيكون التوزيع المتساوي للإشارة الفلورية قريباً من الصفر، في حين أن التوزيع النووي من شأنه أن يفضل قيمة نسبة إيجابية، كما أن توزيع السيتوبلازمية من شأنه أن يتجه نحو قيمة نسبة سالبة.
- قياس المنطقة وشدة الفلورة الخام لكل من النواة والسيتوبلازم باستخدام وصمة عار DAPI النووية لتعيين الحدود الداخلية. تشمل الضوابط النووية والسيتوبلازمية مثل الحمض النووي الريبي النووي (على سبيل المثال، KSHV PAN RNA) والحمض النووي الريبي السيتوبلازمي (على سبيل المثال، المضيف GAPDH mRNA). وعلاوة على ذلك، حساب كثافة الخلفية لثلاث مناطق تشبه الخلية ومتوسط القيم لكل بكسل أو ميكرومتر2.
النتائج
وترد أساليب FISH وIF المفصلة في هذه المخطوطة في الشكل 1 جنبا إلى جنب مع التحديد الكمي للنتائج من خلال آثار خط شدة الفلورسنت. النتائج المعروضة هنا شبه كمية وتقدم نظرة ثاقبة في التوطين، بدلا من المقارنات بين كثافة من البقع الفلورية المختلفة لأن التجارب لم تشمل ...
Discussion
يمكن تكييف البروتوكول الموضح في هذا التقرير مع أنواع الخلايا المختلفة ويتضمن خطوات لسمك RNA وRNA FISH المزدوج مع IF باستخدام الأجسام المضادة الأولية أحادية النسيلة ومتعددة النسيلة. على الرغم من أن الشرائح المعدة عادة ما يتم تصويرها مع المجهر البؤري، يمكن إجراء التصوير مع مجهر STED (استنفاد الانب...
Disclosures
وليس لدى أصحاب البلاغ أي تضارب في المصالح للكشف عنها.
Acknowledgements
نشكر جوناثان رودنفيلز، كازيميرز تكوفسكي، ويوهانا ب. ويذرز على المشورة بشأن تحليل البيانات. كما نشكر ج. هايوارد على الأجسام المضادة لـ SSB. وقد تم دعم هذا العمل بمنحة T32GM007223 وT32AI055403 من المعاهد الوطنية للصحة (إلى TKV) ومنحة NIH (CA16038) (إلى JAS). JAS هو محقق في معهد هوارد هيوز الطبي. تم استنساخ الأشكال 1-3 والجدول 1 بإذن من الجمعية الأمريكية لعلم الأحياء الدقيقة بموجب ترخيص إسناد المشاع الإبداعي من المنشور التالي: Vallery, T. K., Withers, J. B., Andoh, J. A., Steitz, J. A. Kaposi's Sarcoma-Associated يتأثر تراكم فيروس الهربس في البؤر النووية بالنسخ المتماثل للحمض النووي الفيروسي والحمض النووي النووي المتعدد الشفرة غير الشفرة الفيروسية. مجلة علم الفيروسات. 92 (13)، دوي: 10.1128/JVI.00220-18، (2018).
Materials
| Name | Company | Catalog Number | Comments |
| AlexaFluor594-5-dUTP | Life Technologies | C1100 | |
| anti-DIG FITC | Jackson Lab Immunologicals | 200-092-156 | |
| Anti-Rabbit Secondary AlexaFluor594 Monoclonal Antibody | Invitrogen | A-11037 | Goat |
| Anti-SSB Antibody | N/A | N/A | Ref. Chiou et al. 2002 |
| BLASTn | NIH NCBI | N/A | Free Sequence Alignment Software |
| Dextran Sulfate | Sigma Aldrich | D8906 | Molecular Biology Grade |
| DIG-Oligonucleotide Tailing Kit | Sigma Roche | #03353583910 | 2nd Gen |
| Eight-Chamber Slides | Nunc Lab Tek II | #154453 | Blue seal promotes surface tension but separation by clear gel is also available. |
| Formamide | Sigma Aldrich | F9037 | Molecular Biology Grade |
| GAPDH Probes | Stellaris | SMF-2019-1 | Compatible with protocol, Quasar 670 |
| ImageJ | NIH, Bethesda, MD | N/A | Free Image Analysis Software, [http:rsb.info.nih.gov/ij/] |
| OligoAnalyzer | IDT | N/A | Free Oligonucleotide Analyzer |
| pcDNA3 | Invitrogen | A-150228 | |
| pmaxGFP | Amaxa | VDF-1012 | |
| Poly L-Lysine | Sigma Aldrich | P8920 | |
| Terminal Transferase | Sigma Roche | #003333574001 | |
| Vanadyl Ribonucleoside Complexes | NEB | S1402S | |
| Vectashield | Vector Laboratories, Inc. | H-1000 | DAPI within the mounting media scatters the light and reduces contrast. |
References
- Amen, M. A., Griffiths, A. Packaging of Non-Coding RNAs into Herpesvirus Virions: Comparisons to Coding RNAs. Frontiers in Genetics. 2, 81 (2011).
- Schmid, M., Speiseder, T., Dobner, T., Gonzalez, R. A. DNA virus replication compartments. Journal of Virology. 88 (3), 1404-1420 (2014).
- Pawlicki, J. M., Steitz, J. A. Primary microRNA transcript retention at sites of transcription leads to enhanced microRNA production. Journal of Cell Biology. 182 (1), 61-76 (2008).
- Borah, S., Darricarrere, N., Darnell, A., Myoung, J., Steitz, J. A. A viral nuclear noncoding RNA binds re-localized poly(A) binding protein and is required for late KSHV gene expression. Public Library of Science Pathogens. 7 (10), e1002300 (2011).
- Tycowski, K. T., Shu, M. D., Borah, S., Shi, M., Steitz, J. A. Conservation of a triple-helix-forming RNA stability element in noncoding and genomic RNAs of diverse viruses. Cell Reports. 2 (1), 26-32 (2012).
- Weinberg, R. A., Penman, S. Small molecular weight monodisperse nuclear RNA. Journal of Molecular Biology. 38 (3), 289-304 (1968).
- Myoung, J., Ganem, D. Generation of a doxycycline-inducible KSHV producer cell line of endothelial origin: maintenance of tight latency with efficient reactivation upon induction. Journal of Virology Methods. 174 (1-2), 12-21 (2011).
- Brulois, K. F., et al. Construction and manipulation of a new Kaposi's sarcoma-associated herpesvirus bacterial artificial chromosome clone. Journal of Virology. 86 (18), 9708-9720 (2012).
- Sturzl, M., Gaus, D., Dirks, W. G., Ganem, D., Jochmann, R. Kaposi's sarcoma-derived cell line SLK is not of endothelial origin, but is a contaminant from a known renal carcinoma cell line. International Journal of Cancer. 132 (8), 1954-1958 (2013).
- Chiou, C. J., et al. Patterns of gene expression and a transactivation function exhibited by the vGCR (ORF74) chemokine receptor protein of Kaposi's sarcoma-associated herpesvirus. Journal of Virology. 76 (7), 3421-3439 (2002).
- Cole, R. W., Jinadasa, T., Brown, C. M. Measuring and interpreting point spread functions to determine confocal microscope resolution and ensure quality control. Nature Protocols. 6 (12), 1929-1941 (2011).
- Nakamura, H., et al. Global changes in Kaposi's sarcoma-associated virus gene expression patterns following expression of a tetracycline-inducible Rta transactivator. Journal of Virology. 77 (7), 4205-4220 (2003).
- Majerciak, V., Yamanegi, K., Zheng, Z. M. Gene structure and expression of Kaposi's sarcoma-associated herpesvirus ORF56, ORF57, ORF58, and ORF59. Journal of Virology. 80 (24), 11968-11981 (2006).
- Sun, R., Lin, S. F., Gradoville, L., Miller, G. Polyadenylylated nuclear RNA encoded by Kaposi sarcoma-associated herpesvirus. Proceedings of the National Academy Sciences U S A. 93 (21), 11883-11888 (1996).
- Vallery, T. K., Withers, J. B., Andoh, J. A., Steitz, J. A. Kaposi's Sarcoma-Associated Herpesvirus mRNA Accumulation in Nuclear Foci Is Influenced by Viral DNA Replication and Viral Noncoding Polyadenylated Nuclear RNA. Journal of Virology. 92 (13), (2018).
- Borah, S., Nichols, L. A., Hassman, L. M., Kedes, D. H., Steitz, J. A. Tracking expression and subcellular localization of RNA and protein species using high-throughput single cell imaging flow cytometry. RNA. 18 (8), 1573-1579 (2012).
- Bruce, A. G., et al. Quantitative Analysis of the KSHV Transcriptome Following Primary Infection of Blood and Lymphatic Endothelial Cells. Pathogens. 6 (1), (2017).
- Chen, C. P., et al. Kaposi's Sarcoma-Associated Herpesvirus Hijacks RNA Polymerase II To Create a Viral Transcriptional Factory. Journal of Virology. 91 (11), (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved