A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פלואורסצנטית כמותי באתרו היברידיזציה (דג) ו Immunofluorescence (IF) של מוצרים גנטיים ספציפיים בתאים שנדבקו KSHV
In This Article
Summary
אנו מתארים פרוטוקול ניצול הקרינה היברידיזציה באתרו (דג) כדי להמחיש RNAs מרובים של הרפס בתוך תאים אנושיים נגועים ליקיה, או בהשעיה או חסיד. פרוטוקול זה כולל כימות של זריחה המייצרת יחס נוקלאוציטוסמטי וניתן להארכה להדמיה סימולטני של חלבונים מארחים ונגיליים עם immunofluorescence (IF).
Abstract
תובנה מכניסטית מגיעה מלמידה קפדנית ומקוונפיקציה של RNAs וחלבונים ספציפיים. המיקומים היחסיים של biomolecules אלה ברחבי התא בזמנים ספציפיים יכולים להילכד עם אור היברידיזציה באתרו (דג) ו immunofluorescence (IF). במהלך זיהום וירוס lytic, הנגיף מעורר את התא המארח כדי להיות מעדיפים לבטא גנים ויראליים, גרימת שינויים במבנה התא והתנהגות של biomolecules. פעילויות lytic ממורכזים במפעלים גרעיניים, כינה תאי שכפול ויראלי, אשר ניתן להבחין רק עם דגים ו IF. כאן אנו מתארים פרוטוקול הסתגלות של ה-RNA פיש, אם טכניקות עבור סרקומה של קפושי וירוס הקשורים (KSHV)-תאים נגועים, שניהם חסיד ו השעיה. השיטה כוללת שלבים להתפתחות של מחלת האנטי-סנס מסוימת, דגי RNA כפולים, דגי RNA עם IF, וחישובים כמותיים של עוצמות הזריחה. פרוטוקול זה הוחל בהצלחה על סוגי תאים מרובים, תאים לא נגוע, תאים סמויים, תאים lytic, זמן קורסים, ותאים מטופלים עם מעכבי לנתח את הפעילויות הטמפורלית של rnas וחלבונים ספציפיים מהמארח האנושי ו . לא, לא.
Introduction
בשלב lytic שלהם, הרפס לחטוף את התא המארח, גרימת שינויים במבנה התא ולוקליזציה של מולקולות ביולוגיות, כדי לייצר הריטונים. הבסיס של המבצעים הוא הגרעין, שבו הגנום כפול ויראלי DNA הוא משוכפל וארוזים לתוך קליפת חלבון, נקרא capsid1. כדי להתחיל, הווירוס מבטא חלבונים משלו, חטיפת מכונות מארח ומניעת ביטוי של גנים מארחים שאינם חיוניים, תהליך המכונה אפקט שוטוף מארח. רוב הפעילות הזאת הוא מקומי ספציפי 4 ′, 6-diamidino-2-phenylindole (DAPI)-אזורים גרעיניים ללא תשלום הנקרא תאי שכפול ויראלי, מורכב הן חלבונים מארחים ויראלי, RNAs, ו-DNA נגיפי2. התא הוא מוגזם כדי לספק מרחב ומשאבים עבור תאי השכפול ובכך הרכבה של הקפידים ויראלי. ברגע שהקפסיד יוצא מהגרעין, כיצד הקפיסיד אפוף בציטופלסמה כדי לייצר חלקיק נגיפי מאוגד, הידוע גם בשם וויריאון, אינו ברור. הבנת הלוקליזציה והשינויים המרחביים של הbiomolecules המארחים והנגיפי במהלך השלב lytic מספק תובנה מכניסטית עמוקה יותר לתוך הסידור של תא השכפול, אפקט שוביטוף מארח, מסלול היציאה והמעבר, ועוד תהליכים הקשורים לזיהום ושכפול הרפס.
כיום השיטה הטובה ביותר לזהות וללמוד שינויים אלה היא ויזואליזציה של חלבונים ו-RNAs בתאים נגועים עם immunofluorescence (IF) ו פלורסנט באתרו היברידיזציה (דג), בהתאמה. שימוש בזמן-קורס עם טכניקות אלה חושף את הלוקליזציה של biomolecules בנקודות מפתח של השלב lytic או פשוט, הנתונים הזמני. דגים ואם משלימים טכניקות ביוכימיות אחרות, כגון עיכוב של תהליך הסלולר (למשל, עיכוב של שכפול ה-DNA ויראלי), RT-qpcr (תגובת שרשרת פולימראז בזמן אמת), רצפי RNA, בלוטים צפוניים, ספקטרומטר מסה, בלוק מערבי, ו ניתוח של ייצור ה-DNA נגיפי, כי עשוי לספק תמונה גלובלית יותר של פעילויות סלולריות.
פיתחנו את האסטרטגיות של ה-RNA לבדיקת מוצרי RNA מגנים ספציפיים ואנליזה חישובית המחשבת את היחס הנוקלאולוציציסמטי של מוצר גנטי מסוים. הכנת המדגם, שונה מפרסומים קודמים על ידי steitz ועמיתים3,4, הוא קל יחסית והוא יכול לשמש הן מחסיד והן תאים מושעה. הפרוטוקול הוא גם להתאמה לשימוש בו זמנית של מספר אסטרטגיות RNA דגים (כפול רנ א) או דג RNA עם אסטרטגיות IF. פיתוח אסטרטגיית דגים ספציפית מאתגרת, אך הצעות לשיפור ההצלחה מתוארות במיתאר. ניתוח הנתונים המתואר כאן הוא כמותי אם חרוזי פלורסנט וסמנים חזקים של גבולות תא משמשים ומציעה תובנה נוספת במיקרוגרפים, תובנה המסירה הטיית תצפית. הפרוטוקול המפורט מיועד לתאים סמויים וליטיק נגוע בווירוס הקשורות סרקומה של קפושי (KSHV) והוא יכול לשמש עם תאים לא נגועים או תאים נגועים על ידי אחרים הרפס5. שיטות הקוונלויות הינן ישימות למחקרים על משמרות נוקלאוציטוצילסמטי או לוקליזציה מחדש בין תאי משנה ברוב התאים.
Protocol
1. עיצוב של הקרינה הפלואורסצנטית (דג) אנטי-סנס מקומית לזיהוי תעתיק מסוים של הרפס
- בחר 25 כדי 40 nt מקטעים מתוך רצף של RNA של עניין ולהמיר להיות אנטי הגיוני. אסטרטגיית דגים מוצלחת עשויה להכיל מאחד עד עשר או יותר אנטי-סנס שונה ומאוזן. בעת בחירת רצפים, שקול את הפרטים הבאים:
- אם ה-RNA של הריבית מכיל אזור חוזר ייחודי, ולאחר מכן הקלד את האות הרישית בתכונה זו ועצב את הפעולה האנטי-מונואותית נגד התחושה כדי למקד את רצף החזרה.
הערה: Tycowski ועמיתים5 לספק דוגמה של אסטרטגיה זו עם רזוס השרירים (rrv) הגרעין הגרעיני (פאן) RNA. - אם ה-RNA של הריבית מכיל אתר בעל כריכת חלבונים מוכר או מבנה לולאת-לולאה, עיצוב מיני-ליגונואודים הנמנעים מאזורים אלה.
- בהתאם ליעדי הניסויים, שקול את הרצף האינטרואני, והאם לתכנן את הדבר האנטי-מונואני.
- אם ה-RNA של הריבית מכיל אזור חוזר ייחודי, ולאחר מכן הקלד את האות הרישית בתכונה זו ועצב את הפעולה האנטי-מונואותית נגד התחושה כדי למקד את רצף החזרה.
- בצע ניתוחים חישוביים פשוטים ברצפי האנטי-סנס הנבחרים כדי להבטיח ספציפיות לכריכה ולצמצם את הצבירה של האנטי-שגיאות נגד היגיון.
- הרצפים חייבים להיות כ-50% GC עשיר (התוכן הגבוה גואנין ו ציטוסינוס) ויש להם טמפרטורת ההיתוך בטווח של 60 כדי 70 ° c.
- השתמשו בכלי מנתח רצף כדי לבחור רצפים שאינם מדיכים את עצמם או את סיכות השיער בטמפרטורות ההיתוך מעל 37 ° c, טמפרטורת הכלאה.
- ביצוע BLASTn NCBI ק (המרכז הלאומי למידע ביוטכנולוגיה בסיסי מידע יישור מקומי הכלי חיפוש עבור מערכים נוקלאוטיד) חיפוש של הרצפים שנבחרו נגד הן מארח ויראלי ההמרה באמצעות ההגדרה ' דומה במקצת '. חיפוש זה יזהה אנטי-סנס מיוחד ומלא-רגיש שסביר להניח שהוא לא ייאגד לתעתיקים אחרים של המחשב המארח או הנגיפי.
הערה: אם ההמרה אינם זמינים, בצע את החיפוש הפיצוץ עם רצפי גנומי. זה אידיאלי אם החיפושים מבוצעים על רצפי מן הווירוס מבודדים מן התאים הנגועים בשימוש בניסוי כי זנים פראי נוטים לגוון ולהכיל שילוב של רצפים מתוך זנים מעבדה שונים.
- הזמנת ה-DNA מטוהרים olig, מתאים לרצף אנטי-ההיגיון כי כבר מאומת בחינה חישובית להיות ייחודי וסביר לאגד את RNA היעד. אין צורך להציג שינויים מיוחדים. בתוך מחלת האוליונודים
- בדוק את מחלת האנטי-סנס המעוצבת באמצעות מחייב של דגים וכתמי צפון.
- באמצעות שורת תא לא נגוע מאותו זן מארח (למשל, 293T) ובאופן אידיאלי את אותו סוג תא, לנהל את הקשר עם פלסטלינה ביטוי ה-RNA של עניין מיזם חזק (CMV, cytomegalovirus) ואחד עם וקטור ריק (למשל, pcDNA3). השתמש בשליטה חיובית עבור העברה כגון שיתוף החצייה עם GFP (חלבון פלורסנט ירוק) פלפריאמצע (g., pmaxGFP) או וקטור המכיל GFP.
הערה: חשוב להימנע מקווי התאים שכבר הונצח באמצעות וירוס הרפס אפשטיין-בר (EBV) מאחר שקיימים קווי דמיון בין הרפס. - בצע את הדגים כפי שמתואר בסעיף 3 בשני הסטים של התאים עם מחלת האנטי-ביגורונואוטיים כמתואר בפרוטוקול זה. להסיק את המועמדים המצליחים על ידי השוואת ניסויים דגים עם הפרט, זוגות, או סטים של האנטי ההיגיון oligonucleotides. השתמש בפקד חיובי עבור פרוטוקול הדג כגון U2 snRNA (RNA גרעיני קטן) דג, הווה ב 500,000 עותקים לכל גרעין התא האנושי6 (טבלה 1).
- אות הפלורסנט צריך להיות ספציפי וחזק בתא המכיל את ה-RNA של הריבית. לעצב עוד מחלת האנטי-סנס-מילולית כדי לחזק את האות ולהסיר את מחלת האנטי-מונוליתים שאינם מתחשבים במיוחד. עוצמת האות חייבת להיות מעל לרקע ולפלואורסצנטית אוטומטי.
- בדוק ספציפיות לכריכה על-ידי אבן חשופה צפונית.
- באמצעות שורת תא לא נגוע מאותו זן מארח (למשל, 293T) ובאופן אידיאלי את אותו סוג תא, לנהל את הקשר עם פלסטלינה ביטוי ה-RNA של עניין מיזם חזק (CMV, cytomegalovirus) ואחד עם וקטור ריק (למשל, pcDNA3). השתמש בשליטה חיובית עבור העברה כגון שיתוף החצייה עם GFP (חלבון פלורסנט ירוק) פלפריאמצע (g., pmaxGFP) או וקטור המכיל GFP.
2. הכנות והכנת תאים
- בעקבות ההוראות של היצרן, השתמש בטרמינל טרנספראז כדי לתייג את האנטי-חוש מחלת החמצון עם dioxigenin (לחפור)-dutp או, אם מחייב בחוזקה, ישירות עם נוקלאוטיד הפלורסנט כמו אלקסה fluor 594-5-dutp. לאחר תיוג, אין צורך בטיהור נוסף. החנות מתויג oligונומטר ב-20 ° c עד מספר שנים וברדיד פח, אם מתויג ישירות כדי למנוע הלבנה.
התראה: פתרון התיוג מכיל חומר רעיל, ואשלגן מאוחר. טיפול תגובות תיוג עם כפפות.
הערה: כדי לחסוך במשאבים, ניתן לתייג מספר משאבים שונים של אנטי-סנס בתגובה אחת. פרוטוקול זה מנצל 3 '-end תיוג. תיוג פנימי מאתגר כי הקבוצה הכימית (למשל, לחפור או fluorophore) נתפס או אינו מסוגל להיכנס לאתר הפעיל של ה-DNA פולימראז. ניסוי עם שני RNAs שונים ניתן לבצע באמצעות התווית ישירות אנטי-הגיוני ואנטי לחפור אימונוofluorrvrorrrrg עם fluorophore למשל, FITC (fluorophore) או אלקסה Fluor 488 עם אלקסה Fluor 594). - להתאים את התאים לשקופיות שמונה בחדר.
הערה: השקופיות הקאמריות מאפשרות מספר ניסויים בו זמנית, תוך מזעור משאבים יקרי ערך כמו נוגדנים. חלופה לשמונה שקופיות קאמרית היא לוחית שישה היטב של תרבות הרקמה עם שמיכות סטנדרטיות (22 מ"מ x 22 מ"מ) שניהם עקרים. סידור דומה אפשרי עם שמיכות עגול ולוחית של תרבות 24 רקמה. עבור שניהם, להגדיל את אמצעי האחסון שהוזכרו בפרוטוקול זה על ידי 10-15x (למשל, 1.75 mL פתרון הכלאה), ו 4x (למשל, 600 μL הכלאה פתרון) בהתאמה.- עבור תאים ליטיים חסיד, השתמש ב-1x טריפסין/PBS ב 37 ° צ' ו 5% CO2 עבור 10 דקות כדי להשעות את התאים ולדלל ל 60% שליטה.
הערה: קווי תאים מחסיד המשמשים ניסויים דגים כללה 293T, iSLK. 2197, ו ISLK-BAC36 תאים8. - החל 200 μL של השעיית תא לכל תא של שקופיות סטרילי שמונה שעות ולאפשר צמיחת זרעים עבור 12-24 h ב 37 ° צ' ו 5% CO2. התאם את הנדרש לתאים איטיים או בעלי צמיחה מהירה ועבור תאים הפגומים בקלות על-ידי טריפסין.
הערה: המטרה היא שתאים מרווחים באופן שווה מחוברים היטב לשקופית. שקול לגרימת השלב lytic לאחר הדבקה אם התאים lytic הם שבירים. מסקנות שנמשכו מניסויים. עם תאים מוגבלים ב-9 - עבור lytic ההשעיה תאים, טרום לטפל שמונה שקופיות קאמרית עם 1:10 פולי L-ליזין עבור 5 דקות תחת כיסוי התרבות רקמה. ואז להשאיר את השקופיות להתייבש בלילה בטמפרטורת החדר או 1 h ב 65 ° c. דגירה 800 μL של תאים lytic בריכוז של 1 x 106 תאים/mL עם שקופיות החדרניות עבור 30 דקות עד 1 h ב 37 ° צ' ו 5% CO2.
הערה: ההשעיה-תאים יהיה ליישב מונאולייר, נדבק ליזין פולי ולכן התאים העודפים אינם חשש בהשוואה לתאים חסיד. התאים lytic היוצרים אשכולות ענבים, אם אפשרי, צריך להיות מופרדים על ידי וורטקנג עדין או אמצעים כימיים. יש להודות, המחברים לא היה הצלחה רבה עם המלצות כאלה במקרה של lytic BJAB-RRV תאים. אם ההשעיה-תאים לא לדבוק היטב, לשקול להגדיל את הזמן או הריכוז של הדגירה פולי L-ליזין.
- עבור תאים ליטיים חסיד, השתמש ב-1x טריפסין/PBS ב 37 ° צ' ו 5% CO2 עבור 10 דקות כדי להשעות את התאים ולדלל ל 60% שליטה.
3. קיבעון, אימונואופלוורנציה (אופציונלי), היברידיזציה, ויזואליזציה של RNAs ויראלי
- הסר מדיה ותאים עודפים. במהלך פרוטוקול זה, השתמש שאיבה ואקום כדי להסיר פתרונות ומיקרופיליטוף עדין כדי להוסיף פתרונות.
הערה: החוזק של ואקום יכול להיות מופחת על ידי הצבת קצה 200 μL מיקרופיפטה על גבי הזכוכית פסטר. החליפו את העצה המיקרופיפטה בין שטיפת הצעדים כדי למנוע זיהום. כל צעד לשטוף חייב להתבצע במהירות, כי זה הכרחי כי התאים לעולם לא להתייבש. - מיד, לתקן את התאים עם מקורר מראש 4% פורמלדהיד/PBS (מלוחים באגירה פוספט) על הקרח 30 דקות. לשטוף את התאים שלוש פעמים עם 200 μL 1x PBS מקורר 4 ° צ' ו דגירה עבור 5 דקות בטמפרטורת החדר או על הקרח.
- החדירות התאים קבוע עם 200 μL של טרום מקורר 0.5% טריטון-X/PBS (מלוחים באגירה פוספט) עבור 10 דקות על קרח או 750 μL של טרום מקורר 70% אתנול ב 4 ° צ' עבור 1 h (דקות) כדי 7 d (מקסימום).
הערה: לאסוף חלבון, כולל RNA, ודגימות דנ א גנומית בנקודת הקיבעון כדי להבטיח עקביות בין התמונות הביוכימי אומר. כל שוטף בפרוטוקול זה מבוצעים באותו אופן אלא אם צוין אחרת. 70% אתנול משחרר את הדבק בין התאים לבין השקופית, המקל על הפרדה מאוחרת יותר, ומספק גם הפוגה משמעותית בפרוטוקול. עם זאת, השימוש בסרט פרפין סביב השקופית הקאמרית כדי להפחית את האידוי ולבדוק את רמת האתנול בכל חדר על כל 8 h. 70% אתנול גם ששטף את התאים, ביצוע התמונה מצנן, בעוד טריטון-X אינו מפחית את התאים ולשנות את ממדים של התא.
- החדירות התאים קבוע עם 200 μL של טרום מקורר 0.5% טריטון-X/PBS (מלוחים באגירה פוספט) עבור 10 דקות על קרח או 750 μL של טרום מקורר 70% אתנול ב 4 ° צ' עבור 1 h (דקות) כדי 7 d (מקסימום).
- להסיר את הלשכה בקפידה כדי למנוע פיצוח השקופית. אם הניסוי כולל immunofluorescence (IF) של חלבון ויראלי או מארח עם נוגדן ראשוני רב שבטים, לבצע את IF כפי שמתואר להלן לפני שאתה ממשיך ל-RNA FISH. אם האימונולופסינציה משתמשת בנוגדן ראשוני חד-שבטיים, לאחר מכן לבצע מאימונו3.3.1 לאחר מכן כמתואר בשלב לאחר שלב 3.11.
הערה: השתמש במכשיר הסרה טרי או אחד עם דבק קטן מאוד שאריות שסופקו על ידי היצרן ולהקל בעדינות את החדרים כדי למנוע סדיקה של השקופית. שימוש 70% אתנול כמו החדיר הכימית של 4 h מפחית במידה ניכרת את הסבירות של סדיקה. במקרה של סדק, להמשיך את הפרוטוקול על צ'יימברס לא מושפע הסדק ולהיות מודעים שיעור חמצון גבוה יותר של שקופיות אטום לחלוטין (כלומר ירידה בחיים האחסון).- לשטוף את התאים עם מקורר 1 x PBS ולחסום עם pre-מקורר 4% BSA (סרום שור)/1x PBS עבור 30 דקות ב 4 ° c.
הערה: השימוש ב-BSA לאורך פרוטוקול זה מגביל תיוג שאינו ספציפי. - הסרת פתרון חסימת ו-מודתאת התאים עם 1:200 או אחר נוגדן ראשי רב שבטיים ב 0.1% BSA/1x PBS עבור 1 h ב 4 ° c. ואז לרחוץ שלוש פעמים עם 1x PBS.
הערה: נוגדן10 עבור זיהוי של ssb/ORF6 (ויראלי אחד תקוע חלבון איגוד ה-DNA) שימש ב 1:200 דילול. - דגירה את התאים עם נוגדן משני עם fluorophore תואם את הנוגדן זיהוי דגים עבור 1 h ב 4 ° c. לרחוץ שלוש פעמים עם 1x PBS. לאחר מכן לתקן עם 4% פורמלדהיד/1x PBS עבור 10-15 דקות והחדירות עם טריטון-X או 70% אתנול כפי שתוארה בעבר לפני שתמשיך דג. כיסוי שקופית עם רדיד אלומיניום כדי לשמר את האות פלורסנט ולמנוע הלבנה.
- לשטוף את התאים עם מקורר 1 x PBS ולחסום עם pre-מקורר 4% BSA (סרום שור)/1x PBS עבור 30 דקות ב 4 ° c.
- לשטוף את התאים עם 2 x למטה (מלוחים נתרן ציטראט) פעם אחת ולאחר מכן להחיל 45 μl של פתרון היברידיזציה המורכבת של 50% בטופס1, 10% תוספי סולפט, 2x למעלה, 0.1% bsa, 500 μg/ml דנ א הזרע, 125 μg/ml E. coli , ו 1 מתחמי. מודטה עבור 1 h ב 37 ° c בחדר לחות שיכול להיות 150 מ"מ צלחת פטרי עם מגבונים סטרילי לחלח.
הערה: הכינו פתרון הכלאה טרי לפחות שעה לפני השימוש. לפזר את תוספי סולפט במים הראשון, vortexing לעתים קרובות הדגירה ב 37 בג ° c באמבט מים. - חישוב כדי לקבל ריכוז מוצע של 25 μM ליגורונומטר בפתרון היברידיזציה 35-uL לכל תא. התאימו את ריכוז האנטי-סנס. בזמן הדרוש הוסף מים מזוקקים ל-פורוזימטר כדי להביא את נפח הדנטורציה ל -10 μl.
הערה: בעקבות תגובת התיוג, מאוחסנים האוליונוקלאודים בתמיסה הקרה המכילה 0.18 מ' אשלגן, 23 מ"מ-HCl, 0.23 mg/mL BSA, 4.5 mM CoCl2, 18 מ"מ edta, 2.7 mM K-פוספט, ו-6.8 Mm kcl, 45 μm 2-Mercaptoethanol, 0.02% טריטון X-100, ו 2% גליצרול. הריכוזים גבוהים מספיק כי דילול עם המים יביא את הפתרון דנטורציה לריכוזים ליד 1 x TE (10 מ"מ טריס-HCl ו 1 מ"מ edta), מאגר מדיה רגילה של נוקלאוטידים. - הספרות לחפירות החפירה ו/או אלקסה פלואור 594 מסומנות ב-95 ° c עבור 5 דקות. לאחר מכן להוסיף 35 μL פתרון היברידיזציה טרי לכל חדר מיועד לחדרי ההקפאה. אם ביצוע של דג כפול, שתי הקבוצות של מחלת המין האנטי-הגיוניות עלולות להיות מהוכלא ביחד.
- הסר את הפתרון הקדם-היברידיזציה ולאחר מכן הוסף פתרון היברידיזציה המכילה את התאים המסומנים בתווית לתאי החיבור. המלון משלב בין לילה בחדר הלחות ב-37 מעלות צלזיוס עם רדיד פח כדי להגן על הלוגונואולוגאנוגורידים המתויגים.
הערה: הדגירה צריכה להיות לפחות 10 h ולא יותר מ 24 שעות. - למחרת, לשטוף את התאים פעמיים עם התחנה השנייה של 2 x עבור 10 דקות ב 37 ° c ולאחר מכן פעמיים עם 1x לפחות 10 דקות ב -25 ° c.
- תקן את התאים עם טרום מקורר 4% פורמלדהיד/1x PBS עבור 10-15 דקות על הקרח. ואז לשטוף את התאים עם PBS שלוש פעמים וחדירות עבור 1 h עם טרום מקורר 70% אתנול או 10 דקות עם pre-מקורר 0.5% טריטון-X/1x PBS ב 4 ° c.
- דגירה את התאים עם 1:200 נגד לחפור FITC ב טרום מקורר 0.1% BSA/1x PBS עבור 1 h ב 4 ° c. הסר את פתרון נוגדן ולשטוף שלוש פעמים עם 1x PBS.
- תקן עם טרום מקורר 4% פורמלדהיד/1x PBS עבור 10-15 דקות ב 4 ° צ' ולאחר מכן לשטוף שלוש פעמים עם 1x PBS. במקרה של ביצוע אימונולופסיזציה למחשב מארח או חלבון נגיפי עם נוגדן ראשוני חד שבטיים, יש לחלחל את התאים ולאחר מכן לבצע את הפרוטוקול IF המתואר בשלב 3.3.1. אחרת, המשך לצביעת DAPI.
- דגירה את התאים עם 0.4 μg/mL DAPI ב טרום מקורר 0.5% טריטון-X/1x PBS עבור 15 דקות על הקרח ולאחר מכן לשטוף שלוש פעמים עם 1x PBS.
- טעינת שקופיות עם חרוזי פלורסנט (אופציונלי) ומדיום הרכבה. ואז לאטום את הכיסויים. לשקופית עם לק ברור
- באמצעות מיקרוסקופ קונפוקלית וקד, לאסוף תמונות של דגימות תוך שעה עד שבוע של ביצוע הפרוטוקול בהגדלה 630x. להחיל מספר מעילים של מסמר לק כדי לאטום את שובר הכיסוי כדי להאריך את החיים fluorophore ידי הפחתת שיעור של חמצון.
הערה: אין להשתמש במדיום הכולל המכיל DAPI. בשעת איסוף התמונות, כלול את סרגל הסרגל בכל תמונה לצורך כימות מאוחר יותר. חרוזי פלורסנט משמשים כפקדים של עוצמת קרינה פלואורסצנטית בין שקופיות לבין ההכנות לדוגמה11. השיגו תמונות בחלק האמצעי של התא לקוונפיקציה דו-ממדית (2D) בשלב 4.
4. הכמת של דגים ותמונות IF כדי להדגיש לוקליזציה subcellular כדי לקבוע את היחס הנוקלאולוציטוסמטי של הזריחה
- בצעו ניתוח תמונה בערימה שהורכבה של התמונות השונות של הפלורסנט והממוזגות כדי להבטיח עקביות. קבעו את קנה המידה של תוכנת ניתוח התמונה באמצעות סרגל הקנה מידה שנכלל בעת איסוף התמונות.
- כדי לכמת את עוצמת הקרינה הפלואורסצנטית על פני מספר ערוצים ובהתייחסות לכתם DAPI גרעיני, השתמש בכלי קו ובפונקציית פרופיל מזימה. לאחר מכן ציינו את הקו לצמיתות על עותק של התמונה באמצעות סמנים שאינם משפיעים על שיקול הדעת של הצופה.
- בסס קריטריונים להנחות במקומות שבהם הקו מצויר, כגון מעקב הלוכד מגוון של תכונות טופוגרפיות, פסגות ועמקים, לאורך ציר מרכזי או קו שאינו חוצה אזורים בעלי רוויה.
הערה: סימני הקווים האלה מתארים את הקרינה הגולמית בתא ולכן הם מוגבלים להשוואות של מיקומי הכתם, לא בעוצמה. כדי להשוות בין עוצמות הכתמים של אותו הכתם בין שקופיות, טיפולים או הכנות, הוסף מחרוז פלורסנט לשקופית כפקד פנימי במהלך שלב 3.13. חרוז פלורסנט יש להוסיף במהלך תהליך ההרכבה וזיהה עם הגדרות זהות על לייזר עירור ושפופרת פוטולטיפייר (confocal וקד).
- בסס קריטריונים להנחות במקומות שבהם הקו מצויר, כגון מעקב הלוכד מגוון של תכונות טופוגרפיות, פסגות ועמקים, לאורך ציר מרכזי או קו שאינו חוצה אזורים בעלי רוויה.
- כדי לכמת משמרת בלוקליזציה הסלולר, לחשב יחס נוקלאולוצילסמטי של תאים שעברו טיפולים שונים.
- למדוד את האזור ואת עוצמת הזריחה הגולמית של הגרעין הן הציטופלסמה באמצעות הכתם DAPI גרעינית כדי להגדיר את הגבול הפנימי. כלול שולטת גרעינית ו cytoplasmic כגון RNA גרעיני (g., KSHV פאן RNA) ו-RNA cytoplasmic (g., מארח מארחים של המרכז הרחב). יתר על כן, לחשב את עוצמת הרקע עבור שלושה אזורים כמו תא וממוצע הערכים לפיקסל או יקרומטר2.
הערה: ערכי העוצמה נוטים להיעדר יחידות ולכן המונח ' יחידות ' משמש. - לנרמל את הערכים הגרעיניים והסלולאריים בעוצמות התקשורת על-ידי קביעת הרקע הממוצע לאותו אזור ולאחר מכן הפחתת הערך האינדיווידואלי מעוצמת הגלם של האזור.
- לדוגמה, הגרעין של תא B-lytic יש שטח של 133.4 יקרומטר2 ו עוצמה גולמית של 75976 יחידות בעוד עוצמת הרקע של אותו אות פלורסנט נקבע להיות 0.67 יחידות לכל יקרומטר2. העוצמה הגרעינית המנורמלת תהיה
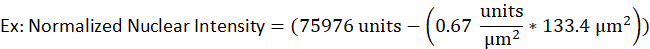
- לדוגמה, הגרעין של תא B-lytic יש שטח של 133.4 יקרומטר2 ו עוצמה גולמית של 75976 יחידות בעוד עוצמת הרקע של אותו אות פלורסנט נקבע להיות 0.67 יחידות לכל יקרומטר2. העוצמה הגרעינית המנורמלת תהיה
- הזן את הערכים במשוואה הבאה.

הערה: בקרי חישוב אלה עבור שינויים באזור משנה הסלולרית. האינדוקציה הליטיק וטיפולי הסמים יכולים להגדיל את הגרעין או לשנות את גודל התא, בהתאמה. - כדי לפרש את התוצאות, צור מזימה הקצבה תיבה. התפלגות שווה של אות הפלורסנט יהיה קרוב לאפס, בעוד התפלגות גרעינית לטובת ערך יחס חיובי התפלגות cytoplasmic היה מגמה לקראת ערך יחס שלילי.
- למדוד את האזור ואת עוצמת הזריחה הגולמית של הגרעין הן הציטופלסמה באמצעות הכתם DAPI גרעינית כדי להגדיר את הגבול הפנימי. כלול שולטת גרעינית ו cytoplasmic כגון RNA גרעיני (g., KSHV פאן RNA) ו-RNA cytoplasmic (g., מארח מארחים של המרכז הרחב). יתר על כן, לחשב את עוצמת הרקע עבור שלושה אזורים כמו תא וממוצע הערכים לפיקסל או יקרומטר2.
תוצאות
שיטות ה-FISH ו-IF המפורטות בכתב יד זה מוצגות באיור 1 יחד עם כימות התוצאות בעקבות שורות של עוצמת פלורסנט. התוצאות המוצגות כאן הן למחצה כמותיים ומציעות תובנה לוקליזציה, ולא להשוואות בין עוצמות של כתמי פלורסנט שונים, משום שניסויים לא כללו מכלול פלורסנט בהכנה לשק...
Discussion
הפרוטוקול המתואר בדו ח זה יכול להיות מותאם לסוגי תאים שונים וכולל שלבים עבור כפול RNA פיש ו-RNA דגים עם אם באמצעות שבטים מונוניים ונוגדנים ראשוניים רב שבטיים. למרות שקופיות מוכנות הם בדרך כלל בתמונה עם מיקרוסקופ קונפוקלית וקד, הדמיה ניתן לבצע עם מחסור בפליטה ממריצים) לאחר שינויים של ריכוז הנו...
Disclosures
למחברים אין קונפליקטים של עניין לגלות.
Acknowledgements
אנו מודים ליונתן רוזדנלס, קז'ימייז ' טיקובסקי ו ג'ואנה ב. ווית לקבלת ייעוץ בנוגע לניתוח נתונים. אנו גם מודים לג הייוורד. על נוגדן האנטי-SSB עבודה זו נתמכת על ידי מענקים T32GM007223 ו T32AI055403 מן המכונים הלאומיים לבריאות (ל TKV) ו-NIH מענק (CA16038) (כדי JAS). JAS הוא חוקר של המכון הרפואי הווארד יוז. איורים 1-3 ושולחן 1 שוחזרו באישור החברה האמריקנית למיקרוביולוגיה תחת רישיון ייחוס מלאי יצירתי מהפרסום הבא: Vallery, ט. ק., ווית, J. B., אנדו, ג'יי א., Steitz, J. א. קפוסי סרקומה של הקשורים מבנה mRNA הצטברות ב-Foci גרעינית מושפע DNA נגיפי שכפול ויראלי שאינם קידוד רב RNA גרעינית. כתב העת לוירולוגיה. 92 (13), דוי: 10.1128/jvi. 00220-18, (2018).
Materials
| Name | Company | Catalog Number | Comments |
| AlexaFluor594-5-dUTP | Life Technologies | C1100 | |
| anti-DIG FITC | Jackson Lab Immunologicals | 200-092-156 | |
| Anti-Rabbit Secondary AlexaFluor594 Monoclonal Antibody | Invitrogen | A-11037 | Goat |
| Anti-SSB Antibody | N/A | N/A | Ref. Chiou et al. 2002 |
| BLASTn | NIH NCBI | N/A | Free Sequence Alignment Software |
| Dextran Sulfate | Sigma Aldrich | D8906 | Molecular Biology Grade |
| DIG-Oligonucleotide Tailing Kit | Sigma Roche | #03353583910 | 2nd Gen |
| Eight-Chamber Slides | Nunc Lab Tek II | #154453 | Blue seal promotes surface tension but separation by clear gel is also available. |
| Formamide | Sigma Aldrich | F9037 | Molecular Biology Grade |
| GAPDH Probes | Stellaris | SMF-2019-1 | Compatible with protocol, Quasar 670 |
| ImageJ | NIH, Bethesda, MD | N/A | Free Image Analysis Software, [http:rsb.info.nih.gov/ij/] |
| OligoAnalyzer | IDT | N/A | Free Oligonucleotide Analyzer |
| pcDNA3 | Invitrogen | A-150228 | |
| pmaxGFP | Amaxa | VDF-1012 | |
| Poly L-Lysine | Sigma Aldrich | P8920 | |
| Terminal Transferase | Sigma Roche | #003333574001 | |
| Vanadyl Ribonucleoside Complexes | NEB | S1402S | |
| Vectashield | Vector Laboratories, Inc. | H-1000 | DAPI within the mounting media scatters the light and reduces contrast. |
References
- Amen, M. A., Griffiths, A. Packaging of Non-Coding RNAs into Herpesvirus Virions: Comparisons to Coding RNAs. Frontiers in Genetics. 2, 81 (2011).
- Schmid, M., Speiseder, T., Dobner, T., Gonzalez, R. A. DNA virus replication compartments. Journal of Virology. 88 (3), 1404-1420 (2014).
- Pawlicki, J. M., Steitz, J. A. Primary microRNA transcript retention at sites of transcription leads to enhanced microRNA production. Journal of Cell Biology. 182 (1), 61-76 (2008).
- Borah, S., Darricarrere, N., Darnell, A., Myoung, J., Steitz, J. A. A viral nuclear noncoding RNA binds re-localized poly(A) binding protein and is required for late KSHV gene expression. Public Library of Science Pathogens. 7 (10), e1002300 (2011).
- Tycowski, K. T., Shu, M. D., Borah, S., Shi, M., Steitz, J. A. Conservation of a triple-helix-forming RNA stability element in noncoding and genomic RNAs of diverse viruses. Cell Reports. 2 (1), 26-32 (2012).
- Weinberg, R. A., Penman, S. Small molecular weight monodisperse nuclear RNA. Journal of Molecular Biology. 38 (3), 289-304 (1968).
- Myoung, J., Ganem, D. Generation of a doxycycline-inducible KSHV producer cell line of endothelial origin: maintenance of tight latency with efficient reactivation upon induction. Journal of Virology Methods. 174 (1-2), 12-21 (2011).
- Brulois, K. F., et al. Construction and manipulation of a new Kaposi's sarcoma-associated herpesvirus bacterial artificial chromosome clone. Journal of Virology. 86 (18), 9708-9720 (2012).
- Sturzl, M., Gaus, D., Dirks, W. G., Ganem, D., Jochmann, R. Kaposi's sarcoma-derived cell line SLK is not of endothelial origin, but is a contaminant from a known renal carcinoma cell line. International Journal of Cancer. 132 (8), 1954-1958 (2013).
- Chiou, C. J., et al. Patterns of gene expression and a transactivation function exhibited by the vGCR (ORF74) chemokine receptor protein of Kaposi's sarcoma-associated herpesvirus. Journal of Virology. 76 (7), 3421-3439 (2002).
- Cole, R. W., Jinadasa, T., Brown, C. M. Measuring and interpreting point spread functions to determine confocal microscope resolution and ensure quality control. Nature Protocols. 6 (12), 1929-1941 (2011).
- Nakamura, H., et al. Global changes in Kaposi's sarcoma-associated virus gene expression patterns following expression of a tetracycline-inducible Rta transactivator. Journal of Virology. 77 (7), 4205-4220 (2003).
- Majerciak, V., Yamanegi, K., Zheng, Z. M. Gene structure and expression of Kaposi's sarcoma-associated herpesvirus ORF56, ORF57, ORF58, and ORF59. Journal of Virology. 80 (24), 11968-11981 (2006).
- Sun, R., Lin, S. F., Gradoville, L., Miller, G. Polyadenylylated nuclear RNA encoded by Kaposi sarcoma-associated herpesvirus. Proceedings of the National Academy Sciences U S A. 93 (21), 11883-11888 (1996).
- Vallery, T. K., Withers, J. B., Andoh, J. A., Steitz, J. A. Kaposi's Sarcoma-Associated Herpesvirus mRNA Accumulation in Nuclear Foci Is Influenced by Viral DNA Replication and Viral Noncoding Polyadenylated Nuclear RNA. Journal of Virology. 92 (13), (2018).
- Borah, S., Nichols, L. A., Hassman, L. M., Kedes, D. H., Steitz, J. A. Tracking expression and subcellular localization of RNA and protein species using high-throughput single cell imaging flow cytometry. RNA. 18 (8), 1573-1579 (2012).
- Bruce, A. G., et al. Quantitative Analysis of the KSHV Transcriptome Following Primary Infection of Blood and Lymphatic Endothelial Cells. Pathogens. 6 (1), (2017).
- Chen, C. P., et al. Kaposi's Sarcoma-Associated Herpesvirus Hijacks RNA Polymerase II To Create a Viral Transcriptional Factory. Journal of Virology. 91 (11), (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved