Method Article
فحص مثبطات كيناز في ميكروصفائف البروتين البشري المجمعة ذاتيا
In This Article
Summary
يتم تقديم بروتوكول مفصل لتوليد ميكروصفائف البروتين البشري المجمعة ذاتيا لفحص مثبطات كيناز.
Abstract
فحص مثبطات كيناز أمر حاسم لتحسين فهم خصائص المخدرات وتحديد الأهداف المحتملة الجديدة مع الآثار السريرية. وتم الإبلاغ عن عده منهجيات لإنجاز هذا الفحص. ومع ذلك ، كل له القيود الخاصة به (علي سبيل المثال ، فحص نظائرها ATP فقط ، وتقييد استخدام المجالات المنقية كيناز ، والتكاليف الكبيرة المرتبطة باختبار أكثر من عدد قليل من تحركات في وقت واحد ، وعدم وجود مرونة في فحص البروتين تحركات مع طفرات جديده). هنا ، يتم عرض بروتوكول جديد يتغلب علي بعض من هذه القيود ويمكن استخدامها لفحص غير متحيز لمثبطات كيناز. قوه هذه الطريقة هي قدرتها علي مقارنه نشاط مثبطات كيناز عبر العديد من البروتينات ، اما بين الانزيمات المختلفة أو المتغيرات المختلفة لنفس كيناز. وتستخدم المصفوفات المجهرية للبروتين التي يتم تجميعها ذاتيا والمتولدة من خلال التعبير عن البروتينات التي يقوم بها نظام النسخ والترجمة القائم علي الإنسان في المختبر (IVTT). البروتينات المعروضة علي ميكرواري نشطه ، مما يسمح لقياس اثار مثبطات كيناز. يصف الاجراء التالي خطوات البروتوكول بالتفصيل ، من توليد ميكروصفيف والفرز إلى تحليل البيانات.
Introduction
كيناسيس البروتين هي المسؤولة عن فوسفولات من أهدافها ، ويمكن ان تعدل المسارات الجزيئية المعقدة التي تتحكم في العديد من الوظائف الخلوية (اي انتشار الخلايا ، والتمايز ، وموت الخلايا والبقاء علي قيد الحياة). ويرتبط تحرير نشاط كيناز مع أكثر من 400 الامراض ، مما يجعل مثبطات كيناز واحده من الفئات الرئيسية من الادويه المتاحة لعلاج العديد من الامراض ، بما في ذلك السرطان والقلب والاوعيه الدموية والاضطرابات العصبية وكذلك التهابات وامراض المناعة الذاتية1،2،3.
مع ظهور الطب الدقيق ، وتحديد العلاجات الجديدة ، وخاصه مثبطات كيناز ، لديها نداء كبير صيدليا وسريريا. ويمكن استخدام العديد من النهج لتحديد أزواج جديده ممكنة من مثبطات كيناز/كيناز ، بما في ذلك تصميم دي نوفو من مثبطات كيناز وتحديد أهداف جديده للادويه القائمة المعتمدة من قبل هيئه الاغذيه والعقاقير. هذه الاخيره جذابة بشكل خاص ، حيث ان الوقت والمال اللازم لتنفيذ هذه الادويه في العيادات تنخفض بشكل كبير بسبب توافر بيانات التجارب السريرية السابقة. والمثال المتعارف عليه لأعاده الغرض من مثبطات كيناز هو imatinib ، المصممة في البداية لعلاج ابيضاض الدم النقوي المزمن (CML) من خلال تثبيط BCR-Abl ، والتي يمكن أيضا ان تستخدم بنجاح لعلاج الإفراط في التعبير c-كيت أورام الأمعاء اللحمية (العلماء)4،5،6،7.
يمكن اجراء فحص مثبطات كيناز في اختبارات ملزمه أو المقايسات القائمة علي الانزيميه. تركز الدرجة الاولي من المقايسات علي تفاعلات البروتين والدواء ويمكن ان توفر معلومات مثل موقع الربط والتقارب. منذ نشاط كيناز في وقت هذه الاختبارات غير معروف ، يمكن تفويتها عدد من التفاعلات أو تحديدها زورا بسبب التغيرات المطابقة في البروتين. ومن ناحية أخرى ، تتطلب المقايسات القائمة علي الانزيميه ان تكون البروتينات البروتينية نشطه وتوفر معلومات قيمه فيما يتعلق بتاثير المثبط علي نشاط الانزيم ، ومع ذلك ، فان هذا النوع من الفحص هو عموما أكثر استهلاكا للوقت ومكلفا. حاليا ، كلا النوعين من المقايسات متاحه تجاريا من عده مصادر. انها تمثل خيارا موثوقا للكشف عن مثبطات كيناز مع بعض القيود, بما في ذلك: I) معظم الطرق تنطوي علي اختبار الانزيمات المتعددة بشكل فردي, التي يمكن ان تجعل من فحص مجموعه كبيره من البروتينات مكلفه; II) تقتصر مجموعه من الانزيمات التي سيتم اختبارها علي قائمه من النوع الذي تم اختياره مسبقا ، والأنواع البرية ، والعديد من الإصدارات المتحولة المعروفة لبعض الانزيمات ، مما يعوق اختبار العديد من الاشكال الجديدة المتحولة.
وفي هذا السياق ، فان ميكروصفائف البروتين هي منصة قويه قادره علي التغلب علي بعض القيود التي تقدمها التقنيات المتاحة تجاريا. وهي مناسبه لاجراء اختبارات الانزيميه في الفحص عاليه الانتاجيه باستخدام كامل الطول ، والبروتينات النشطة من اي تسلسل الفائدة. يمكن ان تتولد ميكروصفائف من قبل نهج تجميعها ذاتيا مثل نابا (الحمض النووي مصفوفة بروتين قابل للبرمجة) ، والتي يتم التعبير عن البروتينات في الوقت المناسب لاختبارات ، مما يزيد من احتمال ان تلك المعروضة علي الصفيف هي في الواقع نشطه. يتم إنتاج البروتينات المعروضة علي نابا باستخدام التماثيل البشرية المشتقة والبروتينات المرافقة من أجل تحسين احتمال الطي الطبيعي والنشاط.
يتم برمجه البروتينات في البداية عن طريق الطباعة cdnas الترميز للجينات من الفائدة تنصهر مع علامة التقاط ، مع وكيل القبض ، علي سطح ميكرواري. ثم يتم إنتاج البروتينات علي ميكروصفائف باستخدام نظام النسخ والترجمة في المختبر (ivtt) ، ويتم تعبئة البروتينات المعرب عنها حديثا علي سطح ميكروارس من قبل وكيل القبض. ويمكن استخدام صفائف نابا المعرب عنها لدراسة البروتينات المعروضة علي الصفيف بطريقه غير متحيزة ، عاليه الانتاجيه8،9.
سابقا ، تبين ان البروتينات المعروضة علي صفائف نابا مطوية بشكل صحيح للتفاعل مع الشركاء المعروفين10؛ وعلاوة علي ذلك, تم استغلال النشاط الانزيمي لأول مره في 2018, عندما تبين ان البروتين كيناسيس عرض علي ميكروصفيف اوتوفوسفروفات11. حتى الآن ، تم استخدام منهجيه نابا للعديد من التطبيقات المتميزة ، بما في ذلك اكتشاف المؤشرات البيولوجية12،13،14،15،16،17، البروتين البروتين التفاعلات10،18، الركيزة تحديد19، وفحص المخدرات11. وتعد مرونته أحدي الخصائص الرئيسية للمنبر التي تسمح بالتكيف مع كل تطبيق.
هنا ، يتم تقديم بروتوكول لفحص مثبطات التيروزين كيناز في صفائف نابا تجميعها ذاتيا. تم تحسين المنصة لعرض البروتين البشري النشط ولتحليل نشاط بروتين كيناز ، مع خلفيه منخفضه ونطاق ديناميكي عالي. ومن بين التعديلات التي تم تنفيذها لاستخدام نابا لفحص مثبطات كيناز ما يلي: انا) التغييرات في كيمياء الطباعة ، II) دي فوسفوريلاتيون من البروتين ميكروصفيف قبل فحص مثبطات كيناز ، و III) الأمثل للكشف عن البروتينات الفوسفوليه علي الصفيف. هذا البروتوكول هو الأول من نوعه ويوفر معلومات فريدة عن دراسة كيناز في ميكروصفائف نابا.
Protocol
1. المخازن المؤقتة المشتركة والحلول لاستخدامها
- اعداد السل المتوسطة: مرق رائع (24 غرام/لتر الخميرة استخراج ؛ 20 غرام/لتر الترتوني ؛ 4 مل/لتر الجلسرين ؛ 0.017 M KH2PO4؛ و 0.072 m K2hpo4). و 0.017 M KH2po4 و 0.072 m K2hpo4 الحلول يمكن شراؤها باعتبارها 10x الفوسفات العازلة (0.17 m kh2PO4 و 0.72 M K2hpo4).
- اعداد LB المتوسطة: لوريا-Bertani (5 غرام/لتر الخميرة استخراج ؛ 10 غرام/لتر الترتوني ؛ و 10 غرام/لتر كلوريد الصوديوم). ضبط درجه الحموضة إلى 7.0 مع 5 م NaOH.
- اعداد 1x TBS: تريس-المحلول الملحي المخزنة (TBS: 50 mM تريس-Cl ، pH = 7.5 ، 150 mM كلوريد الصوديوم).
- اعداد 1x TBST: TBS تستكمل مع 0.1 ٪ توين 20.
2. اعداد الحمض النووي
ملاحظه: يجب ان يكون الحمض النووي المستخدم لمصفوفة نابا نقيا للغاية. ولذلك ، لا ينصح الحمض النووي التجارية الصغيرة-preps. حاليا ، يتم استخدام بروتوكولين لاعداد الحمض النووي: في منزل عاليه الانتاجيه مصغره الاعداديه (الموصوفة هنا) أو التجارية ميدي-أو ماكسي الاعداديه. متوسط الانتاجيه للبروتوكول الاعداديه في المنزل هو 1,500 عينات يوميا للشخص الواحد.
- نمو البكتيريا في المنزل عاليه الانتاجيه مصغره الاعداديه
- اعداد LB/أجار لوحه اومني. صب 30-40 مل من أجار LB (1.5 ٪ أجار البكتريولوجية في وسائل الاعلام LB تكمله مع المضادات الحيوية لاختيار استنساخ ايجابيه) في كل لوحه بئر واحده.
- بقعه الأسهم الجلسرين علي رطل/أجار لوحه. تمييع الأسهم الجلسرين في وسائل الاعلام LB (1:300 ، وعاده 2 μL في 600 μL من LB). يهز لمده 10 دقيقه. بقعه 3 μL من الأسهم المخففة علي لوحه LB/أجار. احتضان في 37 درجه مئوية ، راسا علي عقب ، بين عشيه وضحيها.
- تطعيم الثقافات. باستخدام الجهاز 96 دبوس التي تم تعقيمها في 80 ٪ الايثانول واللهب ، تطعيم الثقافة من لوحه أجار في كتله عميقة البئر مع 1.5 mL لكل بئر من متوسط السل تستكمل مع المضادات الحيوية.
- احتضان الثقافات. تغطيه كتله مع ختم نفاذيه الغاز واحتضان ل 22-24 ح في 37 درجه مئوية ، 300-800 دوره في الدقيقة اعتمادا علي شاكر.
ملاحظه: الهزازات المحددة في 800 لفه في الدقيقة هي الأمثل لهذه الحضانة. قد يؤدي استخدام شاكر سرعه إبطا في الثقافات اقل كثافة وانخفاض غله تنقيه الحمض النووي. - الثقافات بيليه. كتل تدور في 3,800 x g و 4 درجه مئوية لمده 30 دقيقه تجاهل supernatant.
- في المنزل عاليه الانتاجيه مصغره الاعداديه
ملاحظه: يمكن استخدام الأنابيب متعددة القناات أو موزعات التلقائي لأداء العالية الانتاجيه في المنزل الاعداديه الصغيرة. في حاله استخدام موزع تلقائي ، تاكد من تنظيف النظام قبل الاستخدام وبين الحلول.- اعداد جميع الحلول المستخدمة اثناء الاعداديه المصغرة:
- اعداد الحل 1: TE أعاده تعليق العازلة (50 mM تريس ، pH = 8.0 ؛ 10 مم أدتا ، pH = 8.0 ؛ 0.1 ملغ/مل RNAse). يخزن عند درجه حرارة 4 درجات مئوية.
- اعداد الحل 2: NaOH/SDS تحلل العازلة (0.2 M NaOH ؛ 1 ٪ SDS). للحصول علي نتائج أفضل ، يجب استخدام حل حديث الصنع.
- اعداد الحل 3: العازلة تحييد KOAC (2.8 M KOAc). ضبط درجه الحموضة من الحل إلى 5.1 مع حمض الخليك الجليدية. يخزن عند درجه حرارة 4 درجات مئوية.
- اعداد الحل N2: تاخيرمن العازلة (100 mM تريس ؛ 900 mM KCl ؛ 15 ٪ EtOH ؛ 0.15 ٪ تريتون X-100). ضبط درجه الحموضة من الحل إلى 6.3 مع حمض الفوسفوريك.
- اعداد الحل N3: باش العازلة (100 mM تريس ؛ 1.15 M KCl ؛ 15 ٪ EtOH). ضبط درجه الحموضة من الحل إلى 6.3 مع حمض الفوسفوريك.
- اعداد الحل N5: العازلة (100 mM تريس ؛ 1 م KCl ؛ 15 ٪ EtOH). ضبط درجه الحموضة من الحل إلى 8.5 مع حمض الفوسفوريك.
ملاحظه: السيطرة الناجحة علي ربط الحمض النووي ، والغسيل ، والتملص خلال تبادل انيون يعتمد إلى حد كبير علي تركيز KCl العازلة وقيم الأس الهيدروجيني. القياسات الدقيقة مكون العازلة وتعديل درجه الحموضة ضرورية. ويمكن ان تؤدي الانحرافات الصغيرة عن القياسات الموصوفة إلى خسارة كبيره في الغلة.
- أعاده تعليق بيليه. أضافه 200 μL من الحل 1 ويهز في 2,000 دوره في الدقيقة لمده 5 دقائق في RT. أعاده التعليق الكامل لبيليه ضروري لتحلل الناجحة. دوامه الكتلة إذا لزم الأمر.
- بكتيريا الليسي. أضافه 200 μL من الحل 2 ، ختم لوحه مع ختم ألومنيوم وعكس 5x. بعناية الوقت هذه الخطوة من بداية الحل 2 أضافه. لا تتجاوز 5 دقائق.
- تحييد الحل. أضافه 200 μL من الحل 3 ، ختم لوحه مع ختم ألومنيوم وعكس 5x. قد يكون ختم فضفاضة بسبب تحلل/تحييد المخازن المؤقتة ، لذلك توخي الحذر عند عكس. ويوصي بالانقلاب الجزئي ، الذي لا يمس الحل أبدا الختم ، لمنع التلوث المتبادل بين العينات.
- مسح الlysate. الطرد المركزي لوحات في 3,800 x g و 4 درجه مئوية لمده 30 دقيقه.
- اعداد انيون الطين الصرف الراتنج خلال التكوير الطردة محلله الخطوة. باستخدام زجاجه 1 لتر ، وملء مع راتنج تبادل انيون حتى يصل إلى 300 mL علامة ، ثم أضافه محلول N2 تصل إلى 900 mL.
تحذير: يجب ان يتم هذه الخطوة في غطاء محرك السيارت للحماية ضد استنشاق السيليكا. - اعداد انيون لوحات الراتنج الصرف. كومه لوحات فلتر علي راس كتله جيده لتكون بمثابه سفينة جمع النفايات. خلط الطين تبادل انيون حتى انها متجانسة ، ثم تصب في الحوض الزجاجي. باستخدام P1000 واسعه الملل نصائح ، نقل 450 μL من الطين في كل بئر من لوحات فلتر.
- ألواح الطرد المركزي مكدسه (لوحه الراتنج/لوحه بئر عميق) في تسارع بطيء لمده 5 دقائق في 130 x g و RT. تجاهل التدفق من خلال.
- نقل محلله ماده طافي إلى لوحه الراتنج/أكوام كتله البئر العميق. تدور لوحات مكدسه لمده 5 دقائق في 30 × g مع بطء الصعود السرعة.
- العمود يغسل. أضافه 400 μL من الحل N3 (غسل العازلة) لكل بئر. نقل لوحه الراتنج لفراغ مشعب لأزاله العازلة غسل. كرر خطوات الغسيل 3x. علي الغسيل الأخير ، تاكد من إفراغ جميع الآبار بشكل صحيح. تدور لوحات المكدس في 150 x g لمده 5 دقائق لأزاله اي المخزن المؤقت المتبقية.
- الحمض النووي elute. ضع لوحه الراتنج علي لوحه مجموعه 800 μL نظيفه. أضافه 300 μL من الحل N5 لكل بئر. السماح لها بالجلوس في RT لمده 10 دقيقه ، ثم تدور لوحات مكدسه لمده 5 دقائق في 20 × ز مع سرعه المنحدر الصعود بطيئه. تدور لوحات مكدسه لمده 1 دقيقه في 233 x g.
- تحديد كميه الحمض النووي وألواح التخزين عند-20 درجه مئوية حتى الاستخدام الإضافي أو الانتقال مباشره إلى هطول الحمض النووي.
ملاحظه: الحد الأدنى من 30 ميكروغرام من الحمض النووي لكل عينه ضروري. إذا كان الحمض النووي العائد منخفضا ، فمن المستحسن ان تكرار الحمض النووي الاعداديه مصغره ، أو بدلا من ذلك الجمع بين لوحين اثناء الخطوة هطول الامطار (القسم 2.3).
- اعداد جميع الحلول المستخدمة اثناء الاعداديه المصغرة:
- الحمض النووي هطول الامطار
- ذوبان لوحات ، دوامه لتجانس حل الحمض النووي ، وتدور في 230 x g ل 30 s لجمع كل حل في الجزء السفلي من البئر.
- أضافه 40 μL من 3 M NaOAc و 240 μL من الايزوبروبانول لكل بئر. غطي الصفيحة بختم من ألمنيوم واخلطيها بواسطة قلب 3x.
- الطرد المركزي لوحات في لمده 30 دقيقه في 3,800 x g و 25 درجه مئوية. بعناية تجاهل سوبرناتانت.
ملاحظه: للجمع بين لوحين ، نقل الحمض النووي من اللوحة الثانية إلى بيليه من اللوحة الاولي وكرر الخطوات 2-3-2-2.3.3. - يغسل ويعجل الحمض النووي. أضافه 400 μL من 80 ٪ الايثانول لكل بئر. لوحات الختم مع ختم ألومنيوم ويهز في 1,000 لفه في الدقيقة لمده 30 دقيقه. أجهزه الطرد المركزي في 3,800 x g لمده 30 دقيقه عند 25 درجه مئوية. تجاهل الخارقة.
- جفف كريات الحمض النووي. وضع لوحات راسا علي عقب في زاوية علي المناشف الورقية والسماح لهم الجافة ل 1-2 h ، حتى لا يوجد الكحول في الجزء السفلي من البئر. ختم والطرد المركزي في 230 x g لمده 2 دقيقه لجلب اي الكريات إلى أسفل.
- مره واحده لوحات جافه ، اما ختم مع ختم ألومنيوم وتجميد عند-20 درجه مئوية لاستخدامها لاحقا أو الاستمرار في أعاده تعليق الحمض النووي (الخطوة 4.1).
3. طلاء الشرائح امينوسيليكات
- وضع الشرائح الزجاجية في رف معدني. فحص بصريا كل شريحة لضمان عدم وجود خدوش أو عيوب موجودة.
- الشرائح الفرعية في محلول الطلاء (2 ٪ امينوسيليكات الكاشف في الأسيتون) لمده 15 دقيقه في حين هزاز. ويمكن استخدام محلول امينوسيليكات لمعطف اثنين من الرفوف من 30 الشرائح كل قبل ان تحتاج إلى التخلص منها.
- شطف الخطوة. دمج رف الشريحة في غسل الأسيتون (99 ٪ الأسيتون) ، يهز ذهابا وإيابا ، ثم صعودا وهبوطا بسرعة 5x. أماله إلى زاوية واحده لتنقيط قباله ، ثم دمج في المياه Ultrapure صعودا وهبوطا 5x بسرعة. أماله لتنقيط ، ثم وضع علي المناديل.
ملاحظه: يمكن استخدام غسول الأسيتون مرتين ، في حين يجب تغيير الماء فائق النقاء في كل مره. - الشرائح الجافة باستخدام الهواء الضغط ، وتهب عليها من جميع الزوايا لمده 3 دقائق تقريبا حتى تتم أزاله جميع قطرات الماء. تخزين الشرائح المغلفة في RT في رف معدني داخل مربع مختومه باحكام.
4. اعداد عينه صفيف
- أعاده تعليق بيليه الحمض النووي من الاعداديه في المنزل (الخطوة 2) في 20 μl من المياه نقاء ويهز في 1,000 لفه في الدقيقة لمده 2 ساعة. ل midi/ماكس الاعداديه الحمض النووي ، تمييع كل عينه إلى تركيز النهائي من 1.5 ميكروغرام/μL ونقل 20 μL إلى لوحه جمع 800 μL.
- اعداد مزيج الطباعة. ل 1 96 لوحه جيدا ، واعداد 1 مل من مزيج الطباعة [237.5 μl من المياه نقاء ؛ 500 μl من بولي-يسين (0.01 ٪) ؛ 187.5 μl من BS3 (bis-سولفوسكاليميديل ، 50 mg/mL في dmso) ؛ و 75 μl من بولكلونل مكافحه العلم الأجسام المضادة أرنب)].
ملاحظه: يجب أضافه المواد الكيميائية في الترتيب المحدد لتجنب هطول الامطار. - أضافه 10 μL من مزيج الطباعة لكل عينه ، لوحات ختم مع رقائق ألومنيوم ، ويهز في RT ل 90 دقيقه في 1,000 دوره في الدقيقة. تخزين لوحات بين عشيه وضحيها (~ 16 ساعة) في 4 درجه مئوية.
- في يوم الطباعة ، ودوامه لفتره وجيزة وتدور لوحات. نقل 28 μL من كل عينه إلى لوحه صفيف 384. ويمكن القيام بهذا النقل باستخدام الاتمته أو الماصة متعددة القناات. فمن المهم لتتبع موقف العينات في لوحه صفيف 384.
- تدور لوحه أسفل لفتره وجيزة لأزاله اي فقاعات. ختم لوحات مع إحباط.
5. جيل من صفائف نابا: الطباعة ميكروصفيف
ملاحظه: تم تحسين جميع شروط الطباعة للاداه المدرجة في جدول المعدات والمواد. في حاله استخدام صفيف مختلف ، قد يتطلب الأمر تحسينا إضافيا.
- العراب ينظف قبل البدء ، إفراغ جميع خزانات النفايات وأعاده ملء الخزانات بالماء فائق النقاء أو 80 ٪ الايثانول ، إذا لزم الأمر. دبابيس نظيفه واحده تلو الأخرى مع مناديل خاليه من الوبر والماء فائق النقاء. جففي الدبابيس بمناديل مبلله خاليه من الوبر وضعيها بعناية مره أخرى في راس العراب.
- اعداد العراب: مواصفات الطباعة [الحد الأقصى لعدد الطوابع لكل حبر: 1 ؛ عدد الطوابع في الموقع: 1 ؛ توقيت الطوابع المتعددة:--؛ وقت الختم (ms): 0 مللي ثانيه ؛ وقت التحبير (ms): 0 مللي ثانيه ؛ تعديل عمق الطباعة: 90 ميكرون ؛ عدد اللمس: 0]. ثم اتبع بروتوكول التعقيم: غسل المياه نقاء ل 2,000 ms مع 0 مللي من وقت التجفيف و 500 مللي ثانيه من وقت الانتظار. كرر هذه الخطوات 6x; يتبع بغسل مع 80% ايثانول ل 2,000 ms مع 1,200 ms من تجفيف وقت و 500 مللي من وقت الانتظار; كرر هذه الخطوات 6x.
- تصميم الشرائح: اعداد العراب مع نمط المطلوب الضال. وينبغي ان ياخذ التصميم في الاعتبار عده عوامل [اي عدد النسخ المتماثلة لكل عينه ، وموقع وعدد ميزات التحكم ، وتخطيط المصفوفة (كتله واحده ، والعديد من الكتل المتماثلة) ، وعدد المصفوفات التي ستطبع ، وطول الشوط ، وما إلى ذلك].
- وضع الشرائح المغلفة امينوسيليكات (الخطوة 3.4) علي سطح السفينة arrayer. تحقق لمعرفه ما إذا كان الفراغ هو عقد جميع الشرائح بشكل أمن في المكان. بدء جهاز الترطيب (ينبغي تعيينها في 60 ٪).
- وضع لوحه جيدا 384 علي سطح السفينة العراب. بدء تشغيل البرنامج.
- تسميه ميكروصفائف. عند اجراء الطباعة ، ضع تسميات الشرائح في الجانب السفلي (غير المطبوع) لكل شريحة. الحفاظ علي الشرائح ترتيب الطباعة علي سطح السفينة في الترتيب العددي.
- تخزين صفائف المطبوعة في RT في رف معدني داخل مربع مختومه باحكام مع حزمه السيليكا. الشرائح التي تبقي في بيئة جافه لها العمر الافتراضي لمده تصل إلى سنه واحده.
- (اختياري): يمكن طباعه دفعه ثانيه من الشرائح 90 باستخدام نفس العينات. للقيام بذلك ، أزاله لوحه جيدا 384 من سطح السفينة العراب بمجرد الانتهاء من طباعه لوحه. ختم وتخزين اللوحة في 4 درجه مئوية. بعد الدفعة الاولي من صفائف القيام به تماما ، وأزالها من سطح السفينة ، ووضع الشرائح المغلفة امينوسيليكات جديده وبدء تشغيل جديد. تاكد من كل لوحه 384 جيدا هو في RT لمده 30 دقيقه قبل استخدامه. إذا تمت طباعه أكثر من أربع نسخ متماثلة لكل نموذج في دفعه من الشرائح ، فمن المستحسن تقسيم لوحات البئر 384 إلى لوحين لتقليل تبخر العينة عن طريق تقليل مقدار الوقت المستغرق علي سطح السفينة.
ملاحظه: تحقق من جميع الخزانات قبل بداية الشوط الثاني.
6. الكشف عن الحمض النووي علي الشرائح نابا
- حظر الشرائح. ضع الشرائح في مربع ماصه وأضف 30 مل من المخزن المؤقت للحظر. احتضان في RT لمده 1 ساعة علي شاكر هزاز.
- وصمه عار الشرائح. تجاهل الحل حظر وأضافه 20 مل من العازلة وحجب 33 μL من الحمض النووي الفلورسنت-صبغ البينية. احتضان لمده 15 دقيقه مع الانفعالات. ثم ، شطف الشرائح بسرعة مع المياه الفائقة والجافة مع ضغط الهواء. المضي قدما في المسح (القسم 11).
7. التعبير عن الشرائح نابا
- حظر الشرائح مع حظر المخزن المؤقت علي شاكر هزاز في RT ل 1 h. استخدم حوالي 30 مل في علبه ماصه لأربع شرائح.
- اشطف الشرائح بالماء الفائق النقاء وجففه بالهواء المضغوط المصفي. تطبيق طوقا الختم علي كل شريحة في تعليمات الشركة المصنعة.
- أضافه مزيج IVTT. وسوف تتطلب كل شريحة 150 μL من مزيج IVTT. تمييع 82.5 μl من هيلا محلله في 33 μl من المياه depc والملحق مع 16.5 μl من البروتينات التبعي و 33 uL من مزيج التفاعل. أضف مزيج IVTT من الطرف غير المسمي أو غير العينة. ماصه المزيج ببطء (فمن المقبول إذا كان الخرز حتى مؤقتا في نهاية مدخل). يدلك برفق طوقا الختم بحيث ينتشر مزيج IVTT خارج ويغطي المنطقة بأكملها من الصفيف. تطبيق الأختام الصغيرة جولة الميناء إلى كلا الموانئ.
- وضع الشرائح علي دعم ونقلها إلى حاضنه تقشعر لها الأبدان المبرمج. احتضان ل 90 دقيقه في 30 درجه مئوية للتعبير عن البروتين ، تليها 30 دقيقه في 15 درجه مئوية لتجميد البروتين الاستعلام.
- اغسل الشرائح ومنعها. أزاله طوقا الختم وتزج الشرائح في علبه ماصه مع ما يقرب من 30 مل من TBST 1x تستكمل مع 5 ٪ من الحليب لعرض البروتين (القسم 8) أو 1x TBST تستكمل مع 3 ٪ الزلال المصل البقري (جيش الصرب البوسني) لاختبارات كيناز أو فحص المخدرات (المادة 9). احتضان في RT مع الانفعالات لمده 20 دقيقه وكرر هذه الخطوة 2x.
8. الكشف عن البروتينات علي صفائف نابا
- أضافه الأجسام المضادة الاساسيه. قم بازاله الشرائح من محلول الحجب (الخطوة 7.5) وجفف الجانب الخلفي برفق (الجانب غير المطبوع) باستخدام منشفه ورقيه. ضع الشرائح علي الدعم وتطبيق 600 μL من الأجسام المضادة الاساسيه (الماوس لمكافحه العلم) المخفف 1:200 في 1x TBST + 5% الحليب. احتضان لمده 1 ساعة في RT.
- غسل الشرائح مع 1x TBST + 5% الحليب علي شاكر هزاز (3x لمده 5 دقائق لكل منهما).
- أضافه الأجسام المضادة الثانوية. قم بازاله الشرائح من محلول الغسيل وجفف الجانب الخلفي برفق باستخدام منشفه ورقيه. وضع الشرائح علي دعم وتطبيق 600 μL من الأجسام المضادة الثانوية (cy3-labbeled مكافحه الماوس الأضداد) المخفف 1:200 في 1x TBST + 5% الحليب. حماية الشرائح من الضوء واحتضان لمده 1 ساعة في RT.
- اغسل الشرائح مع 1x TBST علي شاكر هزاز (3x لمده 5 دقائق لكل منهما). شطف الشرائح بسرعة مع المياه الفائقة والجافة باستخدام ضغط الهواء. المضي قدما في المسح (القسم 11).
9. الفحص المانع التيروزين كيناز علي صفائف نابا
ملاحظه: يمكن معالجه الشرائح متعددة في نفس التجربة ، ومع ذلك ، تاكد من ان في كل خطوه تتم معالجه شريحة واحده في كل مره وانها لا تجف بين الخطوات. قم باضافه كافة الحلول إلى نهاية الشريحة غير التسمية أو غير العينة.
- اعداد جميع الحلول المستخدمة اثناء فحص المخدرات:
- اعداد الفوسفاتيز/DNase الحل عن طريق الجمع بين ما يلي: 1x البروتين ميتالس-فوسفاتاسيس العازلة (50 mM HEPES ، 100 mM NaCl ، 2 مم DTT ، 0.01 ٪ Brij 35 في درجه الحموضة = 7.5) ؛ 1 مم MnCl2; 8,000 وحدات من البروتين لأمدا الفوسفاتيز; و 2 وحدات من DNase اعداد 400 μL من الحل لكل ميكروصفيف. أضافه الفوسفاتيز و DNase فقط قبل الاستخدام.
- جعل تخفيف المخدرات. يتم أعاده تشكيل المخدرات في DMSO إلى تركيز نهائي من 10 ملم. للتاكد من ان جميع تركيزات المخدرات اختبارها علي الصفيف ، وضمان ان يتم إنشاء نفس الحجم من DMSO (10 ، 000x الأسهم في DMSO) لكل تركيز وابقي في-80 درجه مئوية. في وقت الاستخدام ، يتم تخفيف المخدرات 1:100 في الماء.
- اعداد محلول المخدرات/كيناز من خلال الجمع بين ما يلي: 1x العازلة كيناز (25 مم تريس-حمض الهيدروكلوريك من pH = 7.5) ؛ 5 مم بيتا-غليسيروفوسفات; 2 مم DTT ؛ 0.1 mM Na3VO4; 10 مم MgCl2; 500 μM ATP; و 2 μL من المخدرات (المخفف 1:100 في الماء). اعداد 200 μL من الحل لكل ميكروصفيف.
- اجراء الفوسفاتيز والعلاج DNase. قم بازاله الشرائح من محلول الحجب (الخطوة 7.5) وجفف المؤخر برفق باستخدام منشفه ورقيه. ضع الشرائح علي الدعم وتطبيق 200 μL من الحل الفوسفاتيز/DNase. وضع المشبك ميكروصفيف لتجنب التبخر. احتضان في 30 درجه مئوية لمده 45 دقيقه في الفرن.
- الفوسفاتيز و DNase العلاج الثاني: أزاله صفائف من الفرن ، وتجاهل coverslip ، وأزاله الحل الزائد ، وتطبيق 200 μL من الفوسفاتيز المصنوعة حديثا وحل DNase. تغطيه ميكروصفائف مع كوفيرسليب واحتضان لأخر 45 دقيقه في 30 درجه مئوية في الفرن.
- اغسل الشرائح مع 1x TBST + 0.2 M NaCl علي شاكر هزاز (3x لمده 5 دقائق لكل منهما).
- اجراء علاج المخدرات ورد فعل كيناز. قم بازاله الشرائح من محلول الغسيل وجفف المؤخر برفق باستخدام منشفه ورقيه. وضع الشرائح علي الدعم وتطبيق 200 μL من محلول المخدرات/كيناز. ضع المشبك علي القمه لتجنب التبخر. احتضان لمده 1 ساعة في 30 درجه مئوية في الفرن.
- اغسل الشرائح مع 1x TBST + 0.2 M NaCl علي شاكر هزاز (3x لمده 5 دقائق لكل منهما).
- كرر الخطوات 8.1 – 8.4 باستخدام الأجسام المضادة الاساسيه مكافحه phosho-صور الجسم المخفف 1:100. استبدال 1x TBST + 5% الحليب في جميع الخطوات مع 1x TBST + 3% جيش الصرب البوسنيين.
10. بروتوكول التهجين الألى
ملاحظه: بدلا من ذلك ، يمكن استخدام محطه التهجين لاتمته جميع هيبريديزيشنز ويغسل علي صفائف نابا (الأقسام 7 – 9) ويتم توفير البروتوكول كملف تكميلي 1.
11. الحصول علي الصور
ملاحظه: يجب الحصول علي صور ميكروصفيف بدقه 20 ميكرون أو اعلي.
- تحميل ميكروصفائف في الشريحة حامل المجلة مع البروتينات التي تواجهها. تحميل المجلة في الماسح الضوئي ميكروصفيف.
- حدد الليزر الأخضر مع فلتر انبعاث 575/30 nm لمسح الاشاره من الأجسام المضادة الثانوية المسمية cy-3. إذا تم استخدام فلوروفوري مختلفه ، حدد الليزر الصحيح/الطول الموجي للكشف عن اشاره من صبغه الفلورسنت.
- حدد اسم كل صوره والموقع الذي سيتم حفظها فيه.
- (اختياري): لكل فلوكوفيري الجديدة ، ينصح بتحسين ظروف المسح للكشف عن المدى الخطي لشده الاشاره. للقيام بذلك ، مسح ميكروصفيف باستخدام مجموعه من مضخم (pmt) وكسب حتى يتم الحصول علي صوره واضحة مع اشاره غير مشبعه وخلفيه منخفضه.
- افحص كافة المصفوفات الصغيرة باستخدام الإعدادات المحسنة وتذكر ان تقوم بإيقاف تشغيل اوتوجاين.
ملاحظه: بالنسبة لتحليل البيانات ، يجب مسح كافة المصفوفات الصغيرة باستخدام نفس إعدادات المسح الضوئي. بالنسبة لمقايسات كيناز باستخدام cy3 باعتبارها فلوفيمور ، يتم مسح الصور بواسطة PMT 20 ٪ ، وكثافة الليزر من 25 ٪ ، و 10 ميكرون من القرار ، وذلك باستخدام الماسح الضوئي المدرجة في جدول المعدات والمواد.
12-معالجه البيانات وتحليلها
ملاحظه: تتوفر العديد من حزم البرامج للقياس الكمي لبيانات المصفوفة الصغيرة ذات القدرات المتشابهة. تم تصميم الاجراء الموصوف هنا للبرمجيات المدرجة في جدول المعدات والمواد.
- تحميل ملفات TIFF ليتم تحديدها كميا ، وتصميم الشبكة لتتناسب مع تخطيط ميكروصفيف وضبط حجم البقع لدمج اشاره كامله مع الحد الأدنى من المساحة الممكنة. لا ينبغي ان تتداخل المواقع المجاورة. فحص بصريا مدي أداء البرنامج وضبط الشبكة يدويا ، إذا لزم الأمر.
- تحديد كثافة الاشاره للمجموعة الصغيرة. تفقد بصريا البقع لأي شذوذ (غير محدده ملزمه ، والغبار ، وما إلى ذلك) وأزالها من تحليل البيانات.
- تصحيح الخلفية محليا باستخدام اشاره المناطق المجاورة علي الصفيف الذي لا يوجد بقعه.
- تطبيع البيانات. لمقارنه الاشاره عبر صفائف مختلفه ، يجب تطبيع كثافة الاشاره لكل ميكروصفيف. لاستبعاد اي القيم المتطرفة ، تطبيع البيانات باستخدام يعني قلص 30 ٪ من اشاره من السيطرة الايجابيه (مفتش البقع) من المصفوفات المجهرية ديفوسفوريلاتيد.
ملاحظه: الاشاره من البقعة مفتش لا تتغير اثناء فوسفولات وديفوسفورويليشن من ميكروصفائف ومناسبه لتطبيع..... - التعرف علي الانزيمات النشطة. لكل ميزه معروضه علي ميكروصفيف ، احسب النسبة بين كثافة الاشاره التي تم تطبيعها في الصفائف التلقائية والمصفوفات التي يتم إلغاء الفوسفات. تعيين عتبه من 1.5-اضعاف تغيير لتحديد تحركات النشطة ووضع علامة علي كافة الميزات الأخرى غير قادر علي الخضوع اوتوفوسفوليليشن (N/a).
- احسب نشاط كل كيناز تم تحديده في الخطوة 12.5 كنسبه مئوية من الاشاره المعدلة (كثافة الاشاره لصفيف التحكم الإيجابي الطبيعي (DMSO) الذي تطرحه كثافة الاشاره الخاصة بصفيف التحكم السالب الطبيعي (ديفوسفوفورلات).
النتائج
الذاتي تجميعها نابا ميكروصفائف توفر منصة صلبه التي يمكن استخدامها للعديد من التطبيقات المتميزة ، بما في ذلك اكتشاف المؤشرات الحيوية ، والتفاعلات بروتين البروتين ، وتحديد الركيزة ، وفحص المخدرات10،11 ،12،13،14،15،16،17،18،19،20.
يتم تمثيل المنهجية الشاملة المعتمدة لدراسة نشاط كيناز وفحص مثبطات كيناسيس تيروزين علي ميكروصفائف نابا في الشكل 1. أولا ، يتم إنشاء ميكروصفائف نابا بواسطة التجميد من cDNA والقبض علي عامل علي ميكروصفائف المغلفة. ثم يتم استخدام cDNAs كقالب للنسخ والترجمة من البروتينات ، وذلك باستخدام نظام IVTT القائم علي الإنسان ، والبروتينات التي تم توليفها حديثا يتم تعبئتها من قبل وكيل القبض9. ويمكن رصد نوعيه ميكروصفيف المطبوعة عن طريق قياس مستويات الحمض النووي (تاكيد الطباعة متسقة) أو البروتين المعروضة علي الصفيف (تاكيد التعبير البروتين والقبض; الشكل 1). لإنقاص اشاره الخلفية وزيادة النطاق الديناميكي للتجربة ، يتم التعامل مع ميكروصفائف مع 1) لأمدا الفوسفاتيز لأزاله فوسفوريلاتيون من السير/Thr/صور بقايا ، ثم مع 2) DNase لتبسيط الكيمياء علي الفور وانخفاض خلفيه (الشكل 1).
الخطوة التالية هي رد فعل الفوسفات الألى ، حيث يتم احتضان ميكروصفائف مع العازلة كيناز في غياب ATP (صفيف التحكم السلبية ، المشار اليها باسم ميكروصفائف ديفوسفوريلاتيد) ، ويتم تكمله العازلة كيناز مع ATP (السيطرة الايجابيه ، يشار اليها باسم صفائف اوتوفوسفريلاتيد) أو ATP + DMSO (مراقبه المركبات). وينبغي التاكيد علي انه خلال هذه الخطوة ، لا يتم أضافه كيناز ؛ ولذلك ، يتم تحديد النشاط الجوهري لكل كيناز المعروضة علي ميكرواري من خلال قياس مستويات الفوسفات الخاصة به باستخدام الأجسام المضادة لعموم مكافحه الفوسفس-التيروسين متبوعا الأجسام المضادة الثانوية cy3-labbeled (الشكل 1).
ويظهر في الشكل 2مراقبه جوده صفائف نابا-كيناز التي تعرض لوحه من البروتينات البشرية المطبوعة في بيلوروسي. وتم قياس مستويات الحمض النووي غير المعبا بواسطة تلطيخ الحمض النووي وأظهرت اشاره حتى عبر ميكروصفيف ، مما يوحي بان كميه الحمض النووي المطبوع علي الصفيف كانت موحده. ومن الممكن أيضا لمراقبه العديد من الميزات دون اي تلطيخ الحمض النووي. هذه الميزات تتوافق مع بعض الضوابط التي تم حذف الحمض النووي من مزيج الطباعة [اي ، البقع الفارغة (لا شيء تم طباعته) ، بقع المياه ، وتنقيه بقعه مفتش (بولي-يسين ، crosslinker والمنقي مفتش) ، مزيج الطباعة فقط (مزيج الطباعة كامله: بولي-يسين بالاضافه إلى الأضداد ومكافحه العلم الأجسام المضادة ، من دون اي الحمض النووي)]. وقد تم تقييم مستويات البروتين المعروضة علي ميكروصفائف نابا كيناز بعد رد فعل IVTT باستخدام مضاد لعلامات الجسم.
بالنسبة للفحص كيناز ، تم استخدام العلم كعلامة الاختيار وتم قياس مستوي البروتين المعروض علي ميكرواري باستخدام الأجسام المضادة للعلم. كما هو مبين ، فان غالبيه البقع التي تحتوي علي cDNA عرضت بنجاح مستويات قابله للكشف من البروتين. بعض البقع السيطرة دون cDNA كشفت أيضا اشاره مع الأجسام المضادة للعلم: بقعه مفتش (تستخدم للكشف عن نشاط الأجسام المضادة الثانوية) والبقع ناقلات فارغه (رموز cDNA للعلامة فقط) (الشكل 2). وأظهرت مصفوفات نابا كيناز استنساخ جيده بين الشرائح ، مع ارتباط مستويات عرض البروتين بين دفعات الطباعة متميزة اعلي من 0.88 (الشكل 2). في نفس الدفعة كان الارتباط اعلي حتى ، بالقرب من 0.92 (لا تظهر البيانات).
بعد ذلك ، تم قياس النشاط كيناز اوتوفوسفوليلاتيون من البروتينات المعروضة علي الصفيف باستخدام المضادة-فوسفس-التيروزين الأضداد (الشكل 3). أظهرت البروتينات المعروضة علي الصفيف مستويات عاليه من فوسفولات البروتين بعد التعبير (الشكل 3، يسار) ، والتي قد تكون ناجمه عن نشاط كيناز الذاتية من البروتين المعروض علي الصفيف أو بواسطة تحركات النشطة الموجودة في مزيج ivtt. وقد تمت أزاله هذا الفوسفات تماما مع العلاج الفوسفاتيز لأمدا واستخدمت هذه المصفوفات المجهرية لاختبارات كيناز. بعد الفوسفات ، وأظهرت ردود الفعل اوتوفوسفرويليشن دون ATP اي مستويات كبيره من فوسفوريلاتيون ، كما هو متوقع ، في حين أظهرت ميكروصفائف المحتضنة مع العازلة كيناز في وجود ATP فوسفات البروتين بسرعة 15 دقيقه ( الشكل 3). بالنسبة للكشف عن المخدرات ، تم قياس نشاط كيناز بعد 60 دقيقه من رد الفعل الألى لتعظيم عدد تحركات اختبارها.
وأظهرت المقارنة بين المصفوفات المجهرية التي تم فيها قياس مستويات الفوسفات الحق بعد التعبير عن البروتين (الشكل 3، اليسار) وبعد 60 دقيقه من رد الفعل الألى (الشكل 3، الحق): ط) البروتينات الفوسفارلاتيد فقط بعد التعبير ، مما يوحي بأنها يمكن ان تكون exogenylated بواسطة البروتينات الموجودة علي مزيج IVTT ، ولكن لا يمكن ان يكون اوتوفوسفريلاتيد. ' 2 ' فوسفات البروتين فقط بعد رد فعل الفوسفات الذاتي ، مما يوحي بان هذه البروتينات لم تكن نشطه بعد التعبير عن البروتين والعوامل المشتركة المطلوبة الموجودة في العازلة كيناز لتكون نشطه ؛ أو iii) فوسفات البروتين علي كلا صفائف ، مما يوحي بأنها كانت نشطه في كلا الإعدادين (الشكل 3).
كمثال علي النتائج التي تم الحصول عليها لفحص مثبطات التيروزين كيناز علي مصفوفات نابا كيناز ثلاثه مثبطات كيناسيس مع انتقائية متميزة عبر البروتين واستخدمت كيناسيس: ستوروبورنين ، imatinib و إيبروتينيب. بالنسبة لجميع العروض ، تم احتضان المصفوفات المجهرية الخاصة بالفوسفات مع زيادة تركيزات TKI (بدءا من 100 نانومتر إلى 10 ام) اثناء رد الفعل الألى. اختبار tki الأول كان ستوروبورنين ، مثبط بروتين كيناز العالمية ، التي أظهرت تثبيط كيناز قويه علي ميكروصفيف عبر تقريبا جميع تحركات اختبار11.
بعد ذلك ، تم اختبار imatinib ، وهو مثبط abl و c-كيت تستخدم لعلاج ابيضاض الدم النقوي المزمن والأورام المعدية المعوية4،5،6،7. علي نابا كيناز صفائف imatinib أظهرت انخفاضا كبيرا في النشاط Abl1 و bcr-Abl1 في حين بقيت تحركات الأخرى في الغالب غير متاثر (الشكل 4a). تم تطبيع البيانات الكمية للنشاط كيناز ضد صفيف ديفوسفوفورلات وتمثل كنسبه مئوية من ميكروصفيف السيطرة الايجابيه (السيارة فقط). وترد البيانات المتعلقة TNK2 (كيناز غير ذات الصلة) و Abl1 و BCR-Abl1 في الشكل 4 باء. كما هو متوقع ، أظهرت imatinib تثبيط انتقائي نحو Abl1 و BCR-ABl1. كانت البيانات الخاصة ب c-Kit غير حاسمه بسبب عدم وجود نشاط علي صفائف التحكم الموجبة.
وأخيرا ، تم اختبار إيبروتينيب ، وهو مثبط التكافؤ الذي وافقت عليه الهيئة لشركه بروتون التيروزين كيناز (BTK). ويستخدم حاليا إيبروتينيب في علاج العديد من السرطانات المرتبطة بالدم مع فرط نشاط btk, بما في ذلك سرطان البول اللمفاوي المزمن (cll), الغدد الليمفاوية الخلية عباءة, والدنستروميميد ماكروجلوكولونوميا21,22. الشكل 4C، هو ممثل للنتائج النموذجية التي تم الحصول عليها للفحص الإيبروتينيب. يتم عرض نشاط كيناز ABL1 (غير ذات الصلة كيناز) و BTK (الهدف المتعارف عليه) و ERBB4 (الهدف الجديد المحتمل) في الشكل 4D. وتشير البيانات ERBB4 يمكن ان تثبطها إيبروتينيب بطريقه محدده الجرعة. تم تاكيد هذا التثبيط في المختبر وفي الاختبارات المستندة إلى الخلايا11، مما يدل علي قوه هذه المنصة.
وتشير البيانات الماخوذه معا إلى انه يمكن استخدام منصة نابا-كيناز المجهرية للكشف غير المتحيز عن مثبطات المعارف التقليدية. وعلاوة علي ذلك ، فان الفرز هو سريع ويمكن تخصيصها بسهوله لتشمل اي اختلاف في البروتين الفوائد.
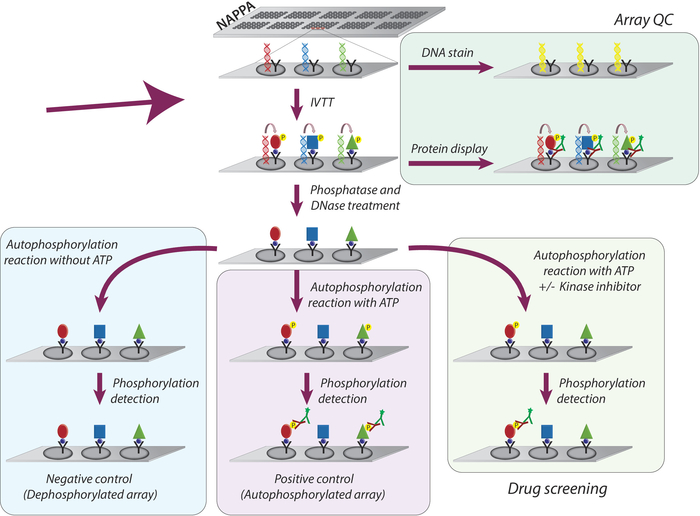
الشكل 1: التمثيل التخطيطي لمراقبه الجودة وفحص مثبطات التيروزين كيناز في صفائف نابا. يتم طباعه صفائف نابا مع الترميز cDNA للبروتين من الفائدة تنصهر مع علامة والأجسام المضادة القبض. خلال النسخ في المختبر ورد فعل الترجمة (ivtt) يتم التقاط البروتينات توليفها علي سطح ميكرواري من خلال العلامة من قبل الأجسام المضادة القبض. يتم تنفيذ مراقبه الجودة (QC) من صفائف عن طريق قياس مستويات الحمض النووي المطبوعة علي الشريحة ، وذلك باستخدام صبغه النيون الحمض النووي-intercalating ، ومستويات البروتين المعروضة علي الصفيف باستخدام الأجسام المضادة علامة محدده. للفحص كيناز ، يتم التعامل مع ميكروصفائف مع DNase و الفوسفاتيز ، بعد رد فعل IVTT ، لأزاله الحمض النووي المطبوع وجميع فوسفولات التي قد تكون وقعت اثناء تخليق البروتين. صفائف ديفوسفولولاتيد جاهزه الآن لاستخدامها في الشاشة المخدرات. بالنسبة لكل فحص ، يتم استخدام ثلاث مجموعات من الضوابط بشكل روتيني: (I) صفائف الفوسفات ، حيث يتم تنفيذ رد الفعل الألى بدون ATP ؛ ' 2 ' المصفوفات المجهرية الفوسفاتية التلقائية ، التي يتم فيها رد فعل الفوسفات الألى في وجود ATP ؛ و (III) مجموعه المعالجة DMSO (المركبة) ، حيث يتم تنفيذ تفاعل اوتوفوسفات الألى مع ATP و DMSO. الشرائح المعالجة بتركيز مختلف من مثبطات كيناز تتبع نفس البروتوكول المستخدم لصفائف المعالجة DMSO. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
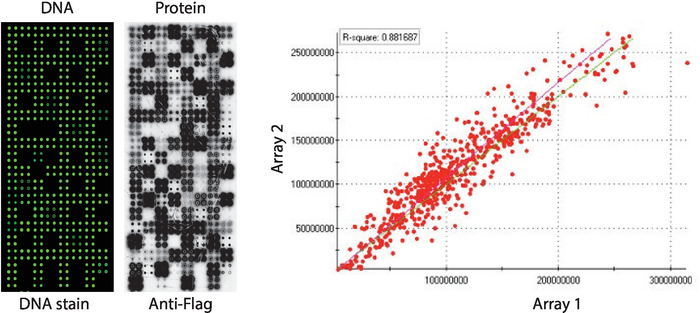
الشكل 2: النتائج التمثيلية لمراقبه الجودة لمصفوفات نابا كيناز ذاتية التجميع. يتم عرض محتوي الحمض النووي الذي يقاس بصبغه الحمض النووي الفلورية البينية (اليسار) ومستويات البروتين المعروضة علي المصفوفة المجهرية التي تقاس بالأجسام المضادة للعلم (الوسط). علي الجانب الأيمن هو مؤامرة الارتباط من مستويات البروتين المعروضة علي اثنين من المصفوفات نابا كيناز المطبوعة في دفعات منفصلة. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
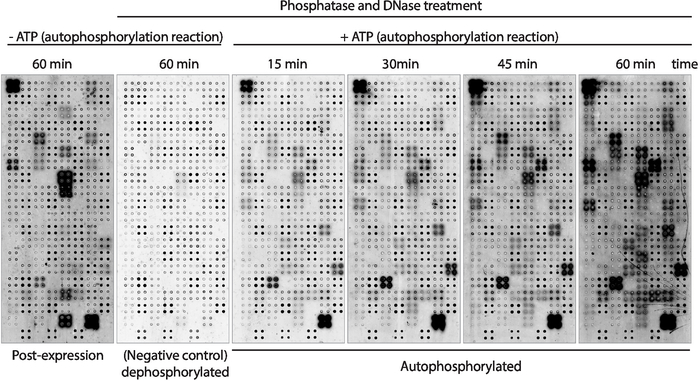
الشكل 3: النتائج التمثيلية لنشاط كيناز في صفائف نابا-كيناز. وقد استخدمت المصفوفات المجهرية التي تعرض انزيمات البروتين في بيلوروسي لدراسة نشاط بروتين كيناز علي الصفيف من خلال قياس فوسفولات البروتين باستخدام أضداد pTyr المضادة ، تليها الأجسام المضادة للماوس cy3 المسمية. التحكم صفائف دون العلاج الفوسفاتيز/DNase وبدون ATP خلال رد فعل الفوسفات الذاتي واستخدمت لقياس فوسفولات الخلفية بعد التعبير البروتين (ما بعد التعبير). تم التعامل مع الميكروصفائف المتبقية مع الفوسفاتيز/الحمض النووي ، وتم تنفيذ رد فعل الفوسفات الألى دون ATP (ديفوسفوريلاتيد ميكروصفيف ، والسيطرة السلبية) أو مع ATP (اوتوفوسفريلاتيد ميكروصفائف). بالنسبة للصفائف المجهرية التلقائية تم تنفيذ رد الفعل الألى لمده 15 دقيقه ، 30 دقيقه ، 45 دقيقه ، أو 60 دقيقه ، كما هو مبين. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
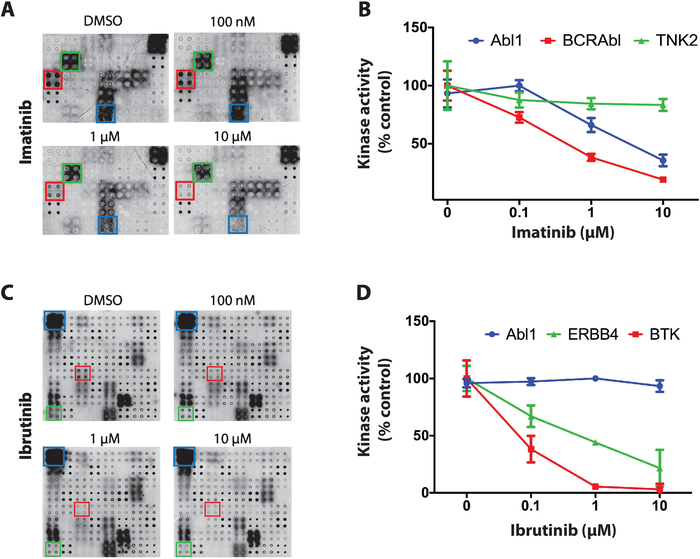
الشكل 4: بيانات تمثيليه من الشاشة التيروزين كيناز علي صفائف نابا كيناز. (ا) تم احتضان الفوسفاتيز/dnase صفائف نابا كيناز في زيادة تركيزات imatinib اثناء رد فعل الفوسفات الذاتي وكان النشاط كيناز قياس مع مضاده فوسفس-صور الأضداد. (ب) القياس الكمي لنشاط كيناز الملاحظ علي مصفوفات نابا-كيناز المعرضة لل imatinib. تم تطبيع البيانات ضد اشاره صفائف التحكم السلبية (ديفوسفوفورلات) ويتم عرضها كنسبه مئوية من صفائف التحكم الايجابيه (رد الفعل التلقائية التي أجريت في وجود DMSO). وترد بيانات مماثله لفحص الإيبروتينيب (جيم ، دال). وقد عدل هذا الرقم من رؤوف وآخرون11. يرجى النقر هنا لعرض نسخه أكبر من هذا الرقم.
الملف التكميلي 1. بروتوكول بديل لفحص مثبطات التيروزين كيناز في صفائف نابا باستخدام محطه التهجين الألى. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
التعديلات واستكشاف الأخطاء وإصلاحها
وخلال مرحله التحسين في دراسة نشاط كيناز علي صفائف نابا ، كان أحد المصادر الرئيسية للخلفية والمدى الديناميكي المنخفض الذي لوحظ هو جيش صرب الجمهورية المستخدم في مزيج الطباعة. وكان الجيش الصربي البوسني يوفر الأمينات الاساسيه اللازمة للربط مع سطح امينوسيليكات وكان محاصره الحمض النووي والأجسام المضادة للقبض علي الفور. ومع ذلك ، فان الجيش الصربي البوسني هو الفوسفارلاتيد للغاية ، مما يجعل من الصعب للكشف عن اشاره اوتوفوسفرويليشن علي الصفيف فوق الضوضاء الخلفية. ولحل هذه المشكلة ، تم اختبار عده بدائل للجيش الصربي البوسني في مزيج الطباعة ، وتم تحديد بولي-ليسين كبديل جيد. بولي-يسين يفتقر إلى اي موقع فوسفرويليشن; لذلك ، الخلفية من صفائف غير المعرب عنها الحد الأدنى جدا. وعلاوة علي ذلك ، ميكروصفائف المطبوعة مع بولي يسين هي استنساخه وعرض مستويات جيده من البروتينات (الشكل 2).
وكان التعديل الحاسم التالي الذي اجري علي فحص نابا القياسية أضافه خطوه العلاج الفوسفاتيز/DNase. العلاج من ميكروصفائف مع الفوسفاتيز يسمح بازاله اي فوسفولات التي وقعت في مزيج IVTT اثناء تخليق البروتين والقبض (الشكل 3). مصدر هذا فوسفولات يمكن ان يكون من النشاط اوتوفوسفروسيليشن الذاتية أو من نشاط كيناسيس الموجودة في مزيج IVTT. وقد سمح أزاله جميع الفوسفات بعد التعبير بسهوله التعرف علي الانزيمات النشطة والتي يمكن الخضوع لها (الشكل 3).
الخطوات الحاسمة داخل البروتوكول
نابا هي تقنيه قويه ، ولكن كما هو متوقع ، هناك العديد من الخطوات الحاسمة. الأول هو الحصول علي الحمض النووي عاليه الجودة في التركيز المناسب. استخدام الحمض النووي من نوعيه رديئه أو في تركيزات منخفضه سوف تولد ميكروصفائف نوعيه رديئه مع العديد من الميزات التي لا يتم التعبير عنها وعرضها في المستويات المناسبة ، وخفض عدد البروتينات تحليلها علي الصفيف. الخطوة الحاسمة الثانية هي التعبير عن البروتينات علي ميكروصفيف. استخدام نظام IVTT التي من شانها ان تعبر عن مستويات عاليه من البروتين الوظيفي أمر حيوي لدراسة نشاط كيناز علي الصفيف.
والخطوة الحاسمة التالية في فحص TKI هي كيفيه معالجه المصفوفات المجهرية. يجب ان لا تجف ميكروصفائف اثناء اي خطوه من البروتوكول ، وينصح التعامل مع لطيف لمنع الخدوش التي يمكن ان تزيد من اشاره الخلفية. نظرا لان صفائف من التجربة بأكملها ستقارن ضد بعضها البعض ، فمن المهم ان أؤكد ان كل خطوه الحضانة حتى عبر جميع الشرائح. علي سبيل المثال ، الوقت المطلوب لتنفيذ خطوه واحده في صفيف واحد يجب ان يؤخذ في الاعتبار عند معالجه دفعه من 20 صفائف لمنع الاختلافات في طول الحضانة عبر الصفائف.
وأخيرا ، فان تصميم التجربة وادراج كل من الضوابط الايجابيه والسلبية أمران بالغا الاهميه لمراقبه الجودة وتحليل البيانات. المجموعة الاولي من عناصر التحكم هي تلك التي تطبع في كل صفيف وتشمل الضوابط السلبية [اي ، البقع الفارغة (دون اي ماده مطبوعه) ، الماء أو ناقل فارغ (التعبير عن العلامة فقط)] ، فضلا عن السيطرة الايجابيه (اي ، مفتش المنقي ، التي يتم الكشف عنها من قبل الأجسام المضادة الثانوية وخاملة للتغيير في مستويات فوسفولات). بشكل جماعي ، فانها تقيس مستويات الخلفية من ميكروصفيف ، يمكن ترحيلها اثناء الطباعة وكثافة اشاره من طريقه الكشف.
والمجموعة التالية من عناصر التحكم هي ضوابط فحص المخدرات وتشمل المصفوفات المجهرية الفوسفاتية والفوسفروكسيلاتيد (في وجود أو غياب DMSO). وكما ذكر في وقت سابق ، يقيس ميكروصفيف ديفوسفوريلاتيد مستوي الفوسفاريليشن بعد العلاج الفوسفاتيز التالي مستوي خط الأساس لجميع التجارب الأخرى. ال [لوور] الخط أساسي مستوي, ال [هيغر] المدى حركيه من الاختبارات. المصفوفات التلقائية التي تقدم الحد الأقصى لمستويات فوسفولات من جميع صفائف ويجب ان تكون الاشاره قويه وواضحة. يتم استخدامه لتحليل البيانات ، ولكن أيضا كعنصر تحكم ان يتم تنفيذ كافة ردود الفعل بنجاح علي الصفيف.
قيود التقنية
اعتبارا من الآن ، واحده من القيود المفروضة علي الكشف عن المخدرات المعروضة هنا هو قدرته علي الشاشة فقط كيناسيس البروتين التي يمكن ان تكون اوتوفوسفوليلتيد. واحده من الطرق الممكنة للتغلب علي هذا هو طباعه كيناز والركيزة المعروفة في نفس المكان. وتم بنجاح إنجاز الطباعة المشتركة للحمضالنووي لاثنين من البروتينات المتميزة ، مما يوحي بجدوى هذا النهج. وعلاوة علي ذلك ، قد لا يتم طي البروتين المعروض علي الصفيف بشكل صحيح مما يؤدي إلى وجود بروتين غير نشط. وقد حقق استخدام نظام التعبير القائم علي الإنسان تحسنا كبيرا في نشاط كيناز مقيسا بالمصفوفة ؛ ومع ذلك ، لا يزال لا يمكن تحليل بعض البروتينات علي الصفيف بسبب عدم نشاطها.
والقيد الثاني هو قياس الفوسفات باستخدام الأجسام المضادة لعموم فوسفس-صور. وعلي الرغم من عدم الخصوصية المتعلقة بالفكرة الخاصة بموقع الفوفوفورلات ، فقد حدثت جميع فوسفولات القياس علي بقايا تيروزين ، تاركه وراءها المصليين والثلاثات والانزيمات الخاصة بهم. حتى الآن ، تم اختبار أكثر من 10 الأجسام المضادة لعموم الفوسفاو-سر/Thr دون نجاح ، علي الرغم من عده محاولات لتحسين الحضانة وظروف الغسيل. نظام الكشف الجديد الذي هو مستقل عن الأجسام المضادة قد يكون الخيار الأفضل لتوسيع عدد البروتينات التي يمكن فحصها لتثبيط المخدرات. في هذا السياق ، تتوفر بعض الخيارات بما في ذلك النشاط الإشعاعي أو النهج الكيميائية مثل الاقتران بالنقر. وهناك حاجه إلى سلسله من التحسينات للتقليل من اشاره الخلفية وتوفير مجموعه ديناميكية جيده لمقايسات.
القيد الثالث هو الحصول علي استنساخ cDNA ليتم طباعتها علي الصفيف. يمكن إنشاء استنساخ cDNA باستخدام اي تقنيه الاستنساخ بما في ذلك أنظمه أعاده التركيب الخاصة بالموقع ، مثل منشئ أو بوابه23. خيار آخر هو شراء المستنسخين من مكتبه دناس ، وجدت في < https://Dnasu.cor/dnasu/hom.do > ، حيث أكثر من 17,000 cDNAs المستنسخة ، بما في ذلك kinome البشرية بأكملها ، متاحه بسهوله لاستخدامها لبناء نابا صفائف24 .
والقيد الرابع هو انه ليس كل مختبر مجهز بالمعدات المناسبة لتلفيق وفرز صفائف نابا الخاصة بهم. يوفر هذا البروتوكول أساليب بديله لتوليد الحمض النووي للطباعة علي ميكروصفيف ، دون الحاجة إلى معدات عاليه الانتاجيه ، وبروتوكولات لتنفيذ جميع الخطوات التهجين يدويا. ومع ذلك ، لا يزال من الضروري الوصول إلى ماسح ضوئي و ميكروصفيف. أحد الخيارات للتغلب علي هذه المشكلة هو استخدام خدمه ومرفق نابا الاساسيه ، وجدت في < http://nappaproteinarray.org/> ، والتي توزع ميكروصفائف نابا مخصصه بسعر الاكاديميه غير الربحية. وأخيرا ، واعتبارا من اي منهجيه للفحص ، فان البيانات التي يتم الحصول عليها علي صفائف تكون عرضه لان تكون تحفا (اما ايجابيه أو سلبيه) التالي ينبغي التحقق من صحتها باستخدام المقايسات المتعامدة.
الاهميه فيما يتعلق بالأساليب القائمة
العديد من منصات متاحه تجاريا للكشف عن كيناسيس البروتين. نهج واحد يستخدم بشكل روتيني هو اختبارات ملزمه ، والتي يمكن ان تؤدي مع شظايا البروتين ، والمجال كيناز ، وشظايا البروتين أكبر مع المجال كيناز وبعض المناطق التنظيمية ، وحتى البروتينات كامله الطول. وعاده ما يتم التعبير عن البروتينات في النظم البكتيرية بسبب التكلفة والبساطة في بروتوكولات التعبير وتنقيه. ثم يتم قياس التفاعل بين الدواء من الفائدة والبروتين مع نوع من الفحص التقرير مثل مضان أو وجود العلامات ، علي سبيل المثال. القيد الرئيسي لهذه المجموعة من النهج هو حقيقة ان البروتين ليس بالضرورة نشطه اثناء التفاعل مع المخدرات ، والتي قد تؤدي إلى تحديد التفاعلات السلبية الايجابيه والزائفة كاذبه. شظايا البروتين هي عرضه بشكل خاص للتغيرات في التكوين وعدم وجود النشاط وجميع البيانات التي تم الحصول عليها ينبغي التحقق من صحتها باستخدام البروتينات النشطة ، ويفضل في شكلها كامل طول. وهناك قيد آخر علي بعض المنصات هو القدرة علي الشاشة فقط النظير ATP ، والحد من استخدامها الشامل.
معظم الخدمات المتاحة تجاريا لفحص TKIs باستخدام النهج الانزيميه القائمة تستخدم فقط الإصدارات من نوع البرية من كيناز الفائدة ، وأحيانا فقط عدد قليل مختاره من المسوخ. مع العلم ان مقاومه المخدرات شائعه جدا في المرضي الذين يتعاملون مع TKI ، من المهم ان تكون قادره علي قياس الاستجابة للمخدرات في المسوخ مختلفه ، لاختيار المثبط الأكثر ملاءمة. نظرا لطبيعة نابا ، وفحص المسوخ كيناز بسيطه ويمكن إنجازها بسهوله ، والاداه المطلوبة الوحيدة هي دمج متحولة كيناز في مجموعه نابا cDNA ، والتي يمكن القيام به عن طريق الطفرات الخاصة بالموقع ، علي سبيل المثال.
التطبيقات المستقبلية
واحده من الاشكال الأكثر شيوعا من العلاج الذي ينقضي في العلاج بالسرطان باستخدام مثبطات كيناز هو اكتساب الطفرات في الهدف المخدرات خلال دوره العلاج. فحص هذه المسوخ بشان استجابتها لمثبطات كيناز له اهميه حيوية لاختيار الجيل الثاني/الثالث من TKIs لتحقيق العلاج الشخصي لكل مريض. نهج الكشف عن المخدرات المعروضة هنا, يوفر منصة الفرز غير متحيزة التي يمكن اختبار اي مثبطات كيناز التيروزين ضد لوحه من الكيناسيس تيروزين الموجودة في الجينوم البشري. منذ يتم التعبير عن البروتينات المعروضة علي صفائف نابا في المختبر من cDNA المطبوعة علي الشريحة ، اي متغير متحولة يمكن بسهوله ان تدمج في مجموعه cDNA ليتم عرضها علي الصفيف. المنشاة التي يمكن توليد المسوخ كيناز والتعبير عنها علي الصفيف ، جنبا إلى جنب مع قوه عاليه الانتاجيه من تقنيه نابا ، يوفر بيئة فريدة من نوعها لدراسة المسوخ كيناز واستجابتهم للمخدرات ، مما يجعل نابا مناسبه فحص المخدرات شخصيه ، واحده من أهداف الطب الدقة.
Disclosures
ولا يعلن أصحاب البلاغ عن اي تضارب في المصالح.
Acknowledgements
ويود المؤلفون ان يشكروا الجميع في مختبر لاباير علي مساعدتهم وانتقادهم اثناء تطوير المشروع. وقد تم دعم هذا المشروع من قبل منحه المعاهد القومية للصحة U01CA117374 ، U01AI077883 ومؤسسه فرجينيا ج. بايبر.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 364 well plates (for arraying) | Genetix | x7020 | |
| 800 µL 96-well collection plate | Abgene | AB-0859 | |
| 96-pin device | Boekel | 140500 | |
| Acetic Acid | Millipore-Sigma | 1.00066 | |
| Acetone 99.9% | Millipore Sigma | 650501 | |
| Aluminum seal for 96 well plates | VWR | 76004-236 | |
| Aminosilane (3-aminopropyltriethoxysilane) | Pierce | 80370 | |
| ANTI-FLAG M2 antibody produced in mouse | Millipore Sigma | F3165 | |
| Anti-Flag rabbit Antibody (polyclonal) | Millipore Sigma | F7425 | |
| ATP 10 mM | Cell Signaling | 9804S | |
| β-Glycerophosphate disodium salt hydrate | Millipore-Sigma | G9422 | |
| bacteriological agar | VWR | 97064-336 | |
| Blocking Buffer | ThermoFisher/Pierce | 37535 | |
| Brij 35 | ThermoFisher/Pierce | BP345-500 | |
| BS3 (bis-sulfosuccinimidyl) | ThermoFisher/Pierce | 21580 | |
| BSA (bovine serum albumin) | Millipore Sigma | A2153 | |
| Coverslip 24 x 60 mm | VWR | 48393-106 | |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | |
| DeepWell Block, case of 50 | ThermoFisher/AbGene | AB-0661 | |
| DEPC water | Ambion | 9906 | |
| DMSO (Dimethyl Sulfoxide) | Millipore-Sigma | D8418 | |
| DNA-intercalating dye | Invitrogen | P11495 | |
| DNase I | Millipore-Sigma | AMPD1-1KT | |
| DTT | Millipore-Sigma | 43816 | |
| EDTA | Millipore-Sigma | EDS | |
| Ethanol 200 proof | Millipore-Sigma | E7023 | |
| Filter plates | Millipore-Sigma | WHA77002804 | |
| Gas Permeable Seals, box of 50 | ThermoFisher/AbGene | AB-0718 | |
| Glass box | Wheaton | 900201 | |
| Glass slides | VWR | 48300-047 | |
| Glycerol | Millipore-Sigma | G5516 | |
| HCl (Hydrochloric acid) | Millipore-Sigma | H1758 | |
| HEPES Buffer Solution | Millipore-Sigma | 83264 | |
| Human-based IVTT system | Thermo Scientific | 88882 | |
| ImmunoPure Mouse IgG whole molecule | ThermoFisher/Pierce | 31202 | |
| Isopropanol | Millipore-Sigma | I9516 | |
| KCl (Potassium chloride) | Millipore-Sigma | P9333 | |
| KH2PO4(Potassium phosphate monobasic) | Millipore-Sigma | P5655 | |
| Kinase buffer | Cell Signaling | 9802 | |
| KOAc (Potassium acetate) | Millipore-Sigma | P1190 | |
| Lambda Protein Phosphatase | new england biolabs | P0753 | |
| Lifterslips, 24 x 60 mm | ThermoFisher Scientific | 25X60I24789001LS | |
| Metal 30-slide rack with no handles | Wheaton | 900234 | |
| MgCL2 (Magnesium chloride) | Millipore-Sigma | M8266 | |
| Na3VO4 (Sodium orthovanadate) | Millipore-Sigma | S6508 | |
| NaCl (Sodium Chloride) | Millipore-Sigma | S3014 | |
| NaOAc (Sodium acetate) | Millipore-Sigma | S2889 | |
| NaOH (Sodium hydroxide) | Millipore-Sigma | S8045 | |
| NucleoBond Xtra Midi / Maxi | Macherey-Nagel | 740410.10 / 740414.10 | |
| Nucleoprep Anion II | Macherey Nagel | 740503.1 | |
| Phosphoric Acid | Millipore-Sigma | 79617 | |
| Poly-L-Lysine Solution (0.01%) | Millipore-Sigma | A-005-C | |
| Protein Phosphatase (Lambda) | New England Biolabs | P0753 | |
| RNAse | Invitrogen | 12091021 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | L6026 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | 05030 | |
| Sealing gasket | Grace Bio-Labs, Inc | 44904 | |
| Silica packets | VWR | 100489-246 | |
| Single well plate | ThermoFisher/Nalge Nunc | 242811 | |
| Sodium acetate (3M, pH 5.5) | Millipore-Sigma | 71196 | |
| TB media (Terrific Broth) | Millipore-Sigma | T0918 | |
| Tris | IBI scientific | IB70144 | |
| Triton X-100 | Millipore-Sigma | T8787 | |
| Tryptone | Millipore-Sigma | T7293 | |
| Tween 20 | Millipore-Sigma | P9416 | |
| Yeast Extract | Millipore-Sigma | Y1625 | |
| Name | Company | Catalog number | Comments |
| Equipments | Maker/model | ||
| Programmable chilling incubator | Torrey Pines IN30 Incubator with Cooling | ||
| Shaker for bacterial growth | ATR Multitron shaker | ||
| Vacuum manifold with liquid waste trap | MultiScreenVacuum Manifold 96 well | ||
| 96 well autopippetor/liquid handler | Genmate or Biomek FX | ||
| Liquid dispenser | Wellmate | ||
| DNA microarrayer | Genetix QArray2 | ||
| Automatic hybridization station | Tecan HS4800 Pro Hybridization Station | ||
| Microarray scanner | Tecan PowerScanner | ||
| Microarray data quantification | Tecan Array-ProAnalyzer 6.3 |
References
- Melnikova, I., Golden, J. Targeting protein kinases. Nature Review Drug Discovery. 3 (12), 993-994 (2004).
- Patterson, H., Nibbs, R., McInnes, I., Siebert, S. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases. Clinical and Experimental Immunology. 176 (1), 1-10 (2014).
- Wu, P., Nielsen, T. E., Clausen, M. H. FDA-approved small-molecule kinase inhibitors. Trends Pharmacological Sciencies. 36 (7), 422-439 (2015).
- Druker, B. J., et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nature Medicine. 2 (5), 561-566 (1996).
- Heinrich, M. C., et al. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood. 96 (3), 925-932 (2000).
- Stagno, F., et al. Imatinib mesylate in chronic myeloid leukemia: frontline treatment and long-term outcomes. Expert Review Anticancer Therapy. 16 (3), 273-278 (2016).
- Ben Ami, E., Demetri, G. D. A safety evaluation of imatinib mesylate in the treatment of gastrointestinal stromal tumor. Expert Opinions in Drug Safety. 15 (4), 571-578 (2016).
- Ramachandran, N., et al. Self-assembling protein microarrays. Science. 305 (5680), 86-90 (2004).
- Festa, F., et al. Robust microarray production of freshly expressed proteins in a human milieu. Proteomics Clinical Applications. 7 (5-6), 372-377 (2013).
- Yazaki, J., et al. Mapping transcription factor interactome networks using HaloTag protein arrays. Proceedings of the National Academy of Sciences of the United States of America. 113 (29), E4238-E4247 (2016).
- Rauf, F., et al. Ibrutinib inhibition of ERBB4 reduces cell growth in a WNT5A-dependent manner. Oncogene. 37 (17), 2237-2250 (2018).
- Anderson, K. S., et al. Protein microarray signature of autoantibody biomarkers for the early detection of breast cancer. Journal of Proteome Research. 10 (1), 85-96 (2011).
- Wang, J., et al. Plasma Autoantibodies Associated with Basal-like Breast Cancers. Cancer Epidemiol Biomarkers Prevention. 24 (9), 1332-1340 (2015).
- Bian, X., et al. Tracking the Antibody Immunome in Type 1 Diabetes Using Protein Arrays. Journal of Proteome Research. 16 (1), 195-203 (2017).
- Song, L., et al. Identification of Antibody Targets for Tuberculosis Serology using High-Density Nucleic Acid Programmable Protein Arrays. Molecular and Cellular Proteomics. 16 (4 suppl 1), S277-S289 (2017).
- Wang, J., et al. Comparative Study of Autoantibody Responses between Lung Adenocarcinoma and Benign Pulmonary Nodules. Journal of Thoracic Oncology. 11 (3), 334-345 (2016).
- Montor, W. R., et al. Genome-wide study of Pseudomonas aeruginosa outer membrane protein immunogenicity using self-assembling protein microarrays. Infection and Immunity. 77 (11), 4877-4886 (2009).
- Tang, Y., Qiu, J., Machner, M., LaBaer, J. Discovering Protein-Protein Interactions Using Nucleic Acid Programmable Protein Arrays. Current Protocols in Cell Biology. 74, 11-15 (2017).
- Yu, X., et al. Copper-catalyzed azide-alkyne cycloaddition (click chemistry)-based detection of global pathogen-host AMPylation on self-assembled human protein microarrays. Molecular and Cellular Proteomics. 13 (11), 3164-3176 (2014).
- Anderson, K. S., et al. Autoantibody signature for the serologic detection of ovarian cancer. Journal of Proteome Research. 14 (1), 578-586 (2015).
- Woyach, J. A., Johnson, A. J., Byrd, J. C. The B-cell receptor signaling pathway as a therapeutic target in CLL. Blood. 120 (6), 1175-1184 (2012).
- Smith, M. R. Ibrutinib in B lymphoid malignancies. Expert Opinion on Pharmacotherapy. 16 (12), 1879-1887 (2015).
- Festa, F., Steel, J., Bian, X., Labaer, J. High-throughput cloning and expression library creation for functional proteomics. Proteomics. 13 (9), 1381-1399 (2013).
- Seiler, C. Y., et al. DNASU plasmid and PSI:Biology-Materials repositories: resources to accelerate biological research. Nucleic Acids Research. 42, D1253-D1260 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved