Method Article
Kendi kendine monte Edilen İnsan Protein Mikrodizilerinde Kiaz Inhibitörü Taraması
Bu Makalede
Özet
Kiaz inhibitörlerinin taranması için kendi kendine biraraya getirilen insan proteinmikrodizilerinin üretimi için ayrıntılı bir protokol sunulmuştur.
Özet
Kiyaz inhibitörlerinin taranması, bir ilacın özelliklerini daha iyi anlamak ve klinik etkileri olan potansiyel yeni hedeflerin belirlenmesi için çok önemlidir. Bu tür bir taramayı gerçekleştirmek için çeşitli metodolojiler bildirilmiştir. Ancak, her birinin kendi sınırlamaları vardır (örneğin, sadece ATP analoglarının taranması, saflaştırılmış kinaz alan adlarının kullanılmasına yönelik kısıtlama, bir seferde birkaç kindan fazla kinaz ın test edilmesiyle ilgili önemli maliyetler ve protein kinazlarının taranmasında esneklik eksikliği yeni mutasyonlar). Burada, bu sınırlamaların bazılarını aşan ve kiyaz inhibitörlerinin tarafsız taraması için kullanılabilecek yeni bir protokol sunulmuştur. Bu yöntemin bir gücü farklı kinazlar veya aynı kinaz farklı varyantları arasında, birden fazla protein arasında kinaz inhibitörlerinin aktivitesini karşılaştırmak için yeteneğidir. İnsan temelli in vitro transkripsiyon ve çeviri sistemi (IVTT) tarafından protein kinazlarının ekspresyonu ile oluşan kendi kendine birleştirilmiş protein mikrodizileri kullanılmaktadır. Mikrodizide görüntülenen proteinler aktiftir, kiaz inhibitörlerinin etkilerinin ölçülmesine olanak sağlar. Aşağıdaki yordam, mikrodizi oluşturma ve taramadan veri analizine kadar protokol adımlarını ayrıntılı olarak açıklamaktadır.
Giriş
Protein kinazları hedeflerinin fosforilasyonundan sorumludur ve birçok hücresel işlevi kontrol eden karmaşık moleküler yolları (örn. hücre çoğalması, farklılaşma, hücre ölümü ve sağkalım) modüle edebilirler. Kiaz aktivitesinin deregülasyonu 400'den fazla hastalıkla ilişkilidir, kiyaz inhibitörlerini kanser, kardiyovasküler ve nörolojik hastalıkların yanı sıra inflamatuar hastalıklar da dahil olmak üzere çeşitli hastalıkların tedavisi için kullanılan başlıca ilaçlardan biri haline getirir. ve otoimmün hastalıklar1,2,3.
Hassas tıbbın gelişiyle, yeni tedavilerin belirlenmesi, özellikle kinizaz inhibitörleri, ilaç ve klinik büyük itiraz var. Kiaz inhibitörlerinin de novo tasarımı ve mevcut FDA onaylı ilaçlar için yeni hedeflerin belirlenmesi de dahil olmak üzere, olası yeni kigir/kiyaz inhibitörlerinin tanımlanması için çeşitli yaklaşımlar kullanılabilir. Kliniklerde bu ilaçların uygulanması için gereken zaman ve para önceki klinik deney verilerinin kullanılabilirliği nedeniyle önemli ölçüde azaldığı için ikincisi özellikle çekicidir. Bir kiaz inhibitörü repurposing bir kanonik örnek imatinib, başlangıçta kronik miyelojen lösemi tedavisi için tasarlanmış (CmL) BCR-Abl inhibisyonu yoluyla, aynı zamanda başarıyla c-Kit aşırı ifade tedavisi için kullanılabilir gastrointestinal stromal tümörler (GIsTs)4,5,6,7.
Kiyaz inhibitörlerinin taranması bağlayıcı tahlillerde veya enzimatik tabanlı tahlillerde yapılabilir. Tahlillerin birinci sınıfı protein-ilaç etkileşimlerine odaklanır ve ligasyon bölgesi ve yakınlık gibi bilgiler sağlayabilir. Bu tahliller sırasında kizaz aktivitesi bilinmediğinden, proteindeki konformasyonel değişiklikler nedeniyle bir takım etkileşimler gözden kaçırılabilir veya yanlış saptanabilir. Öte yandan, enzim bazlı tahliller protein kinazlarının aktif olmasını gerektirir ve inhibitörün enzim aktivitesi üzerindeki etkisi hakkında değerli bilgiler sağlar, ancak bu tür bir tarama genellikle daha zaman alıcı ve pahalıdır. Şu anda, tahliller her iki tür ticari çeşitli kaynaklardan kullanılabilir. Bunlar, kinaz inhibitörlerinin birkaç sınırlaması ile taranması için güvenilir bir seçenektir: I) yöntemlerin çoğu birden fazla kinazın ayrı ayrı test edilmesini içerir, bu da büyük bir protein setinin taranmasını pahalıya mal edebilir; II) test edilecek kinases kümesi önceden seçilmiş bir liste ile sınırlıdır, yabani tip kinazlar ve bazı kinazlar birkaç iyi bilinen mutasyona uğramış sürümleri, birçok yeni mutasyona uğramış isoforms test engelleyen.
Bu bağlamda, protein mikrodizileri, ticari olarak mevcut tekniklerle sunulan bazı sınırlamaların üstesinden gelebilen güçlü bir platformdur. İlgi çekici tam uzunlukta, aktif proteinler kullanılarak yüksek iş yapma taramasında enzimatik bazlı tahliller yapmak uygundur. Mikrodiziler NAPPA (nükleik asit programlanabilir protein dizisi) gibi kendi kendine biraraya getirilmiş bir yaklaşımla oluşturulabilir ve proteinler tahliller için tam zamanında ifade edilir ve dizide görüntülenenlerin gerçekten aktif olma olasılığını artırır. NAPPA'da görüntülenen proteinler, doğal katlama ve aktivite olasılığını artırmak için insan kaynaklı ribozomlar ve şaperon proteinleri kullanılarak üretilir.
Proteinler başlangıçta bir yakalama etiketi ile kaynaşmış ilgi genleri için kodlayan cDNA'lar baskı tarafından programlanır, bir yakalama maddesi ile birlikte, mikrodizi yüzeyine. Proteinler daha sonra in vitro transkripsiyon ve çeviri (IVTT) sistemi kullanılarak mikrodiziler üzerinde üretilir ve yeni ifade edilen proteinler yakalama maddesi tarafından mikrodizi yüzeyinde hareketsiz hale getirilir. İfade NAPPA dizileri, dizide görüntülenen proteinlerin tarafsız, yüksek iş lenme tarzında incelenmesi için kullanılabilir8,9.
Daha önce, NAPPA dizilerinde görüntülenen proteinlerin bilinen ortaklarla etkileşime girebilmek için düzgün bir şekilde katlandığını göstermiştir10; ayrıca enzimatik aktivitelerinin ilk kez 2018 yılında mikrodizi otofosforilasyon11'deprotein kinazlarının görüldüğü gösterilmiştir. Bugüne kadar, NAPPA metodolojisi biyomarker keşif 12 ,13,14,15,16,17dahil olmak üzere birçok farklı uygulamalar için kullanılmıştır protein-protein etkileşimleri10,18, substrat tanımlama19, ve ilaç taraması11. Esnekliği, platformun her uygulamaya adaptasyon sağlayan temel özelliklerinden biridir.
Burada, kendi kendine monte edilen NAPPA dizilerinde tirozin kinaz inhibitörlerinin taranması için bir protokol sunulmuştur. Platform aktif insan protein kinazlarının görüntülenmesi ve düşük arka plan ve yüksek dinamik aralıkta protein kinaz aktivitesinin analizi için optimize edilebiyi optimize edabedilir. Kiyaz inhibitörlerinin taranması için NAPPA'nın kullanımı için uygulanan modifikasyonlar arasında şunlar: I) baskı kimyasındaki değişiklikler, II) kizaz inhibitörü taraması ndan önce protein mikrodizisinin fosforilasyonunun kaldırılması ve III) dizi üzerinde fosforilasyon lu proteinler. Bu protokol türünün ilk ve NAPPA mikrodizilerde kizaz çalışma hakkında benzersiz bilgiler sağlar.
Protokol
1. Kullanılacak ortak arabellekler ve çözümler
- TB orta hazırlayın: Müthiş et suyu (24 g / L maya özü; 20 g / L tripton; 4 mL / L gliserol; 0.017 M KH2PO4; ve 0.072 M K2HPO4). 0.017 M KH2PO4 ve 0.072 M K2HPO4 çözeltisi 10x fosfat tamponu (0.17 M KH2PO4 ve 0.72 M K2HPO4)olarak satın alınabilir.
- LB orta hazırlayın: Luria-Bertani (5 g / L maya özü; 10 g / L tripton; ve 10 g / L NaCl). 5 M NaOH ile pH'ı 7,0'a ayarlayın.
- 1x TBS hazırlayın: Tris-tamponlu salin (TBS: 50 mM Tris-Cl, pH = 7.5; 150 mM NaCl).
- 1x TBST hazırlayın: TBS% 0.1 Tween 20 ile desteklenmektedir.
2. DNA hazırlığı
NOT: NAPPA dizileri için kullanılan DNA son derece saf olmalıdır; bu nedenle, ticari DNA mini-preps tavsiye edilmez. Şu anda, DNA hazırlığı için iki protokol kullanılmaktadır: ev yüksek iş itimatmini hazırlık (burada açıklanan) veya ticari Midi- veya Maxi-hazırlık. Şirket içi mini hazırlık protokolünün ortalama iş miktarı kişi başına günde 1.500 örnektir.
- Şirket içi yüksek iş ortası mini hazırlık için bakteri üremesi
- LB/Agar omni plakası hazırlayın. Her bir kuyu plakasına 30-40 mL LB agar (%1,5 bakteriyolojik agar LB media pozitif klon seçimi için antibiyotik le desteklenmiştir) dökün.
- LB / agar plaka spot gliserol stok. LB ortamlarında seyreltik gliserol stoku (1:300, genellikle 2 μL 600 μL LB). 10 dakika boyunca çalkalayın. 37 °C'de, baş aşağı, gece boyunca kuluçkaya yatırın.
- Kültürleri aşılamak. %80 etanol ve alev le sterilize edilen 96 iğneli cihazı kullanarak, antibiyotikle desteklenen tb ortamının kuyusu başına 1,5 mL ile derin kuyulu bir bloktaki agar plakasından kültürü aşılayın.
- Kuluçka kültürleri. Bloğu bir gaz geçirbilebilir conta ile kaplayın ve shaker'a bağlı olarak 37 °C,300-800 rpm'de 22-24 saat kuluçkaya yatırın.
NOT: Shakers 800 rpm olarak ayarlanmış bu kuluçka için en uygun. Daha yavaş bir hız shaker kullanımı daha az yoğun kültürler ve düşük DNA arınma verimleri neden olabilir. - Pelet kültürleri. 30 dk. için 3.800 x g ve 4 °C'de spin blokları.
- Şirket içi yüksek iş ortası mini hazırlık
NOT: Çok kanallı pipettorlar veya otomatik dağıtıcılar, şirket içi yüksek iş yapma mini hazırlıklarını gerçekleştirmek için kullanılabilir. Otomatik bir dağıtıcı kullanıyorsanız, sistemi kullanmadan önce ve çözümler arasında temizlediğinden emin olun.- Mini hazırlık sırasında kullanılan tüm çözümleri hazırlayın:
- Hazırlayın Çözelti 1: TE resuspension tampon (50 mM Tris, pH = 8.0; 10 mM EDTA, pH = 8.0; 0.1 mg/mL RNAse). 4 °C'de saklayın.
- Hazırlayın Çözüm 2: NaOH / SDS lysis tampon (0.2 M NaOH; 1% SDS). Daha iyi sonuçlar elde etmek için, yeni yapılmış bir çözüm kullanılmalıdır.
- Hazırlayın Çözüm 3: KOAC nötralizasyon tampon (2.8 M KOAc). Çözeltinin pH'ını buzul asetik asitile 5.1'e ayarlayın. 4 °C'de saklayın.
- Çözüm N2 hazırlayın: denge tampon (100 mM Tris; 900 mM KCl; 15% EtOH; 0.15% Triton X-100). Çözeltinin pH'ını fosforik asitle 6.3'e ayarlayın.
- Hazırlayın Çözelti N3: bash tampon (100 mM Tris; 1.15 M KCl; 15% EtOH). Çözeltinin pH'ını fosforik asitle 6.3'e ayarlayın.
- Hazırlayın Çözelti N5: elüsyon tampon (100 mM Tris; 1 M KCl; 15% EtOH). Çözeltinin pH'ını fosforik asitle 8,5'e ayarlayın.
NOT: Aniyon değişimi sırasında DNA bağlanması, yıkanması ve elüsasyonunun başarılı bir şekilde kontrolü tampon KCl konsantrasyonuna ve pH değerlerine bağlıdır. Dikkatli tampon bileşen ölçümleri ve pH ayarı gereklidir. Açıklanan ölçümlerden küçük sapmalar önemli verim kaybına neden olabilir.
- Peleti yeniden askıya alın. 200 μL çözelti 1 ekleyin ve 2.000 rpm'de RT'de 5 dakika çalkalayın. Gerekirse bloğu girdap.
- Lyse bakterisi. 200 μL çözelti 2 ekleyin, plakayı alüminyum bir contayla kapatın ve 5x ters çevirin. Dikkatle zaman çözüm 2 ek başından itibaren bu adım. 5 dakikayı geçmeyin.
- Çözeltiyi nötralize edin. 200 μL çözelti 3 ekleyin, plakayı alüminyum bir contayla kapatın ve 5x ters çevirin. Mühür lysis/nötralizasyon tamponları nedeniyle gevşek olabilir, bu nedenle ters çevirme yaparken dikkatli olun. Çözeltinin mühüre asla değmeyeceği kısmi bir ters çevirme, numuneler arasında çapraz kontaminasyonu önlemek için önerilir.
- Temiz bir şekilde. Plakaları 30 dk için 3.800 x g ve 4 °C'de santrifüj edin.
- Lysate peletasyon santrifüj adımı nda aniyon değişimi recine bulamacı hazırlayın. 1 L'lik bir şişe kullanarak, 300 mL işaretine ulaşana kadar aniyon değişimi reçine doldurun, ardından 900 mL'ye kadar N2 çözeltisi ekleyin.
DİkKAT: Bu adım silika inhalasyonuna karşı korumak için kaputta yapılmalıdır. - Aniyon değişimi reşin plakaları hazırlayın. Bir atık toplama kabı olarak hareket etmek için derin bir kuyu bloğu üstüne filtre plakaları yığını. Bu homojen olana kadar aniyon değişimi bulamaç karıştırın, sonra bir cam yalak içine dökün. Geniş sıkılmış P1000 ipuçlarını kullanarak, bulamaçtan 450 μL'lik kısmı filtre plakalarının her kuyuya aktarın.
- Santrifüj yığılmış plakalar (reçine plakası/derin kuyu plakası) yavaş ivmede 5 dk 130 x g ve RT. Akışı atın.
- Supernatant'ı reçine plaka/derin kuyu bloğu yığınlarına aktarın. Yığılmış plakaları 5 dk 30 x g'da yavaş rampa hızıyla döndürün.
- Sütunu yıkayın. Her kuyuya 400 μL çözelti N3 (yıkama tamponu) ekleyin. Yıkama tamponu kaldırmak için vakum manifoldu için reçine plaka aktarın. Yıkama adımlarını 3x tekrarlayın. Son yıkamada, tüm kuyuların düzgün bir şekilde boşaltılmış olduğundan emin olun. Herhangi bir artık arabellek kaldırmak için 5 dakika için 150 x g yığın plakaları spin.
- Elute DNA'sı. Reşin plakasını temiz bir 800 μL toplama plakasının üzerine yerleştirin. Her kuyuya 300 μL çözelti N5 ekleyin. 10 dakika RT'de oturun, sonra 5 dk boyunca yığılmış plakaları 20 x g'de yavaş rampa hızıyla döndürün. 233 x g'da 1 dk yığılmış plakaları döndürün.
- DNA'yı ölçün ve plakaları -20 °C'de daha fazla kullanılana veya doğrudan DNA yağışına doğru ilerleyene kadar ölçün.
NOT: Örnek başına en az 30 μg DNA gereklidir. DNA verimi düşükse, DNA mini-prep tekrarlamak için tavsiye edilir, ya da alternatif olarak yağış adım (bölüm 2.3) sırasında iki plaka birleştirmek.
- Mini hazırlık sırasında kullanılan tüm çözümleri hazırlayın:
- DNA yağışı
- Plakaları eritin, DNA çözeltisini homojenize etmek için girdap ve kuyunun dibindeki tüm çözeltiyi toplamak için 30 s için 230 x g'da döndürün.
- Her kuyuya 40 μL 3 M NaOAc ve 240 μL isopropanol ekleyin. Bir alüminyum conta ile plaka kapağı ve 3x ters çevirerek karıştırın.
- 3.800 x g ve 25 °C'de 30 dk plakaları santrifüj edin. Supernatant'ı dikkatlice atın.
NOT: İki plakayı birleştirmek için, DNA'yı ikinci plakadan ilk plakadan pelete aktarın ve 2.3.2-2.3.3 adımlarını tekrarlayın. - DNA'yı yıkayın ve çökeltin. Her kuyuya %80 etanol 400 μL ekleyin. Alüminyum mühürlü plakaları ve 30 dk. Santrifüj için 1.000 rpm'de 3.800 x g'de 30 dk 25 °C'de çalkalayın. Supernatant atın.
- DNA peletlerini kurutun. Tabakları kağıt havlular üzerinde bir açıyla baş aşağı yerleştirin ve kuyunun dibinde alkol bulununa kadar 1-2 saat kurumaya bırakın. Mühür ve santrifüj 230 x g 2 dk herhangi bir pelet aşağı getirmek için.
- Plakalar kurutuldıktan sonra, ya alüminyum conta ile mühürleyin ve daha sonra kullanmak üzere -20 °C'de dondurun veya DNA'yı yeniden askıya almaya devam edin (adım 4.1).
3. Aminosilane slayt kaplama
- Cam slaytları metal rafa yerleştirin. Herhangi bir çizik veya kusur bulunmadığından emin olmak için her slaydı görsel olarak inceleyin.
- Kayarken 15 dakika boyunca kaplama çözeltisi (asetonda %2 aminosilane reaktifi) batırın. Aminosilane çözeltisi, atılması gerekmeden önce her biri 30 kaydıran iki rafı kaplamak için kullanılabilir.
- Durulama adımı. Slayt rafını aseton yıkamada batırın (%99 aseton), ileri geri sallayın, sonra hızlı bir şekilde 5 kat yukarı ve aşağı. Damlatmak için bir köşeye yatırın ve ardından Ultrapure suyuna hızla 5 kat aşağı daldırın. Damlatmak için yatırın, sonra peçetelerin üzerine yerleştirin.
NOT: Aseton yıkama iki kez kullanılabilirken, ultra saf su her seferinde değiştirilmelidir. - Basınçlı hava kullanarak kuru kaydıraklar, tüm su damlacıkları kaldırılana kadar yaklaşık 3 dakika boyunca tüm açılardan üzerlerine üfleme. Kaplamalı slaytları RT'de sıkıca kapatılmış bir kutunun içinde metal bir rafta saklayın.
4. Dizi örnek hazırlama
- 20 μL ultrasaf sudaki dna peletini (adım 2.3.6) şirket içi mini hazırlıktan yeniden askıya alın ve 1000 rpm'de 2 saat çalkalayın. Midi/max prep DNA için, her numuneyi 1,5 g/μL'lik son konsantrasyona seyreltin ve 20 μL'yi 800 μL toplama plakasına aktarın.
- Baskı karışımı hazırlayın. Bir 96 iyi plaka için 1 mL baskı karışımı [237,5 μL ultrasaf su; 500 μL poli-lizin (%0,01); 187,5 μL BS3 (bis-sulfosuccinimidil, DMSO'da 50 mg/mL); ve 75 μL poliklonal anti-bayrak lı tavşan antikoru)] hazırlayın.
NOT: Yağıştan korunmak için kimyasallar belirtilen sırayla eklenmelidir. - Her numuneye 10 μL baskı karışımı ekleyin, plakaları alüminyum folyoyla kapatın ve 1.000 rpm'de 90 dakika BOYUNCA RT'de sallayın. Plakaları gece boyunca (~16 saat) 4 °C'de saklayın.
- Baskı gününde, kısa bir süre girdap ve plakaları spin. Her numunenin 28 μL'sini 384 dizilik bir plakaya aktarın. Bu aktarım otomasyon veya çok kanallı pipet kullanılarak yapılabilir. 384 dizi plakasındaki örneklerin konumunu takip etmek çok önemlidir.
- Herhangi bir kabarcıkları kaldırmak için kısa bir süre aşağı plaka spin. Plakaları folyoyla kapatın.
5. NAPPA dizilerinin üretimi: mikrodizi baskı
NOT: Tüm baskı koşulları, Ekipman ve Malzeme Tablosu'ndalistelenen alet için optimize edilmiştir. Farklı bir dizi kullanıyorsanız, daha fazla optimizasyon gerekebilir.
- Arrayer temizleyin. Başlamadan önce, tüm atık tanklarını boşaltın ve gerekirse rezervuarları ultra saf su veya %80 etanolle doldurun. İğneleri tüy bırakmayan mendil ve ultra saf su ile tektek temizleyin. İğneleri tüy bırakmayan mendillerle kurulayın ve dikkatlice dizinin başına yerleştirin.
- Arrayer kurulumu: yazdırma özellikleri [mürekkep başına pul başına maksimum sayı: 1; nokta başına pul sayısı: 1; çok damga zamanlaması: --; damga süresi (ms): 0 ms; mürekkep zamanı (ms): 0 ms; yazdırma derinliği ayarı: 90 mikron; dokunma-off sayısı: 0]. Sonra, sterilizasyon protokolü: 0 ms kuruma süresi ve 500 ms bekleme süresi ile 2.000 ms ultrasaf su yıkama; bu adımları 6x tekrarlayın; 2.000 ms için %80 etanol ile yıkama, 1.200 ms kuruma süresi ve 500 ms bekleme süresi; bu adımları 6x tekrarlayın.
- Slayt tasarımı: arrayer istenilen dizileme deseni ile ayarlayın. Tasarım çeşitli faktörleri dikkate almalıdır [yani, her örnek için yineleme sayısı, konum ve denetim özelliklerinin sayısı, dizi düzeni (bir blok, birkaç özdeş blok), yazdırılacak dizi sayısı, çalışma uzunluğu, vb.].
- Aminosilane kaplı slaytları (adım 3.4) arrayer güverteye yerleştirin. Vakumun tüm slaytları güvenli bir şekilde yerinde tutup tutmadınolup olmadığını kontrol edin. Nemlendiriciyi başlatın (%60 olarak ayarlanmalıdır).
- 384 kuyu plakasını arrayer güverteye yerleştirin. Programı başlatın.
- Mikrodizileri etiketle. Yazdırma yapıldığında, slayt etiketlerini her sladanın alt tarafına (yazdırılmamış) yerleştirin. Slaytyazdırma sırasını destedeki sayısal sırada koruyun.
- Basılı dizileri RT'de metal bir rafta silika paketiyle sıkıca kapatılmış bir kutunun içinde saklayın. Kuru bir ortamda tutulan kaydırakların raf ömrü bir yıla kadar dır.
- (İsteğe bağlı): aynı örnekler kullanılarak 90 slayttan oluşan ikinci bir seri yazdırılabilir. Bunu yapmak için, plakanın baskısı biter bitmez 384 kuyu plakasını arrayer güverteden çıkarın. Plakayı 4 °C'de kapatın ve saklayın. Dizilerin ilk toplu tamamen bittikten sonra, güverteden kaldırın, yeni aminosilane kaplı slaytlar yerleştirin ve yeni bir çalışma başlar. Her 384 kuyu plakası kullanımdan önce 30 dakika boyunca RT'de olduğundan emin olun. Örnek başına dörtten fazla yineleme slayt lar halinde yazdırılırsa, 384 kuyu plakasının iki plakaya bölünmesi ve dizi destesinde harcanan süreyi azaltarak numune buharlaşmasını azaltması önerilir.
NOT: İkinci çalıştırmabaşlamadan önce tüm rezervuarları kontrol edin.
6. NAPPA slaytlarında DNA tespiti
- Slaytları engelleyin. Slaytları bir pipet kutusuna yerleştirin ve 30 mL engelleme arabelleği ekleyin. Bir sallanan shaker üzerinde 1 saat RT inkübat.
- Slaytları lekele. Engelleme çözeltisini atın ve 20 mL engelleme tamponu ve 33 μL floresan DNA-intercalating boya ekleyin. Ajitasyon ile 15 dakika kuluçka. Daha sonra, hızlı bir şekilde ultrasaf su ile slaytlar durulayın ve basınçlı hava ile kuru. Tarama (bölüm 11) ile devam edin.
7. NAPPA slaytlarının ifadesi
- 1 saat boyunca RT'de sallanan bir çalkalayıcıüzerinde engelleme tamponu ile slaytları engelleyin.
- Ultra saf su ile durulayın slaytlar ve filtrebasınçlı hava ile kuru. Her slayta üreticinin talimatlarına göre sızdırmazlık contası uygulayın.
- IVTT karışımı ekleyin. Her slayt 150 μL IVTT karışımı gerektirir. Seyreltin 82.5 μL HeLa lysate 33 μL DEPC su ve ek 16.5 l aksesuar proteinleri ve reaksiyon karışımı 33 uL ile. IvTT karışımını etiket olmayan veya numune olmayan uçtan ekleyin. Pipet yavaş yavaş karışımı (bu giriş ucunda geçici olarak boncuk eğer kabul edilebilir). IVTT karışımı yayılır ve dizinin tüm alanı kapsar böylece yavaşça sızdırmazlık conta masaj. Küçük yuvarlak bağlantı noktası contalarını her iki bağlantı noktasına da uygulayın.
- Slaytları bir desteğe yerleştirin ve programlanabilir soğutucuya aktarın. Protein ekspresyonu için 30 °C'de 90 dk, sorgu proteininin immobilizasyonu için 15 °C'de 30 dk inkübasyon.
- Slaytları yıkayın ve engelleyin. Sızdırmazlık contasını çıkarın ve yaklaşık 30 mL 1x TBST ile bir pipet kutusuna slaytlar batırın protein görüntüleme için% 5 süt ile takviye (bölüm 8) veya 1x TBST ile takviye 3% sığır serum albumin (BSA) kiazas tahlilleri veya ilaç tarama için (bölüm 9). 20 dakika ajitasyon ile RT inkübasyon ve bu adımı 2x tekrarlayın.
8. NAPPA dizilerinde proteinlerin tespiti
- Birincil antikor ekleyin. Slaytları engelleme çözeltisinden (adım 7.5) çıkarın ve kağıt havlu kullanarak arka tarafı (baskısız tarafı) hafifçe kurutun. Slaytları bir desteğe yerleştirin ve 1x TBST + %5 sütte seyreltilmiş 1:200 birincil antikor (fare anti-bayrağı) 600 μL uygulayın. RT'de 1 saat kuluçka.
- Slaytları sallanan bir çalkalayıcının üzerinde 1x TBST + %5 sütle yıkayın (her biri 5 dakika için 3x).
- İkincil antikor ekleyin. Yıkama çözeltisinden slaytları çıkarın ve kağıt havlu kullanarak arka tarafı hafifçe kurulayın. Slaytları bir desteğe yerleştirin ve 1x TBST + %5 sütte seyreltilmiş 600 μL ikincil antikor (cy3-labbeled anti-fare antikor) uygulayın. Slaytları ışıktan koruyun ve RT'de 1 saat boyunca kuluçkaya yatırın.
- Kayan bir shaker (5 dakika her 3x) üzerinde 1x TBST ile slaytlar yıkayın. Hızlı bir şekilde ultrasaf su ve kuru basınçlı hava kullanarak slaytlar durulayın. Tarama (bölüm 11) ile devam edin.
9. NAPPA dizilerinde tirozin kinaz inhibitörü taraması
NOT: Aynı denemede birden çok slayt işlenebilir, ancak her adımda bir slaytın aynı anda işlendiğinden ve adımlar arasında kurumadığından emin olun. Slaydın etiket olmayan veya numune olmayan ucuna tüm çözümleri ekleyin.
- İlaç taraması sırasında kullanılan tüm çözümleri hazırlayın:
- Fosfataz/DNase çözeltisini aşağıdakileri birleştirerek hazırlayın: 1x protein metallo-fosfataz tamponu (50 mM HEPES, 100 mM NaCl, 2 mM DTT, pH =7,5'te %0.01 Brij 35); 1 mM MnCl2; Lambda protein fosfataz 8.000 adet; ve 2 ünite DNase I. Her mikrodizi için çözeltinin 400 μL'sini hazırlayın. Kullanmadan hemen önce fosfataz ve DNase ekleyin.
- İlacı seyreltin. İlaçlar DMSO'da 10 mM'lik son konsantrasyona kadar yeniden oluşturulmaktadır. Dizi üzerinde test edilen tüm ilaç konsantrasyonlarının her konsantrasyon için aynı dmso hacminin (DMSO'da 10.000 x'lik bir stok) oluşturulduğundan ve -80 °C'de tutulmasını sağlamak için. Kullanım sırasında, ilaçlar suda 1:100 seyreltilir.
- Aşağıdakileri birleştirerek ilaç/kinaz çözeltisi hazırlayın: 1x kinaaz tamponu (25 mM Tris-HCl pH = 7.5); 5 mM beta-gliserinfofosfat; 2 mM DTT; 0.1 mM Na3VO4; 10 mM MgCl2; 500 μM ATP; ve 2 μL ilaç (suda 1:100 seyreltilmiş). Her mikrodizi için çözeltinin 200 μL'sini hazırlayın.
- Fosfataz ve DNase tedavisini gerçekleştirin. Engelleme çözeltisinden slaytları çıkarın (adım 7.5) ve kağıt havlu kullanarak arka tarafı hafifçe kurulayın. Slaytları desteğe yerleştirin ve 200 μL fosfataz/DNase çözeltisi uygulayın. Buharlaşmayı önlemek için bir mikrodizi coverslip yerleştirin. Fırında 45 dk için 30 °C'de kuluçka.
- Fosfataz ve DNase tedavisi II: dizileri fırından çıkarın, kapak kaymasını atın, fazla çözeltiyi çıkarın ve 200 μL taze fosfataz ve DNase çözeltisi uygulayın. 30 °C'de 45 dakika daha kapağı kapağı ve kuluçka ile mikrodizileri kapatın.
- Kayan bir çalkalayıcıüzerinde 1x TBST + 0,2 M NaCl ile kaydırakları yıkayın (her biri 5 dakika için 3x).
- İlaç tedavisi ve kinase reaksiyonu gerçekleştirin. Yıkama çözeltisinden slaytları çıkarın ve kağıt havlu kullanarak arka tarafı hafifçe kurulayın. Slaytları desteğe yerleştirin ve 200 μL uyuşturucu/kinaz çözeltisi uygulayın. Buharlaşmayı önlemek için üzerine bir kapak slip yerleştirin. Fırında 30 °C'de 1 saat kuluçka.
- Kayan bir çalkalayıcıüzerinde 1x TBST + 0,2 M NaCl ile kaydırakları yıkayın (her biri 5 dakika için 3x).
- Tekrar adımları 8.1-8.4 birincil antikor anti-fossho-Tyr antikor olarak kullanarak seyreltilmiş 1:100. 1x TBST + %5 süt 1x TBST + %3 BSA ile tüm adımlarda değiştirin.
10. Otomatik hibridizasyon protokolü
NOT: Alternatif olarak, bir hibridizasyon istasyonu NAPPA dizileri (bölüm 7-9) tüm hibridizasyon ve yıkama otomatikleştirmek için kullanılabilir ve protokol Ek Dosya 1olarak sağlanır.
11. Görüntü edinimi
NOT: Mikrodizi görüntüleri 20 mikron veya daha yüksek çözünürlükte elde edilmelidir.
- Mikrodizileri, proteinler yukarı bakacak şekilde slayt tutucu dergisine yükleyin. Dergiyi mikrodizi tarayıcısına yükleyin.
- Cy-3 etiketli ikincil antikordan gelen sinyali tarayabilmek için 575/30 nm emisyon filtresine sahip yeşil lazeri seçin. Farklı bir florofor kullanılırsa, floresan boyadan gelen sinyali tespit etmek için doğru lazer/dalga boyunu seçin.
- Her görüntünün adını ve kaydedilecekleri konumu tanımlayın.
- (İsteğe bağlı): her yeni florofor için, sinyal yoğunluğunun doğrusal aralığını algılamak için tarama koşullarının optimizasyonu önerilir. Bunu yapmak için, bir dizi fotoçarpan (PMT) kullanarak bir mikrodizi tarayıp, doymamış sinyal ve düşük arka plan ile net bir görüntü elde edilene kadar kazanç elde edin.
- Optimize edilmiş ayarlarla tüm mikrodizileri tarayıp otomatik kazancı kapatmayı unutmayın.
NOT: Veri analizi için tüm mikrodiziler aynı tarama ayarları kullanılarak taranmalıdır. Florofor olarak cy3 kullanan kizaz tahlilleri için, görüntüler Ekipman ve Malzeme Tablosu'nda listelenen tarayıcı kullanılarak %20 PMT, %25 lazer yoğunluğu ve 10 mikron çözünürlükile taranır.
12. Veri işleme ve analizi
NOT: Mikrodizi verilerinin benzer özelliklere sahip sayısallaştırılması için çeşitli yazılım paketleri mevcuttur. Burada açıklanan prosedür, Ekipman ve Malzeme Tablosu'ndalistelenen yazılım lar için tasarlanmıştır.
- TIFF dosyalarını ölçülecek şekilde yükleyin, ızgarayı mikrodizi düzenine uyacak şekilde tasarlayın ve tüm sinyali mümkün olan minimum alana dahil etmek için noktaların boyutunu ayarlayın. Komşu noktalar çakışmamalıdır. Yazılımın ne kadar iyi performans gösterdiğini görsel olarak inceleyin ve gerekirse ızgarayı el ile ayarlayın.
- Mikrodizinin sinyal yoğunluğunu ölçün. Lekeleri herhangi bir anormallik (spesifik olmayan bağlama, toz vb.) için görsel olarak inceleyin ve veri analizinden çıkarın.
- Hiçbir noktanın bulunmadığı dizideki komşu alanların sinyalini kullanarak arka planı yerel olarak düzeltin.
- Verileri normalleştirin. Sinyali farklı diziler arasında karşılaştırmak için, her mikrodizinin sinyal yoğunluğu normalleştirilmelidir. Herhangi bir aykırılığı dışlamak için, kesilmiş sinyali kullanarak verileri normalleştirin, sinyalin %30'u fosforilasyonlu mikrodizilerin pozitif kontrolünden (IgG lekeleri) elde edilir.
NOT: IgG noktasından gelen sinyal mikrodizilerin fosforilasyon ve defosforilasyon sırasında değişmez ve normalizasyon için uygundur. - Etkin kinazları tanımlayın. Mikrodizide görüntülenen her özellik için, otofosforilasyonlu ve fosforilasyonlu dizilerde normalleştirilmiş sinyal yoğunluğu arasındaki oranı hesaplayın. Aktif kinazların tanımlanması için 1,5 kat değişiklik eşiği belirleyin ve diğer tüm özellikleri otofosforilasyondan (N/A) geçemeyen olarak işaretleyin.
- 12.5 adımda tanımlanan her kizazın aktivitesini ayarlanmış sinyalyüzdesi olarak hesaplayın (normalleştirilmiş negatif kontrol dizisinin sinyal yoğunluğu (dephosphorileted) tarafından çıkarılan normalleştirilmiş pozitif kontrol dizisinin (DMSO) sinyal yoğunluğu).
Sonuçlar
Kendi kendine monte NAPPA mikrodizileri biyomarker keşfi, protein-protein etkileşimleri, substrat tanımlama ve ilaç taraması10,11 dahil olmak üzere birçok farklı uygulamalar için kullanılabilecek sağlam bir platform sağlar ,12,13,14,15,16,17,18,19,20.
NAPPA mikrodizilerinde kinaz aktivitesi ve tirozin kinaz inhibitörlerinin taranması için benimsenen genel metodoloji Şematikolarak Şekil 1'de gösterilmiştir. İlk olarak, NAPPA mikrodizileri cDNA ve yakalama ajanının kaplamalı mikrodiziler üzerine immobilizasyonu ile oluşturulur. CDNA'lar daha sonra insan tabanlı IVTT sistemi kullanılarak proteinlerin transkripsiyonu ve çevirisi için şablon olarak kullanılır ve yeni sentezlenen proteinler yakalama ajanı9tarafından hareketsiz hale getirilmiştir. Basılı mikrodizi kalitesi DNA düzeyleri (tutarlı baskı onaylayan) veya protein dizi (protein ekspresyonu ve yakalama teyit) ölçülerek izlenebilir; Şekil 1). Arka plan sinyalini azaltmak ve deneyin dinamik aralığını artırmak için, mikrodiziler 1) lambda fosfataz ile tedavi edilir Ser/Thr/Tyr artıklarından fosforilasyon un giderilmesi, daha sonra 2) DNase ile yerinde kimyayı basitleştirmek ve azaltmak için arka plan (Şekil 1).
Bir sonraki adım, mikrodizilerin ATP yokluğunda kizaz tamponu ile kuluçkaya yatırıldığı otofosforilasyon reaksiyonudur (negatif kontrol dizisi, defosforilasyon mikrodizileri olarak adlandırılır) ve kiyaz tamponu ATP ile desteklenir (pozitif kontrol, otofosforilasyon dizileri olarak adlandırılır) veya ATP + DMSO (araç kontrolü). Bu adımda kigaz eklenmez; bu nedenle, mikrodizide görüntülenen her kinazın içsel aktivitesi, bir pan anti-fosfo-tirozin antikor kullanılarak fosforilasyon düzeylerinin ölçülmesi ile ölçülür ve ardından cy3-labbeled sekonder antikor(Şekil 1).
Dört boyutlu olarak basılan insan protein kinazlarından oluşan bir panel gösteren NAPPA-kinaz dizilerinin kalite kontrolü Şekil 2'degösterilmiştir. Hareketsiz DNA seviyeleri DNA boyama ile ölçüldü ve mikrodizide eşit bir sinyal gösterdi, bu da dizide basılan DNA miktarının tek düze olduğunu gösteriyor. Dna lekelenmeden çeşitli özellikleri gözlemlemek de mümkündür. Bu özellikler, DNA'nın baskı karışımından atlandığı bazı kontrollere karşılık gelir [yani, boş noktalar (hiçbir şey basılmamış), su lekeleri, saflaştırılmış IgG noktası (poli-lizin, crosslinker ve saflaştırılmış IgG), baskı karışımı sadece (tam baskı karışımı: poli-lizin artı crosslinker ve anti-bayrak antikor, herhangi bir DNA olmadan)]. NAPPA-kiaz mikrodizilerinde görüntülenen protein düzeyleri anti-tag antikor kullanılarak IVTT reaksiyonundan sonra değerlendirildi.
Kizaz taraması için Bayrak tercih edilen etiket olarak kullanılmış ve mikrodizide görüntülenen protein düzeyi anti-bayrak antikor kullanılarak ölçüldü. Görüldüğü gibi, cDNA içeren lekelerin çoğu başarıyla protein tespit edilebilir düzeyde görüntülenir. CDNA içermeyen kontrol noktalarından bazıları da anti-bayrak antikorlu sinyal ortaya koymuştur: IgG noktası (ikincil antikor aktivitesini tespit etmek için kullanılır) ve boş vektör noktaları (sadece etiket için cDNA kodları)(Şekil 2). NAPPA-kiazmikrodizileri slaytlar arasında iyi tekrarlanabilirlik gösterdi ve protein görüntüleme düzeylerinin 0,88'den yüksek farklı baskı gruplar arasında korelasyonu gösterdi (Şekil 2). Aynı parti içinde korelasyon 0,92 'ye yakın ,daha da yüksekti (veriler gösterilmedi).
Daha sonra dizide görüntülenen proteinlerin kinaz otofosforilasyon aktivitesi antifosfo-tirozin antikor kullanılarak ölçüldü (Şekil 3). Dizide görüntülenen protein, ekspresyondan sonra yüksek düzeyde protein fosforilasyon gösterdi(Şekil 3, solda), dizide görüntülenen proteinin içsel kinaz aktivitesi nden veya IVTT karışımında bulunan aktif kinazlardan kaynaklanabilir. Bu fosforilasyon lambda fosfataz tedavisi ile tamamen kaldırılmış ve bu mikrodiziler kizaz tahlilleri için kullanılmıştır. Defosforilasyondan sonra, ATP olmadan yapılan otofosforilasyon reaksiyonları beklendiği gibi önemli bir fosforilasyon düzeyi göstermezken, ATP varlığında kizim tamponu ile inkübe edilen mikrodizimler protein fosforilasyonunun 15 dk kadar hızlı olduğunu göstermiştir ( Şekil 3). İlaç taraması için kinaz aktivitesi test edilen kinaz sayısını en üst düzeye çıkarmak için 60 dk otofosforilasyon reaksiyonundan sonra ölçüldü.
Protein ekspresyonundan hemen sonra fosforilasyon düzeylerinin ölçüldüğü mikrodiziler arasındaki karşılaştırma(Şekil 3, sol) ve 60 dk sonra otofosforilasyon reaksiyonu(Şekil 3, sağ) gösterdi: i) proteinler sadece fosforilasyon ifadeden sonra, IVTT karışımında bulunan proteinler tarafından dışsal olarak fosforile edilebilen, ancak otofosforilasyon yapılamaz; ii) protein fosforile sadece otofosforilasyon reaksiyonundan sonra, bu proteinlerin protein ekspresyonundan sonra aktif olmadığını ve kinaz tamponunda aktif olması için gerekli ko-faktörlerin bulunmadığını düşündürmektedir; veya iii) protein her iki dizide de fosforilasyon alabildive her iki ortamda da aktif olduklarını düşündürmektedir(Şekil 3).
NAPPA-kinaz dizilerinde tirozin kinaz inhibitörlerinin taranması için elde edilen sonuçlara örnek olarak protein kinazları arasında belirgin seçiciliğe sahip üç kinaz inhibitörü kullanılmıştır: staurosporine, imatinib ve ibrutinib. Tüm taramalar da otofosforilasyon reaksiyonu sırasında defosforilasyonlu NAPPA mikrodizileri artan TKI konsantrasyonları (100 nM ile 10 uM arasında değişen) ile kuluçkaya yatırıldı. İlk TKI test staurosporine oldu, küresel bir protein kinaz inhibitörü, hemen hemen tüm kinazlar arasında mikrodizi üzerinde güçlü kinaz inhibisyonu gösterdi11.
Daha sonra, imatinib test edildi, kronik miyelojen lösemi ve gastrointestinal stromal tümörlerin tedavisinde kullanılan bir ABL ve c-Kit inhibitörü4,5,6,7. NAPPA-kinaz dizilerinde imatinib Abl1 ve BCR-Abl1 aktivitesinde önemli bir azalma gösterirken, diğer kinazlar çoğunlukla etkilenmemiş olarak kalmıştır(Şekil 4A). Kizaz aktivitesi için veri niceliği defosforilasyon dizisine göre normalleştirildi ve pozitif kontrol mikrodizisinin bir yüzdesi olarak temsil edildi (sadece araç). TNK2 (ilgili olmayan kinaz), Abl1 ve BCR-Abl1 verileri Şekil 4B'degösterilmiştir. Beklendiği gibi, imatinib Abl1 ve BCR-ABl1 doğru selektif inhibisyon gösterdi. C-Kit'e ait veriler pozitif kontrol dizilerinde etkinlik olmaması nedeniyle yetersizdi.
Son olarak, Bruton'un tirozin kinazının (BTK) FDA onaylı kovalent inhibitörü ibrutinib test edildi. Ibrutinib şu anda kronik lenfositik lösemi (CLL), manto hücreli lenfoma ve Waldenström's makroglobulinemi21,22dahil olmak üzere aşırı aktif BTK ile çeşitli kan ile ilgili kanserlerin tedavisinde kullanılır. Şekil 4C,ibrutinib taraması için elde edilen tipik sonuçları temsil eder. ABL1 (ilgili olmayan kinaaz) ve BTK (kanonik hedef) ve ERBB4 (potansiyel yeni hedef) kiyaz aktivitesi Şekil 4D'degösterilmiştir. Veriler ERBB4'ün doza özgü bir şekilde ibrutinib tarafından inhibe edilebilmiş olabileceğini göstermektedir. Bu inhibisyon in vitro doğrulandı ve hücre bazlı tahliller11, Bu platformun gücünü gösteren.
Birlikte ele alındığında, veriler NAPPA-kiyaz mikrodizi platformu TK inhibitörlerinin tarafsız tarama için kullanılabilir öneririz. Ayrıca, tarama hızlı ve kolayca ilgi protein kinazherhangi bir varyasyon içerecek şekilde özelleştirilebilir.
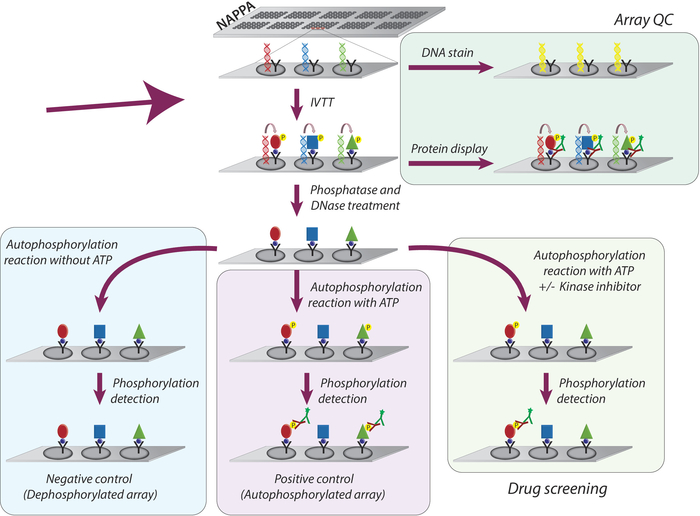
Şekil 1: NAPPA dizilerinde tirozin kinaz inhibitörlerinin kalite kontrolü ve taranması şeması. NAPPA dizileri, bir etiket ve yakalama antikorile kaynaşmış ilgi proteini için cDNA kodlaması ile yazdırılır. In vitro transkripsiyon ve çeviri reaksiyonu (IVTT) sırasında sentezlenen proteinler yakalama antikoru tarafından etiket üzerinden mikrodizi yüzeyinde yakalanır. Dizilerin kalite kontrolü (QC), slaytta basılan DNA düzeylerinin, floresan DNA'nın ara verdiği boya ve etikete özgü antikorlar kullanılarak dizide görüntülenen protein düzeyleri kullanılarak gerçekleştirilir. Kinaz taraması için mikrodiziler, IVTT reaksiyonundan sonra, protein sentezi sırasında oluşmuş olabilecek tüm fosforilasyon ve baskılı DNA'yı çıkarmak için DNase ve fosfataz ile tedavi edilir. Fosforlu diziler artık ilaç taraması için kullanılmaya hazır. Her bir titreşme için, rutin olarak üç kontrol kümesi kullanılır: (I) otofosforilasyon reaksiyonunun ATP olmadan yapıldığı fosforilasyonlu diziler; (II) atp varlığında otofosforilasyon reaksiyonu yapılan otofosforilasyon mikrodizileri; ve (III) DMSO tedavi edilen dizi (araç), atp ve DMSO ile otofosforilasyon reaksiyonu yapılır. Farklı kiaz inhibitörleri konsantrasyonu ile tedavi edilen slaytlar, DMSO ile tedavi edilen diziler için kullanılan protokolün aynısını izler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
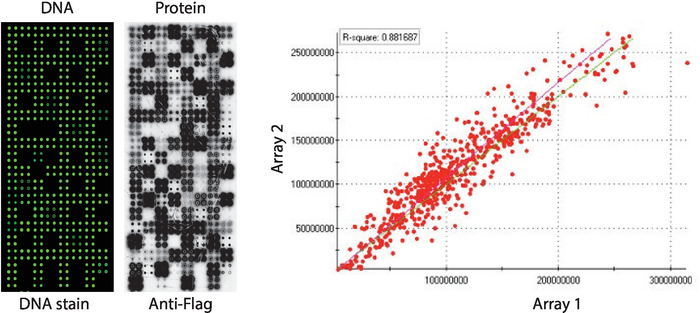
Şekil 2: Kendi kendine monte edilmiş NAPPA-kinaaz dizileri için kalite kontrolünün temsili sonuçları. Floresan DNA-intercalating boya (solda) ile ölçülen DNA içeriği ve anti-Flag antikor (orta) ile ölçülen mikrodizi üzerinde görüntülenen protein düzeyleri gösterilir. Sağ tarafta, ayrı gruplar halinde basılan iki NAPPA-kinaaz dizisinde görüntülenen protein düzeylerinin korelasyon grafiği yer alır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
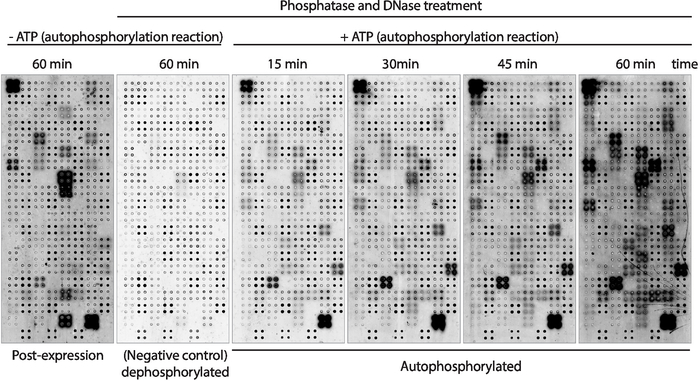
Şekil 3: NAPPA-kinaaz dizilerinde kizaz aktivitesinin temsili sonuçları. Dörtlü protein kinazlarını gösteren mikrodiziler, anti-pTyr antikor kullanılarak protein fosforilasyonölçümü yoluyla dizideki protein kinaz aktivitesini incelemek için kullanıldı ve ardından cy3 etiketli anti-fare antikorları kullanıldı. Protein ekspresyonu (post-ekspresyon) sonrası arka plan fosforilasyonundan sonra fosfataz/DNase tedavisi olmayan ve otofosforilasyon reaksiyonu sırasında ATP olmayan kontrol dizileri kullanıldı. Geri kalan mikrodiziler fosfataz/DNA ile, otofosforilasyon reaksiyonu ATP (defosforilted mikrodizi, negatif kontrol) veya ATP (otofosforilted mikrodiziler) olmadan uygulandı. Otofosforilasyonlu mikrodiziler için gösterildiği gibi 15 dk, 30 dk, 45 dk veya 60 dk için otofosforilasyon reaksiyonu yapılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
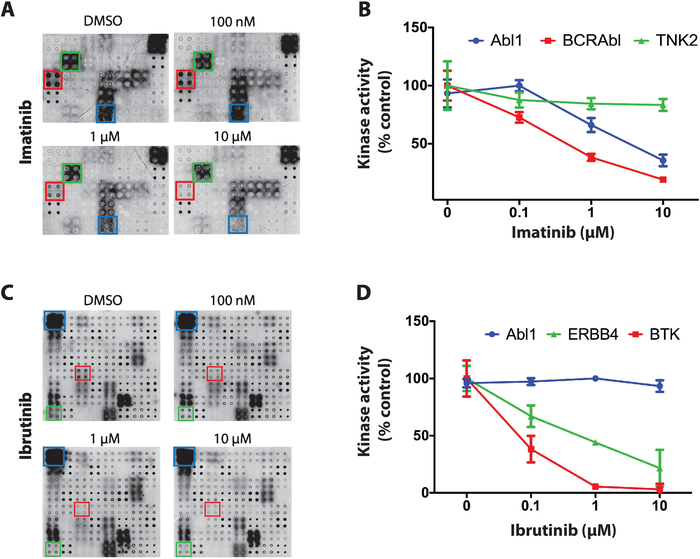
Şekil 4: NAPPA-kinaz dizilerinde tirozin kinaz ekranından gelen temsili veriler. (A) Fosfataz/DNase tedavi edilen NAPPA-kinaz dizileri otofosforilasyon reaksiyonu sırasında artan imatinib konsantrasyonlarında kuluçkaya yatırıldı ve kinaz aktivitesi anti-fosfo-tir antikor ile ölçüldü. (B) İmatinib'e maruz kalan NAPPA-kinaaz dizilerinde gözlenen kinaz aktivitesinin ölçülmesi. Veriler negatif kontrol dizilerinin (fosforilasyondan arındırılmış) sinyaline karşı normalleştirildi ve pozitif kontrol dizilerinin (DMSO varlığında yapılan otoforilasyon reaksiyonu) yüzdesi olarak gösterilmiştir. Benzer veriler ibrutinib(C,D)taraması için gösterilmiştir. Bu rakam Rauf ve ark.11'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1. Otomatik hibridizasyon istasyonu kullanarak NAPPA dizilerinde tirozin kinaz inhibitörlerinin taranması için alternatif protokol. Bu dosyayı indirmek için lütfen buraya tıklayınız.
Tartışmalar
Değişiklikler ve sorun giderme
NAPPA dizileri üzerindeki kinaz aktivitesi nin optimizasyon aşamasında, gözlenen ana arka plan ve düşük dinamik aralık kaynaklarından biri baskı karışımında kullanılan BSA'dır. BSA aminosilane yüzeyi ile çapraz bağlantı için gerekli birincil aminler sağlamak ve yerinde DNA ve yakalama antikor tuzak oldu. Ancak, BSA son derece fosforilasyon, zor arka plan gürültüsü üzerinde dizi üzerinde otofosforilasyon sinyali tespiti için yapım. Bu sorunu çözmek için, baskı karışımı BSA için çeşitli alternatifler test edildi ve poli-lizin iyi bir yedek olarak tespit edildi. Poli-lizin herhangi bir fosforilasyon alanı yoksundur; bu nedenle, ifade edilmeyen dizilerin arka planı çok azdır. Ayrıca poli-lizin ile basılan mikrodiziler tekrarlanabilir ve iyi düzeyde protein gösterirler(Şekil 2).
Standart NAPPA testinde yapılan bir sonraki kritik modifikasyon fosfatse/DNase tedavi adımının eklenmesiydi. Mikrodizilerin fosfataz ile işlenmesi, protein sentezi ve yakalama sırasında IVTT karışımında meydana gelen fosforilasyonun giderilmesine olanak sağlar(Şekil 3). Bu fosforilasyonun kaynağı içsel otofosforilasyon aktivitesinden veya IVTT karışımında bulunan kinazların aktivitesinden kaynaklanabilir. İfade sonrası tüm fosforilasyonun giderilmesi, aktif olan ve otofosforilasyona uğrayabilen kinazların kolay tanımlanmasına olanak sağlamıştır(Şekil 3).
Protokol içindeki kritik adımlar
NAPPA sağlam bir teknolojidir, ancak beklendiği gibi, birkaç kritik adım vardır. Bunlardan ilki, uygun konsantrasyonda yüksek kaliteli DNA elde edilmesidir. Düşük kaliteli veya düşük konsantrasyonlarda DNA'nın kullanılması, dizide analiz edilen protein sayısını azaltarak, uygun seviyelerde ifade edilmeyen ve görüntülenmeyen çeşitli özelliklere sahip düşük kaliteli mikrodiziler oluşturur. İkinci kritik adım, mikrodizideki proteinlerin ifadesidir. Fonksiyonel protein yüksek düzeyde ifade edecek bir IVTT sisteminin kullanımı dizi kiaz aktivitesi ni incelemek için hayati önem taşımaktadır.
TKI taramasındaki bir sonraki kritik adım mikrodizilerin nasıl işlendiğidir. Mikrodiziler protokolün herhangi bir adımında kurumamalıdır ve arka plan sinyalini artırabilecek çizilmeleri önlemek için nazik kullanım önerilir. Tüm deneydeki diziler birbiriyle karşılaştırılacağından, her kuluçka adımının tüm slaytlarda bile olduğundan emin olmak önemlidir. Örneğin, diziler arasında kuluçka süresi farklılıklarını önlemek için 20 dizilik bir toplu işişlendiğinde, tek bir dizide bir adımı gerçekleştirmek için gereken süre dikkate alınmalıdır.
Son olarak, deneyin tasarımı ve hem pozitif hem de negatif denetimlerin dahil edilmesi kalite kontrol ve veri analizi için çok önemlidir. İlk denetim kümesi her dizide yazdırılan lardır ve negatif kontroller [yani, boş noktalar (herhangi bir malzeme yazdırılmadan), su veya boş vektör (yalnızca etiketi ifade eder)]] ve pozitif bir kontrol (örn. saflaştırılmış IgG) ikincil antikor ve fosforilasyon düzeylerinde değişiklik için inert). Topluca, mikrodizinin arka plan düzeylerini, baskı sırasında olası taşımayı ve algılama yönteminin sinyal yoğunluğunu ölçerler.
Bir sonraki kontrol seti ilaç tarama kontrolleridir ve defosforile ve otofosforilasyonlu mikrodizileri (DMSO'nun varlığında veya yokluğunda) içerir. Daha önce de belirtildiği gibi, fosforlu mikrodizi fosfataz tedavisinden sonra fosforilasyon düzeyini ve dolayısıyla diğer tüm deneyler için temel düzeyini ölçer. Taban çizgisi düzeyi ne kadar düşükse, tahlillerin dinamik aralığı da o kadar yüksektir. Otofosforilasyonlu diziler tüm dizilerin maksimum fosforilasyon düzeylerini sunar ve sinyal güçlü ve net olmalıdır. Veri analizi için kullanılır, ama aynı zamanda tüm reaksiyonlar dizi üzerinde başarıyla gerçekleştirildi bir kontrol olarak.
Tekniğin sınırlamaları
Şu andan itibaren, burada sunulan ilaç taraması nın kısıtlamalarından biri, sadece otofosforilasyon alabilen protein kinazlarını tarayabilme yeteneğidir. Bunun üstesinden gelmenin bir yolu da aynı yerde bir kigaz ve bilinen substrat yazdırmaktır. İki farklı protein için DNA'nın birlikte basımı başarıyla15,buyaklaşımın fizibilitesini düşündüren gerçekleştirildi. Ayrıca, dizide görüntülenen protein doğru bir şekilde katlanamayabilir ve bu da inaktif bir proteinle sonuçlanabilir. İnsan tabanlı ifade sisteminin kullanımı dizi üzerinde ölçülen kizaz aktivitesinde önemli bir iyileşme sağladı; ancak, bazı proteinler hala onun hareketsizlik nedeniyle dizi üzerinde analiz edilemez.
İkinci bir sınırlama bir pan anti-fosfo-tir antikor kullanarak fosforilasyon ölçümü. Fosforilasyon alanının motifi ile ilgili olarak özgüllüğü ne kadar açık olsa da, ölçülen tüm fosforiller tirozin artıkları üzerinde meydana geldi ve geride serinler, treoninler ve ilgili kinaslar kaldı. Bugüne kadar, 10'dan fazla pan fosfo-Ser/Thr antikorları, kuluçka ve yıkama koşullarını optimize etmek için yapılan çeşitli girişimlere rağmen başarılı olamamıştır. Antikorlardan bağımsız yeni bir tespit sistemi ilaç inhibisyonu için taranabilir protein kinazlarının sayısını artırmak için en iyi seçenek olabilir. Bu bağlamda, radyoaktivite veya tıklama çekimi gibi kimyasal yaklaşımlar da dahil olmak üzere birkaç seçenek mevcuttur. Arka plan sinyalini en aza indirmek ve tahliller için iyi bir dinamik aralık sağlamak için bir dizi optimizasyon gereklidir.
Üçüncü sınırlama, diziye basılacak cDNA klonlarının edinimidir. CDNA klonları, Creator veya Gateway23gibi siteye özgü rekombinasyon sistemleri de dahil olmak üzere herhangi bir klonlama tekniği kullanılarak oluşturulabilir. Diğer bir seçenek de klonları DNAsu kütüphanesinden satın almaktır, , tüm insan kinomu da dahil olmak üzere 17.000'den fazla cDNA klonu, NAPPA dizilerinin yapımında kullanılabilir24 .
Dördüncü sınırlama, her laboratuvar kendi NAPPA dizileri imal etmek ve ekrana uygun ekipman ile donatılmış olmasıdır. Bu protokol, yüksek işlem donanımına gerek kalmadan mikrodiziüzerine basılacak DNA'yı oluşturmak için alternatif yöntemler ve tüm hibridizasyon adımlarını el ile gerçekleştirmek için protokoller sağlar. Ancak, bir dizi ve mikrodizi tarayıcı erişim hala gereklidir. Bu sorunun üstesinden gelmek için bir seçenek nappa çekirdek hizmet ve tesis, bulunan kullanmaktır , kar amacı gütmeyen bir akademik fiyata özelleştirilmiş NAPPA microarrays dağıtır. Son olarak, herhangi bir tarama metodolojisi itibariyle, diziler üzerinde elde edilen veriler eserler (pozitif veya negatif) olmaya duyarlıdır ve bu nedenle ortogonal tahliller kullanılarak doğrulanmalıdır.
Mevcut yöntemlere göre önemi
Protein kinazlarının taranması için çeşitli platformlar mevcuttur. Rutin olarak kullanılan bir yaklaşım protein parçaları, kinaz etki alanı, kizaz etki alanı ve bazı düzenleyici bölgeler ile büyük protein parçaları ve hatta tam uzunlukta proteinler ile yapılabilir bağlayıcı tahliller vardır. Proteinler genellikle bakteri sistemlerinde maliyet ve ifade ve saflaştırma protokolleri basitlik nedeniyle ifade edilir. İlgi ilaç ve protein arasındaki etkileşim daha sonra floresan veya etiketlerin varlığı gibi rapor tsay çeşit ile ölçülür, örneğin. Bu yaklaşım kümesinin ana sınırlaması, proteinin ilaçla etkileşim sırasında mutlaka aktif olmamasıdır, bu da yanlış pozitif ve yanlış negatif etkileşimlerin tanımlanmasına neden olabilir. Protein parçaları özellikle konformasyondaki değişikliklere ve aktivite eksikliğine karşı savunmasızdır ve elde edilen tüm veriler aktif proteinler kullanılarak, tercihen tam uzunlukta formlarında doğrulanmalıdır. Bazı platformların bir diğer sınırlaması da, genel kullanımını sınırlayan yalnızca ATP analoglarını tarama yeteneğidir.
Enzimatik temelli yaklaşımlar kullanarak TKI'ların taranması için kullanılan ticari hizmetlerin çoğu, ilgi kinizin sadece vahşi tip versiyonlarını ve bazen de sadece seçilmiş birkaç mutantı kullanmaktadır. TKI ile tedavi edilen hastalarda ilaç direncinin çok yaygın olduğunu bilerek, en uygun inhibitörün seçimi için, farklı mutantlarda ilaç yanıtını ölçebilmek önemlidir. NAPPA doğası nedeniyle, kinaz mutantlarının taranması basit ve kolayca gerçekleştirilebilir, ve gerekli tek araç nappa cDNA koleksiyonuna kigaz mutant dahil, hangi siteye özgü mutagenez tarafından yapılabilir, örneğin.
Gelecekteki uygulamalar
Kiaz inhibitörleri kullanılarak kanser tedavisinde en yaygın tedavi biçimlerinden biri, bir tedavi kursu sırasında ilaç hedefindeki mutasyonların elde edilmesidir. Bu mutantların kiaz inhibitörlerine verdikleri yanıtla ilgili olarak taranması, her hasta için kişiselleştirilmiş bir tedavi elde etmek için ikinci/üçüncü nesil TKI'ların seçimi için hayati önem taşımaktadır. Burada sunulan ilaç tarama yaklaşımı, herhangi bir tirozin kinaz inhibitörü insan genomunda mevcut tirozin kinazbirbir panel karşı test edilebilir tarafsız bir tarama platformu sağlar. NAPPA dizilerinde görüntülenen proteinler slaytta basılan cDNA'dan in vitro olarak ifade edildiğiiçin, herhangi bir mutant varyantı dizide görüntülenmek üzere cDNA koleksiyonuna kolayca dahil edilebilir. Kigaz mutantlarının üretilebildiği ve dizi üzerinde ifade edilebildiği tesis, NAPPA tekniğinin yüksek iş gücü ile birleşerek, kizaz mutantlarının incelenmesi ve ilaçlara verdikleri tepki için benzersiz bir ortam sağlayarak NAPPA'yı kişiselleştirilmiş ilaç tarama, hassas tıp hedeflerinden biri.
Açıklamalar
Yazarlar çıkar çatışması beyan etmezler.
Teşekkürler
Yazarlar projenin geliştirilmesi sırasında yardım ve eleştiri için LaBaer laboratuvarında herkese teşekkür etmek istiyorum. Bu proje NIH hibe U01CA117374, U01AI077883 ve Virginia G. Piper Vakfı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 364 well plates (for arraying) | Genetix | x7020 | |
| 800 µL 96-well collection plate | Abgene | AB-0859 | |
| 96-pin device | Boekel | 140500 | |
| Acetic Acid | Millipore-Sigma | 1.00066 | |
| Acetone 99.9% | Millipore Sigma | 650501 | |
| Aluminum seal for 96 well plates | VWR | 76004-236 | |
| Aminosilane (3-aminopropyltriethoxysilane) | Pierce | 80370 | |
| ANTI-FLAG M2 antibody produced in mouse | Millipore Sigma | F3165 | |
| Anti-Flag rabbit Antibody (polyclonal) | Millipore Sigma | F7425 | |
| ATP 10 mM | Cell Signaling | 9804S | |
| β-Glycerophosphate disodium salt hydrate | Millipore-Sigma | G9422 | |
| bacteriological agar | VWR | 97064-336 | |
| Blocking Buffer | ThermoFisher/Pierce | 37535 | |
| Brij 35 | ThermoFisher/Pierce | BP345-500 | |
| BS3 (bis-sulfosuccinimidyl) | ThermoFisher/Pierce | 21580 | |
| BSA (bovine serum albumin) | Millipore Sigma | A2153 | |
| Coverslip 24 x 60 mm | VWR | 48393-106 | |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | |
| DeepWell Block, case of 50 | ThermoFisher/AbGene | AB-0661 | |
| DEPC water | Ambion | 9906 | |
| DMSO (Dimethyl Sulfoxide) | Millipore-Sigma | D8418 | |
| DNA-intercalating dye | Invitrogen | P11495 | |
| DNase I | Millipore-Sigma | AMPD1-1KT | |
| DTT | Millipore-Sigma | 43816 | |
| EDTA | Millipore-Sigma | EDS | |
| Ethanol 200 proof | Millipore-Sigma | E7023 | |
| Filter plates | Millipore-Sigma | WHA77002804 | |
| Gas Permeable Seals, box of 50 | ThermoFisher/AbGene | AB-0718 | |
| Glass box | Wheaton | 900201 | |
| Glass slides | VWR | 48300-047 | |
| Glycerol | Millipore-Sigma | G5516 | |
| HCl (Hydrochloric acid) | Millipore-Sigma | H1758 | |
| HEPES Buffer Solution | Millipore-Sigma | 83264 | |
| Human-based IVTT system | Thermo Scientific | 88882 | |
| ImmunoPure Mouse IgG whole molecule | ThermoFisher/Pierce | 31202 | |
| Isopropanol | Millipore-Sigma | I9516 | |
| KCl (Potassium chloride) | Millipore-Sigma | P9333 | |
| KH2PO4(Potassium phosphate monobasic) | Millipore-Sigma | P5655 | |
| Kinase buffer | Cell Signaling | 9802 | |
| KOAc (Potassium acetate) | Millipore-Sigma | P1190 | |
| Lambda Protein Phosphatase | new england biolabs | P0753 | |
| Lifterslips, 24 x 60 mm | ThermoFisher Scientific | 25X60I24789001LS | |
| Metal 30-slide rack with no handles | Wheaton | 900234 | |
| MgCL2 (Magnesium chloride) | Millipore-Sigma | M8266 | |
| Na3VO4 (Sodium orthovanadate) | Millipore-Sigma | S6508 | |
| NaCl (Sodium Chloride) | Millipore-Sigma | S3014 | |
| NaOAc (Sodium acetate) | Millipore-Sigma | S2889 | |
| NaOH (Sodium hydroxide) | Millipore-Sigma | S8045 | |
| NucleoBond Xtra Midi / Maxi | Macherey-Nagel | 740410.10 / 740414.10 | |
| Nucleoprep Anion II | Macherey Nagel | 740503.1 | |
| Phosphoric Acid | Millipore-Sigma | 79617 | |
| Poly-L-Lysine Solution (0.01%) | Millipore-Sigma | A-005-C | |
| Protein Phosphatase (Lambda) | New England Biolabs | P0753 | |
| RNAse | Invitrogen | 12091021 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | L6026 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | 05030 | |
| Sealing gasket | Grace Bio-Labs, Inc | 44904 | |
| Silica packets | VWR | 100489-246 | |
| Single well plate | ThermoFisher/Nalge Nunc | 242811 | |
| Sodium acetate (3M, pH 5.5) | Millipore-Sigma | 71196 | |
| TB media (Terrific Broth) | Millipore-Sigma | T0918 | |
| Tris | IBI scientific | IB70144 | |
| Triton X-100 | Millipore-Sigma | T8787 | |
| Tryptone | Millipore-Sigma | T7293 | |
| Tween 20 | Millipore-Sigma | P9416 | |
| Yeast Extract | Millipore-Sigma | Y1625 | |
| Name | Company | Catalog number | Comments |
| Equipments | Maker/model | ||
| Programmable chilling incubator | Torrey Pines IN30 Incubator with Cooling | ||
| Shaker for bacterial growth | ATR Multitron shaker | ||
| Vacuum manifold with liquid waste trap | MultiScreenVacuum Manifold 96 well | ||
| 96 well autopippetor/liquid handler | Genmate or Biomek FX | ||
| Liquid dispenser | Wellmate | ||
| DNA microarrayer | Genetix QArray2 | ||
| Automatic hybridization station | Tecan HS4800 Pro Hybridization Station | ||
| Microarray scanner | Tecan PowerScanner | ||
| Microarray data quantification | Tecan Array-ProAnalyzer 6.3 |
Referanslar
- Melnikova, I., Golden, J. Targeting protein kinases. Nature Review Drug Discovery. 3 (12), 993-994 (2004).
- Patterson, H., Nibbs, R., McInnes, I., Siebert, S. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases. Clinical and Experimental Immunology. 176 (1), 1-10 (2014).
- Wu, P., Nielsen, T. E., Clausen, M. H. FDA-approved small-molecule kinase inhibitors. Trends Pharmacological Sciencies. 36 (7), 422-439 (2015).
- Druker, B. J., et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nature Medicine. 2 (5), 561-566 (1996).
- Heinrich, M. C., et al. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood. 96 (3), 925-932 (2000).
- Stagno, F., et al. Imatinib mesylate in chronic myeloid leukemia: frontline treatment and long-term outcomes. Expert Review Anticancer Therapy. 16 (3), 273-278 (2016).
- Ben Ami, E., Demetri, G. D. A safety evaluation of imatinib mesylate in the treatment of gastrointestinal stromal tumor. Expert Opinions in Drug Safety. 15 (4), 571-578 (2016).
- Ramachandran, N., et al. Self-assembling protein microarrays. Science. 305 (5680), 86-90 (2004).
- Festa, F., et al. Robust microarray production of freshly expressed proteins in a human milieu. Proteomics Clinical Applications. 7 (5-6), 372-377 (2013).
- Yazaki, J., et al. Mapping transcription factor interactome networks using HaloTag protein arrays. Proceedings of the National Academy of Sciences of the United States of America. 113 (29), E4238-E4247 (2016).
- Rauf, F., et al. Ibrutinib inhibition of ERBB4 reduces cell growth in a WNT5A-dependent manner. Oncogene. 37 (17), 2237-2250 (2018).
- Anderson, K. S., et al. Protein microarray signature of autoantibody biomarkers for the early detection of breast cancer. Journal of Proteome Research. 10 (1), 85-96 (2011).
- Wang, J., et al. Plasma Autoantibodies Associated with Basal-like Breast Cancers. Cancer Epidemiol Biomarkers Prevention. 24 (9), 1332-1340 (2015).
- Bian, X., et al. Tracking the Antibody Immunome in Type 1 Diabetes Using Protein Arrays. Journal of Proteome Research. 16 (1), 195-203 (2017).
- Song, L., et al. Identification of Antibody Targets for Tuberculosis Serology using High-Density Nucleic Acid Programmable Protein Arrays. Molecular and Cellular Proteomics. 16 (4 suppl 1), S277-S289 (2017).
- Wang, J., et al. Comparative Study of Autoantibody Responses between Lung Adenocarcinoma and Benign Pulmonary Nodules. Journal of Thoracic Oncology. 11 (3), 334-345 (2016).
- Montor, W. R., et al. Genome-wide study of Pseudomonas aeruginosa outer membrane protein immunogenicity using self-assembling protein microarrays. Infection and Immunity. 77 (11), 4877-4886 (2009).
- Tang, Y., Qiu, J., Machner, M., LaBaer, J. Discovering Protein-Protein Interactions Using Nucleic Acid Programmable Protein Arrays. Current Protocols in Cell Biology. 74, 11-15 (2017).
- Yu, X., et al. Copper-catalyzed azide-alkyne cycloaddition (click chemistry)-based detection of global pathogen-host AMPylation on self-assembled human protein microarrays. Molecular and Cellular Proteomics. 13 (11), 3164-3176 (2014).
- Anderson, K. S., et al. Autoantibody signature for the serologic detection of ovarian cancer. Journal of Proteome Research. 14 (1), 578-586 (2015).
- Woyach, J. A., Johnson, A. J., Byrd, J. C. The B-cell receptor signaling pathway as a therapeutic target in CLL. Blood. 120 (6), 1175-1184 (2012).
- Smith, M. R. Ibrutinib in B lymphoid malignancies. Expert Opinion on Pharmacotherapy. 16 (12), 1879-1887 (2015).
- Festa, F., Steel, J., Bian, X., Labaer, J. High-throughput cloning and expression library creation for functional proteomics. Proteomics. 13 (9), 1381-1399 (2013).
- Seiler, C. Y., et al. DNASU plasmid and PSI:Biology-Materials repositories: resources to accelerate biological research. Nucleic Acids Research. 42, D1253-D1260 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır