Method Article
Скрининг ингибиктора Киназы в самособранных микроарах человеческого белка
В этой статье
Резюме
Представлен подробный протокол для генерации самособранных человеческих белковых микроаррей для скрининга ингибиторов киназы.
Аннотация
Скрининг ингибиторов киназы имеет решающее значение для лучшего понимания свойств препарата и для выявления потенциально новых целей с клиническими последствиями. Сообщалось о нескольких методологиях, которые могли бы провести такой скрининг. Тем не менее, каждый из них имеет свои собственные ограничения (например, скрининг только аналогов АТФ, ограничение на использование очищенных доменов киназы, значительные затраты, связанные с тестированием более чем несколько киназ в то время, и отсутствие гибкости в скрининге белка киназы с новые мутации). Здесь представлен новый протокол, который преодолевает некоторые из этих ограничений и может быть использован для беспристрастного скрининга ингибиторов киназы. Сила этого метода заключается в его способности сравнивать активность ингибиторов киназы между несколькими белками, либо между различными киназами, либо различными вариантами одной и той же киназы. Используются самособранные белковые микроаррей, генерируемые в результате выражения белковых киназ человеческой системой экстракорпорации и перевода (IVTT). Белки, отображаемые на микроарере, активны, что позволяет измерять эффекты ингибиторов киназы. Следующая процедура подробно описывает этапы протокола, начиная с генерации микроаррей и скрининга и консиворивая данных.
Введение
Белковые киназы отвечают за фосфорилирование своих целей и могут модулировать сложные молекулярные пути, контролирующие многие клеточные функции (т.е. пролиферацию клеток, дифференциацию, гибель клеток и выживание). Дерегуляция активности киназы связана с более чем 400 заболеваниями, что делает ингибиторы киназы одним из основных классов препаратов, доступных для лечения ряда заболеваний, включая рак, сердечно-сосудистые и неврологические расстройства, а также воспалительные и аутоиммунные заболевания1,2,3.
С появлением высокоточной медицины, выявление новых методов лечения, особенно ингибиторы киназы, имеют большую привлекательность фармацевтически и клинически. Несколько подходов могут быть использованы для выявления возможных новых пар ингибиторов киназы/киназы, включая de novo дизайн ингибиторов киназы и определение новых целей для существующих препаратов, одобренных FDA. Последнее особенно привлекательно, так как время и деньги, необходимые для внедрения этих препаратов в клиниках, резко сокращаются из-за наличия предыдущих данных клинических испытаний. Каноническим примером повторного использования ингибитора киназы является иматиниб, первоначально предназначенный для лечения хронического миелоимного лейкоза (ХМЛ) через ингибирование BCR-Abl, который также может быть успешно использован для лечения c-Kit чрезмерного выражения стромальных опухолей желудочно-кишечного тракта (ГИСТ)4,5,6,7.
Скрининг ингибиторов киназы может быть выполнен в связывающих анализов или ферментативных анализов. Первый класс анализов фокусируется на белково-лекарственное взаимодействие и может предоставить информацию, такую как место перевязки и сродство. Поскольку активность киназы во время этих анализов неизвестна, ряд взаимодействий может быть пропущен или ложно идентифицирован из-за конформанционных изменений в белке. С другой стороны, ферментативные анализы требуют, чтобы протеиновые киназы были активными и предоставляют ценную информацию о влиянии ингибитора на активность ферментов, однако этот тип скрининга, как правило, занимает больше времени и дороже. В настоящее время оба типа анализов доступны на коммерческой стадии из нескольких источников. Они представляют собой надежный вариант для скрининга ингибиторов киназы с некоторыми ограничениями, в том числе: I) большинство методов включают тестирование нескольких киназов индивидуально, что может сделать скрининг большого набора белков дорогостоящим; II) набор киназ, которые должны быть протестированы ограничивается список предварительно отобранных, дикого типа киназы и несколько известных мутировавших версий некоторых киназов, препятствуя тестированию многих новых мутировавших изоформ.
В этом контексте белковые микроаррей являются мощной платформой, способной преодолеть некоторые ограничения, представленные коммерчески доступными методами. Подходит для проведения ферментативных анализов при высокопроемном скрининге с использованием полнометражных активных белков любой последовательности интереса. Микроаррей может быть создан с помощью самособранного подхода, такого как NAPPA (программируемый набор нуклеиновых кислот), в котором белки выражаются как раз вовремя для анализов, увеличивая вероятность того, что те, которые отображаются на массиве, действительно активны. Белки, отображаемые на NAPPA, производятся с использованием биосом и белков сопровождающего человека для повышения вероятности естественного складывания и активности.
Белки первоначально запрограммированы путем печати cDNAs кодирования для генов, представляющих интерес сливается с захватом тега, вместе с агентом захвата, на поверхность microarray. Белки затем производятся на microarrays с помощью системы экстракорпорации и перевода (IVTT), а свежевыраженные белки обездвиживаются на поверхности микроаррей агентом захвата. Выраженные массивы NAPPA могут быть использованы для изучения белков, отображаемых на массиве в беспристрастным, высокой пропускнойспособом8,9.
Ранее было показано, что белки, отображаемые на массивах NAPPA, складываются должным образом, чтобы взаимодействовать с известными партнерами10; кроме того, их ферментативная активность была впервые использована в 2018 году, когда было показано, что протеиновые киназы, отображаемые на микроаре ауфосфорилат11. На сегодняшний день методология NAPPA используется для многих различных применений, включая открытие биомаркеров12,13,14,15,16,17, белково-белковые взаимодействия10,18,идентификация субстрата19,и скрининг препарата11. Его гибкость является одной из ключевых характеристик платформы, которая позволяет адаптироваться к каждому приложению.
Здесь представлен протокол скрининга ингибиторов тирозинкиназы в самособранных массивах NAPPA. Платформа оптимизирована для отображения активных человеческих белковых киназ и для анализа белковой киназы, с низким фоном и высоким динамическим диапазоном. Среди модификаций, реализованных для использования NAPPA для скрининга ингибиторов киназы, включают: I) изменения в химии печати, II) дефосфорилирование микроаря белка до скрининга ингибитора киназы, и III) оптимизация обнаружения фосфорилированных белков на массиве. Этот протокол является первым в своем роде и предоставляет уникальную информацию об исследовании киназы в микроарах NAPPA.
протокол
1. Общие буферы и решения, которые будут использоваться
- Подготовка туберкулеза среды: Потрясающий бульон (24 г/ л дрожжевого экстракта; 20 г/ л триптона; 4 мл/л глицерола; 0,017 M KH2PO4;и 0,072 M K2HPO4). Решения 0.017 M KH2PO4 и 0.072 M K2HPO4 можно приобрести в виде 10-х фосфатного буфера (0,17 М KH2PO4 и 0,72 M K2HPO4).
- Подготовка LB средний: Лурия-Бертани (5 г/ l дрожжевого экстракта; 10 г/ l триптона; и 10 г/L NaCl). Отрегулируйте рН до 7,0 с 5 M NaOH.
- Подготовка 1x TBS: Tris-буферный солен (TBS: 50 мм Tris-Cl, рН 7,5; 150 мм NaCl).
- Подготовка 1x TBST: TBS дополнены 0,1% Tween 20.
2. Подготовка ДНК
ПРИМЕЧАНИЕ: ДНК, используемая для массивов NAPPA, должна быть очень чистой; поэтому коммерческие мини-препсы ДНК не рекомендуются. В настоящее время используются два протокола для подготовки ДНК: в доме высокой пропускной мини-подготовки (описанные здесь) или коммерческих Midi- или Maxi-prep. Средняя пропускная плата в рамках мини-протокола составляет 1500 образцов в день на человека.
- Бактериальный рост для мини-подготовки с высокой пропускной результатой в доме
- Подготовка LB / Агар omni пластины. Налейте 30-40 мл агара LB (1,5% бактериологического агара в LB MEDIA, дополненного антибиотиком для выбора положительных клонов) в каждую хорошо тарелку.
- Пятно глицерол акций на LB / агар пластины. Разбавить глицерол в LB-сми (1:300, обычно 2 л в 600 ЛБ). Встряхните в течение 10 мин. Пятно 3 л разбавленного бульона на пластину LB/agar. Инкубировать при 37 градусах Цельсия, вверх ногами, на ночь.
- Прививать культуры. Используя 96-контактное устройство, которое было стерилизовано в 80% этанола и пламени, привить культуру от агара пластины в глубоко-колодцблок с 1,5 мл на колодец туберкулеза среды дополняется антибиотиком.
- Инкубировать культуры. Накройте блок газопроницаемым уплотнением и инкубируйте 22-24 ч при 37 градусах по Цельсию, 300-800 об/мин в зависимости от шейкера.
ПРИМЕЧАНИЕ: Шейкеры, установленные при 800 об/мин, оптимальны для этой инкубации. Использование более медленного скоростного шейкера может привести к менее плотным культурам и снижению урожайности ДНК. - Культура пеллет. Спиновые блоки на 3800 х г и 4 кв 30 мин. Отбросить супернатант.
- В доме высокой пропускной результате мини-подготовки
ПРИМЕЧАНИЕ: Многоканальные пипететоры или автоматические дозаторы могут быть использованы для выполнения в доме высокой пропускной записи мини-подготовки. При использовании автоматического дозатора, убедитесь, что для очистки системы до использования и между решениями.- Подготовьте все решения, используемые во время мини-подготовки:
- Подготовка Решения 1: РЕЗЕРВНЫй буфер TE (50 мм Трис, рН 8,0; 10 мМ EDTA, рН 8,0; 0,1 мг/мЛ РНКС). Хранить при 4 градусах по Цельсию.
- Подготовьте решение 2: буфер лиза Lysis NaOH/SDS (0.2 M NaOH; 1% SDS). Для получения лучших результатов следует использовать свежесделанное решение.
- Подготовка решения 3: буфер нейтрализации KOAC (2,8 M KOAc). Отрегулируйте рН раствора до 5,1 с ледниковой уксусной кислотой. Хранить при 4 градусах по Цельсию.
- Подготовка решения N2: буфер равновесия (100 мм Tris; 900 мМ KCl; 15% EtOH; 0,15% Triton X-100). Отрегулируйте рН раствора до 6,3 с фосфорной кислотой.
- Подготовка решения N3: буфер bash (100 мм Tris; 1.15 M KCl; 15% EtOH). Отрегулируйте рН раствора до 6,3 с фосфорной кислотой.
- Подготовка решения N5: элюционный буфер (100 мм Трис; 1 М ККЛ; 15% EtOH). Отрегулируйте рН раствора до 8,5 с помощью фосфорной кислоты.
ПРИМЕЧАНИЕ: Успешный контроль связывания ДНК, стирки и elution во время обмена анионов сильно зависит от концентрации кCl буфера и значений рН. Тщательные измерения буферного компонента и регулировка рН имеют важное значение. Небольшие отклонения от описанных измерений могут привести к значительной потере урожайности.
- Повторно приостановить гранулы. Добавьте 200 л раствора 1 и встряхните при 2000 об/мин в течение 5 мин на РТ. Полная повторная подвеска гранул необходима для успешного лиза. Вихрь блока, если это необходимо.
- Бактерии lyse. Добавьте 200 л раствора 2, загерметизуйте пластину алюминиевым уплотнением и инвертизуйте 5x. Тщательно время этот шаг от начала решения 2 дополнение. Не превышать 5 мин.
- Нейтрализовать решение. Добавьте 200 л раствора 3, загерметизуйте пластину алюминиевым уплотнением и инвертизуйте 5x. Уплотнение может быть свободным из-за буферов лизиса/нейтрализации, поэтому используйте осторожность при инвертировании. Частичная инверсия, при которой раствор никогда не касается уплотнения, рекомендуется для предотвращения перекрестного загрязнения среди образцов.
- Очистить лисат. Центрифуге пластин на 3800 х г и 4 кв кв в течение 30 мин.
- Подготовка анион обмена суспензии обмена во время лизатных гранул центрифугации шаг. Используя бутылку 1 л, заполните ее анионной биржевой массой до тех пор, пока она не достигнет отметки 300 мл, затем добавьте раствор N2 до 900 мл.
ВНИМАНИЕ: Этот шаг должен быть сделан в капюшоне, чтобы защитить от вдыхания кремнезема. - Подготовка анион обмена тарелки сгой. Стек фильтровальных пластин на верхней части глубокого блока хорошо выступать в качестве судна для сбора отходов. Смешайте анион обмена шламдов, пока он не однороден, а затем вылить в стеклянное корыто. Используя широко скучную подсказку P1000, перенесите 450 л суспензии в каждую скважину фильтрующих пластин.
- Центрифуга сложены пластины (тарелка с ресиней / глубокой скважины пластины) при медленном ускорении в течение 5 мин при 130 х г и RT. Отбросьте поток через.
- Передача lysate supernatant в тарелку с тарелкой и глубоким колодцем блок стеки. Спин сложенные пластины в течение 5 минут на 30 х г с медленной наращивания скорости.
- Колонка для мытья. Добавьте 400 л раствора N3 (буфер мытья) к каждой скважине. Передача тарелки с ресиней в вакуумную многообразие, чтобы удалить буфер для мытья. Повторите стирки 3x. На последней стирке убедитесь, что все скважины должным образом опорожняются. Спин стек пластин на 150 х г в течение 5 минут, чтобы удалить любой остаточный буфер.
- Elute ДНК. Поместите тарелку с ресиней на чистую пластину для сбора 800 л. Добавьте 300 л раствора N5 к каждой скважине. Пусть он сидит на RT в течение 10 минут, а затем спина сложены пластины в течение 5 минут на 20 х г с медленной наращивания скорости. Спин сложенные пластины в течение 1 мин на 233 х г.
- Количественно ДНК и хранить пластины при -20 градусов до дальнейшего использования или перейти прямо к выпадениям ДНК.
ПРИМЕЧАНИЕ: Необходимо как минимум 30 мкг ДНК на один образец. Если урожайность ДНК низкая, рекомендуется повторить мини-подготовку ДНК или же смешать две пластины во время шага осадков (раздел 2.3).
- Подготовьте все решения, используемые во время мини-подготовки:
- Выпадение ДНК
- Оттепель из пластин, вихрь, чтобы гомогенизировать раствор ДНК, и спина на 230 х г в течение 30 с, чтобы собрать все растворы в нижней части скважины.
- Добавьте 40 qL из 3 M NaOAc и 240 л изопропанола к каждой скважине. Накройте тарелку алюминиевым уплотнением и перемешайте, перевернув 3x.
- Центрифуга пластин на 30 мин при 3800 х г и 25 градусов по Цельсию. Аккуратно отбросьте супернатант.
ПРИМЕЧАНИЕ: Чтобы объединить две пластины, перенесите ДНК со второй пластины в гранулы из первой пластины и повторите шаги 2.3.2-2.3.3. - Вымойте и осаждните ДНК. Добавьте 400 л 80% этанола к каждому колодцу. Печать пластин с алюминиевой печатью и встряхнуть при 1000 об/мин в течение 30 мин. Центрифуга при 3800 х г в течение 30 мин при 25 градусах По Цельсию. Отбросьте супернатант.
- Высушите гранулы ДНК. Поместите тарелки вверх ногами под углом на бумажных полотенец и дайте им высохнуть в течение 1-2 ч, пока алкоголь не присутствует в нижней части колодца. Печать и центрифуга на 230 х г в течение 2 минут, чтобы принести любые гранулы вниз.
- Как только пластины высохнут, либо уплотняют алюминиевым уплотнением и замораживают при -20 градусов по Цельсию для последующего использования, либо продолжают повторно приостанавливать РАБОТУ ДНК (шаг 4.1).
3. Аминосилан слайд-покрытие
- Поместите стеклянные горки в металлическую стойку. Визуально проверить каждый слайд, чтобы убедиться, что не царапины или недостатки присутствуют.
- Погрузите слайды в покрытие раствора (2% аминозилана реагента в ацетоне) в течение 15 минут во время качания. Раствор аминозилана можно использовать для покрытия двух стоек по 30 слайдов каждый, прежде чем его нужно отбросить.
- Промыть шаг. Погрузите стойку слайда в стирку ацетона (99% ацетона), встряхните взад и вперед, затем вверх и вниз быстро 5x. Наклонитесь к одному углу, чтобы капать, а затем погрузиться в Ultrapure воды вверх и вниз быстро 5x. Наклон, чтобы капать, а затем место на салфетки.
ПРИМЕЧАНИЕ: Ацетон мыть можно использовать дважды, в то время как ультрачистая вода должна быть изменена каждый раз. - Сухие горки с использованием насильного воздуха, дует на них со всех сторон в течение примерно 3 мин, пока все капли воды были удалены. Храните с покрытием слайды на RT в металлической стойке внутри плотно запечатанной коробки.
4. Подготовка образцов массива
- Отрежь гранулы ДНК из мини-подготовки (шаг 2.3.6) в 20 л ультрачистой воды и встряхните при 1000 об/мин в течение 2 ч. Для миди/макс-подготовительной ДНК разбавьте каждый образец до конечной концентрации в 1,5 мкг/Л и перенесите 20 л на коллекционную пластину размером 800 л.
- Подготовка печатной смеси. Для одной пластины 96 скважин приготовьте 1 мл печатной смеси (237,5 л ультрачистой воды; 500 л полилизина (0,01%); 187,5 л БС3 (бис-сульфосуччинимидил, 50 мг/мл в ДМСО); и 75 л поликлонального антифлага.
ПРИМЕЧАНИЕ: Химические вещества должны быть добавлены в указанном порядке, чтобы избежать осадков. - Добавьте 10 юл печатной смеси к каждому образцу, уплотнить пластины с алюминиевой фольгой, и встряхнуть на RT в течение 90 минут при 1000 об/мин. Храните тарелки на ночь (16 ч) при 4 градусах Цельсия.
- В день печати, кратко вихрь и спина пластин. Передача 28 qL каждого образца на 384 массивпластины пластины. Этот перевод может быть осуществлен с помощью автоматизации или многоканальной пипетки. Очень важно отслеживать положение образцов в 384 массивной пластине.
- Спин пластины вниз кратко, чтобы удалить любые пузырьки. Запечатать тарелки фольгой.
5. Поколение массивов NAPPA: печать микроаррей
ПРИМЕЧАНИЕ: Все условия печати были оптимизированы для инструмента, перечисленного в таблице оборудования и материалов. При использовании другого массива может потребоваться дальнейшая оптимизация.
- Arrayer очистить. Перед началом опорожнить все резервуары для отходов и пополнить резервуары ультрачистой водой или 80% этанола, если это необходимо. Чистые булавки один за одним с без ворсом салфетки и ультрачистая вода. Сухие булавки с ворсом свободных салфеток и аккуратно поместите их обратно в голову arrayer.
- Arrayer настроен: печать спецификации «максимальное количество марок на чернила: 1; количество марок на месте: 1; многоштамповские сроки: --; время штампа (мс): 0 мс; время чернил (мс): 0 мс; регулировка глубины печати: 90 микрон; количество сенсорного: 0 протокол стерилизации: ультрачистая вода мыть на 2000 мс с 0 мс времени сушки и 500 мс времени ожидания; повторить эти шаги 6x; затем мытье с 80% этанола для 2000 мс с 1200 мс времени сушки и 500 мс времени ожидания; повторить эти шаги 6x.
- Слайд-дизайн: настроить массивик с желаемым шаблоном массивирования. Конструкция должна учитывать несколько факторов, т.е. количество реплик для каждого образца, местоположение и количество элементов управления, макет массива (один блок, несколько одинаковых блоков), количество массивов, которые должны быть напечатаны, длина выполнения и т.д.».
- Поместите аминозовые слайды с покрытием (шаг 3.4) на палубу массива. Проверьте, если вакуум держит все слайды надежно на месте. Начало увлажнителя (он должен быть установлен на уровне 60%).
- Поместите 384 хорошо пластины на массивной палубе. Запустите программу.
- Пометьте микроаррей. При печати поместите метки слайдов на нижней (непечатной) стороне каждого слайда. Поддерживайте порядок печати слайдов на палубе в численном порядке.
- Храните печатные массивы на RT в металлической стойке внутри плотно запечатанной коробки с пакетом кремнезема. Слайды, хранящиеся в сухой среде, имеют срок годности до одного года.
- (Необязательно): вторая партия из 90 слайдов может быть напечатана с использованием тех же образцов. Для этого удалите 384 пластины скважины с палубы массива, как только печать пластины будет сделано. Печать и хранить пластины при 4 градусах Цельсия. После того, как первая партия массивов полностью сделана, удалите их с палубы, поместите новые слайды с покрытием аминосилана и начните новый запуск. Убедитесь, что каждый 384 хорошо пластины на RT в течение 30 минут до его использования. Если более четырех реплик на образец печатаются в партии слайдов, рекомендуется разделить 384 пластины скважины на две пластины, чтобы уменьшить испарение образца за счет уменьшения времени, затрачиваемого на палубу массивника.
ПРИМЕЧАНИЕ: Проверьте все резервуары до начала второго запуска.
6. Обнаружение ДНК на слайдах NAPPA
- Заблокируйте слайды. Поместите слайды в коробку пипетки и добавьте 30 мл блокирующего буфера. Инкубировать на RT в течение 1 ч на качалке шейкер.
- Попятнать горки. Откажитесь от блокирующего раствора и добавьте 20 мл блокирующего буфера и 33 л флуоресцентного днк-интеркалатного красителя. Инкубировать в течение 15 минут с волнением. Затем быстро промыть горки ультрачистой водой и высушить с давлением воздуха. Продолжить сканирование (раздел 11).
7. Выражение слайдов NAPPA
- Блок слайды с блокированием буфера на качалке шейкер на RT в течение 1 ч. Используйте около 30 мл в коробке пипетки для четырех слайдов.
- Промыть слайды с ультрачистой водой и высушить с фильтрованным сжатым воздухом. Нанесите герметичной прокладкой к каждому слайду в зависимости от инструкций производителя.
- Добавьте смесь IVTT. Каждый слайд потребует 150 л смеси IVTT. Разбавить 82,5 л lysate HeLa в 33 л воды DEPC и дополнить 16,5 л вспомогательных белков и 33 uL реакции смеси. Добавьте смесь IVTT из конца не-метки или не-образца. Pipette смесь медленно (это приемлемо, если это бисер временно в конце впускного налета). Аккуратно массируйте уплотняющую прокладку так, чтобы смесь IVTT разлика и охватывала всю площадь массива. Нанесите небольшие круглые уплотнения порта на оба порта.
- Поместите слайды на опору и перенесите их в программируемый леденящий душу инкубатор. Инкубировать в течение 90 мин при 30 градусах по Цельсию для экспрессии белка, а затем 30 мин при 15 градусах по Цельсию для иммобилизации белка запроса.
- Вымойте и заблокируйте слайды. Удалите уплотняющую прокладку и погрузите слайды в коробку пипетки примерно с 30 мл 1x TBST, дополненный 5% молоком для протеинового дисплея (раздел 8) или 1x TBST, дополненный 3% бычьей сывороткой альбумина (BSA) для анализов киназы или скрининга наркотиков (раздел 9). Инкубировать на RT с волнением в течение 20 минут и повторить этот шаг 2x.
8. Обнаружение белков на массивах NAPPA
- Добавить первичные антитела. Удалите слайды из блокирующего раствора (шаг 7.5) и аккуратно высушите заднюю сторону (непечатную сторону) с помощью бумажного полотенца. Поместите слайды на опору и нанесите 600 л первичных антител (мышь антифлаг) разбавленной 1:200 в 1x TBST 5% молока. Инкубировать 1 ч на RT.
- Вымойте слайды с 1x TBST 5% молока на качалке шейкер (3x за 5 минут каждый).
- Добавить вторичные антитела. Удалите слайды из стирального раствора и аккуратно высушите заднюю сторону с помощью бумажного полотенца. Поместите слайды на опору и нанесите 600 л вторичных антител (ци3-лабибилированные антимышечные антитела) разбавленного 1:200 в 1x TBST и 5% молока. Защитите горки от света и инкубировать в течение 1 ч на RT.
- Вымойте слайды с 1x TBST на качалке шейкер (3x для 5 мин каждый). Быстро промыть горки с ультрачистой водой и высушить с помощью воздуха под давлением. Продолжить сканирование (раздел 11).
9. Скрининг ингибитора тирозинкиназы на массивах NAPPA
ПРИМЕЧАНИЕ: Несколько слайдов могут быть обработаны в одном эксперименте, однако, убедитесь, что в каждом шаге, один слайд обрабатывается в то время, и что они не высыхают между шагами. Добавьте все решения в конец слайда, не относясь к маркировке или не образцу.
- Подготовьте все растворы, используемые во время скрининга препарата:
- Подготовка фосфатазы/DNase раствор, сочетая в себе следующее: 1x белок металло-фосфатаз буфер (50 мм HEPES, 100 мм NaCl, 2 мМ DTT, 0,01% Brij 35 при рН 7,5); 1 мМ MnCl2; 8000 единиц фосфатазы белка лямбда; и 2 единицы DNase I. Подготовьте 400 л раствора для каждого микроаря. Добавить фосфатазы и DNase непосредственно перед использованием.
- Сделать препарат разбавления. Наркотики восстанавливаются в ДМСО до конечной концентрации в 10 мМ. Для обеспечения того, чтобы все концентрации наркотиков, протестированные на массиве, убедитесь, что один и тот же объем DMSO (запас 10000x в DMSO) создается для каждой концентрации и хранится на уровне -80 градусов по Цельсию. Во время употребления препараты разбавляют 1:100 в воде.
- Подготовка препарата / киназы решение путем объединения следующие: 1x киназа буфера (25 мм Tris-HCl рН 7,5); 5 мМ бета-глицерофосфат; 2 мМ ДТТ; 0,1 мМ Na3VO4; 10 мМ MgCl2; 500 ММ АТП; и 2 л препарата (разбавленного 1:100 в воде). Подготовьте 200 л раствора для каждого микроаря.
- Выполните фосфатазу и лечение DNase. Удалите слайды из блокирующего раствора (шаг 7.5) и аккуратно высушите заднюю часть с помощью бумажного полотенца. Поместите слайды на опору и нанесите 200 Л раствора фосфатазы/ДНазе. Поместите microarray coverslip, чтобы избежать испарения. Инкубировать при температуре 30 градусов по Цельсию в течение 45 минут в духовке.
- Фосфатаза и DNase лечение II: удалить массивы из духовки, отбросить coverslip, удалить избыток раствора, и применять 200 Л свежеприготовленных фосфатазы и DNase раствора. Обложка microarrays с coverslip и инкубировать еще 45 мин при температуре 30 градусов по Цельсию в духовке.
- Вымойте слайды с 1x TBST 0,2 M NaCl на качалке шейкер (3x за 5 минут каждый).
- Выполните медикаментозное лечение и реакцию киназы. Удалите слайды из стирального раствора и аккуратно высушите заднюю часть с помощью бумажного полотенца. Поместите слайды на поддержку и нанесите 200 Л раствора препарата/киназы. Поместите крышку сверху, чтобы избежать испарения. Инкубировать в течение 1 ч при температуре 30 градусов по Цельсию в духовке.
- Вымойте слайды с 1x TBST 0,2 M NaCl на качалке шейкер (3x за 5 минут каждый).
- Повторите шаги 8.1-8.4 с использованием в качестве основного антифо-тител антифо-тира антитела разбавленной 1:100. Замените 1x TBST 5% молоко во всех шагах с 1x TBST и 3% BSA.
10. Автоматизированный протокол гибридизации
ПРИМЕЧАНИЕ: Кроме того, станция гибридизации может быть использована для автоматизации всех гибридизации и смылок на массивах NAPPA (разделы 7-9), и протокол предоставляется как дополнительный файл 1.
11. Приобретение изображений
ПРИМЕЧАНИЕ: Microarray изображения должны быть приобретены с разрешением 20 микрон или выше.
- Загрузите microarrays в журнал держателя скольжения с протеинами стороной вверх. Загрузите журнал в сканер microarray.
- Выберите зеленый лазер с фильтром излучения 575/30 нм для сканирования сигнала от cy-3 помеченных вторичных антител. Если используется другой флюорофор, выберите правильную длину лазера/волны для обнаружения сигнала от флуоресцентного красителя.
- Определите имя для каждого изображения и место, где они будут сохранены.
- (Необязательно): для каждого нового фторофора рекомендуется оптимизация условий сканирования для определения линейного диапазона интенсивности сигнала. Для этого сканировать микроаррей с помощью ряда фотомультипликатора (PMT) и получить до получения четкого изображения с ненасыщенным сигналом и низким фоном.
- Сканирование всех microarrays с оптимизированными настройками и не забудьте выключить autogain.
ПРИМЕЧАНИЕ: Для анализа данных все микроэлементы должны быть отсканированы с использованием одних и тех же настроек сканирования. Для киназы анализы с использованием cy3 в качестве фторофора, изображения сканируются с 20% PMT, интенсивность лазера 25%, и 10 микрон разрешения, с помощью сканера, перечисленных в таблице оборудования и материалов.
12. Обработка и анализ данных
ПРИМЕЧАНИЕ: Несколько пакетов программного обеспечения доступны для количественной оценки данных микроarray с аналогичными возможностями. Описанная здесь процедура была разработана для программного обеспечения, указанного в таблице оборудования и материалов.
- Загрузите файлы TIFF, которые будут количественно определены, разработайте сетку в соответствии с макетом microarray и отрегулируйте размер пятен, чтобы включить весь сигнал с минимальной возможной областью. Соседние пятна не должны перекрываться. Визуально проверить, насколько хорошо программное обеспечение выполняет и настроить сетку вручную, если это необходимо.
- Количественная интенсивность сигнала микроаррей. Визуально проверить пятна на наличие каких-либо отклонений (неспецифические связывания, пыли и т.д.) и удалить их из анализа данных.
- Исправьте фон локально, используя сигнал соседних областей на массиве, в котором нет места.
- Нормализация данных. Для сравнения сигнала в разных массивах необходимо нормализовать интенсивность сигнала каждого микроаря. Чтобы исключить любые выбросы, нормализовать данные, используя обрезанное среднее 30% сигнала от положительного контроля (пятна IgG) дефосфорилированных микроаррей.
ПРИМЕЧАНИЕ: Сигнал от пятна IgG не изменяет во время фосфорилирования и dephosphorylation microarrays и соответствующ для нормализации. - Определите активные киназы. Для каждой функции, отображаемой на microarray, вычислите соотношение между нормализованной интенсивностью сигнала в автофосфорилированных и дефосфорилированных массивах. Установите порог в 1,5 раза изменения для идентификации активных киназы и пометить все другие функции, как не в состоянии пройти аутофосфорилирование (N / A).
- Рассчитайте активность каждой киназы, идентифицированной в шаге 12.5 в процентах от скорректированного сигнала (интенсивность сигнала нормализованного положительного контрольного массива (DMSO), вычитаемого интенсивностью сигнала нормализованного отрицательного контрольного массива (дефосфорилированного).
Результаты
Самособранные микроаррей NAPPA обеспечивают прочную платформу, которая может быть использована для многих различных применений, включая открытие биомаркеров, белково-белковые взаимодействия, идентификацию субстрата и скрининг атлет10,11 ,12,13,14,15,16,17,18,19,20.
Общая методология, принятая для изучения активности киназы и скрининга ингибиторов тирозина киназы на микроарах NAPPA, схематично представлена на рисунке 1. Во-первых, микроаррей NAPPA генерируются путем иммобилизации кДНК и захвата агента на микроарях с покрытием. cDNAs затем используются в качестве шаблона для транскрипции и перевода белков, используя человеческую систему IVTT, и вновь синтезированные белки обездвижены агентом захвата9. Качество печатного микроаря можно контролировать путем измерения уровней ДНК (подтверждение последовательной печати) или белка, отображаемого на массиве (подтверждение экспрессии белка и захвата; Рисунок 1). Чтобы уменьшить фоновый сигнал и увеличить динамический диапазон эксперимента, микроаррей обрабатываются 1) лямбда фосфатазы для удаления фосфорилирования из остатков Ser/Thr/Tyr, затем с 2) DNase для упрощения химии на месте и уменьшения фон(рисунок 1).
Следующим шагом является реакция аутофосфорилирования, при которой микроаррей инкубируются с буфером киназы в отсутствие АТФ (отрицательный контрольный массив, называемый дефосфорилированными микроарями), а буфер киназы дополняется АТФ (положительный контроль, называются аутофосфорилированными массивами) или АТФ и DMSO (управление транспортным средством). Следует подчеркнуть, что во время этого шага киназа не добавляется; Таким образом, внутренняя активность каждой киназы отображается на microarray количественно путем измерения его уровней фосфорилирования с помощью пан антифосфо-тирозин антитела следуют cy3-labbeled вторичного антитела (Рисунок 1).
Контроль качества массивов NAPPA-киназы, отображающие панель человеческих белковых киназ, напечатанных в четвероногих, показан на рисунке 2. Уровни обездвиженной ДНК были измерены путем окрашивания ДНК, и он показал четный сигнал через microarray, предполагая, что количество ДНК, напечатанной на массиве, было однородным. Также можно наблюдать несколько особенностей без каких-либо окрашивания ДНК. Эти характеристики соответствуют некоторым элементам управления, в которых ДНК была опущена из печатной смеси (т.е. пустые пятна (ничего не было напечатано), пятна воды, очищенное пятно IgG (поли-лизин, кросслинкер и очищенный IgG), печать только (полипечатная смесь: поли-лизин плюс кросслинкер и антифлаг антитела, без КАКих-либо ДНК) . Уровни белка, отображаемые на микроарах NAPPA-киназы, были оценены после реакции IVTT с использованием антитеговских антител.
Для скрининга киназы, Флаг был использован в качестве тега выбора и уровень белка отображается на microarray был измерен с помощью антифлаг антитела. Как показано, большинство пятен, содержащих кДНК успешно отображается обнаруживаемых уровней белка. Некоторые из контрольных пятен без кДНК также показали сигнал с антифлаг антитела: IgG месте (используется для обнаружения активности вторичного антитела) и пустые векторные пятна (cDNA коды только тег) (Рисунок 2). Микроаррей NAPPA-киназы показали хорошую воспроизводимость среди слайдов, при этом корреляция уровней протеинового дисплея между отдельными печатными партиями выше 0,88 (рисунок 2). В той же партии корреляция была еще выше, близко к 0,92 (данные не показаны).
Далее, киназа аутофосфорилирования активность белков отображается на массиве был измерен с помощью антифосфо-тирозина антитела (Рисунок 3). Белок, отображаемый на массиве, показал высокий уровень фосфорилирования белка после экспрессии(рисунок 3, слева), который может быть вызван внутренней киназы активности белка отображается на массиве или активных киназов, присутствующих в смеси IVTT. Это фосфорилирование было полностью удалено с помощью лечения лямбда фосфатазы и эти микроаррей были использованы для анализов киназы. После дефосфорилирования, аутофосфорилирование реакций, выполняемых без АТФ показали никаких значительных уровней фосфорилирования, как ожидалось, в то время как microarrays инкубируется с буфером киназы в присутствии АТФ показал фосфорилирование белка так быстро, как 15 мин ( Рисунок 3). Для скрининга препарата, активность киназы была измерена после 60 мин аутофосфорилирования реакции, чтобы максимизировать количество киназы испытания.
Сравнение микроаррей, в которых уровни фосфорилирования измерялись сразу после экспрессии белка(рисунок 3, слева) и после 60 мин аутофосфорилирования реакции(рисунок 3, справа) показали: i) белки фосфорилированных только после выражения, предполагая, что они могут быть экзогенно фосфорилированных белков, присутствующих на смеси IVTT, но не может быть аутофосфорилирован; ii) белок фосфорилированный только после реакции автофосфорилирования, предполагая, что эти белки не были активны после экспрессии белка и требовали, чтобы кофакторы, присутствующие в буфере киназы, были активными; или iii) белок фосфорилна на обоих массивах, предполагая, что они были активны в обоих условиях(рисунок 3).
В качестве примера результатов, полученных для скрининга ингибиторов тирозина киназы на массивах NAPPA-киназы, были использованы три ингибитора киназы с ярковыраженной избирательностью между белковыми киназами: стауроспоррин, иматиниб и ибрутиниб. Для всех скринингов, дефосфорилированных микроаррей NAPPA были инкубированы с увеличением концентрации ТКИ (от 100 нм до 10 uM) во время реакции аутофосфорилирования. Первый TKI испытания был staurosporine, глобальный ингибитор киназы белка, который показал мощное ингибирование киназы на microarray практически все киназы испытания11.
Далее был протестирован иматиниб, ингибитор ABL и c-Kit используется для лечения хронического миелоимного лейкоза и стромальных опухолей желудочно-кишечного тракта4,5,6,7. На напыленно-киназовых массивах иматиниб показал значительное снижение активности Abl1 и BCR-Abl1, в то время как другие киназы остались в основном не затронутыми(рисунок 4A). Количественная оценка данных для деятельности киназы была нормализована в отношении дефосфорилированного массива и представляла собой процент от положительного микроаря управления (только для транспортных средств). Данные для TNK2 (несоответствующая киназа), Abl1 и BCR-Abl1 показаны на рисунке 4B. Как и ожидалось, иматиниб показал селективное торможение к Abl1 и BCR-ABl1. Данные для c-Kit были безрезультатными из-за отсутствия активности на положительных контрольных массивах.
Наконец, был протестирован ибрутиниб, одобренный FDA ковалентным ингибитором тирозиной киназы Брутона (BTK). Ibrutinib в настоящее время используется в лечении нескольких связанных с кровью раковых заболеваний с гиперактивным BTK, в том числе хронический лимфоцитарный лейкоз (ХЛЛ), мантии клеточной лимфомы, и макроглобулинемия Вальденстрёма21,22. Рисунок 4C, является репрезентативным типичных результатов, полученных для скрининга ibrutinib. Активность киназы ABL1 (несоответствующая киназа) и БТК (каноническая цель) и ERBB4 (потенциальная новая цель) показана на рисунке 4D. Данные показывают, ERBB4 может быть ингибируется ibrutinib в дозе конкретного моды. Это ингибирование было подтверждено в пробирке и в клеточных анализов11, демонстрируя силу этой платформы.
В совокупности данные свидетельствуют о том, что платформа микроаррей NAPPA-киназы может быть использована для беспристрастного скрининга ингибиторов ТЗ. Кроме того, скрининг является быстрым и может быть легко настроить, чтобы включить любые изменения белковых киназ, представляющих интерес.
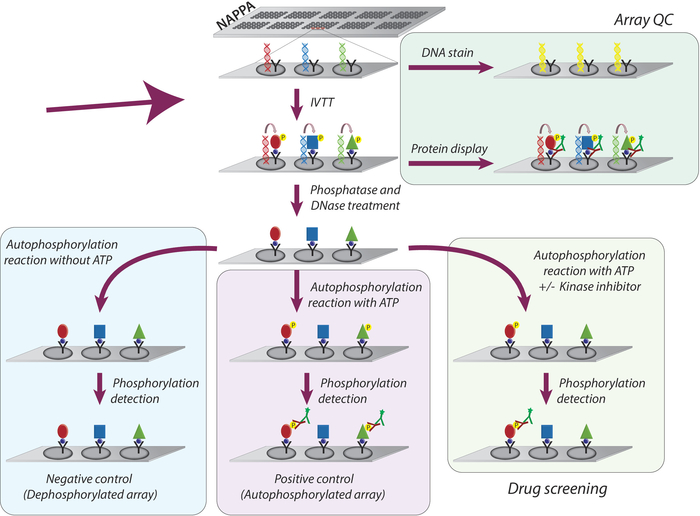
Рисунок 1: Схематическое представление контроля качества и скринингинг ингибиторов тирозинкиназы в массивах NAPPA. Массивы NAPPA печатаются с помощью кДНК-кодирования для белка, слитого с тегом и улавливающим антителом. Во время транскрипции и реакции перевода in vitro (IVTT) синтезированные белки захватываются на поверхности микроаря через бирку антителом захвата. Контроль качества (КК) массивов осуществляется путем измерения уровней ДНК, напечатанных на слайде, с использованием флуоресцентного ДНК-интеркалатного красителя, и уровней белка, отображаемого на массиве с использованием антител, специфических для тегов. Для скрининга киназы, microarrays обработаны с DNase и phosphatase, после реакции IVTT, для того чтобы извлечь напечатанную дна и вся фосфорилирование которое могло произойти во время синтеза протеина. Dephosphoryled массивы теперь готовы к использованию для экрана наркотиков. Для каждого ассса обычно используются три набора элементов управления: (I) дефосфорилированные массивы, в которых аутофосфорилирование реакции выполняется без АТФ; (II) аутофосфорилированные микроаррей, в которых аутофосфорилирование реакции выполняется в присутствии АТФ; и (III) DMSO обработанный массив (транспортное средство), в котором аутофосфорилирование реакции осуществляется с АТФ и DMSO. Слайды, обработанные различной концентрацией ингибиторов киназы, следуют точно такому же протоколу, используемому для обработанных массивов DMSO. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
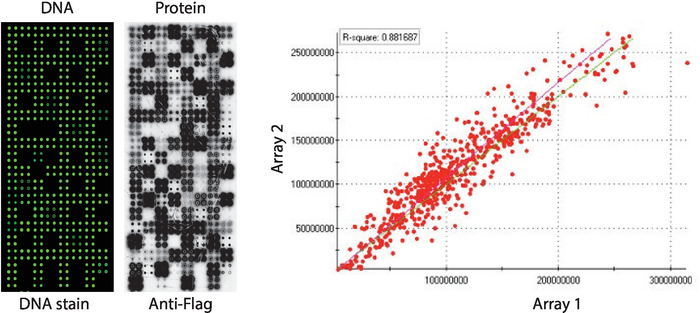
Рисунок 2: Репрезентативные результаты контроля качества для самособранных массивов NAPPA-киназы. Показано содержание ДНК, измеряемое флуоресцентным дискотелированным красителем (слева) и уровнями белка, отображаемого на микроарле, измеренном антифлагами (средний). Справа находится корреляционный участок уровней белка, отображаемый на двух массивах NAPPA-киназы, напечатанных отдельными партиями. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
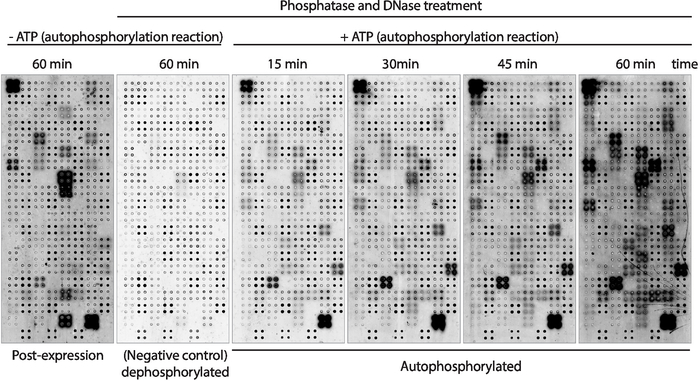
Рисунок 3: Репрезентативные результаты активности киназы в массивах NAPPA-киназы. Microarrays отображения белка киназы в четырехместный были использованы для изучения активности белка киназы на массиве путем измерения фосфорилирования белка с помощью анти-pTyr антитела, а затем cy3-помечены анти-мышь антитела. Контрольные массивы без лечения фосфатазой/DNase и без АТФ во время реакции аутофосфорилирования использовались для измерения фоновой фосфорилирования после экспрессии белка (пост-экспрессия). Остальные микроаррей лечились фосфатазой/ДНК, а аваусфорилирование было выполнено без АТФ (дефосфорилированный микроаррей, отрицательный контроль) или с АТФ (автофосфорилированные микроаррей). Для автофосфорилированных микроаррей аутофосфорилирование реакции было выполнено в течение 15 мин, 30 мин, 45 мин, или 60 мин, как показано на рисунке. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
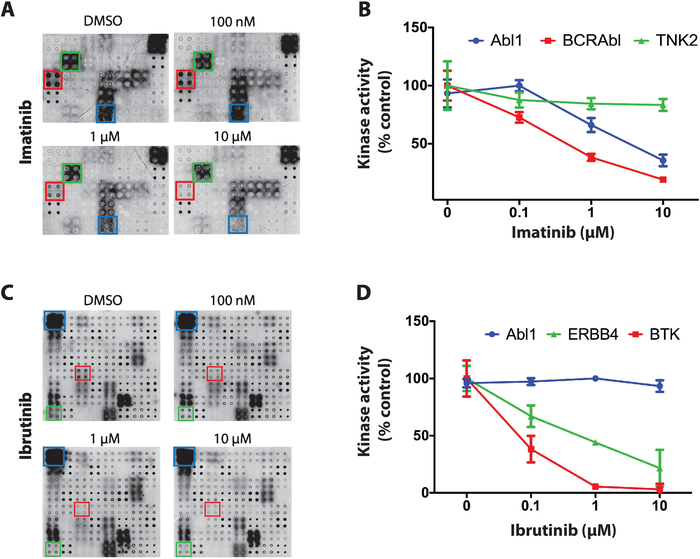
Рисунок 4: Репрезентативные данные с экрана тирозинкиназы на массивах NAPPA-киназы. (A) Фосфатаза / DNase лечение NAPPA-киназы массивы были инкубированы в увеличении концентрации иматиниба во время реакции аутофосфорилации и киназы деятельности была мера с антителами антифосфо-тир. (B) Количественная активность киназы наблюдается на napPA-киназы массивов подвергаются иматиниб. Данные были нормализованы против сигнала отрицательных контрольных массивов (дефосфорилированных) и показаны в процентах от положительных контрольных массивов (аутофоспорная реакция, выполняемая в присутствии ДМСО). Аналогичные данные показаны для скрининга ибрутиниба(C,D). Эта цифра была изменена с Рауф и др.11. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный файл 1. Альтернативный протокол для скрининга ингибиторов тирозинкиназы в массивах NAPPA с использованием автоматизированной станции гибридизации. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Модификации и устранение неполадок
На этапе оптимизации исследования активности киназы на массивах NAPPA одним из основных источников фона и низкого динамического диапазона была BSA, используемая в печатной смеси. BSA обеспечивала первичные амины, необходимые для перекрестного соединения с поверхностью аминозилана, и захватывал ДНК и улавливание антитела на месте. Тем не менее, BSA является высоко фосфорилированным, что затрудняет обнаружение сигнала автофосфорилирования на массиве над фоновым шумом. Для решения этой проблемы было протестировано несколько альтернатив ДЛЯ BSA в печатной смеси, и поли-лизин был определен в качестве хорошей замены. Поли-лизин не имеет какого-либо фосфорилирования сайта; таким образом, фон из невыраженных массивов очень минимален. Кроме того, микроаррей, напечатанные поли-лизином, воспроизводимы и отображают хорошие уровни белков(рисунок 2).
Следующей критической модификацией, выполненной на стандартном ассее NAPPA, было добавление шага лечения фосфатазой/DNase. Обработка микроаррей с фосфатазой позволяет удалить любой фосфорилирование, которое произошло в смеси IVTT во время синтеза и захвата белка(рисунок 3). Источником этого фосфорилирования может быть внутренняя аутофосфорилационная активность или активность киназы, присутствующие в смеси IVTT. Удаление всех фосфорилирования пост-выражения позволило легко идентификации киназы, которые являются активными и могут пройти аутофосфорилирование(рисунок 3).
Критические шаги в протоколе
NAPPA является надежной технологией, но, как и ожидалось, есть несколько критических шагов. Во-первых, приобретение высококачественной ДНК в соответствующей концентрации. Использование ДНК низкого качества или в низких концентрациях будет генерировать низкое качество microarrays с несколькими функциями не выражается и отображается в соответствующих уровнях, уменьшая количество белков, проанализированных на массиве. Вторым важным шагом является выражение белков на микроарле. Использование системы IVTT, которая будет выражать высокий уровень функционального белка имеет жизненно важное значение для изучения активности киназы на массиве.
Следующим важным шагом на скрининге TKI является обработка микрорейрей. Микроаррей не должен высыхать во время любого этапа протокола, а для предотвращения царапин, которые могут увеличить фоновый сигнал, рекомендуется нежная обработка. Поскольку массивы всего эксперимента будут сравниваться друг с другом, важно гарантировать, что каждый инкубационный шаг равномерно проходит на всех слайдах. Например, время, необходимое для выполнения одного шага в одном массиве, следует учитывать при обработке партии из 20 массивов для предотвращения различий в длине инкубации в массивах.
Наконец, разработка эксперимента и включение как позитивного, так и отрицательного контроля имеют решающее значение для контроля качества и анализа данных. Первый набор элементов управления печатается в каждом массиве и включает в себя отрицательные элементы управления (т.е. пустые пятна (без какого-либо материала напечатаны), воду или пустой вектор (выразить только тег) , а также положительный контроль (т.е. очищенный IgG, который обнаруживается вторичные антитела и инертны к изменению уровня фосфорилирования). В совокупности они измеряют фоновые уровни микроаррей, возможную перенос во время печати и интенсивность сигнала метода обнаружения.
Следующий набор мер контроля является контроль за скринингом наркотиков и включает в себя дефосфорилированные и аутофосфорилированные микроаррей (при наличии или отсутствии ДМСО). Как упоминалось ранее, дефосфорилированный микроаррей измеряет уровень фосфорилирования после лечения фосфатазой и, следовательно, базовый уровень для всех других экспериментов. Чем ниже базовый уровень, тем выше динамический диапазон анализов. Аутофосфорилированные массивы представляют максимальные уровни фосфорилирования всех массивов, и сигнал должен быть сильным и ясным. Он используется для анализа данных, но и в качестве контроля, что все реакции были успешно выполнены на массиве.
Ограничения техники
На данный момент, одним из ограничений наркотиков скрининга представлены здесь является его способность экранировать только протеиновые киназы, которые могут быть аутофосфорилированы. Один из возможных способов преодолеть это является печать киназы и известный субстрат в том же месте. Совместное печать ДНК для двух различных белков была успешно выполнена15,что свидетельствует о целесообразности такого подхода. Кроме того, белок, отображаемый на массиве, может быть неправильно сложен, что приводит к неактивному белку. Использование системы экспрессии на основе человека значительно улучшило активность киназы, измеряемую на массиве; однако, некоторые белки все еще не могут быть проанализированы на массиве из-за его бездействия.
Вторым ограничением является измерение фосфорилирования с помощью антифосфо-тир-антитела. Несмотря на свою неспеционность в отношении мотива фосфорилирования сайта, все измеренные фосфорилирования произошли на остатках тирозина, оставляя после себя серины и трионины и их соответствующие киназы. На сегодняшний день более 10 антител pan phospho-Ser/Thr были протестированы безуспешно, несмотря на несколько попыток оптимизировать условия инкубации и стирки. Новая система обнаружения, которая не зависит от антител может быть лучшим вариантом для расширения числа белковых киназ, которые могут быть проверены на ингибирование препарата. В этом контексте доступно несколько вариантов, включая радиоактивность или химические подходы, такие как спряжение кликов. Для минимизации фонового сигнала и обеспечения хорошего динамического диапазона для анализов требуется серия оптимизаций.
Третьим ограничением является приобретение клонов кДНК, которые будут напечатаны на массиве. Клоны кДНК могут быть сгенерированы с помощью любой техники клонирования, включая системы рекомбинации, такие как Creator или Gateway23. Другим вариантом является покупка клонов из библиотеки DNAsu, найденных в lt;https://dnasu.org/DNASU/Home.do'gt;, где более 17 000 клонов cDNAs, включая весь человеческий киноман, легко доступны для использования для строительства массивов NAPPA24 .
Четвертое ограничение заключается в том, что не каждая лаборатория оснащена соответствующим оборудованием для изготовления и проверки собственных массивов NAPPA. Этот протокол предоставляет альтернативные методы для создания ДНК для печати на microarray, без необходимости высокой пропускной техники, и протоколы для ручной выполнения всех шагов гибридизации. Тем не менее, доступ к массивнику и сканеру microarray по-прежнему необходим. Одним из вариантов решения этой проблемы является использование основной службы и объекта NAPPA, найденного по адресу: http://nappaproteinarray.org/'gt; который распространяет индивидуальные микроары NAPPA по некоммерческой академической цене. Наконец, как и любая методология скрининга, данные, полученные на массивах, могут быть артефактами (как положительными, так и отрицательными) и поэтому должны быть проверены с помощью ортогонных анализов.
Значение по отношению к существующим методам
Несколько платформ доступны на коммерческой коммерческой точки зрения для скрининга белковых киназ. Один из подходов, обычно используемых является обязательным анализы, которые могут быть выполнены с фрагментами белка, киназа домена, большие фрагменты белка с киназой домена и некоторых нормативных регионов, и даже полнометражные белки. Белки обычно выражаются в бактериальных системах из-за стоимости и простоты в протоколах выражения и очистки. Взаимодействие между препаратом интереса и белка затем измеряется с некоторым типом отчета анализ, как флуоресценция или наличие тегов, например. Основным ограничением этого набора подходов является тот факт, что белок не обязательно активен во время взаимодействия с препаратом, что может привести к выявлению ложноположительных и ложных негативных взаимодействий. Фрагменты белков особенно уязвимы к изменениям в конформации и отсутствии активности, и все полученные данные должны быть проверены с использованием активных белков, предпочтительно в их полнометражной форме. Еще одним ограничением некоторых платформ является возможность экранировать только аналоги ATP, ограничивая его общее использование.
Большинство коммерчески доступных услуг для скрининга ТКИ с использованием ферментативных подходов используют только дикие версии киназы, представляющие интерес, а иногда и лишь отдельные несколько мутантов. Зная, что лекарственная устойчивость очень распространена у пациентов, получавших ТКИ, важно уметь измерять реакцию препарата у различных мутантов, для выбора наиболее подходящего ингибитора. В связи с характером NAPPA, скрининг мутантов киназы прост и может быть легко выполнен, и единственным необходимым инструментом является включение мутанта киназы в коллекцию NAPPA cDNA, что может быть сделано с помощью сайта конкретных мутагенеза, например.
Будущие приложения
Одной из наиболее распространенных форм лечения в терапии рака с использованием ингибиторов киназы является приобретение мутаций в лекарственной мишени во время курса лечения. Скрининг этих мутантов относительно их реакции на ингибиторы киназы имеет жизненно важное значение для выбора второго/третьего поколения ТКИ для достижения персонализированного лечения для каждого пациента. Подход к скринингу наркотиков, представленный здесь, обеспечивает объективную платформу скрининга, в которой любой ингибитор тирозинкиназы может быть протестирован на панели тирозиновых киназ, присутствующих в геноме человека. Поскольку белки, отображаемые на массивах NAPPA, выражены в пробирке из кДНК, напечатанной на слайде, любой вариант мутантов может быть легко включен в коллекцию cDNA, которая будет отображаться на массиве. Объект, в котором мутанты киназы могут быть созданы и выражены на массиве, в сочетании с высокой пропускной способностью техники NAPPA, обеспечивает уникальную среду для изучения мутаций киназы и их реакции на наркотики, что делает NAPPA пригодным для персонализированный скрининг на наркотики, одна из целей точной медицины.
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Благодарности
Авторы хотели бы поблагодарить всех в лаборатории LaBaer за их помощь и критику во время разработки проекта. Этот проект был поддержан грантом NIH U01CA117374, U01AI077883 и Фондом Вирджинии Г. Пайпер.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 364 well plates (for arraying) | Genetix | x7020 | |
| 800 µL 96-well collection plate | Abgene | AB-0859 | |
| 96-pin device | Boekel | 140500 | |
| Acetic Acid | Millipore-Sigma | 1.00066 | |
| Acetone 99.9% | Millipore Sigma | 650501 | |
| Aluminum seal for 96 well plates | VWR | 76004-236 | |
| Aminosilane (3-aminopropyltriethoxysilane) | Pierce | 80370 | |
| ANTI-FLAG M2 antibody produced in mouse | Millipore Sigma | F3165 | |
| Anti-Flag rabbit Antibody (polyclonal) | Millipore Sigma | F7425 | |
| ATP 10 mM | Cell Signaling | 9804S | |
| β-Glycerophosphate disodium salt hydrate | Millipore-Sigma | G9422 | |
| bacteriological agar | VWR | 97064-336 | |
| Blocking Buffer | ThermoFisher/Pierce | 37535 | |
| Brij 35 | ThermoFisher/Pierce | BP345-500 | |
| BS3 (bis-sulfosuccinimidyl) | ThermoFisher/Pierce | 21580 | |
| BSA (bovine serum albumin) | Millipore Sigma | A2153 | |
| Coverslip 24 x 60 mm | VWR | 48393-106 | |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | |
| DeepWell Block, case of 50 | ThermoFisher/AbGene | AB-0661 | |
| DEPC water | Ambion | 9906 | |
| DMSO (Dimethyl Sulfoxide) | Millipore-Sigma | D8418 | |
| DNA-intercalating dye | Invitrogen | P11495 | |
| DNase I | Millipore-Sigma | AMPD1-1KT | |
| DTT | Millipore-Sigma | 43816 | |
| EDTA | Millipore-Sigma | EDS | |
| Ethanol 200 proof | Millipore-Sigma | E7023 | |
| Filter plates | Millipore-Sigma | WHA77002804 | |
| Gas Permeable Seals, box of 50 | ThermoFisher/AbGene | AB-0718 | |
| Glass box | Wheaton | 900201 | |
| Glass slides | VWR | 48300-047 | |
| Glycerol | Millipore-Sigma | G5516 | |
| HCl (Hydrochloric acid) | Millipore-Sigma | H1758 | |
| HEPES Buffer Solution | Millipore-Sigma | 83264 | |
| Human-based IVTT system | Thermo Scientific | 88882 | |
| ImmunoPure Mouse IgG whole molecule | ThermoFisher/Pierce | 31202 | |
| Isopropanol | Millipore-Sigma | I9516 | |
| KCl (Potassium chloride) | Millipore-Sigma | P9333 | |
| KH2PO4(Potassium phosphate monobasic) | Millipore-Sigma | P5655 | |
| Kinase buffer | Cell Signaling | 9802 | |
| KOAc (Potassium acetate) | Millipore-Sigma | P1190 | |
| Lambda Protein Phosphatase | new england biolabs | P0753 | |
| Lifterslips, 24 x 60 mm | ThermoFisher Scientific | 25X60I24789001LS | |
| Metal 30-slide rack with no handles | Wheaton | 900234 | |
| MgCL2 (Magnesium chloride) | Millipore-Sigma | M8266 | |
| Na3VO4 (Sodium orthovanadate) | Millipore-Sigma | S6508 | |
| NaCl (Sodium Chloride) | Millipore-Sigma | S3014 | |
| NaOAc (Sodium acetate) | Millipore-Sigma | S2889 | |
| NaOH (Sodium hydroxide) | Millipore-Sigma | S8045 | |
| NucleoBond Xtra Midi / Maxi | Macherey-Nagel | 740410.10 / 740414.10 | |
| Nucleoprep Anion II | Macherey Nagel | 740503.1 | |
| Phosphoric Acid | Millipore-Sigma | 79617 | |
| Poly-L-Lysine Solution (0.01%) | Millipore-Sigma | A-005-C | |
| Protein Phosphatase (Lambda) | New England Biolabs | P0753 | |
| RNAse | Invitrogen | 12091021 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | L6026 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | 05030 | |
| Sealing gasket | Grace Bio-Labs, Inc | 44904 | |
| Silica packets | VWR | 100489-246 | |
| Single well plate | ThermoFisher/Nalge Nunc | 242811 | |
| Sodium acetate (3M, pH 5.5) | Millipore-Sigma | 71196 | |
| TB media (Terrific Broth) | Millipore-Sigma | T0918 | |
| Tris | IBI scientific | IB70144 | |
| Triton X-100 | Millipore-Sigma | T8787 | |
| Tryptone | Millipore-Sigma | T7293 | |
| Tween 20 | Millipore-Sigma | P9416 | |
| Yeast Extract | Millipore-Sigma | Y1625 | |
| Name | Company | Catalog number | Comments |
| Equipments | Maker/model | ||
| Programmable chilling incubator | Torrey Pines IN30 Incubator with Cooling | ||
| Shaker for bacterial growth | ATR Multitron shaker | ||
| Vacuum manifold with liquid waste trap | MultiScreenVacuum Manifold 96 well | ||
| 96 well autopippetor/liquid handler | Genmate or Biomek FX | ||
| Liquid dispenser | Wellmate | ||
| DNA microarrayer | Genetix QArray2 | ||
| Automatic hybridization station | Tecan HS4800 Pro Hybridization Station | ||
| Microarray scanner | Tecan PowerScanner | ||
| Microarray data quantification | Tecan Array-ProAnalyzer 6.3 |
Ссылки
- Melnikova, I., Golden, J. Targeting protein kinases. Nature Review Drug Discovery. 3 (12), 993-994 (2004).
- Patterson, H., Nibbs, R., McInnes, I., Siebert, S. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases. Clinical and Experimental Immunology. 176 (1), 1-10 (2014).
- Wu, P., Nielsen, T. E., Clausen, M. H. FDA-approved small-molecule kinase inhibitors. Trends Pharmacological Sciencies. 36 (7), 422-439 (2015).
- Druker, B. J., et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nature Medicine. 2 (5), 561-566 (1996).
- Heinrich, M. C., et al. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood. 96 (3), 925-932 (2000).
- Stagno, F., et al. Imatinib mesylate in chronic myeloid leukemia: frontline treatment and long-term outcomes. Expert Review Anticancer Therapy. 16 (3), 273-278 (2016).
- Ben Ami, E., Demetri, G. D. A safety evaluation of imatinib mesylate in the treatment of gastrointestinal stromal tumor. Expert Opinions in Drug Safety. 15 (4), 571-578 (2016).
- Ramachandran, N., et al. Self-assembling protein microarrays. Science. 305 (5680), 86-90 (2004).
- Festa, F., et al. Robust microarray production of freshly expressed proteins in a human milieu. Proteomics Clinical Applications. 7 (5-6), 372-377 (2013).
- Yazaki, J., et al. Mapping transcription factor interactome networks using HaloTag protein arrays. Proceedings of the National Academy of Sciences of the United States of America. 113 (29), E4238-E4247 (2016).
- Rauf, F., et al. Ibrutinib inhibition of ERBB4 reduces cell growth in a WNT5A-dependent manner. Oncogene. 37 (17), 2237-2250 (2018).
- Anderson, K. S., et al. Protein microarray signature of autoantibody biomarkers for the early detection of breast cancer. Journal of Proteome Research. 10 (1), 85-96 (2011).
- Wang, J., et al. Plasma Autoantibodies Associated with Basal-like Breast Cancers. Cancer Epidemiol Biomarkers Prevention. 24 (9), 1332-1340 (2015).
- Bian, X., et al. Tracking the Antibody Immunome in Type 1 Diabetes Using Protein Arrays. Journal of Proteome Research. 16 (1), 195-203 (2017).
- Song, L., et al. Identification of Antibody Targets for Tuberculosis Serology using High-Density Nucleic Acid Programmable Protein Arrays. Molecular and Cellular Proteomics. 16 (4 suppl 1), S277-S289 (2017).
- Wang, J., et al. Comparative Study of Autoantibody Responses between Lung Adenocarcinoma and Benign Pulmonary Nodules. Journal of Thoracic Oncology. 11 (3), 334-345 (2016).
- Montor, W. R., et al. Genome-wide study of Pseudomonas aeruginosa outer membrane protein immunogenicity using self-assembling protein microarrays. Infection and Immunity. 77 (11), 4877-4886 (2009).
- Tang, Y., Qiu, J., Machner, M., LaBaer, J. Discovering Protein-Protein Interactions Using Nucleic Acid Programmable Protein Arrays. Current Protocols in Cell Biology. 74, 11-15 (2017).
- Yu, X., et al. Copper-catalyzed azide-alkyne cycloaddition (click chemistry)-based detection of global pathogen-host AMPylation on self-assembled human protein microarrays. Molecular and Cellular Proteomics. 13 (11), 3164-3176 (2014).
- Anderson, K. S., et al. Autoantibody signature for the serologic detection of ovarian cancer. Journal of Proteome Research. 14 (1), 578-586 (2015).
- Woyach, J. A., Johnson, A. J., Byrd, J. C. The B-cell receptor signaling pathway as a therapeutic target in CLL. Blood. 120 (6), 1175-1184 (2012).
- Smith, M. R. Ibrutinib in B lymphoid malignancies. Expert Opinion on Pharmacotherapy. 16 (12), 1879-1887 (2015).
- Festa, F., Steel, J., Bian, X., Labaer, J. High-throughput cloning and expression library creation for functional proteomics. Proteomics. 13 (9), 1381-1399 (2013).
- Seiler, C. Y., et al. DNASU plasmid and PSI:Biology-Materials repositories: resources to accelerate biological research. Nucleic Acids Research. 42, D1253-D1260 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены