Method Article
הקרנת מעכבי קינאז במיקרוערכים של חלבון אנושי מורכב בעצמו
In This Article
Summary
פרוטוקול מפורט ליצירת מיקרומערכים של חלבון אנושי מורכב באמצעות הקרנת מעכבי הסרט מוצג.
Abstract
הקרנת מעכבי קינאז חיונית להבנה טובה יותר של התרופה ולזיהוי יעדים שעלולים להיות חדשים עם השלכות קליניות. מספר מתודולוגיות דווחו לביצוע הקרנה כזו. עם זאת, לכל אחד יש מגבלות משלו (לדוגמה, הקרנת התוכנה האנלוגית של ATP בלבד, הגבלה לשימוש בתחומים של קינאז מטוהרים, עלויות משמעותיות הקשורות לבדיקות יותר מכמה כלוניות בזמן, וחוסר גמישות בסינון החלבונים עם מוטציות הרומן). כאן, פרוטוקול חדש הגוברת על חלק ממגבלות אלה ניתן להשתמש להקרנה משוחדת של מעכבי קינאז מוצג. חוזק של שיטה זו הוא יכולתה להשוות את הפעילות של מעכבי קינאז על פני חלבונים מרובים, בין הקינסים שונים או גרסאות שונות של אותו קינאז. מיקרומערכים חלבון מורכבים הנוצרים באמצעות הביטוי של הקיסים חלבונים על ידי האדם מבוסס תמלול ומערכת תרגום (IVTT) מועסקים. החלבונים המוצגים על המיקרו-מערך פעילים, ומאפשרים מדידה של השפעות מעכבי קינאז. הפרוצדורה הבאה מתארת את שלבי הפרוטוקול בפירוט, מדור המיקרו-מערך ומהקרנה לניתוח הנתונים.
Introduction
קינטיות חלבונים אחראים על זרחון של מטרות שלהם יכול לווסת מסלולים מולקולריים מורכבים השולטים בפונקציות סלולריות רבות (כלומר, הפצת תאים, בידול, מוות תאים והישרדות). פעילות רגולציה של קינאז קשורה ליותר מ-400 מחלות, מה שהופך את קינאז מעכבי אחת המחלקות העיקריות של תרופות הזמינות לטיפול במחלות מספר, כולל סרטן, וכלי דם הפרעות נוירולוגיות, כמו גם דלקתי . ומחלות אוטואימוניות1,2,3
עם הופעתו של הרפואה דיוק, הזיהוי של טיפולים חדשים, בעיקר מעכבי קינאז, יש ערעור גדול ברוקחות וקלינית. ניתן להשתמש במספר גישות לזיהוי צמדים חדשים אפשריים של מעכבי קינאז/קינאז, כולל עיצוב דה נובו של מעכבי קינאז וזיהוי מטרות חדשות עבור תרופות הקיימות באישור ה-FDA. האחרון הוא אטרקטיבי במיוחד, מאז הזמן והכסף הנדרשים כדי ליישם תרופות אלה במרפאות מופחת באופן דרסטי בשל הזמינות של נתוני ניסוי קליני הקודם. דוגמה קאנונית של מעכב קינאז הוא imatinib, תוכנן בתחילה לטיפול של לוקמיה myelogenous כרונית (CML) באמצעות עיכוב של BCR-Abl, אשר יכול גם לשמש בהצלחה לטיפול של c-Kit מעל-הבעת סטרומה גידולים במערכת העיכול (בלוגים)4,5,6,7.
ניתן לבצע את הקרנת מעכבי קינאז בכריכה מחייבת או באסמפי מבוסס-אנזימטי. המחלקה הראשונה של הספר מתמקדת באינטראקציות של תרופות חלבונים ויכולות לספק מידע כגון אתר לתקשורת ואהדה. מאחר שפעילותו של קינאז בזמן הפעולה הזאת אינה ידועה, מספר אינטראקציות עשויות להחמיץ או להיות מזוהות בטעות בשל שינויים בחלבון. מצד שני, בסיס אנזימטי מבוסס על הצורך להיות פעיל ולספק מידע חשוב לגבי השפעת המעכב על פעילות האנזים, עם זאת, סוג זה של ההקרנה הוא בדרך כלל יותר זמן רב ויקר. כיום, שני הסוגים של בחני הם זמינים מסחרית ממספר מקורות. הם מייצגים אופציה אמינה להקרנה של מעכבי קינאז עם מספר מגבלות, כולל: אני) רוב השיטות כרוכות בדיקה של מספר קינסים בנפרד, אשר יכול לעשות את ההקרנה של קבוצה גדולה של חלבונים יקרים; II) הקבוצה של הקינסים להיבדק מוגבלת לרשימה של מראש שנבחרו, פראי סוג הקונסים ומספר גרסאות ידועות מוטציה של כמה הקינסים, בחינת בדיקות של מוטציה חדשים רבים.
בהקשר זה, מיקרו-מערכי חלבון הם פלטפורמה רבת עוצמה המסוגלת להתגבר על חלק מהמגבלות המוצגות על ידי טכניקות זמינות מסחרית. היא מתאימה לביצוע מספר אנזימטי מבוסס בהקרנה בתפוקה גבוהה, תוך שימוש בחלבונים פעילים באורך מלא, בכל רצף של עניין. ניתן לייצר את המיקרו-מערכים על-ידי גישה הניתנת להרכבה עצמית, כגון מערך הגרעין של ה-"נאפה" (מערכת החלבונים הניתנים לתכנות), שבהם חלבונים מבוטאים בדיוק בזמן לקבלת הספר, הגדלת הסבירות שאלה המוצגים על המערך אכן פעילים. החלבונים המוצגים ב-נאפה מיוצרים בעזרת הריבוזומים אנושיים וחלבונים המלווה על מנת לשפר את הסבירות לקיפול ולפעילות טבעיים.
החלבונים מתוכנתים בתחילה על ידי הדפסת קידוד cDNAs עבור גנים של עניין התמזגו עם תג לכידת, יחד עם סוכן לכידה, על פני השטח microarray. החלבונים מיוצרים לאחר מכן על המיקרומערכים באמצעות תמלול ותרגום מחוץ למערכת (IVTT), והחלבונים המובטאים הטריים מוטאים על המשטח המיקרומערך על ידי סוכן הלכידה. ניתן להשתמש במערכים מסוג נאפה לחקר החלבונים המוצגים על המערך באופן בלתי משוחד ותפוקה גבוהה8,9.
בעבר, הוצגה העובדה שחלבונים המוצגים במערכים של הנפה מקופלים כראוי כדי לקיים אינטראקציה עם שותפים מוכרים10; יתרה מזאת, הפעילות האנזימטית שלהם נוצלה לראשונה ב-2018, כאשר הוצגה הצגת החלבונים בחלבון המוצג על המיקרו-מערך האוטומטי11. עד היום, מתודולוגיה של נאפה בשימוש עבור יישומים רבים ושונים, כולל גילוי ביואריקר12,13,14,15,16,17, אינטראקציות חלבונים בחלבון10,18, זיהוי מצע19, והקרנת תרופות11. הגמישות שלה היא אחת מתכונות המפתח של הפלטפורמה המאפשרת הסתגלות לכל יישום.
כאן מוצג פרוטוקול להקרנת מעכבי טירולי קינאז במערכים מורכבים מתוך מערכי הנפה. הפלטפורמה מותאמת במיוחד להצגת הקיזות של חלבון אנושי פעיל ולניתוח של פעילות חלבון קינאז, עם רקע נמוך וטווח דינמי גבוה. בין השינויים שבוצעו באמצעות ההקרנה בשנת הקרנת מעכבי קינאז: I) שינויים בכימיה המודפסת, II, דה-זירחון של מיקרומערך החלבון לפני הקרנת המעכב של קינאז, ו III) אופטימיזציה של גילוי חלבונים זרחליים על המערך. פרוטוקול זה הוא הראשון מסוגו ומספק מידע ייחודי על מחקר קינאז במיקרו-מיקרו של הנפה.
Protocol
1. מאגרים ופתרונות נפוצים לשימוש
- הכנת בינוני TB: ציר מצוין (24 גרם/שמרים לחלץ; 20 גרם/L טריטונה; 4 מל/l גליצרול; 0.017 M KH2פו; ו 0.072 M K2hpo4). 0.017 M KH2פו4 ו 0.072 M K2hpo4 פתרונות ניתן לרכוש כמו מאגר פוספט 10x (0.17 M kh2פו4 ו 0.72 M K2hpo4).
- הכנת מדיום LB: לוריא-ברגאני (5 שמרים g/L; 10 גרם/ליטר; ו-10 גרם/L). להתאים את ה-pH כדי 7.0 עם 5 M NaOH.
- להכין 1x TBS: טריס-מלוחים באגירה (TBS: 50 mM טריס-Cl, pH = 7.5; 150 mM הנאל).
- להכין 1 x TBST: TBS בתוספת עם 0.1% רצף 20.
2. הכנת דנ א
הערה: הדי-אן-איי שנוצל עבור מערכי הנפה מחייב להיות טהור מאוד; לכן, המיני-DNA מסחרי מיני-preps אינם מומלצים. כיום, שני פרוטוקולים עבור הכנה DNA משמשים: בבית מיני תפוקה גבוהה ההכנה (המתואר כאן) או מסחרי Midi-או מקסי-להתכונן. התפוקה הממוצעת של פרוטוקול ההכנה המיני של הבית היא 1,500 דגימות ליום לאדם.
- גידול חיידקי להכנה מצומצמת של הבית
- הכינו את לוחית האומני ליברות/אגר. שופכים 30-40 מ ל ליברות אגר (1.5% בקטיולוגי אגר במדיה LB בתוספת אנטיביוטיקה לבחירה של שיבוטים חיוביים) לתוך כל צלחת הבאר יחיד.
- ספוט גליצרול מלאי על הצלחת LB/אגר. לדלל מלאי גליצרול במדיה LB (1:300, בדרך כלל 2 μL ב 600 μL של LB). לנער עבור 10 דקות. ספוט 3 μL של מלאי מדולל על הצלחת LB/אגר. , מודטה ב-37 ° c. הפוכה, בן לילה
- התרבות האיחסן. באמצעות מכשיר 96-pin שהיה מעוקר ב 80% אתנול ולהבה, האיחסן את התרבות מן הצלחת אגר בבלוק עמוק-באר עם 1.5 mL לכל טוב של שחפת בינוני בתוספת אנטיביוטיקה.
- . תרבויות הדגירה לכסות את הבלוק עם חותם חדיר גז הדגירה של 22 – 24 h ב 37 ° צ', 300 – 800 סל ד בהתאם שייקר.
הערה: שאיפה להגדיר ב 800 rpm הם אופטימליים עבור הדגירה הזו. השימוש של שייקר מהירות איטית עלולה לגרום לתרבויות צפוף פחות והתשואות לטיהור DNA נמוך. - . תרביות גלולה בלוקים ספין ב 3,800 x g ו-4 ° צ' עבור 30 דקות למחוק supernatant.
- הכנה מצומצמת של תפוקה גבוהה בתוך הבית
הערה: ניתן להשתמש בפיפטורים מרובי-ערוצים או במנפק אוטומטיים כדי לבצע הכנה מצומצמת של תפוקה גבוהה בתוך הבית. בשעת שימוש במנפק אוטומטי, הקפידו לנקות את המערכת לפני השימוש והבין הפתרונות.- הכן את כל הפתרונות המשמשים במהלך ההכנה המצומצמת:
- הכנת פתרון 1: מאגר הבולם העצמי של TE (50 mM טריס, pH = 8.0; 10 מ"מ EDTA, pH = 8.0; 0.1 mg/mL RNAse). חנות ב -4 ° c.
- הכנת פתרון 2: מאגר הליזה נאאה/SDS (0.2 M NaOH; 1% SDS). לקבלת תוצאות טובות יותר, יש להשתמש בפתרון טרי שנעשה.
- הכנת פתרון 3: מאגר ניטרול KOAC (2.8 M KOAc). להתאים את ה-pH של הפתרון כדי 5.1 עם חומצה אצטית קרחוני. חנות ב -4 ° c.
- הכנת פתרון N2: מאגר באקוויציה (100 mM Tris; 900 mM KCl; 15% אטוח; 0.15% טריטון X-100). להתאים את ה-pH של הפתרון כדי 6.3 עם חומצה זרחתית.
- הכנת פתרון N3: מאגר bash (100 mM Tris; 1.15 M KCl; 15% אטוח). להתאים את ה-pH של הפתרון כדי 6.3 עם חומצה זרחתית.
- הכנת פתרון N5: מאגר הימנעות (100 mM Tris; 1 M KCl; 15% אטוח). להתאים את ה-pH של הפתרון כדי 8.5 עם חומצה זרחתית.
הערה: שליטה מוצלחת של כריכת ה-DNA, כביסה, ו הימנעות במהלך החלפת החליפין הוא תלוי מאוד במאגר KCl ריכוז וערכי pH. מדידות של רכיבי מאגר זהירים וכוונון pH חיוניים. סטיות קטנות מהמדידות המתוארות יכולות לגרום לאובדן משמעותי של תשואות.
- . להשעות מחדש את הגלולה הוסף 200 μL של פתרון 1 ולנער ב 2,000 סל ד עבור 5 דקות ב RT. להשלים מחדש השעיה של הגלולה הוא הכרחי לפירוק מוצלח. מערבולת הבלוק אם יש צורך.
- . חיידקים ליאוס להוסיף 200 μL של פתרון 2, לאטום את הצלחת עם חותם אלומיניום ולהפוך 5x. בזהירות הזמן הזה מתחילת פתרון 2 בנוסף. אין לחרוג מ-5 דקות.
- . נטרל את הפתרון הוסף 200 μL של פתרון 3, אטום את הצלחת עם חותם אלומיניום והיפוך 5x. החותם עשוי להיות רופף בשל הליזה/ניטרול מאגרי, כך להשתמש בזהירות בעת היפוך. היפוך חלקי, בו הפתרון לעולם אינו נוגע בחותם, מומלץ למנוע זיהום צולב בין דגימות.
- . ברור לליפוסט צנטריפוגה את הצלחות ב 3,800 x g ו 4 ° צ' עבור 30 דקות.
- להכין אניון החליפין שרף במהלך הצעד לצנטריפוגה ליפוסט. באמצעות בקבוק 1 L, למלא אותו עם שרף החליפין אניון עד שהוא מגיע לסמן 300 ml, ולאחר מכן להוסיף פתרון N2 עד 900 mL.
התראה: שלב זה צריך להיעשות במכסה המנוע כדי להגן מפני שאיפת סיליקה. - הכינו את לוחיות הרישוי של הבורסה. מחסנית לוחיות הסינון על גבי בלוק באר עמוק כדי לשמש כלי איסוף פסולת. מערבבים את האניב החליפין משקה עד שהוא הומוגנית, ואז לשפוך לתוך שוקת זכוכית. באמצעות P1000 רחב משועמם טיפים, להעביר 450 μL של שעמום לתוך כל טוב של לוחיות הסינון.
- צנטריפוגה מוערמים צלחות (צלחת שרף/צלחת הבאר עמוק) ב האצה איטית עבור 5 דקות ב 130 x ו RT. למחוק את הזרימה דרך.
- העברת ליפוסט על הצלחת שרף/בלוק היטב ערימות. לסובב את מוערמים לוחות עבור 5 דקות ב 30 x g עם מהירות הסוללה איטית.
- שטוף עמודה. הוסף 400 μL של פתרון N3 (לשטוף מאגר) לכל טוב. להעביר את הצלחת שרף סעפת ואקום כדי להסיר את המאגר לשטוף. חזור על שלבי שטיפת 3x. בשטיפה האחרונה, ודא שכל. הבארות מרוקנים כראוי לסובב את לוחיות מחסנית ב 150 x g עבור 5 דקות כדי להסיר כל מאגר שיורית.
- . דנ א של אליוט מניחים את הצלחת שרף על לוחית נקי 800 μL אוסף. הוסף 300 μL של פתרון N5 לכל טוב. תן לו לשבת על RT עבור 10 דקות, ואז לסובב את הלוחות מוערמים עבור 5 דקות ב 20 x g עם מהירות הרמפה איטית. לסובב את מוערמים לוחות עבור 1 דקות ב 233 x g.
- לכמת דנ א וצלחות לאחסן ב-20 ° c עד שימוש נוסף או להמשיך ישירות משקעים DNA.
הערה: מינימום של 30 μg של דנ א לכל מדגם נדרש. אם התשואה של הדנ א נמוכה, מומלץ לחזור על ההכנה המצומצמת של הדנ א, או לחלופין לשלב שתי צלחות במהלך המשקעים (סעיף 2.3).
- הכן את כל הפתרונות המשמשים במהלך ההכנה המצומצמת:
- משקעים גנטיים
- להפשיר את הצלחות, מערבולת כדי המגון פתרון ה-DNA, ו ספין ב 230 x g עבור 30 s כדי לאסוף את כל הפתרון בחלק התחתון של הבאר.
- הוסף 40 μL של 3 M NaOAc ו 240 μL של איזופנול לכל טוב. לכסות את הצלחת עם חותם אלומיניום ולערבב על ידי היפוך 3x.
- צנטריפוגה את הצלחות במשך 30 דקות ב 3,800 x ו -25 ° c. . בזהירות, ביטול הסופרנטאנט
הערה: כדי לשלב שתי צלחות, להעביר את ה-DNA מן הלוח השני לתוך הגלולה מן הצלחת הראשונה ולחזור על צעדים 2.3.2 – 2.3.3. - . לשטוף ולזרז את הדי. אנ. איי הוסף 400 μL של 80% אתנול לכל טוב. חותם לוחיות עם חותמת אלומיניום ולנער ב 1,000 rpm עבור 30 דקות. צנטריפוגה ב 3,800 x g עבור 30 דקות ב -25 ° c. . מחק את הסופרנטאנט
- . תייבש את כדורי הדי. אנ. איי מניחים את הלוחות הפוכים בזווית על מגבות נייר ולתת להם להתייבש עבור 1 – 2 h, עד לא קיים אלכוהול בתחתית הבאר. חותם וצנטריפוגה ב 230 x g עבור 2 דקות כדי להביא כל כדורי למטה.
- לאחר הצלחות יבשים, או לאטום עם חותם אלומיניום להקפיא ב-20 ° צ' לשימוש מאוחר יותר או להמשיך להשעות את ה-DNA (שלב 4.1).
3. כיסוי מחליק עמינח
- מניחים את שקופיות הזכוכית במדף המתכת. בחן באופן חזותי כל שקופית כדי להבטיח שאין שריטות או פגמים נוכחים.
- לטבול שקופיות בתמיסה לציפוי (2% עמינח מגיב באצטון) במשך 15 דקות בזמן הנדנדה. ניתן להשתמש בתמיסה העמינח של הפסל בשני מדפים של 30 שקופיות לפני שהוא צריך להיות מושלך.
- . לשטוף את המדרגה לטבול את מתלה השקופיות ב שטיפת אצטון (99% אצטון), לנער הלוך ושוב, ואז למעלה ולמטה במהירות 5x. הטיה לפינה אחת כדי לטפטף, ואז לטבול במים Ultrapure למעלה ולמטה במהירות 5x. להטות כדי לטפטף, ואז למקם על מפיות.
הערה: שטיפת אצטון יכולה לשמש פעמיים, בעוד שהמים האולטרה-טהורים חייבים להשתנות בכל פעם. - שקופיות יבשות באמצעות לחצה אוויר, נושבת עליהם מכל הזוויות במשך כ 3 דקות עד כל טיפות המים הוסרו. אחסן את השקופיות המצופות ב-RT בארון מתכת בתוך תיבה אטומה היטב.
4. הכנה לדגימת מערך
- להשעות מחדש את הגלולה DNA מן הבית מיני להכנה (שלב 2.3.6) ב 20 μl של מים אלקטרופורזה ולנער ב 1,000 rpm עבור 2 h. עבור ה-DNA הכנה midi/מקס, לדלל כל מדגם לריכוז הסופי של 1.5 μg/μL ולהעביר 20 μL לצלחת אוסף 800 μL.
- הכן תמהיל הדפסה. עבור 1 96 ובכן צלחת, להכין 1 מ ל של הדפסה mix [237.5 μl של מים אלקטרופורזה; 500 μl של פולי ליזין (0.01%); 187.5 μl של BS3 (bis-sulfo cinil, 50 mg/mL ב dmso); ו-μl של נוגדן הארנב האנטי-דגל שבטיים)].
הערה: יש להוסיף את הכימיקלים בסדר שצוין כדי למנוע משקעים. - הוסף 10 μL של שילוב הדפסה לכל מדגם, חותם צלחות עם רדיד אלומיניום, ולטלטל ב RT עבור 90 דקות ב 1,000 rpm. לאחסן את הצלחות בלילה (~ 16 h) ב 4 ° c.
- ביום ההדפסה, מערבולת קצרה. ומסובבת את הצלחות העבר 28 μL של כל דוגמה ללוח 384 מערך. ניתן לבצע העברה זו באמצעות האוטומציה או הפיפטה רב-הערוצים. חשוב לעקוב אחר המיקום של דגימות בלוח 384 מערך.
- סובב את הצלחת למטה לזמן קצר כדי להסיר בועות כלשהן. . אטום את הצלחות בנייר כסף
5. הדור של מערכי הנפה: הדפסה מיקרוarray
הערה: כל תנאי ההדפסה היו ממוטבים עבור המכשיר הרשום בטבלה של ציוד וחומרים. אם נעשה שימוש במערך אחר, ייתכן שיהיה צורך במיטוב נוסף.
- . אראייר תנקה לפני תחילת, רוקן את כל הטנקים פסולת ולמלא את המאגרים עם מים באולטרסאונד או 80% אתנול, אם יש צורך. לנקות סיכות אחד על אחד עם מגבונים נטול סיבים ומים אולטרה-סאונד. מייבשים את הסיכות עם מגבונים בחינם ומניחים אותם בזהירות בחזרה לראש האראייר.
- אראייר מוגדר: מפרטי הדפסה [מספר מירבי של בולים לדיו: 1; מספר חותמות לנקודה: 1; תזמון מרובה-חותמות:--; זמן החתמת (אלפיות השנייה): 0 אלפיות השניה; זמן לכתיבה אוטומטית (אלפיות ששניה): 0 אלפיות ה90 דפסה; לאחר מכן, בצע את ה פרוטוקול עיקור: שטיפת מים אלקטרופורזה עבור 2,000 ms עם 0 ms של זמן ייבוש ו 500 ms של זמן המתנה; חזור על שלבים אלה 6x; ואחריו כביסה עם 80% אתנול עבור 2,000 ms עם 1,200 ms של זמן ייבוש, 500 ms של זמן המתנה; חזור על השלבים הבאים 6x.
- עיצוב שקופית: הגדר את הסידור בתבנית הרצויה. העיצוב צריך לקחת בחשבון מספר גורמים [i.e., את מספר העותקים המשוכפלים עבור כל מדגם, מיקום ומספר של תכונות הבקרה, פריסת מערך (בלוק אחד, כמה בלוקים זהים), מספר מערכים להדפסה, אורך של הפעלה, וכו '].
- מניחים את השקפים המצופים (שלב 3.4) על סיפון המרפסת. בדוק אם הוואקום מחזיק את כל. השקופיות במקום מאובטח הפעל את מכשיר האדים (זה צריך להיות מוגדר ב 60%).
- מניחים את הצלחת 384. על הסיפון היפה . הפעל את התוכנה
- סמן את המיקרו-מערכים. כאשר ההדפסה מתבצעת, הצב תוויות שקופיות בצד התחתון (לא מודפס) של כל שקופית. שמור על סדר ההדפסה של השקופיות על החפיסה בסדר מספרי.
- אחסן את המערכים המודפסים ב-RT בארון מתכת בתוך תיבה אטומה היטב עם מנת סיליקה. לשקופיות שנשמרו בסביבה יבשה יש חיי מדף עד שנה אחת.
- (אופציונלי): אצווה שנייה של 90 שקופיות ניתן להדפיס באמצעות אותם דגימות. כדי לעשות זאת, להסיר את הצלחת 384 מתוך הסיפון אראייר ברגע הדפסת הצלחת נעשה. החותם ואחסן את הצלחת ב -4 ° c. לאחר שהאצווה הראשונה מתבצעת לגמרי, הסירו אותן מהסיפון, הציבו מגלשות חדשות מצופות מחדש והתחילו בריצה חדשה. ודא שכל 384 הצלחת היא ב-RT עבור 30 דקות לפני השימוש בו. אם יותר מארבעה עותקים משוכפלים למדגם מודפסים בתוך אצווה של שקופיות, מומלץ לפצל את 384 לוחות היטב לתוך שני צלחות כדי להקטין את האידוי לדוגמה על ידי הפחתת כמות הזמן שהושקע על הסיפון לקשט.
הערה: בדוק את כל המאגרים לפני תחילת ההפעלה השניה.
6. זיהוי דנ א על שקופיות נאפה
- חסום את השקופיות. מקם את השקופיות בתיבת פיפטה והוסף 30 מ ל של מאגר חסימה. מודטה ב-RT עבור 1 h על שייקר נדנדה.
- . להכתים את השקופיות למחוק את הפתרון חסימה ולהוסיף 20 מ ל של מאגר חסימת ו-33 μL של ה-DNA של פלורסנט-intercalating צבע. מודקון למשך 15 דקות. עם עצבנות לאחר מכן, לשטוף במהירות את השקופיות עם מים באולטרסאונד ויבש עם לחץ אוויר. המשך בסריקה (סעיף 11).
7. ביטוי של שקופיות נאפה
- לחסום את השקופיות עם מאגר חוסם על שייקר נדנדה ב-RT עבור 1 h. השתמש בכ-30 מ ל בקופסת פיפטה עבור ארבע שקופיות.
- לשטוף שקופיות עם מים באולטרסאונד ויבש עם מסוננים אוויר דחוס. החל אטם איטום לכל שקופית עבור הוראות היצרן.
- הוסף תמהיל IVTT. כל שקופית תדרוש 150 μL של ערבול IVTT. לדלל 82.5 μL של הלה ליפוסט ב 33 μL של מים DEPC ותוספת עם 16.5 μL של חלבונים אביזר ו33 uL של ערבוב התגובה. הוסף שילוב IVTT מהקצה שאינו של התווית או הלא-דגימה. פיפטה את התערובת באיטיות (זה מקובל אם הוא מחרוזת באופן זמני בקצה מפרץ). עסה בעדינות את אטם האיטום כך שתמהיל ה-IVTT יתפשט ויכסה את כל האזור במערך. החל את חותמות היציאה העגולות הקטנות לשתי היציאות.
- הנח את השקופיות על תמיכה והעבר אותן לאינקובטור הקירור הניתן לתכנתים. מודקון עבור 90 דקות ב 30 ° צ' עבור ביטוי חלבון, ואחריו 30 דקות ב 15 ° c עבור השתק של חלבון השאילתה.
- שטוף וחסום את השקופיות. הסר את gasket איטום ולטבול שקופיות בתיבת פיפטה עם כ 30 מ ל של 1x tbst שיושלם עם 5% חלב לתצוגה חלבון (סעיף 8) או 1 x tbst שיושלם עם 3% בסרום פרה אלבומין (bsa) עבור קינאז בחני או הקרנת התרופה (סעיף 9). דגירה ב RT עם עצבנות עבור 20 דקות ולחזור על שלב זה 2x.
8. זיהוי חלבונים במערכים נאפה
- הוסף נוגדן ראשי. הסר את השקופיות מהפתרון החוסם (שלב 7.5) וייבש בעדינות את הצד האחורי (צד שאינו מודפס) באמצעות מגבת נייר. מניחים את השקופיות על תמיכה ולהחיל 600 μL של הנוגדן העיקרי (העכבר נגד הדגל) מדולל 1:200 ב 1 x TBST + 5% חלב. . מודטה בשביל 1 h ב-RT
- שטוף את השקופיות עם 1 x TBST + 5% חלב על שייקר (3x עבור 5 דקות כל אחד).
- הוסף נוגדן משני. הסר את השקופיות מפתרון הכביסה וייבש בעדינות את הצד האחורי באמצעות מגבת נייר. מניחים את השקופיות על תמיכה ולהחיל 600 μL של נוגדן משני (cy3-labbeled נגד העכבר נוגדן) מדולל 1:200 ב-1x TBST + 5% חלב. להגן על השקופיות מפני האור ו-מודטה עבור 1 h ב RT.
- שוטפים את השקופיות בעזרת TBST 1 x על שייקר (3x עבור 5 דקות כל אחד). לשטוף במהירות את השקופיות עם מים באולטרסאונד ויבש באמצעות לחץ אוויר. המשך בסריקה (סעיף 11).
9. הקרנת ההקרנה של טירולך קינאז במערכים נאפה
הערה: ניתן לעבד שקופיות מרובות באותו ניסוי, ולוודא שבכל שלב, שקופית אחת מעובדת בכל פעם ושהן אינן יבשות בין שלבים. הוסף את כל הפתרונות לקצה שאינו של התווית או אל הדגימה של השקופית.
- הכינו את כל הפתרונות המשמשים במהלך הקרנת התרופה:
- להכין את הפתרון פוספספטאז/DNase על ידי שילוב הבאים: 1x מטאלו חלבון metallo-מאגר זרחן (50 mM HEPES, 100 מ"מ הנאל, 2 מ"מ DTT, 0.01% Brij 35 ב-pH = 7.5); 1 מ"מ ממ2; 8,000 יחידות של פוספוליאז חלבון למדא; ו-2 יחידות של DNase I. הכן 400 μL של הפתרון עבור כל מיקרוarray. הוסף פוספספטאז ו DNase ממש לפני השימוש.
- . הפוך את התרופה לדילול תרופות מהוות מחדש ב DMSO לריכוז הסופי של 10 מ"מ. כדי להבטיח כי כל ריכוזי הסמים שנבדקו על המערך, ודא כי אותו נפח של DMSO (10, 000x מניות ב DMSO) נוצר עבור כל ריכוז ושמרו ב-80 ° c. בזמן השימוש, הסמים מדוללים 1:100 במים.
- הכנת פתרון סם/קינאז על ידי שילוב הבאים: מאגר 1 x קינאז (25 מ"מ Tris-HCl של pH = 7.5); 5 מ"מ-glycerophosphate ביתא; 2 מ"מ DTT; 0.1 מ"מ Na3VO4; 10 מ"מ MgCl2; 500 μM ATP; ו 2 μL של תרופה (מדולל 1:100 במים). הכינו 200 μL של הפתרון עבור כל מיקרו-מערך.
- בצע את הטיפול פוספספטאז ו DNase. הסר שקופיות מפתרון החסימה (שלב 7.5) ויבש בעדינות את הישבן באמצעות מגבת נייר. מניחים את השקופיות על תמיכה ולהחיל 200 μL של הפתרון פוספספטאז/DNase. הניחו שמיכות מיקרו-מערך כדי למנוע התאיידות. מודקון ב 30 ° צ' עבור 45 דקות בתנור.
- פוספספטאז ו DNase הטיפול II: להסיר מערכים מן התנור, למחוק את הכיסויים, להסיר את הפתרון העודף, ולהחיל 200 μL של פוספספטאז טרי ותמיסת DNase. כיסוי מיקרו מערכים עם coverslip ו-מודטה עבור אחר 45 דקות ב 30 ° c בתנור.
- שוטפים שקופיות עם 1 x TBST + 0.2 M הנאגל על שייקר (3x עבור 5 דקות כל אחד).
- בצע את הטיפול בתרופות ותגובת קינאז. הסר שקופיות מפתרון הכביסה וייבש בעדינות את הישבן באמצעות מגבת נייר. הצב את השקופיות על תמיכה והחל 200 μL של פתרון התרופה/קינאז. מניחים שמיכות על גבי כדי למנוע אידוי. מודטה עבור 1 h ב 30 ° c בתנור.
- שוטפים שקופיות עם 1 x TBST + 0.2 M הנאגל על שייקר (3x עבור 5 דקות כל אחד).
- חזור על שלבים 8.1 – 8.4 באמצעות הנוגדן העיקרי anti-phosho-Tyr הנוגדן מדולל 1:100. החליפו את החלב 1x TBST + 5% בכל השלבים באמצעות 1 x TBST + 3% BSA.
10. פרוטוקול הכלאה אוטומטי
הערה: לחלופין, ניתן להשתמש בתחנת הכלאה כדי להפוך את כל הימינליות והשטף על מערכי ה-, (סעיפים 7 – 9) והפרוטוקול מסופק כקובץ משלים 1.
11. רכישת תמונה
הערה: יש לרכוש תמונות Microarray ברזולוציה של 20 מיקרון ומעלה.
- טען מיקרו-מערכים לתוך המחסנית עם החלבונים הפונים כלפי מעלה. . תטען את המגזין לסורק המיקרו-מערך
- בחר את לייזר ירוק עם מסנן פליטת ננומטר 575/30 nm כדי לסרוק את האות מן הנוגדן cy-3 המסומנת משני הסימנים. אם משתמשים בצבעי פלואורואופפור שונים, בחרו בלייזר/הגל הנכון כדי לזהות את האות מצבע הפלורסנט.
- הגדר את השם עבור כל תמונה והמיקום שבו הם יישמרו.
- (אופציונלי): עבור כל fluorophore חדש, אופטימיזציה של תנאי סריקה מומלץ לזהות את הטווח הליניארי של עוצמת האות. לשם כך, סרוק מיקרו-מערך תוך שימוש בטווח של פוטוגרפית (PMT) והרווח עד שתמונה ברורה מתקבלת עם אות לא רווי ורקע נמוך.
- סרוק את כל המיקרו-מערכים עם ההגדרות הממוטבות וזכור להפעיל את הרווח האוטומטי.
הערה: לניתוח נתונים, יש לסרוק את כל המיקרו-מערכים באמצעות אותן הגדרות סריקה. עבור קינאז מספר באמצעות cy3 כמו fluorophore התמונות נסרקים עם 20% PMT, עוצמת לייזר של 25%, ו 10 מיקרון של רזולוציה, באמצעות הסורק המפורטים בטבלה של ציוד וחומרים.
12. עיבוד וניתוח נתונים
הערה: מספר חבילות תוכנה זמינות לקוונפיקציה של נתוני microarray עם יכולות דומות. ההליך המתואר כאן תוכנן עבור התוכנה המופיעה בטבלת הציוד והחומרים.
- טען את קובצי TIFF לכימות, עצב את הרשת כך שתתאים לפריסת המיקרו-מערך והתאם את גודל הנקודות כדי לשלב את האות כולו באזור המינימלי האפשרי. כתמים שכנים לא צריכים לחפוף. בחן באופן חזותי עד כמה התוכנה מבצעת ומתאמת את הרשת באופן ידני, במידת הצורך.
- לכמת את עוצמת האות של המיקרו-מערך. לבדוק באופן חזותי את הנקודות עבור כל סטייה (איגוד לא ספציפי, אבק, וכו ') ולהסיר אותם מניתוח הנתונים.
- תקן את הרקע באופן מקומי באמצעות האות של אזורים שכנים במערך שבו אין מקום.
- לנרמל נתונים. כדי להשוות את האות בין מערכים שונים, יש לנרמל את עוצמת האות של כל מיקרו-מערך. כדי לא לכלול החוצה, לנרמל את הנתונים באמצעות ממוצע גזוז 30% של האות מהפקד החיובי (IgG נקודות) של מיקרו מערכים deזרחטים.
הערה: האות מנקודת הigg אינה משתנה במהלך הזירחון והדרחון של המיקרו-מערכים ומתאים לנורמליזציה. - זיהוי שקיסים פעילים. עבור כל תכונה המוצגת במיקרו-מערך, חשב את היחס בין עוצמת האות המנורמלת במערכים האוטומטיים והפחת. הגדר סף של שינוי בקיפול 1.5 לזיהוי הקיסים הפעילים וסמן את כל התכונות האחרות כאין באפשרותם לעבור בתצוגה מקדימה אוטומטית (N/A).
- חישוב הפעילות של כל קינאז המזוהה בשלב 12.5 כאחוז של אות מותאם (עוצמת אות של מערך בקרה מנורמל (DMSO) המופחת על-ידי עוצמת האות של מערך הבקרה השלילי המנורמל (הפחת).
תוצאות
מיקרומערכים מורכבים בלבד מספקים פלטפורמה מוצקה שניתן להשתמש בהם עבור יישומים רבים וברורים, כולל גילוי ביואריקר, אינטראקציות חלבון חלבון, זיהוי מצע והקרנת סמים10,11 ,12,13,14,15,16,17,18,19,20.
המתודולוגיה הכללית שאומצה לחקר הפעילות של קינאז והקרנת מעכבי הטירולה במיקרו-מיקרו-מיקרומערכים מיוצגים באיור 1. ראשית, מיקרומערכים של הנפה מופקים על-ידי השתק של cDNA וסוכן לכידה על המיקרומערכים הצופים. CDNAs משמשים לאחר מכן כתבנית עבור תמלול ותרגום של חלבונים, באמצעות מערכת ה-IVTT האנושית מבוססת, ואת החלבונים החדשים מסונתז הם מקיבוע על ידי סוכן לכידת9. ניתן לנטר את איכות המיקרו-מערך המודפס על-ידי מדידת רמות ה-DNA (המאשרת הדפסה עקבית) או חלבון המוצג במערך (אישור ביטוי חלבון ולכידה; איור 1). כדי להקטין את אות הרקע ולהגדיל את הטווח הדינמי של הניסוי, המיקרו-מערכים מטופלים עם 1) למדא פוספטאז כדי להסיר זירחון מפסולת Ser/שאריות, ואז עם 2) DNase כדי לפשט את הכימיה במקום ולהקטין רקע (איור 1).
השלב הבא הוא התגובה האוטומטית הבאה, שבה מיקרו מערכים מודבטים עם מאגר קינאז בהעדר ATP (מערך בקרה שלילי, המכונה מיקרו-מערכים מדיזליים), ומאגר קינאז הינו בתוספת ATP (בקרה חיובית, המכונים מערכים הנמצאים בתצוגה מקדימה) או ב-ATP + DMSO (בקרת רכב). יש להדגיש כי במהלך שלב זה, אף קינאז לא נוספה; לפיכך, הפעילות הפנימית של כל קינאז המוצגת על המיקרו-מערך היא בכמת באמצעות מדידה של רמות זירחון שלה באמצעות הפאן נגד פוספפו-זרחן, ואחריו נוגדן משני cy3-labbeled (איור 1).
בקרת איכות של מערכי נאפה-קינאז המציגה פאנל של מעטפת חלבונים אנושיים המודפסים בקורופליקיטה מוצגת באיור 2. רמות של ה-DNA הקיבוע נמדדו על ידי כתמים DNA וזה הראה אות אפילו על פני microarray, מציע את כמות ה-DNA המודפס על המערך היה אחיד. כמו כן ניתן להתבונן במספר תכונות ללא כתמים של דנ א. תכונות אלה מתאימות לפקדים מסוימים שבהם ה-DNA הושמט מתמהיל ההדפסה [i.e., כתמים ריקים (שום דבר לא הודפס), כתמי מים, מטוהר במקום IgG (פולי ליזין, crosslinker קשר ומטוהרים IgG), מיקס הדפסה בלבד (להשלים לערבב הדפסה: פולי ליזין בתוספת הקרומקשר ואנטי הדגל נוגדן, ללא כל דנ א)]. רמות החלבון המוצגות על המיקרומערכים נאפה-קינאז העריכו לאחר תגובת ה-IVTT באמצעות נוגדן נגד תגים.
עבור ההקרנה קינאז, הדגל שימש תג הבחירה ואת רמת החלבון המוצג על מיקרוarray נמדד באמצעות נוגדן אנטי דגל. כפי שמוצג, רוב המקומות המכילים cDNA הציג בהצלחה רמות לזיהוי חלבונים. חלק מנקודות הבקרה ללא cDNA חשף גם את האות עם נוגדן נגד הדגל: הספוט IgG (משמש כדי לזהות את הפעילות של הנוגדן המשני) וכתמים וקטוריים ריק (cDNA קודי לתג רק) (איור 2). מיקרו-מערכי נאפה-קינאז הראו באמצעות שקופיות, עם התאמה של רמות התצוגה החלבונים בקרב אצוות הדפסה ברורות יותר מ-0.88 (איור 2). בתוך אותה אצווה המתאם היה אפילו גבוה יותר, קרוב 0.92 (הנתונים לא מוצגים).
בשלב הבא, הפעילות האוטומטית של קינאז בחלבונים המוצגים על המערך נמדדה באמצעות נוגדן אנטי-פוספהו-טירולי (איור 3). חלבון מוצג על המערך הראה רמות גבוהות של זרחון חלבון לאחר הביטוי (איור 3, שמאל), אשר עשוי להיגרם על ידי פעילות פנימית קינאז של החלבון המוצג על המערך או על ידי בעלי כישורים פעילים הנמצאים בתמהיל ivtt. זרחון זה הוסר לחלוטין עם הטיפול למדא פוספספטאז ומיקרומערכים אלה שימשו לקינאז. לאחר הדרחון, תגובות באופן אוטומטי בוצעו ללא ATP לא הראו רמות משמעותיות של זירחון, כצפוי, בעוד מיקרומערכים מודבטים עם מאגר קינאז בנוכחות ATP הראה זרחון חלבון מהר ככל 15 דקות ( איור 3). עבור הקרנת התרופה, הפעילות בקינאז נמדדה לאחר 60 דקות של התגובה האוטומטית להגדלת מספר הקינסים שנבדקו.
ההשוואה בין מיקרוערכים בהם נמדדו רמות הזרחון מיד לאחר ביטוי החלבון (איור 3, שמאל) ולאחר 60 דקות של תגובת היתר (איור 3, ימין) הראו: i) חלבונים הנמדדים רק לאחר הביטוי, הרומז שהם יכולים להיות זרחתית באופן שווה על-ידי חלבונים המצויים בתמהיל ה-IVTT, אך לא ניתן להציג אותם באופן אוטומטי; ii) החלבון הזורך רק לאחר התגובה האוטומטית, הרומז שהחלבונים האלה לא היו פעילים לאחר ביטוי החלבון והנדרשים הגורמים השותפים המצויים במאגר קינאז להיות פעילים; או iii) חלבון זרחני בשני המערכים, ורומז שהם היו פעילים בשתי ההגדרות (איור 3).
כדוגמה לתוצאות שהתקבלו עבור הקרנת מעכבי טירוצין קינאז על מערכי נאפה-קינאז שלושה מעכבי הקיסים עם סלקטיביות ברורה ברחבי הקינסים בחלבון שימשו: סטרוספורטין, imatinib ו-ibrutinib. עבור כל ההקרנות, המיקרו-מיקרו-מערכים של ה-מיקרוא מואבקים בריכוזים הגדלים של TKI (החל מ-100 ננומטר ל -10 uM) במהלך התגובה האוטומטית. ה-TKI הראשון שנבדק היה סטרוספורטין, מעכב פרוטאין קינאז גלובלי, שהראה על המיקרו-מערך של קינאז על המיקרוarray ברחבי העולם כמעט כל הקיסים שנבדקו11.
הבא, imatinib נבדק, מעכבי abl ו-c-Kit משמש לטיפול לוקמיה myeloסוגני כרונית וסטרומה גידולים במערכת העיכול4,5,6,7. במערכים נאפה-קינאז imatinib הראו ירידה משמעותית בפעילות Abl1 ו-BCR-Abl1 בעוד ששאר הקינסים נותרו מושפעים ברובו (איור 4A). כימות הנתונים עבור פעילות קינאז הייתה מנורמלת כנגד המערך המנוכה ומיוצגת כאחוז ממיקרו הבקרה החיובי (הרכב בלבד). נתונים עבור TNK2 (קינאז שאינם רלוונטיים), Abl1 ו-BCR-Abl1 מוצגים באיור 4B. כצפוי, imatinib הראה עיכוב סלקטיבי לעבר Abl1 ו BCR-ABl1. הנתונים עבור c-Kit לא היו חד-משמעית עקב חוסר פעילות על מערכי בקרה חיוביים.
לבסוף, ibrutinib, מעכב ה-FDA מאושר קשר קוולנטי ברוטון של טירולך קינאז (btk), נבדק. Ibrutinib משמש כיום לטיפול במספר סוגי סרטן הקשורים דם עם btk הפרוע, כולל לוקמיה לימפוציטית כרונית (CLL), לימפומה תא מנטל, ו Waldenström's קרוגלוביולינמיה21,22. איור 4C, מייצג תוצאות טיפוסיות שהתקבלו עבור הקרנת ibrutinib. פעילות קינאז של ABL1 (קינאז שאינה רלוונטית) ו-BTK (היעד הקאנוני) ו-ERBB4 (מטרה חדשה פוטנציאלית) מוצגת באיור 4D. הנתונים מצביעים על ERBB4 יכול להיות מעוכב על ידי ibrutinib בצורה מסוימת מינון. , ובתא מבוסס מספר11. מפגין את כוחה של הפלטפורמה
יחד עם זאת, הנתונים מצביעים על כך שפלטפורמת microarray-קינאז מיקרוarray עשויה לשמש להקרנה משוחדת של מעכבי TK. יתר על כן, ההקרנה מהירה וניתן להתאים אישית בקלות כדי לכלול כל וריאציה של החלבון של הריבית.
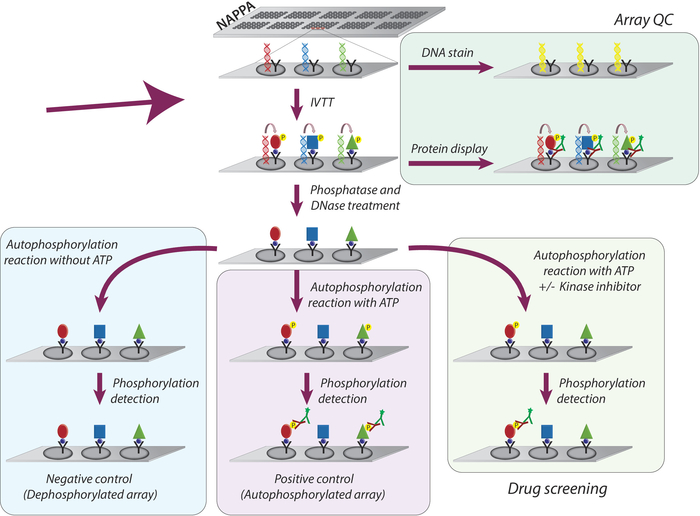
איור 1: ייצוג סכמטי של בקרת איכות והקרנת מעכבי טירולך קינאז במערכים נאפה. מערכי נאפה מודפסים בקידוד cDNA עבור חלבון הריבית התמזגו עם תגית ונוגדן לכידה. במהלך תמלול ותגובת התרגום (IVTT) החלבונים מסונתז נלכדים על משטח microarray דרך התג על ידי נוגדן לכידת. בקרת איכות (QC) של המערכים מבוצעת על ידי המדידה של רמות ה-DNA מודפס על השקופית, באמצעות הצבע ה-DNA של פלורסנט-intercalating, ואת רמות החלבון המוצג על המערך באמצעות נוגדנים ספציפיים לתגים. עבור ההקרנה קינאז, מיקרו מערכים מטופלים עם DNase ו פוספספטאז, לאחר תגובת ה-IVTT, כדי להסיר את ה-DNA המודפס ואת כל זרחון שייתכן שהתרחשו במהלך סינתזה החלבון. המערכים שאינם מוכנים כעת לשימוש עבור מסך התרופות. עבור כל אחת מהקיימות, שלושה סטים של פקדים משמשים באופן שגרתי: (I) מערכים בעלי מערכי הפחת, בהם התגובה האוטומטית מבוצעת ללא ATP; (II) המיקרו-מיקרו-מערכים, שבהם התגובה האוטומטית מבוצעת בנוכחות ATP; ו (III) DMSO מטופל מערך (כלי רכב), שבו התגובה האוטומטית מבוצעת עם ATP ו DMSO. השקופיות שטופלו בריכוז שונה של מעכבי קינאז מתבצע בדיוק באותו פרוטוקול המשמש למערכים שטופלו DMSO. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
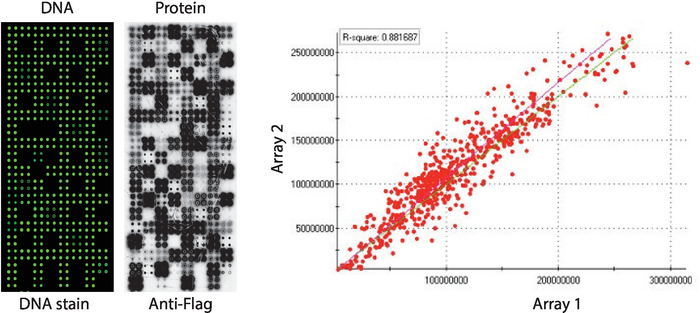
איור 2: התוצאות הייצוגיות של בקרת איכות למערכים נאפה-קינאז התאספו בעצמם. תוכן ה-DNA נמדד על ידי ה-DNA צבען-intercalating צבע (משמאל) ורמות של חלבון מוצג על microarray נמדד על ידי אנטי דגל נוגדן (באמצע) מוצגים. מצד ימין מהווה מגרש מתאם של רמות החלבון המוצגות על שני מערכי נאפה-קינאז המודפסים בקבוצות נפרדות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
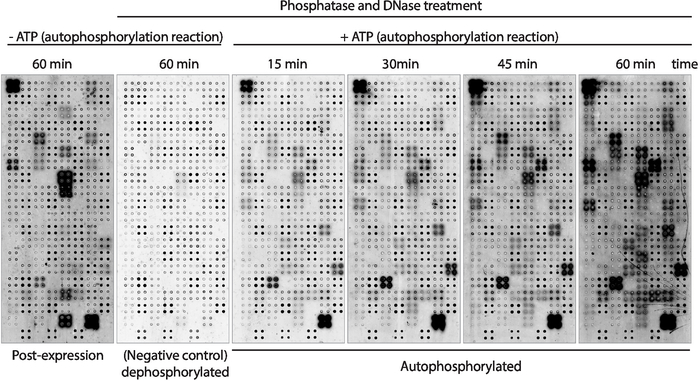
איור 3: התוצאות הייצוגיות של פעילות קינאז במערכים נאפה-קינאז. מיקרו-מערכים המציגים כקיסים חלבונים בקוורופלייצ'טה שימשו לחקר הפעילות בחלבון קינאז על המערך באמצעות המדידה של זרחון החלבון באמצעות נוגדן אנטי-pTyr, ואחריו נוגדן נגד עכבר cy3. מערכי בקרה ללא הטיפול בפוספספטאז/DNase וללא ATP במהלך התגובה האוטומטית שימשו למדידת זירחון הרקע לאחר ביטוי החלבון (לאחר ביטוי). המיקרומערכים הנותרים טופלו באמצעות פוספספטאז/דנ א, והתגובה האוטומטית בוצעה ללא ATP (microarrays מיקרו, שליטה שלילית) או ב-ATP (מיקרו-מערכים מיקרואוטומטיים). עבור המיקרו-מערכים האוטומטיים התגובה האוטומטית היתה בוצעה עבור 15 דקות, 30 דקות, 45 דקות, או 60 דקות, כפי שמוצג. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
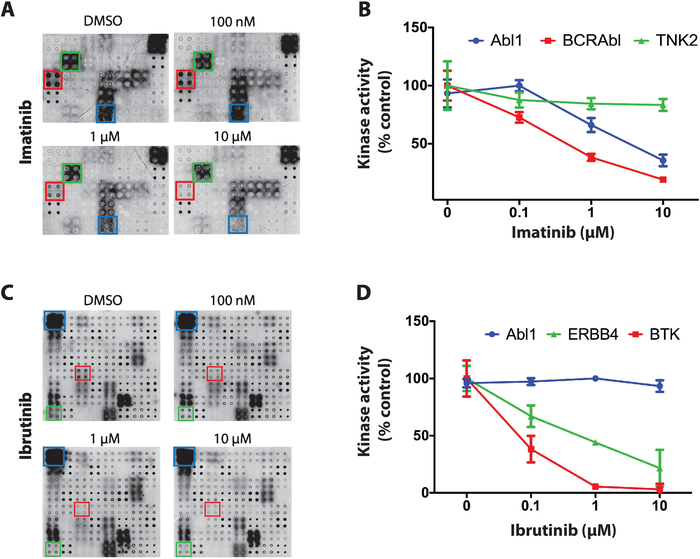
איור 4: נתונים מייצגים ממסך טירולך קינאז במערכים נאפה-קינאז. (א) פוספספטאז/DNase טיפל במערכים נאפה-קינאז הותוו בריכוזים הגדלים של imatinib במהלך התגובה האוטומטית והפעילות של קינאז הייתה מדידה עם נוגדן אנטי-פוספהו-tyr. (ב) הכמת מפעילות קינאז שנצפתה על מערכי נאפה-קינאז שנחשפו לאימאטב. הנתונים הונורממו כנגד האות של מערכי הבקרה השליליים (שאינם מצורפים) והוא מוצג כאחוז מערכי הבקרה החיוביים (התגובה האוטומטית המבוצעת בנוכחות DMSO). נתונים דומים מוצגים להקרנה של ibrutinib (C, D). דמות זו שונתה מראוף ואח '11. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
קובץ משלים 1. פרוטוקול אלטרנטיבי להקרנה של מעכבי טירולך קינאז במערכים נאפה באמצעות תחנת הכלאה אוטומטית. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
שינויים ופתרון בעיות
במהלך שלב האופטימיזציה של המחקר של הפעילות של קינאז על מערכי הנפה, אחד המקורות העיקריים של הרקע וטווח דינמי נמוך נצפתה היה BSA בשימוש בתמהיל ההדפסה. BSA סיפק את האמינים העיקריים הנחוצים ליצירת קשר עם פני השטח של עמינח והוא היה לוכדת את ה-DNA ואת נוגדן לכידת במקום. עם זאת, BSA הוא זרחתית מאוד, ומקשה על גילוי האות האוטומטית במערך מעל רעשי הרקע. כדי לפתור בעיה זו, כמה חלופות BSA בתמהיל ההדפסה נבדקו, ו פולי ליזין זוהה כתחליף טוב. ליזין פולי חסר כל אתר זירחון; לכן, הרקע ממערכים שאינם מבוטא הוא מאוד מינימלי. יתר על כן, מיקרו מערכים מודפסים עם פולי ליזין מוצגים ומציגים רמות טובות של חלבונים (איור 2).
השינוי הקריטי הבא שבוצע על-גבי התיקון הסטנדרטי של הנפה היתה תוספת של שלב הטיפול בפוספספטאז/DNase. הטיפול במיקרו מערכים עם פוספספטאז מאפשר הסרה של זירחון כלשהו שהתרחש בתמהיל ה-IVTT במהלך סינתזה החלבונים ולכידה (איור 3). המקור של זרחון זה יכול להיות מתוך פעילות פנימית בתוך התצוגה האוטומטית או מן הפעילות של החולים הקיימים בתמהיל IVTT. ההסרה של כל זירחון שלאחר הביטוי מאפשרת זיהוי קל של הקיסים הפעילים ויכולים לעבור מראש המואזלציה (איור 3).
צעדים קריטיים בפרוטוקול
נאפה היא טכנולוגיה איתנה, אך כצפוי, קיימים מספר שלבים קריטיים. הראשונה היא רכישת ה-DNA באיכות גבוהה בריכוז המתאים. שימוש ב-DNA של איכות ירודה או בריכוזים נמוכים יפיק מיקרומערכים באיכות ירודה עם מספר תכונות לא להיות מבוטא ומוצג ברמות המתאימות, הפחתת מספר החלבונים שנותחו על המערך. הצעד הקריטי השני הוא הביטוי של חלבונים במיקרו-מערך. השימוש במערכת IVTT אשר לבטא רמות גבוהות של חלבון פונקציונלי הוא חיוני עבור לימוד הפעילות של קינאז במערך.
השלב הקריטי הבא בהקרנה TKI הוא האופן שבו מטופלות המיקרו-מערכים. המיקרו-מערכים לא צריכים להתייבש במהלך כל שלב של הפרוטוקול, וטיפול עדין מומלץ למנוע שריטות שיכולות להגביר את אות הרקע. מאחר והמערכים מהניסוי כולו יושוו זה לזה, חשוב לוודא שכל צעד של הדגירה הוא אפילו בכל השקופיות. לדוגמה, יש לקחת בחשבון את הזמן הנדרש לביצוע שלב אחד במערך יחיד, כאשר קבוצה של 20 מערכים מעובדת כדי למנוע הבדלים באורך הדגירה בין מערכים.
לבסוף, עיצוב הניסוי והכללה של פקדים חיוביים ושליליים הם קריטיים עבור בקרת איכות וניתוח נתונים. הסט הראשון של פקדים הם אלה המודפסים בכל מערך וכולל פקדים שליליים [i.e., כתמים ריקים (ללא כל חומר מודפס), מים או וקטור ריק (לבטא רק את התג)], כמו גם שליטה חיובית (כלומר, igg מטוהרים, המזוהה על ידי ה נוגדן משני והוא אינרטי שינוי ברמות זירחון). באופן קולקטיבי, הם מודדים את רמות הרקע של המיקרו-מערך, הניתן לנשיאה במהלך ההדפסה ועוצמת האות של שיטת הזיהוי.
מערכת הבקרה הבאה היא שולטת בסינון התרופות וכוללות את המיקרו-מערכים הדאטיים והאוטומטיים (בנוכחות או העדר DMSO). כפי שהוזכר קודם לכן, המיקרו-מערך הפחת מודד את רמת זירחון לאחר טיפול פוספספטאז ולכן רמת הבסיס לכל הניסויים האחרים. ככל שרמת הבסיס נמוכה יותר, כך הטווח הדינמי גבוה יותר של ה-assays. המערכים האוטומטיים מציגים את רמות הזרחון המקסימליים של כל המערכים והאות צריך להיות חזק וברור. היא משמשת לניתוח נתונים, אך גם כפקד שכל התגובות בוצעו בהצלחה במערך.
מגבלות הטכניקה
נכון לעכשיו, אחת המגבלות של הקרנת התרופה המוצגת כאן היא יכולתה להקרין רק את החלבונים שניתן להציג בתצוגה מקדימה. דרך אפשרית אחת להתגבר על כך היא הדפסת קינאז והמצע המוכר באותו מקום. הדפסה משותפת של ה-DNA עבור שני חלבונים נפרדים הושגה בהצלחה15, מציע את הכדאיות של גישה זו. יתר על כן, החלבון המוצג במערך עשוי לא להיות מקופל כראוי חלבון לא פעיל. השימוש במערכת ביטויים מבוססי-אדם גרם לשיפור משמעותי בפעילות קינאז הנמדדת במערך; עם זאת, חלבונים מסוימים עדיין לא ניתן לנתח על המערך בשל חוסר הפעילות שלה.
הגבלה שנייה היא המדידה של זרחון באמצעות המחבת נגד פוספפו-זרחן-tyr. למרות חוסר הספציפיות שלה לגבי המוטיב של אתר הזירחון, כל ההדנידות שנמדדו התרחשו על שאריות טירוזינים, והשאירו מאחור סרביני וטראונינים והקינסים בהתאמה. עד כה נבדקו ללא הצלחה, למרות ניסיונות מסוימים לייעל את תנאי הדגירה והכביסה. מערכת איתור חדשה שאינה תלויה בנוגדנים עשויה להיות האופציה הטובה ביותר להרחבת מספר הקינסים של חלבונים שניתן לוקרן לצורך עיכוב בסמים. בהקשר זה, מספר אפשרויות זמינות כולל רדיואקטיביות או גישות כימיות כגון בניינים לחץ. סדרה של מיטוב נדרשים כדי למזער את אות הרקע ולספק טווח דינמי טוב עבור assays ספר.
המגבלה השלישית היא רכישת שיבוטים cDNA כדי להיות מודפס על המערך. שיבוטים cDNA ניתן ליצור באמצעות כל טכניקת שיבוט כולל מערכות משולבות ספציפי לאתר, כגון הבורא או שער23. אפשרות נוספת היא לרכוש את המשובטים מספריית DNAsu, שנמצאו ב-< https:/Psu.olnoda/sas.lssatupfi//b >, שם יותר מ-17,000 cDNAs שיבוטים, כולל kinome האנושי כולו, זמין לשמש לבניית מערכים נאפה24 .
המגבלה הרביעית היא שלא כל מעבדה מצוידת בציוד מתאים כדי להמציא ולהקרין את מערכי ה-נאפה שלהם. פרוטוקול זה מספק שיטות חלופיות ליצירת ה-DNA שיודפס על המיקרו-מערך, ללא צורך בציוד של תפוקה גבוהה ופרוטוקולים לביצוע ידני של כל צעדי הכלאה. עם זאת, עדיין יש צורך בגישה לסורק מוכן ומערך מיקרו. אפשרות אחת להתגבר על בעיה זו היא להשתמש בשירות הליבה של נאפה ובמתקן, שנמצא ב-< http:/uparapaatsnleminnear.p\>, המפיץ מיקרומיקרו מותאם אישית במחיר ללא כוונת רווח. לבסוף, כמו כל מתודולוגיה להקרנה, הנתונים המתקבלים על המערכים רגישים להיות חפצי אמנות (חיובי או שלילי) ולכן יש לאמת באמצעות אורתוגונאליות.
משמעות ביחס לשיטות קיימות
מספר פלטפורמות זמינים מסחרית להקרנה של החלבון. גישה אחת המשמשת באופן שגרתי היא מחייבת מחייב, אשר ניתן לבצע עם שברי חלבונים, מתחם קינאז, שברי חלבונים גדולים יותר עם הדומיין קינאז וכמה אזורי רגולציה, ואפילו חלבונים באורך מלא. החלבונים מבוטאים בדרך כלל במערכות חיידקיים בשל העלות והפשטות של הביטוי ופרוטוקולי הטיהור. האינטראקציה בין הסם של הריבית לבין החלבון נמדד לאחר מכן עם סוג כלשהו של שיטת דו ח כמו זריחה או נוכחות של תגים, למשל. המגבלה העיקרית של קבוצה זו של גישות היא העובדה כי החלבון הוא לא בהכרח פעיל במהלך האינטראקציה עם התרופה, אשר עשוי לגרום לזיהוי של האינטראקציות חיוביות שווא שווא מוטעה. שברי החלבון פגיעים במיוחד לשינויים במבנה ובחוסר הפעילות וכל הנתונים המתקבלים צריכים להיות מאומתים באמצעות חלבונים פעילים, רצוי בצורתם המלאה. מגבלה נוספת של חלק מהפלטפורמות היא היכולת להקרין רק את ה-ATP האנלוגית, ולהגביל את השימוש הכולל בו.
רוב השירותים הזמינים מסחרית עבור הקרנת TKIs באמצעות גישות מבוססות אנזימטית לנצל רק גרסאות סוג פראי של קינאז של עניין, ולפעמים רק מוטציות מסוימות שנבחרו. בידיעה כי התנגדות לסמים היא נפוצה מאוד בחולים שטופלו TKI, חשוב להיות מסוגל למדוד את תגובת הסמים במוטציות שונים, עבור הבחירה של המעכב המתאים ביותר. בשל טבעו של נאפה, הקרנת מוטציות קינאז פשוטה וניתנת לביצוע בקלות, והכלי הנדרש היחיד הוא שילוב המוטציה של קינאז באוסף ה-"נאפה cDNA", שניתן לבצע על-ידי מוטזיס ספציפי לאתר, למשל.
יישומים עתידיים
אחת הצורות הנפוצות ביותר של טיפול שחלוף בטיפול בסרטן באמצעות מעכבי קינאז היא רכישת מוטציות ביעד התרופה במהלך קורס הטיפול. הקרנת מוטציות אלה לגבי התגובה שלהם מעכבי קינאז היא בעלת חשיבות חיונית לבחירת הדור השני/השלישי של TKIs כדי להשיג טיפול מותאם אישית עבור כל מטופל. הגישה הקרנת התרופה המוצגת כאן, מספק פלטפורמת הקרנה משוחדת שבה כל מעכב טירולך קינאז ניתן לבחון נגד פאנל של טירולי kinases בנוכחות הגנום האנושי. מאחר שהחלבונים המוצגים על מערכי הנפה מבוטאים בתוך מבחנה מחוץ ל-cDNA המודפס על השקופית, כל משתנה מוטציה יכול להיות משולב בקלות באוסף cDNA כדי להיות מוצג על המערך. המתקן בו ניתן ליצור מוטציות קינאז ולהתבטא במערך, בשילוב עם כוח התפוקה הגבוהה של טכניקת ה-נאפה, מספק סביבה ייחודית לחקר מוטציות קינאז ותגובתם לסמים, מה שהופך את המלון למתאים ל הקרנת תרופות אישית, אחת המטרות של רפואה מדויקת.
Disclosures
המחברים אינם מצהירים על ניגודי אינטרסים.
Acknowledgements
המחברים רוצים להודות לכולם במעבדת הLaBaer על עזרתם וביקורתם במהלך התפתחות הפרויקט. פרויקט זה נתמך על ידי המענק NIH U01CA117374, U01AI077883 ו-וירג ג ' פייפר קרן.
Materials
| Name | Company | Catalog Number | Comments |
| Reagent/Material | |||
| 364 well plates (for arraying) | Genetix | x7020 | |
| 800 µL 96-well collection plate | Abgene | AB-0859 | |
| 96-pin device | Boekel | 140500 | |
| Acetic Acid | Millipore-Sigma | 1.00066 | |
| Acetone 99.9% | Millipore Sigma | 650501 | |
| Aluminum seal for 96 well plates | VWR | 76004-236 | |
| Aminosilane (3-aminopropyltriethoxysilane) | Pierce | 80370 | |
| ANTI-FLAG M2 antibody produced in mouse | Millipore Sigma | F3165 | |
| Anti-Flag rabbit Antibody (polyclonal) | Millipore Sigma | F7425 | |
| ATP 10 mM | Cell Signaling | 9804S | |
| β-Glycerophosphate disodium salt hydrate | Millipore-Sigma | G9422 | |
| bacteriological agar | VWR | 97064-336 | |
| Blocking Buffer | ThermoFisher/Pierce | 37535 | |
| Brij 35 | ThermoFisher/Pierce | BP345-500 | |
| BS3 (bis-sulfosuccinimidyl) | ThermoFisher/Pierce | 21580 | |
| BSA (bovine serum albumin) | Millipore Sigma | A2153 | |
| Coverslip 24 x 60 mm | VWR | 48393-106 | |
| Cy3 AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-165-150 | |
| DeepWell Block, case of 50 | ThermoFisher/AbGene | AB-0661 | |
| DEPC water | Ambion | 9906 | |
| DMSO (Dimethyl Sulfoxide) | Millipore-Sigma | D8418 | |
| DNA-intercalating dye | Invitrogen | P11495 | |
| DNase I | Millipore-Sigma | AMPD1-1KT | |
| DTT | Millipore-Sigma | 43816 | |
| EDTA | Millipore-Sigma | EDS | |
| Ethanol 200 proof | Millipore-Sigma | E7023 | |
| Filter plates | Millipore-Sigma | WHA77002804 | |
| Gas Permeable Seals, box of 50 | ThermoFisher/AbGene | AB-0718 | |
| Glass box | Wheaton | 900201 | |
| Glass slides | VWR | 48300-047 | |
| Glycerol | Millipore-Sigma | G5516 | |
| HCl (Hydrochloric acid) | Millipore-Sigma | H1758 | |
| HEPES Buffer Solution | Millipore-Sigma | 83264 | |
| Human-based IVTT system | Thermo Scientific | 88882 | |
| ImmunoPure Mouse IgG whole molecule | ThermoFisher/Pierce | 31202 | |
| Isopropanol | Millipore-Sigma | I9516 | |
| KCl (Potassium chloride) | Millipore-Sigma | P9333 | |
| KH2PO4(Potassium phosphate monobasic) | Millipore-Sigma | P5655 | |
| Kinase buffer | Cell Signaling | 9802 | |
| KOAc (Potassium acetate) | Millipore-Sigma | P1190 | |
| Lambda Protein Phosphatase | new england biolabs | P0753 | |
| Lifterslips, 24 x 60 mm | ThermoFisher Scientific | 25X60I24789001LS | |
| Metal 30-slide rack with no handles | Wheaton | 900234 | |
| MgCL2 (Magnesium chloride) | Millipore-Sigma | M8266 | |
| Na3VO4 (Sodium orthovanadate) | Millipore-Sigma | S6508 | |
| NaCl (Sodium Chloride) | Millipore-Sigma | S3014 | |
| NaOAc (Sodium acetate) | Millipore-Sigma | S2889 | |
| NaOH (Sodium hydroxide) | Millipore-Sigma | S8045 | |
| NucleoBond Xtra Midi / Maxi | Macherey-Nagel | 740410.10 / 740414.10 | |
| Nucleoprep Anion II | Macherey Nagel | 740503.1 | |
| Phosphoric Acid | Millipore-Sigma | 79617 | |
| Poly-L-Lysine Solution (0.01%) | Millipore-Sigma | A-005-C | |
| Protein Phosphatase (Lambda) | New England Biolabs | P0753 | |
| RNAse | Invitrogen | 12091021 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | L6026 | |
| SDS (Sodium dodecyl sulfate) | Millipore-Sigma | 05030 | |
| Sealing gasket | Grace Bio-Labs, Inc | 44904 | |
| Silica packets | VWR | 100489-246 | |
| Single well plate | ThermoFisher/Nalge Nunc | 242811 | |
| Sodium acetate (3M, pH 5.5) | Millipore-Sigma | 71196 | |
| TB media (Terrific Broth) | Millipore-Sigma | T0918 | |
| Tris | IBI scientific | IB70144 | |
| Triton X-100 | Millipore-Sigma | T8787 | |
| Tryptone | Millipore-Sigma | T7293 | |
| Tween 20 | Millipore-Sigma | P9416 | |
| Yeast Extract | Millipore-Sigma | Y1625 | |
| Name | Company | Catalog number | Comments |
| Equipments | Maker/model | ||
| Programmable chilling incubator | Torrey Pines IN30 Incubator with Cooling | ||
| Shaker for bacterial growth | ATR Multitron shaker | ||
| Vacuum manifold with liquid waste trap | MultiScreenVacuum Manifold 96 well | ||
| 96 well autopippetor/liquid handler | Genmate or Biomek FX | ||
| Liquid dispenser | Wellmate | ||
| DNA microarrayer | Genetix QArray2 | ||
| Automatic hybridization station | Tecan HS4800 Pro Hybridization Station | ||
| Microarray scanner | Tecan PowerScanner | ||
| Microarray data quantification | Tecan Array-ProAnalyzer 6.3 |
References
- Melnikova, I., Golden, J. Targeting protein kinases. Nature Review Drug Discovery. 3 (12), 993-994 (2004).
- Patterson, H., Nibbs, R., McInnes, I., Siebert, S. Protein kinase inhibitors in the treatment of inflammatory and autoimmune diseases. Clinical and Experimental Immunology. 176 (1), 1-10 (2014).
- Wu, P., Nielsen, T. E., Clausen, M. H. FDA-approved small-molecule kinase inhibitors. Trends Pharmacological Sciencies. 36 (7), 422-439 (2015).
- Druker, B. J., et al. Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells. Nature Medicine. 2 (5), 561-566 (1996).
- Heinrich, M. C., et al. Inhibition of c-kit receptor tyrosine kinase activity by STI 571, a selective tyrosine kinase inhibitor. Blood. 96 (3), 925-932 (2000).
- Stagno, F., et al. Imatinib mesylate in chronic myeloid leukemia: frontline treatment and long-term outcomes. Expert Review Anticancer Therapy. 16 (3), 273-278 (2016).
- Ben Ami, E., Demetri, G. D. A safety evaluation of imatinib mesylate in the treatment of gastrointestinal stromal tumor. Expert Opinions in Drug Safety. 15 (4), 571-578 (2016).
- Ramachandran, N., et al. Self-assembling protein microarrays. Science. 305 (5680), 86-90 (2004).
- Festa, F., et al. Robust microarray production of freshly expressed proteins in a human milieu. Proteomics Clinical Applications. 7 (5-6), 372-377 (2013).
- Yazaki, J., et al. Mapping transcription factor interactome networks using HaloTag protein arrays. Proceedings of the National Academy of Sciences of the United States of America. 113 (29), E4238-E4247 (2016).
- Rauf, F., et al. Ibrutinib inhibition of ERBB4 reduces cell growth in a WNT5A-dependent manner. Oncogene. 37 (17), 2237-2250 (2018).
- Anderson, K. S., et al. Protein microarray signature of autoantibody biomarkers for the early detection of breast cancer. Journal of Proteome Research. 10 (1), 85-96 (2011).
- Wang, J., et al. Plasma Autoantibodies Associated with Basal-like Breast Cancers. Cancer Epidemiol Biomarkers Prevention. 24 (9), 1332-1340 (2015).
- Bian, X., et al. Tracking the Antibody Immunome in Type 1 Diabetes Using Protein Arrays. Journal of Proteome Research. 16 (1), 195-203 (2017).
- Song, L., et al. Identification of Antibody Targets for Tuberculosis Serology using High-Density Nucleic Acid Programmable Protein Arrays. Molecular and Cellular Proteomics. 16 (4 suppl 1), S277-S289 (2017).
- Wang, J., et al. Comparative Study of Autoantibody Responses between Lung Adenocarcinoma and Benign Pulmonary Nodules. Journal of Thoracic Oncology. 11 (3), 334-345 (2016).
- Montor, W. R., et al. Genome-wide study of Pseudomonas aeruginosa outer membrane protein immunogenicity using self-assembling protein microarrays. Infection and Immunity. 77 (11), 4877-4886 (2009).
- Tang, Y., Qiu, J., Machner, M., LaBaer, J. Discovering Protein-Protein Interactions Using Nucleic Acid Programmable Protein Arrays. Current Protocols in Cell Biology. 74, 11-15 (2017).
- Yu, X., et al. Copper-catalyzed azide-alkyne cycloaddition (click chemistry)-based detection of global pathogen-host AMPylation on self-assembled human protein microarrays. Molecular and Cellular Proteomics. 13 (11), 3164-3176 (2014).
- Anderson, K. S., et al. Autoantibody signature for the serologic detection of ovarian cancer. Journal of Proteome Research. 14 (1), 578-586 (2015).
- Woyach, J. A., Johnson, A. J., Byrd, J. C. The B-cell receptor signaling pathway as a therapeutic target in CLL. Blood. 120 (6), 1175-1184 (2012).
- Smith, M. R. Ibrutinib in B lymphoid malignancies. Expert Opinion on Pharmacotherapy. 16 (12), 1879-1887 (2015).
- Festa, F., Steel, J., Bian, X., Labaer, J. High-throughput cloning and expression library creation for functional proteomics. Proteomics. 13 (9), 1381-1399 (2013).
- Seiler, C. Y., et al. DNASU plasmid and PSI:Biology-Materials repositories: resources to accelerate biological research. Nucleic Acids Research. 42, D1253-D1260 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved