A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تطبيق الضوضاء العشوائية لتقييم حساسية الخلايا العصبية النواة الدهليزية الوسيطة في المختبر
In This Article
Summary
التحفيز الدهليزي الكلفاني في البشر يعرض تحسينات في وظيفة دهليزية. ومع ذلك، فمن غير المعروف كيف تحدث هذه التأثيرات. هنا، ونحن نصف كيفية تطبيق الضوضاء الكهربائية الجيوب الأنفية والعشوائية وتقييم السعة التحفيزية المناسبة في الخلايا العصبية الأساسية الأساسية الأساسية في الماوس C57BL/6.
Abstract
وقد ثبت التحفيز الدهليزي الكلفاني (GVS) لتحسين مقاييس التوازن في الأفراد الذين يعانون من التوازن أو العاهات الدهليزية. ويُقترح أن يعزى ذلك إلى ظاهرة الرنين العشوائي (SR)، التي تُعرَّف بأنها تطبيق حافز منخفض المستوى/دون عتبة على نظام غير خطي لزيادة الكشف عن الإشارات الأضعف. ومع ذلك، لا يزال من غير المعروف كيف يظهر SR آثاره الإيجابية على التوازن البشري. هذا هو واحد من المظاهرات الأولى لآثار الضوضاء الجيوب الأنفية والعشوائية على الخلايا العصبية الفردية. باستخدام كامل الخلية التصحيح المشبك الفيزيولوجيا الكهربائية، يمكن تطبيق الضوضاء الزعنفة والعشوائية مباشرة على الخلايا العصبية الفردية في النواة الدهليزية الوسيطة (MVN) من الفئران C57BL/6. هنا نبين كيفية تحديد عتبة الخلايا العصبية MVN من أجل ضمان المحفزات الزفية والعشوائية هي عتبة فرعية ومن هذا، تحديد الآثار التي كل نوع من الضوضاء على كسب الخلايا العصبية MVN. نبين أن الضوضاء السينوسية والعشوائية تحت العتبة يمكن أن تعدل حساسية الخلايا العصبية الفردية في MVN دون التأثير على معدلات إطلاق النار القاعدية.
Introduction
يتحكم النظام الدهليزي (أو التوازن) في إحساسنا بالتوازن من خلال دمج المعلومات السمعية، والحسية، والحسية الجسدية والبصرية. وقد ثبت أن تدهور النظام الدهليزي يحدث كدالة للعمر ويمكنأن يؤدي إلى عجز في التوازن 1،2. ومع ذلك، فإن العلاجات التي تستهدف أداء النظام الدهليزي نادرة.
وقد ثبت التحفيز الدهليزي الكلفاني (GVS) لتحسين مقاييس التوازن، والأداء اللاإرادي وغيرها من الطرائق الحسية داخل البشر3،4،5،6. ويقال أن هذه التحسينات تعود إلى ظاهرة الرنين العشوائي (SR)، وهي الزيادة في الكشف عن إشارات أضعف في الأنظمة غير الخطية عن طريق تطبيق الضوضاء تحت العتبة7،8. وقد أظهرت هذه الدراساتتحسينات في ثابت 9،10 ودينامية11،12 التوازن، واختبارات الإخراج الدهليزيمثل لفة عداد العين (OCR)13. ومع ذلك، استخدمت العديد من هذه الدراسات مجموعات مختلفة من المعلمات التحفيز مثل الضوضاء البيضاء9، الضوضاء الملونة13، نطاقات تردد التحفيز المختلفة وتقنيات العتبات. ولذلك، فإن بارامترات التحفيز المثلى لا تزال غير معروفة ويمكن أن يساعد هذا البروتوكول في تحديد البارامترات الأكثر فعالية. وإلى جانب معايير التحفيز، فإن نوع التحفيز مهم أيضاً في الفعالية العلاجية والتجريبية. تم تنفيذ العمل أعلاه في البشر باستخدام محفزات الضوضاء الكهربائية، في حين أن الكثير من العمل الحيواني في الجسم الحي قد استخدمت الميكانيكية14،15 أو البصريات16 محفزات الضوضاء. سيستخدم هذا البروتوكول الضوضاء الكهربائية لفحص الآثار على النوى الدهليزية.
في السابق، تم تنفيذ تطبيق GVS لتحفيز afferents الدهليزية الأولية في الجسم الحي في الخنازير السنجاب17، chinchillas18، أجنة الدجاج15 والخنازير غينيا14. ومع ذلك، درست اثنتان فقط من هذه الدراسات تأثير GVS على كسب afferents الدهليزية الأولية14،15. وقد أجريت هذه التجارب في الجسم الحي مما يعني أنه لا يمكن تحديد الأنماط الدقيقة للتحفيز المفروضة على النوى الدهليزية. على حد علمنا، وقد طبقت دراسة واحدة فقط الضوضاء العشوائية على الخلايا العصبية الفردية الأنزيمية المنفصلة في الجهاز العصبي المركزي19. ومع ذلك، لم يتم إجراء أي تجارب في النوى الدهليزية المركزية لتقييم المعلمات التحفيزية المناسبة وتقنيات العتبات، مما يجعل هذا البروتوكول أكثر دقة في تحديد آثار التحفيز على الخلايا العصبية الفردية داخل الدهليزية النوي.
هنا، ونحن نصف كيفية تطبيق الضوضاء الزعنفة والعشوائية (الكهربائية) مباشرة على الخلايا العصبية الفردية في النواة الدهليزية الوسيطة (MVN)، وتحديد عتبة الخلايا العصبية وقياس التغيرات في كسب / حساسية.
Access restricted. Please log in or start a trial to view this content.
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية الموصوفة من قبل لجنة أخلاقيات الحيوان في جامعة سيدني (رقم البروتوكول المعتمد: 2018/1308).
1- الحيوانات
ملاحظة: تم الحصول على الفئران من المركز الأسترالي للقوارض (ARC; بيرث، أستراليا) وعقد في بناء المؤسسة الطبية مرفق الحيوان في جامعة سيدني.
- الحفاظ على الفئران على دورة طبيعية 12 ساعة ضوء / الظلام مع الإثراء البيئي.
- استخدم الفئران C57BL/6 من الذكور والإناث (3-5 أسابيع) لجميع التجارب.
2. إعداد الحلول
- إعداد 1 لتر من السائل الدماغي الشوكي الاصطناعي (ACSF) يتكون من29 M NaHCO 3، 11 Mالجلوكوز، 120 مل كلونس، 3.3 مليون متر كلك، 1.4 مليون متر شمال شرق 2بو4،2.2 مليون متر مكل2،2.77 م م ككل2.
- إعداد 200 مل من السكروز-ACSF (sACSF) التي تحتوي على 29 مل NaHCO3،11 مل الجلوكوز، 241.5 مليون متر السكروز، 3.3 مليون متر قدم مربع، 1.4مليون متر شمال شرق الولايات المتحدة2PO4،2.2 مليون متر مغكل2،2.77 م م. قبل إدراج CaCl2 إلى ACSF وsACSF، الغاز الحلول مع كاربوجين (95٪ O2 و 5٪ CO2)لإنشاء رقم الهيدروجيني من 7.4 وتجنب هطول الأمطار الكالسيوم (غائم).
- إعداد K+القائم على حل داخل الخلايا يتكون من غلوكونات البوتاسيوم 70 M، 70 مل ككل، 2 مليون متر كلوريد لكل، 10 م هيبس، 4 MM EGTA، 4 m M ملغ2-ATP، 0.3 mM Na3-GTP؛ مع رقم الهيدروجيني النهائي من 7.3 (تعديل باستخدام KOH).
ملاحظة: من المستحسن تصفية الحلول داخل الخلايا مع مرشحات 0.22 ميكرومتر وتخزين aliquots 0.5 مل من الحل في -20 درجة مئوية.
3. إعداد جذع الدماغ
- قبل استخراج جذع الدماغ، معادلة sACSF مع كاربوجين وبارد في -80 درجة مئوية لمدة 25 دقيقة بحيث يتم تشكيل الطين الجليد.
- التخدير الماوس مع isoflurane (3-5 %) المشبعة في الأكسجين (3 مل / دقيقة). مرة واحدة ردود الفعل مخلب الخلفية غائبة، وقطع رأس الماوس مع مقص حاد الفولاذ المقاوم للصدأ.
- كشف الجمجمة عن طريق إجراء شق المترهل في الجلد باستخدام شفرة الحلاقة (#22 تقريب).
- باستخدام نهاية مدببة من زوج من مقص نمط القياسية جعل شق صغير في لامدا وقطع على طول الشق الطولي.
- تعكس بعناية بعيدا العظام الجدارية المقترنة والعظام القذالي باستخدام زوج من الضحلة بينة بيرسون rongeurs.
ملاحظة: خلال هذا الإجراء كله يتم الاستحمام باستمرار الدماغ في الموقع باستخدام الطين sACSF الجليد الباردة التي أعدت سابقا. - عزل جذع الدماغ من الدماغ الأمامي وغلافه العظمي باستخدام شفرة حلاقة (#11 مستقيمة) لخفض sulcus باريتو-occipital وفي النخاع الصدغي.
- قم بتركيب نهاية البطينية المنعزلة على كتلة البوليستيرين شبه المنحرفة التي كانت مقطوعة من قبل. إزالة السوائل الزائدة حول الأنسجة تشريح مع الفتيل من ورقة الأنسجة لضمان التصاق الأنسجة جيدة إلى مرحلة القطع.
ملاحظة: يتم قطع كتلة البوليسترين في شكل شبه منحرف، لضمان نهاية rostral من يناسب منتصف الدماغ والصنابير في الحبل الشوكي. - استخدام الغراء سيانواكريلات لإصلاح كتلة البوليسترين مع نهاية rostral جذع الدماغ المرفقة وصولا الى مرحلة القطع.
- باستخدام سرعة متقدمة من 0.16 مم / ثانية واتساع الاهتزاز من 3.00 مم، وإعداد 200 درجة مئوية شرائح عرضية من MVN.
ملاحظة: يتم تحديد موقع MVN باستخدام أطلس الدماغ الماوس Paxinos وفرانكلين (الأشكال 79-89)20. ال [مفن] (يعدّد بما أنّ [مف] في أطلس) يكذب فورا [فنتريولتر] إلى ال[4] [ث] بطين وكبيرة حق قبل التعلق من المخيخ (بين ال [كلّيكولي] سفليّة وال [أوبكس]). - استخدم ماصة مكسوة بالبلاستيك لنقل الشرائح على قرص ورق مرشح يجلس في ACSF كاربوجينات في 25 درجة مئوية لمدة 30 دقيقة على الأقل قبل التسجيل.
4- الصكوك
- استخدام الإعداد الكهربائي الفسيولوجي القياسية لتنفيذ كامل الخلية التصحيح تقنيات المشبك21.
- إعداد micropipettes باستخدام بروتوكول من خطوتين (الخطوة الحرارية 1: 70؛ الخطوة الحرارية 2: 45) على بكرة micropipette (انظر جدولالمواد). يجب أن يكون Micropipettes مقاومة نهائية تتراوح بين 3-5 MΩ مع الحل الداخلي عند وضعها في الحمام.
ملاحظة: قد تختلف الإعدادات المستخدمة حسب درجة الحرارة داخل الغرفة ويمكن أن تتغير بشكل متكرر.
5. كامل الخلية التصحيح المشبك الفيزيولوجيا الكهربائية
- للحصول على كامل الخلية التصحيح المشبك التسجيلات من الخلايا العصبية الفردية في MVN، يتم استخدام K+القائم على الحل الداخلي داخل ماصة التسجيل.
- نقل شريحة نسيج واحد من غرفة الحضانة إلى غرفة التسجيل وتأمين شريحة باستخدام خيط النايلون على وزن على شكل حرف U. يتغلغل باستمرار غرفة التسجيل مع كاربوجينات-ACSF في 25 درجة مئوية بمعدل تدفق 3 مل / دقيقة.
- بعد ملء micropipette مع الحل الداخلي، حدد موقع MVN باستخدام عدسة موضوعية منخفضة الطاقة (10X). باستخدام هدف عالي الطاقة (40x)، يمكن تحديد موقع الخلايا العصبية الفردية داخل MVN.
ملاحظة: جودة الخلية ضرورية في ضمان جودة التسجيلات ومتانة الخلية عند محاولة تحقيق تكوين الخلية بأكملها. سوف تظهر الخلية الجيدة شكل كروي، غشاء خلية عاكسون ونواة غير مرئية. الخلية السيئة سيكون لها نواة مرئية كبيرة (مثل البيض) ومظهر منتفخ / تقلص. - قبل اختراق الأنسجة مع ماصة، وتطبيق كمية صغيرة من الضغط الإيجابي لدفع الحطام بعيدا عن طرف ماصة.
- نقل الماصة باستخدام micromanipulator نحو الخلايا العصبية المختارة وديمبل الصغيرة يجب أن تشكل على الغشاء العصبي. الإفراج عن الضغط الإيجابي وتطبيق كمية صغيرة من الضغط السلبي.
- بمجرد تحقيق ختم GΩ 1، وتطبيق لطيف ضغط إيجابي قصير وحاد على حامل ماصة من خلال منفذ الشفط لتمزق الغشاء وخلق تكوين خلية كاملة.
- جعل كامل الخلية التسجيلات المشبك الحالي باستخدام التقنيات القياسية21،22.
6. تطبيق الضوضاء الالجيبية والعشوائية على الخلايا العصبية الفدية الفدية الفردية
- تطبيق الضوضاء العشوائية والجيوب الأنفية في مجموعة من السعة من 3 إلى 24 درجة اما pA لتحديد عتبة الخلايا العصبية ومعدل إطلاق النار.
- تحديد العتبة الحسية عن طريق تجميع كثافات التحفيز ية المنخفضة والأعلى وإجراء ANOVA لمراقبة أي اختلافات (كما هو مبين في الشكل التكميلي1).
- حساب متوسط معدل إطلاق النار على مدى فترة 10 ثوان حيث تم / سيتم حقن الخطوة الحالية إزالة الاستقطاب لكل مستوى الحالي الفردية (أي، 7 الحلقات الإجمالية؛ الشكل1).
- استخدم قيم معدل الإطلاق المتوسط لإنشاء معدل إطلاق مقابل الرسم الحالي وإجراء تحليل انحدار خطي لتحديد تدرج خط الملاءمة الأنسب. التدرج من خط من تناسب أفضل يدل على كسب الخلايا العصبية22.
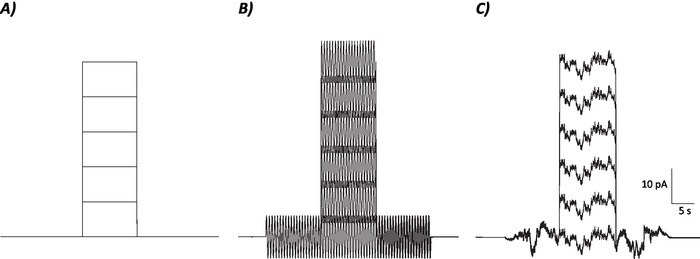
الشكل 1: الملامح التخطيطية للتحكم وبروتوكولات الضوضاء العشوائية والجيوب الأنفية. (أ) بروتوكولات التحكم (بدون ضوضاء) المطبقة على الخلايا العصبية MVN. (B) بروتوكول الضوضاء السينوسية مع تردد 2 هرتز (C)بروتوكولات الضوضاء العشوائية حيث غالبية الطيف الطاقة ≤ 2 هرتز. كل بروتوكول المعروضة هنا لديه سعة ± 6 pA مع 10 ق إلغاء الاستقطاب الحالي زيادة بنسبة 10 pA تصل إلى 50 pA. التحفيز الحقيقي ليس لديه خطوة الحالية إزالة الاستقطاب، وبالتالي هي الحلقة الأولى من هذه البروتوكولات لتحديد التغييرات مكاسب الخلايا العصبية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
النتائج
التسجيلات الأولية يمكن أن توفر معلومات عن الآثار التي الضوضاء الزفية والعشوائية لها على معدلات إطلاق القاعدية من الخلايا العصبية MVN الفردية وكيف تؤثر المحفزات على كسب الخلايا العصبية. ويبين الشكل 2 أنه لا الضجيج السينوسي ولا العشوائي يغير معدلات إطلاق الخلايا ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
وقد تم تسليط الضوء على آثار التحفيز الدهليزي الكلفاني (GVS) على النظام الدهليزي في الجسم الحي في البشر3،13،23، خنازير غينيا14، القوارض18 والرئيسيات غير البشرية24. ومع ذلك، لم يتم تقييم أي من هذه الدراسات ا...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
وحظيت هذه الدراسة بدعم من جامعة سيدني للدراسات العليا في مجال الدراسات العليا.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
References
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved