A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בקשת הרעש סטוכסטי להערכת המין המדיאלי שיווי מערכת הרגישות לנוירונים בחוץ
In This Article
Summary
גירוי בפרוזדור הגלווני בבני אדם מציג שיפורים בתפקוד השייווי. עם זאת, לא ידוע כיצד מתרחשות תופעות אלה. כאן, אנו מתארים כיצד להחיל רעש חשמלי sinusoidal וסטוכסטי ולהעריך הגברה גירוי מתאים המוני בתוך הC57BL האמצעי המדילי בפרוזדור הבין-שיווי של הנוירונים בתוך העכבר.
Abstract
גירוי בפרוזדור הגלווני (GVS) הוכח לשפר את צעדי האיזון אצל אנשים עם איזון או ליקויי שיווי משקל. זה מוצע בגלל תופעת התהודה הסטוכסטית (SR), המוגדרת כיישום של גירוי ברמה נמוכה/תת-הסף למערכת לא-לינארית כדי להגביר את הזיהוי של אותות חלשים. עם זאת, עדיין לא ידוע כיצד SR מציג את ההשפעות החיוביות שלו על איזון האדם. זוהי אחת ההפגנות הראשונות של ההשפעות של רעש sinusoidal וסטוכסטי על נוירונים בודדים. שימוש בתאים כולו מהדק התיקון האלקטרופיזיולוגיה, sinusoidal והרעש סטוכסטי ניתן להחיל ישירות על נוירונים בודדים בגרעין הפרוזדור המדיאלי (MVN) של C57BL/6 עכברים. כאן אנו מדגימים כיצד לקבוע את הסף של נוירונים MVN על מנת להבטיח את הגירוי sinusoidal ו סטוכסטי הם תת הסף ומכאן, לקבוע את ההשפעות כי כל סוג של רעש יש על הרווח העצבי MVN. אנו מראים כי sinusoidal הסף ואת הרעש סטוכסטי יכול לווסת את הרגישות של נוירונים בודדים ב MVN מבלי להשפיע על שיעורי ירי בסיס.
Introduction
מערכת שיווי המאזניים (או איזון) שולטת בתחושת האיזון שלנו על-ידי שילוב של מידע שמיעתי, בעלי מראה מסוחושי וחזותי. השפלה של מערכת שיווי המאזניים הוצגה כפונקציה של הגיל והיא עלולה לגרום לשיווי משקל1,2. עם זאת, טיפולים המכוונים לתפקוד מערכת השמיעה הם נדירים.
גירוי באוזן הגלותי (gvs) הוכח לשפר את צעדי האיזון, התפקוד האוטונומי ושיטות החישה האחרות בתוך בני אדם3,4,5,6. שיפורים אלה אמורים להיות בשל תופעת התהודה הסטוכסטית (SR), שהיא העלייה בזיהוי אותות חלשים יותר במערכות שאינן לינאריות דרך היישום של רעש תת-הסף7,8. מחקרים אלה הראו שיפוריםסטטי 9,10 ודינמי 11,12 איזון, ובדיקות פלט שיווי משקל כגון גליל הדלפק (OCR)13. עם זאת, רבים של מחקרים אלה השתמשו צירופים שונים של פרמטרים הגירוי כגון רעש לבן9, רעש צבעוני13, שונים תדירות הגירוי טווחים וטכניקות סף. לכן, פרמטרי גירוי אופטימליים נשארים בלתי ידועים ופרוטוקול זה יכול לסייע בקביעת הפרמטרים היעילים ביותר. מלבד הגירוי פרמטרים, סוג של גירוי חשוב גם ביעילות טיפולית וניסויית. העבודה לעיל בבני אדם בוצעה באמצעות גירויים רעש חשמלי, בעוד הרבה של vivo בעלי חיים בעבודה השתמשו מכני14,15 או אלקטרואופטיקה16 גירויים רעש. פרוטוקול זה ישתמש ברעש חשמלי כדי לבחון את ההשפעות על גרעיני השמיעה.
בעבר, היישום של gvs לעורר שיווי מעיים העיקרי afferents בוצעה ב vivo בקופי סנאי17, שינשילות18, עוברי עוף15 ושרקנים14. עם זאת, רק שניים ממחקרים אלה בדק את האפקט gvs יש על הרווח של שיווי המשקל הראשי afferents14,15. ניסויים אלו בוצעו בvivo כלומר, לא ניתן לקבוע את דפוסי הגירוי המדויקים המוטלים על גרעיני השמיעה. לידיעתך, רק מחקר אחד נוסף החלה רעש סטוכסטי לנוירונים בודדים אנזימטי הפרעות במערכת העצבים המרכזית19. עם זאת, ניסויים לא בוצעו בתוך הגרעין המרכזי שיווי הבמה כדי להעריך את הפרמטרים המתאימים גירוי וטכניקות סף, מה שהופך את הפרוטוקול הזה מדויק יותר בקביעת השפעות גירוי על נוירונים בודדים בתוך הפרוזדור גרעינים.
כאן, אנו מתארים כיצד להחיל sinusoidal ו סטוכסטי (חשמל) רעש ישירות לנוירונים בודדים בגרעין הפרוזדור המדיאלי (MVN), לקבוע סף עצבי ולמדוד שינויים רווח/רגישות.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הפרוטוקולים הניסיוניים שתוארו אושרו על ידי ועדת האתיקה לבעלי חיים של אוניברסיטת סידני (מספר פרוטוקול שאושר: 2018/1308).
1. בעלי חיים
הערה: עכברים הושגו ממרכז המכרסמים האוסטרלי (ARC; פרת ', אוסטרליה) והתקיימה בבניין הקרן הרפואי בניין בעלי חיים באוניברסיטת סידני.
- לשמור על העכברים על מחזור רגיל 12 שעות אור/כהה עם העשרה סביבתית.
- השימוש זכר ונקבה C57BL/6 עכברים (3 – 5 שבועות בן) עבור כל הניסויים.
2. הכנת פתרונות
- להכין 1 L של נוזל שדרתי מלאכותי (ACSF) מורכב 29 מ"מ נחקו3, 11 מ"מ גלוקוז, 120 מ"מ הנאל, 3.3 Mm kcl, 1.4 mm נה2PO4, 2.2 mm Mgcl2, 2.77 mm cacl2.
- להכין 200 mL של סוכרוז-ACSF (sACSF) המכיל 29 מ"מ נחקו3, 11 מ"מ גלוקוז, 241.5 mm סוכרוז, 3.3 Mm kcl, 1.4 mm נה2PO4, 2.2 mm Mgcl2, 2.77 mm cacl2. לפני הכללת CaCl2 כדי acsf ו sacsf, גז את הפתרונות עם קרבוסג'ן (95% O2 ו 5% CO2) כדי להקים pH של 7.4 ולהימנע משקעים בסידן (בעכירות).
- הכנת K+מבוססי פתרון תאיים מורכב מ70 מילימטר אשלגן, 70 Mm kcl, 2 מ"מ היאl, 10 מ"מ hepes, 4 מ"מ egta, 4 מ ג Mg2-ATP, 0.3 mM Na3-gtp; עם pH הסופי של 7.3 (מותאם באמצעות KOH).
הערה: מומלץ לסנן פתרונות תאיים עם מסנני 0.22 יקרומטר ולאחסן 0.5 mL התשובה של הפתרון ב-20 ° c.
3. הכנת גזע המוח
- לפני החילוץ המוח, באמצעות המחקר באמצעות קרבוגן וקריר ב-80 ° c עבור 25 דקות, כך בנוי קרח.
- הרדים את העכבר עם isofלוריאן (3 – 5%) רווי חמצן (3 מ ל לדקה). לאחר הרפלקסים האחוריים האחוריות נעדרים, ערוף את ראשו של העכבר עם מספריים חד נירוסטה חדה.
- לחשוף את הגולגולת על ידי ביצוע חתך משונן בעור באמצעות להב תער (#22 מעוגל).
- באמצעות הקצה המחודד של זוג מספריים סטנדרטיים דפוס לעשות חתך קטן על למדא ולחתוך לאורך הקרע האורך.
- בזהירות לשקף את העצמות הקודקודית ואת עצמות העורף באמצעות זוג העיקול הרדוד פירסון.
הערה: במהלך כל ההליך הזה המוח הוא התרחץ באופן רציף באתרו באמצעות בעבר הכין קרח קר מאוד-sACSF. - לבודד את גזע המוח מהמוח הקדמי ואת מעטפת הגרמית שלו באמצעות להב תער (#11 ישר) כדי לחתוך את העורף parieto-ובתוך לשד caudal.
- הר המוח מבודד גזע הקצה למטה על בלוק בעבר בלוקים פוליסטירן מוקצף. הסרת נוזל עודף סביב רקמת ביתור עם פתיל של נייר טישו כדי להבטיח הדבקה טובה רקמת לשלב החיתוך.
הערה: בלוק הפוליסטירן נחתך בצורה של טרפז, על מנת להבטיח את הrostral של קצה המוח האמצעי ומתאים לחוט השדרה. - השתמש דבק ציאנואקרילי לתקן את בלוק פוליסטירן עם גזע המוח המצורפת rostral end עד לשלב חיתוך.
- באמצעות מהירות מראש של 0.16 מ"מ/s ורטט משרעת של 3.00 מ"מ, להכין 200 יקרומטר פרוסות רוחבי של mvn.
הערה: מיקום ה-MVN נקבע על ידי שימוש באטלס המוח העכבר Paxinos ופרנקלין (דמויות 79 – 89)20. MVN (המפורטים בתור Mvn ב אטלס) שוכנת מיד ונטה אל חדר החדרהרביעי והוא הגדול ביותר לפני ההחזקה של המוח הקצר (בין הקוליקולאני הנחות ו-obex). - השתמש בפיפטה פלסטיק גזוז כדי להעביר פרוסות אל דיסק נייר סינון בישיבה ב-ACSF ב-25 ° c לפחות 30 דקות לפני ההקלטה.
4. כלי נגינה
- השתמש בכיוונון אלקטרולוגי סטנדרטי כדי לבצע שיטות מלחציים לתיקון תאים שלמים21.
- הכנת מיקרופיפטות באמצעות פרוטוקול בן שני שלבים (מחממים שלב 1:70; חום שלב 2:45) על פולר מיקרופיפטה (ראו טבלת חומרים). מיקרופיפטות צריכות להיות התנגדות סופית של 3 – 5 MΩ עם פתרון פנימי כאשר מניחים באמבטיה.
הערה: הגדרות שנעשה בהן שימוש עשויות להשתנות בהתאם לטמפרטורה בתוך החדר ויכולות להשתנות לעתים תכופות.
5. התיקון השלם תא מהדק אלקטרופיזיולוגיה
- כדי להשיג הקלטות מהדק התיקון השלם מפני נוירונים בודדים ב-MVN, פתרון פנימי מבוסס K+משמש בתוך ההקלטה.
- להעביר פרוסת רקמה אחת מחדר הדגירה אל חדר ההקלטה ולאבטח את הפרוסה באמצעות חוט ניילון על משקל בצורת U. מטפל באופן רציף בחדר ההקלטה עם קרבוגנated-ACSF ב -25 ° c בקצב זרימה של 3 מ ל/דקה.
- לאחר מילוי מיקרופיפטה עם פתרון פנימי, אתר את MVN באמצעות עדשת מטרה נמוכה (10x). שימוש במטרה גבוהה (40x) מטרה, נוירונים בודדים בתוך MVN ניתן לאתר.
הערה: איכות התא חיונית להבטחת הקלטות ועמידות האיכות של התא בעת ניסיון להשיג את תצורת התאים השלמה. תא טוב יהיה להפגין צורה כדורית, קרום התא רפלקטיבי וגרעין בלתי נראה. תא רע יהיה גרעין גלוי גדול (כמו ביצה) ומראה נפוח/צומק. - לפני הפרת הרקמה עם הפיפטה, יש למרוח כמות קטנה של לחץ חיובי כדי לדחוף את הפסולת מקצה הפיפטה.
- הזיזו את הפיפטה בעזרת המיקרומניפולציה לכיוון תא העצב הנבחר וגומת הקטן צריכים להיווצר על הקרום העצבי. שחררו לחץ חיובי והפעילו כמות קטנה של לחץ שלילי.
- לאחר השגת GΩ 1, הפעילו לחץ חיובי קצר ועדין למחזיק הפיפטה דרך יציאת היניקה כדי לקרוע את הקרום וליצור תצורה של תא שלם.
- לעשות הקלטות קלאמפ הנוכחי שלמות באמצעות טכניקות סטנדרטיות21,22.
6. החלת Sinusoidal ורעש סטוכסטי כדי הפרט האמצעי המדילי השיווי גרעין נוירונים
- החל את הרעש הסטוכסטי והsinusoidal במגוון רחב של המוני מ -3 עד 24 שעות לקביעת הסף העצבי וקצב הירי.
- קבעו את סף החישה באמצעות קיבוץ עוצמות הגירוי הנמוכות והגבוהות יותר ובצעו ANOVA להתבונן בכל הבדלים (כפי שמוצג באיור המשלים 1).
- לחשב את שיעור הירי הממוצע במהלך 10 s שבו את הצעד הנוכחי ביטול הקיטוב היה/יהיה מוזרק עבור כל הרמה הנוכחית בודדת (כלומר, 7 פרקים סה כ; איור 1).
- השתמש בערכי קצב הירי הממוצעים כדי ליצור שיעור ירי לעומת ההתוויה הנוכחית ולבצע ניתוח רגרסיה ליניארית כדי לקבוע את הדרגה של קו ההתאמה המיטבית. הדרגה של קו ההתאמה הטובה ביותר מעידה על הרווח העצבי22.
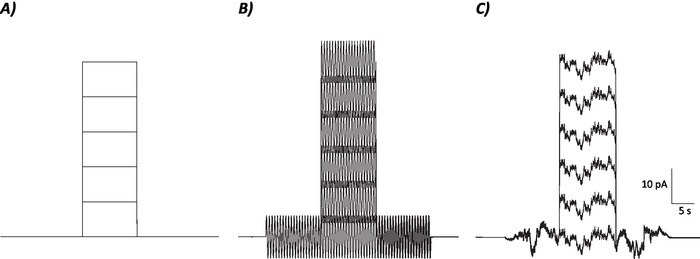
איור 1: פרופילים של שליטה, מsinusoidal ופרוטוקולי רעש סטוכסטיים. (א) שליטה (לא רעש) פרוטוקולים להחיל על mvn נוירונים. (ב) Sinusoidal בפרוטוקול רעש עם תדר של 2 hz. (ג) הפרוטוקולים סטוכסטיים שבהם רוב ספקטרום הכוח הוא ≤ 2 hz. כל פרוטוקול המוצג כאן יש משרעת של ± 6 pA עם 10 s הקטפולזציה הנוכחית גדל על ידי 10 pA עד 50 pA. הגירוי האמיתי אין הצעד הנוכחי הקיטוב ולכן הפרק הראשון של פרוטוקולים אלה כדי לקבוע שינויים עצביים לצבור. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הקלטות ראשוניות יכול לספק מידע על ההשפעות שsinusoidal והרעש סטוכסטי יש על שיעורי ירי בסיס של נוירונים MVN בודדים וכיצד גירויים אפקט הרווח של נוירונים. איור 2 מראה כי לא רעש sinusoidal או סטוכסטי שינוי שיעורי ירי בסיס של נוירונים mvn כאשר לעומת שליטה (אין רעש) הקלטות. מידע זה חי...
Access restricted. Please log in or start a trial to view this content.
Discussion
ההשפעות של גירוי שיווי הגוף הגלווני (gvs) על מערכת השמיעה היתה מודגשת בשנת vivo בבני אדם3,13,23, שרקנים14, מכרסמים18 ו פרימטים לא אנושיים24. עם זאת, אף אחד ממחקרים אלה העריכו את ההשפעה הישירה של רעש חשמלי על הרג...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים אינם מצהירים על ניגודי אינטרסים.
Acknowledgements
SPS הייתה נתמכת על ידי מלגת המחקר של אוניברסיטת סידני לתואר שני.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
References
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved