Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aplicación de ruido estocástico para la evaluación de la sensibilidad medial de la neurona del núcleo vestibular In Vitro
En este artículo
Resumen
La estimulación vestibular galvánica en humanos presenta mejoras en la función vestibular. Sin embargo, se desconoce cómo se producen estos efectos. Aquí, describimos cómo aplicar ruido eléctrico sinusoidal y estocástico y evaluar amplitudes de estímulo apropiadas en neuronas individuales del núcleo vestibular medial en el ratón C57BL/6.
Resumen
Se ha demostrado que la estimulación vestibular galvánica (GVS) mejora las medidas de equilibrio en individuos con deficiencias vestibulares o de equilibrio. Se propone que esto se deba al fenómeno de resonancia estocástica (SR), que se define como la aplicación de un estímulo de bajo nivel/subumbral a un sistema no lineal para aumentar la detección de señales más débiles. Sin embargo, todavía se desconoce cómo SR exhibe sus efectos positivos en el equilibrio humano. Esta es una de las primeras demostraciones de los efectos del ruido sinusoidal y estocástico en las neuronas individuales. Utilizando electrofisiología de abrazadera de parche de células enteras, el ruido sinusoidal y estocástico se puede aplicar directamente a las neuronas individuales en el núcleo vestibular medial (MVN) de los ratones C57BL/6. Aquí demostramos cómo determinar el umbral de las neuronas MVN con el fin de asegurar que los estímulos sinusoidales y estocásticos están subumbrales y a partir de esto, determinar los efectos que cada tipo de ruido tiene en la ganancia neuronal MVN. Mostramos que el ruido sinusoidal y estocástico subumbral puede modular la sensibilidad de las neuronas individuales en el MVN sin afectar las tasas de disparo basales.
Introducción
El sistema vestibular (o de equilibrio) controla nuestro sentido del equilibrio integrando información auditiva, proprioceptiva, somatosensorial y visual. Se ha demostrado que la degradación del sistema vestibular se produce en función de la edad y puede dar lugar a déficits de equilibrio1,2. Sin embargo, las terapias dirigidas al funcionamiento del sistema vestibular son escasas.
Se ha demostrado que la estimulación vestibular galvánica (GVS) mejora las medidas de equilibrio, el funcionamiento autónomo y otras modalidades sensoriales dentro de los seres humanos3,4,5,6. Se dice que estas mejoras se deben al fenómeno de resonancia estocástica (SR), que es el aumento de la detección de señales más débiles en sistemas no lineales mediante la aplicación de ruido subumbral7,8. Estos estudios han demostradomejoras en las pruebas estáticas 9,10 y dinámicas11,12 de equilibrio y de salida vestibular como Ocular Counter Roll (OCR)13. Sin embargo, muchos de estos estudios han utilizado diferentescombinaciones de parámetros de estímulo como el ruido blanco 9, el ruido de color13,diferentes rangos de frecuencia de estímulo y técnicas de umbral. Por lo tanto, los parámetros de estímulo óptimos siguen siendo desconocidos y este protocolo puede ayudar a determinar los parámetros más eficaces. Además de los parámetros de estímulo, el tipo de estímulo también es importante en la eficacia terapéutica y experimental. El trabajo anterior en humanos se realizó utilizando estímulos de ruido eléctrico, mientras que gran parte del trabajo animal in vivo ha utilizado 14,15 u estímulos de ruido optogenéticos16. Este protocolo utilizará ruido eléctrico para examinar los efectos sobre los núcleos vestibulares.
Anteriormente, la aplicación de GVS para estimular afferents vestibulares primarios se realizó in vivo en monos ardilla17,chinchillas18,embriones de pollo15 y conejillos de indias14. Sin embargo, sólo dos de estos estudios examinaron el efecto que GVS tiene sobre la ganancia de aferentes vestibulares primarios14,15. Estos experimentos se realizaron in vivo, lo que significa que no se pueden determinar los patrones precisos de estimulación impuestos a los núcleos vestibulares. Hasta nuestro conocimiento, sólo otro estudio ha aplicado el ruido estocástico a las neuronas enzimáticamente disociadas individuales en el sistema nervioso central19. Sin embargo, no se han realizado experimentos en los núcleos vestibulares centrales para evaluar los parámetros de estímulo apropiados y las técnicas de umbral, haciendo que este protocolo sea más preciso en la determinación de los efectos de estímulo en las neuronas individuales dentro del vestibular Núcleos.
Aquí, describimos cómo aplicar ruido sinusoidal y estocástico (eléctrico) directamente a las neuronas individuales en el núcleo vestibular medial (MVN), determinar el umbral neuronal y medir los cambios en la ganancia / sensibilidad.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los protocolos experimentales descritos fueron aprobados por el Comité de ética animal de la Universidad de Sídney (número de protocolo aprobado: 2018/1308).
1. Animales
NOTA: Los ratones fueron obtenidos del Australian Rodent Centre (ARC; Perth, Australia) y se llevó a cabo en la Fundación Médica Construyendo Instalaciones Animales en la Universidad de Sídney.
- Mantener los ratones en un ciclo normal de 12 h de luz/oscuridad con enriquecimiento ambiental.
- Utilice ratones C57BL/6 machos y hembras (de 3 a 5 semanas de edad) para todos los experimentos.
2. Preparación de soluciones
- Preparar 1 L de líquido cefalorraquídeo artificial (ACSF) compuesto por 29 mM NaHCO3, 11 mM de glucosa, 120 mM NaCl, 3,3 mM KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2.
- Preparar 200 ml de sacarosa-ACSF (sACSF) que contenga 29 mM de NaHCO3, 11 mM de glucosa, 241,5 mM de sacarosa, 3,3 mM de KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM De CaCl2. Antes de la inclusión de CaCl2 en el ACSF y sACSF, gas las soluciones con carbogen (95 % O2 y 5 % CO2) para establecer un pH de 7,4 y evitar la precipitación de calcio (nubosidad).
- PrepararSolución intracelular basada en K +compuesta de gluconato de potasio de 70 mM, 70 mM KCl, 2 mM NaCl, 10 mM HEPES, 4 mM EGTA, 4 mM Mg2-ATP, 0.3 mM Na3-GTP; con un pH final de 7,3 (ajustado mediante KOH).
NOTA: Se recomienda filtrar las soluciones intracelulares con filtros de 0,22 m y almacenar alícuotas de 0,5 ml de la solución a -20 oC.
3. Preparación del tronco encefálico
- Antes de la extracción del tronco encefálico, equilibrar el sACSF con carboen y enfriar a -80 oC durante 25 min para que se forme una suspensión de hielo.
- Anestesiar el ratón con isoflurano (3–5 %) saturado en oxígeno (3 ml/min). Una vez que los reflejos de la pata trasera estén ausentes, decapita el ratón con tijeras de acero inoxidable afiladas.
- Exponga el cráneo haciendo una incisión sagital en la piel usando una cuchilla de afeitar (#22 redondeada).
- Usando el extremo puntiagudo de un par de tijeras de patrón estándar hacer una pequeña incisión en la lambda y cortar a lo largo de la fisura longitudinal.
- Refleja cuidadosamente los huesos parietales emparejados y los huesos occipitales usando un par de rongeurs Pearson de poca curvatura.
NOTA: Durante todo este procedimiento, el cerebro se baña continuamente in situ utilizando la lodos sACSF helada previamente preparada. - Aísle el tronco encefálico del antecefálico y su encuaderrese óseo utilizando una cuchilla de afeitar (#11 recta) para cortar el sulcus parieto-occipital y en la médula caudal.
- Monte el extremo ventral aislado del tronco encefálico en un bloque de poliestireno trapezoidal previamente cortado. Retire el exceso de líquido alrededor del tejido diseccionado con una mecha de papel tisular para asegurar una buena adhesión del tejido a la etapa de corte.
NOTA: El bloque de poliestireno se corta en forma trapezoidal, para asegurar que el extremo rostral del cerebro medio encaje y se enganche en la médula espinal. - Utilice pegamento de cianoacrilato para fijar el bloque de poliestireno con el extremo rostral del tronco encefálico adjunto hasta la etapa de corte.
- Utilizando una velocidad de avance de 0,16 mm/s y una amplitud de vibración de 3,00 mm, prepare rodajas transversales de 200 mm del MVN.
NOTA: La ubicación del MVN se determina utilizando el atlas cerebral del ratón Paxinos y Franklin (Figuras 79–89)20. El MVN (listado como MVe en atlas) se encuentra inmediatamente ventrolateral al ventrículo 4 y es más grande justo antes de la unión del cerebelo (entre el coérdigo inferior y el obbex). - Utilice una pipeta recortada en plástico para transferir las rodajas a un disco de papel de filtro sentado en ACSF carbogenado a 25 oC durante al menos 30 minutos antes de la grabación.
4. Instrumentos
- Utilice una configuración electrofisiológica estándar para realizar técnicas de abrazadera de parche de celda completa21.
- Prepare micropipetas utilizando un protocolo de dos pasos (paso de calor 1: 70; paso de calor 2: 45) en un tirador de micropipetas (consulte la Tabla de materiales). Los micropipetas deben tener una resistencia final que va de 3 a 5 M con solución interna cuando se colocan en el baño.
NOTA: Los ajustes utilizados pueden variar dependiendo de la temperatura dentro de la habitación y pueden cambiar con bastante frecuencia.
5. Electrofisiología de abrazadera de parche de celda completa
- Para obtener grabaciones de abrazaderas de parche de células enteras de neuronas individuales en el MVN, se utiliza una solución interna basada en K+dentro de la pipeta de grabación.
- Transfiera una sola rebanada de tejido de la cámara de incubación a la cámara de registro y asegure la rebanada usando un hilo de nylon en un peso en forma de U. Perfunde continuamente la cámara de grabación con CARSAted-ACSF a 25oC a un caudal de 3 ml/min.
- Después de llenar un micropipeta con solución interna, localice el MVN utilizando una lente objetivo de baja potencia (10x). Usando un objetivo de alta potencia (40x), neuronas individuales dentro del MVN pueden ser localizadas.
NOTA: La calidad celular es esencial para garantizar grabaciones de calidad y durabilidad de la célula al intentar lograr la configuración de toda la célula. Una buena célula demostrará forma esférica, una membrana celular reflectante y un núcleo invisible. Una célula mala tendrá un gran núcleo visible (similar a un huevo) y un aspecto hinchado/encogido. - Antes de romper el tejido con la pipeta, aplique una pequeña cantidad de presión positiva para alejar los desechos de la punta de la pipeta.
- Mueva la pipeta usando el micromanipulador hacia la neurona elegida y se debe formar un pequeño hoyuelo en la membrana neuronal. Libere presión positiva y aplique una pequeña cantidad de presión negativa.
- Una vez que se logra un sello de 1 G, aplique una suave presión positiva corta y afilada al soporte de la pipeta a través del puerto de aspiración para romper la membrana y crear una configuración de células enteras.
- Realice grabaciones de abrazaderas de corriente de celda completa utilizando técnicas estándar21,22.
6. Aplicación de ruido sinusoidal y estocástico a las neuronas del núcleo vestibular medial individual
- Aplique el ruido estocástico y sinusoidal en un rango de amplitudes de 3 a 24 pA para determinar el umbral neuronal y la tasa de disparo.
- Determinar el umbral sensorial agrupando intensidades de estímulo más bajas y más altas y realizar un ANOVA para observar cualquier diferencia (como se muestra en la Figura Suplementaria 1).
- Calcular la tasa de disparo promedio durante el período de 10 s donde el paso actual despolarizante fue / se inyectará para cada nivel de corriente individual (es decir, 7 episodios totales; Figura 1).
- Utilice los valores de velocidad de disparo promedio para generar una tasa de disparo frente a la gráfica actual y realizar un análisis de regresión lineal para determinar el gradiente de la línea de mejor ajuste. El gradiente de la línea de mejor ajuste es indicativo de la ganancia neuronal22.
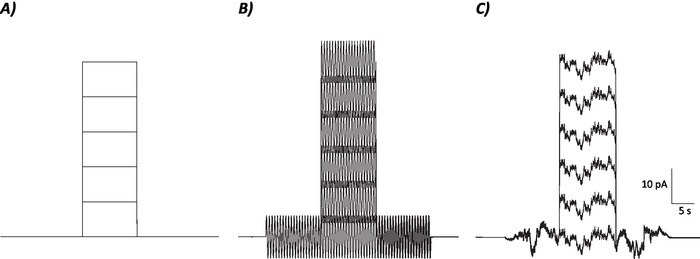
Figura 1: Perfiles diagramales de protocolos de control, sinusoidales y de ruido estocástico. (A) Control (sin ruido) protocolos aplicados a las neuronas MVN. (B) Protocolo de ruido sinusoidal con una frecuencia de 2 Hz. (C) Protocolos de ruido estocástico donde la mayor parte del espectro de potencia es de 2 Hz. Cada protocolo presentado aquí tiene una amplitud de 6 pA con una corriente de despolarizante de 10 s aumentando en 10 pA hasta 50 pA. El verdadero estímulo no tiene un paso actual despolarizante y por lo tanto es el primer episodio de estos protocolos para determinar los cambios en la ganancia neuronal. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Las grabaciones iniciales pueden proporcionar información sobre los efectos que el ruido sinusoidal y estocástico tienen en las tasas de disparo basal de las neuronas MVN individuales y cómo los estímulos afectan la ganancia de las neuronas. La Figura 2 muestra que ni el ruido sinusoidal ni el estocástico cambian las tasas de disparo basal de las neuronas MVN en comparación con las grabaciones de control (sin ruido). Esta información es crucial para determinar el u...
Access restricted. Please log in or start a trial to view this content.
Discusión
Los efectos de la estimulación vestibular galvánica (GVS) en el sistema vestibular se han destacado in vivo en humanos3,13,23, conejillos de indias14, roedores18 y primates no humanos24. Sin embargo, ninguno de estos estudios ha evaluado el impacto directo del ruido eléctrico en la sensibilidad de las neuronas individuales en el sistema vestibular. Aquí ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no declaran conflictos de intereses.
Agradecimientos
SPS fue apoyado por la beca de investigación de posgrado de la Universidad de Sídney.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
Referencias
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados