É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aplicação do ruído estocástico para avaliação da sensibilidade do Neuron do núcleo vestibular medial in vitro
Neste Artigo
Resumo
A estimulação vestibular Galvanic nos seres humanos exibe melhorias na função vestibular. No entanto, não se sabe como esses efeitos ocorrem. Aqui, nós descrevemos como aplicar o ruído elétrico sinusoidal e estocástico e avaliar amplitudes apropriadas do estímulo em neurônios vestibular medial individuais do núcleo no rato C57BL/6.
Resumo
A estimulação vestibular Galvanic (GVS) foi mostrada para melhorar medidas do contrapeso nos indivíduos com contrapeso ou prejuízos vestibulares. Este é proposto para ser devido ao fenômeno da ressonância estocástica (SR), que é definido como a aplicação de um estímulo de baixo nível/sublimiar a um sistema não-linear para aumentar a deteção de sinais mais fracos. No entanto, ainda é desconhecido como o SR apresenta seus efeitos positivos sobre o equilíbrio humano. Esta é uma das primeiras manifestações dos efeitos do ruído sinusoidal e estocástico em neurônios individuais. Usando a electrofisiologia da braçadeira de remendo da todo-pilha, o ruído sinusoidal e estocástico pode ser aplicado diretamente aos neurônios individuais no núcleo vestibular medial (MVN) de C57Bl/6 ratos. Aqui nós demonstramos como determinar o limiar dos neurônios MVN, a fim de garantir que os estímulos sinusoidais e estocásticos são sublimiares e, a partir disso, determinar os efeitos que cada tipo de ruído tem sobre o ganho neuronal MVN. Nós mostramos que o ruído sinusoidal e estocástico do subthreshold pode modular a sensibilidade de neurônios individuais no MVN sem afetar taxas de acendimento basais.
Introdução
O sistema vestibular (ou equilíbrio) controla nosso senso de equilíbrio integrando informações auditivas, proprioceptivas, somatossensoriais e visuais. A degradação do sistema vestibular tem demonstrado ocorrer em função da idade e pode resultar em déficits de equilíbrio1,2. No entanto, as terapias direcionadas ao funcionamento do sistema vestibular são escassas.
A estimulação vestibular Galvanic (GVS) foi mostrada para melhorar medidas do contrapeso, funcionamento autonômico e outras modalidades sensoriais dentro dos seres humanos3,4,5,6. Estas melhorias são ditas devido ao fenômeno da ressonância estocástica (Sr), que é o aumento na detecção de sinais mais fracos em sistemas não-lineares através da aplicação do ruído do sublimiar7,8. Estes estudos mostraram melhorias nos testes estáticos de9,10 e11,12 dinâmicos e de saída vestibular, como o rolo de contador ocular (OCR)13. No entanto, muitos desses estudos utilizaram diferentes combinações de parâmetros de estímulo, como ruído branco9, ruído colorido13, diferentes faixas de frequência de estímulo e técnicas de limiarização. Conseqüentemente, os parâmetros óptimos do estímulo permanecem desconhecidos e este protocolo pode ajudar com determinar os parâmetros os mais eficazes. Além dos parâmetros de estímulo, o tipo de estímulo também é importante na eficácia terapêutica e experimental. O trabalho acima em humanos foi realizado por meio de estímulos de ruído elétrico, enquanto grande parte do trabalho animal in vivo utilizou estímulos de ruído mecânicos de14,15 ou optogenéticos16 . Este protocolo usará o ruído elétrico para examinar os efeitos em núcleos vestibulares.
Anteriormente, a aplicação de GVS para estimular aferentes vestibulares primários foi realizada in vivo em macacos-esquilo17, chinchilas18, embriões de frango15 e cobaias14. Entretanto, apenas dois desses estudos examinaram o efeito que o GVS tem sobre o ganho de aferentes vestibulares primários14,15. Esses experimentos foram realizados in vivo, o que significa que os padrões precisos de estimulação impostas aos núcleos vestibulares não podem ser determinados. A nosso conhecimento, somente um outro estudo aplicou o ruído estocástico aos neurônios enzymaticamente dissociados individuais no sistema nervoso central19. No entanto, não foram realizados experimentos nos núcleos vestibulares centrais para avaliar os parâmetros adequados de estímulo e as técnicas de limiarização, tornando este protocolo mais preciso na determinação dos efeitos do estímulo sobre os neurônios individuais dentro do vestibular Núcleos.
Aqui, nós descrevemos como aplicar o ruído sinusoidal e estocástico (elétrico) diretamente aos neurônios individuais no núcleo vestibular medial (MVN), determinar o limiar neuronal e medir mudanças no ganho/sensibilidade.
Protocolo
Todos os protocolos experimentais descritos foram aprovados pelo Comitê de ética animal da Universidade de Sidney (número de protocolo aprovado: 2018/1308).
1. os animais
Nota: Os camundongos foram obtidos do centro australiano de roedores (ARC; Perth, Austrália) e realizada na Fundação médica edifício animal Facility na Universidade de Sydney.
- Mantenha os camundongos em um ciclo normal de luz/escuridão de 12 h com enriquecimento ambiental.
- Use machos e fêmeas C57BL/6 camundongos (3 – 5 semanas de idade) para todos os experimentos.
2. preparação de soluções
- Prepare 1 L de líquido cefalorraquidiano artificial (ACSF) composto por 29 mM NaHCO3, 11 mm de glicose, 120 mm nacl, 3,3 mm kcl, 1,4 mm NaH2po4, 2,2 mM MgCl2, 2,77 mm CAcl2.
- Prepare 200 mL de sacarose-ACSF (sACSF) contendo 29 mM de NaHCO3, 11 mm de glicose, 241,5 mm de sacarose, 3,3 mm kcl, 1,4 mm NaH2po4, 2,2 mM MgCl2, 2,77 mm CAcl2. Antes da inclusão de CaCl2 ao ACSF e ao sacsf, gás as soluções com Carbogen (95% o2 e 5% co2) para estabelecer um pH de 7,4 e para evitar a precipitação do cálcio (cloudiness).
- Prepare a solução intracelular K+-based composta de 70 mm de gluconato de potássio, 70 mm KCl, 2 mm NaCl, 10 mm HEPES, 4 mm EGTA, 4 mm mg2-ATP, 0,3 mm na3-GTP; com um pH final de 7,3 (ajustado usando KOH).
Nota: recomenda-se filtrar soluções intracelulares com filtros de 0,22 μm e armazenar alíquotas de 0,5 mL da solução a-20 ° c.
3. preparação do tronco cerebral
- Antes da extração do tronco encefálico, equilibrar o sACSF com carbogénio e resfriar a-80 ° c por 25 min para que uma pasta de gelo seja formada.
- Anestesiizar o rato com isoflurano (3 – 5%) saturado em oxigénio (3 mL/min). Uma vez que os reflexos patas traseiras estão ausentes, decapitar o mouse com tesouras de aço inoxidável afiada.
- Expor o crânio, fazendo uma incisão sagital na pele usando uma lâmina de barbear (#22 arredondado).
- Usando a ponta pontiaguda de um par de tesouras padrão fazer uma pequena incisão no lambda e cortar ao longo da fissura longitudinal.
- Reflita cuidadosamente os ossos parietais emparelhados e os ossos occipitais usando um par de rongeurs de Pearson de curvatura rasa.
Nota: Durante todo este procedimento, o cérebro é continuamente banhado in situ usando a pasta sACSF gelada previamente preparada. - Isole o tronco cerebral do prosencéfalo e sua carcaça óssea usando uma lâmina de barbear (#11 reto) para cortar o sulco parieto-occipital e na medula caudal.
- Monte a extremidade ventral isolada do tronco encefálico para baixo em um bloco trapezoidal previamente cortado do poliestireno. Remova o excesso de fluido em torno do tecido dissecado com um pavio de papel tissue para garantir uma boa aderência do tecido ao estágio de corte.
Nota: O bloco do poliestireno é cortado em uma forma trapezoidal, para assegurar a extremidade rostral dos ajustes e dos atarraxamentos do midbrain na medula espinal. - Use cola de cianoacrilato para fixar o bloco de poliestireno com a extremidade rostral anexado do tronco cerebral até o estágio de corte.
- Usando uma velocidade de avanço de 0,16 mm/s e amplitude de vibração de 3, 0 mm, prepare as fatias transversais de 200 μm da MVN.
Nota: A posição do MVN é determinada usando o Atlas do cérebro do rato de Paxinos e de Franklin (figuras 79 – 89)20. O MVN (listado como MVE no Atlas) encontra-se imediatamente ventrolateral ao 4º ventrículo e é o maior direito antes da fixação do cerebelo (entre o colículos inferior e o OBEX). - Use uma pipeta plástico-aparado para transferir fatias em um disco do papel de filtro que senta-se no ACSF carbogenated em 25 ° c por pelo menos 30 minutos antes da gravação.
4. instrumentos de
- Use uma instalação electrofisiológica padrão para executar técnicas da braçadeira de remendo da todo-pilha21.
- Prepare micropipetas usando um protocolo de duas etapas (etapa de calor 1:70; etapa de calor 2:45) em um extrator de micropipeta (consulte a tabela de materiais). As micropipetas devem ter uma resistência final variando de 3 – 5 MΩ com solução interna quando colocadas no banho.
Nota: Os ajustes usados podem variar dependendo da temperatura dentro do quarto e podem mudar completamente freqüentemente.
5. electrofisiologia da braçadeira de remendo da inteiro-pilha
- Para obter gravações de grampo de remendo de células inteiras de neurônios individuais na MVN, uma solução interna baseada em K+é usada dentro da pipeta de gravação.
- Transfira uma única fatia de tecido da câmara de incubação para a câmara de gravação e fixe a fatia usando uma rosca de nylon em um peso em forma de U. Perfuse continuamente a câmara de gravação com carbogenated-ACSF em 25 ° c em uma taxa de fluxo de 3 mL/min.
- Depois de encher uma micropipeta com solução interna, localize o MVN usando uma lente objetiva de baixa potência (10x). Usando um objetivo de alta potência (40x), os neurônios individuais dentro do MVN podem ser localizados.
Nota: A qualidade da célula é essencial para garantir gravações de qualidade e durabilidade da célula ao tentar alcançar a configuração de célula inteira. Uma boa célula demonstrará forma esférica, uma membrana celular reflexiva e um núcleo invisível. Uma célula ruim terá um grande núcleo visível (ovo-like) e uma aparência inchada/encolhida. - Antes de violar o tecido com a pipeta, aplique uma pequena quantidade de pressão positiva para empurrar detritos para longe da ponta da pipeta.
- Mova a pipeta usando o micromanipulador para o neurônio escolhido e uma pequena covinha deve formar-se na membrana neuronal. Libere a pressão positiva e aplique uma pequena quantidade de pressão negativa.
- Uma vez que um selo de 1 GΩ é conseguido, aplique a pressão positiva curta e afiada delicada ao suporte da pipeta através da porta da sucção para romper a membrana e para criar uma configuração da todo-pilha.
- Faça gravações da braçadeira da corrente da inteiro-pilha usando técnicas padrão21,22.
6. aplicando ruído sinusoidal e estocástico a neurônios do núcleo vestibular medial individual
- Aplique o ruído estocástico e sinusoidal em uma escala das amplitudes de 3 a 24 pA para determinar o limiar neuronal e a taxa de disparo.
- Determine o limiar sensorial agrupando as intensidades de estímulo inferiores e maiores e realize uma ANOVA para observar quaisquer diferenças (como mostrado na Figura 1 suplementar).
- Calcule a taxa média de disparo durante o período de 10 s em que a etapa de despolarização atual foi/será injetada para cada nível de corrente individual (ou seja, 7 episódios totais; Figura 1).
- Use os valores médios de taxa de disparo para gerar uma taxa de disparo versus plotagem atual e executar uma análise de regressão linear para determinar o gradiente da linha de melhor ajuste. O gradiente da linha de melhor ajuste é indicativo do ganho neuronal22.
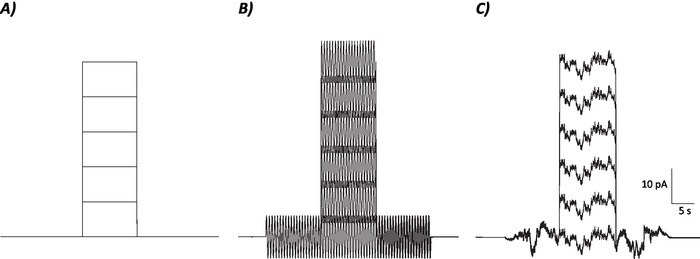
Figura 1: perfis diagramáticos de protocolos de controle, sinusoidal e ruído estocástico. (A) protocolos de controle (sem ruído) aplicados aos neurônios MVN. (B) protocolo de ruído sinusoidal com uma frequência de 2 Hz. (C) protocolos de ruído estocástico em que a maioria do espectro de potência é ≤ 2 Hz. Cada protocolo aqui apresentado tem uma amplitude de ± 6 pA com uma corrente de 10 s despolarizante aumentando em 10 pA até 50 pA. O verdadeiro estímulo não tem um passo de corrente despolarizante e, portanto, é o primeiro episódio desses protocolos para determinar as mudanças de ganho neuronal. Por favor clique aqui para ver uma versão maior desta figura.
Resultados
As gravações iniciais podem fornecer informações sobre os efeitos que o ruído sinusoidal e estocástico tem sobre as taxas de queima basal de neurônios MVN individuais e como os estímulos efetuam o ganho de neurônios. A Figura 2 mostra que nem sinusoidal nem ruído estocástico alteram as taxas de queima basal dos neurônios MVN quando comparadas às gravações de controle (sem ruído). Esta informação é crucial para determinar o limiar dos neurônios individu...
Discussão
Os efeitos da estimulação vestibular Galvanica (GVS) no sistema vestibular têm sido destacados in vivo em humanos3,13,23, cobaias14, roedores18 e primatas não humanos24. Entretanto, nenhum desses estudos avaliou o impacto direto do ruído elétrico na sensibilidade dos neurônios individuais no sistema vestibular. Aqui nós Demonstramos a primeira aplica...
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
A SPS foi apoiada pela bolsa de estudos de pós-graduação da Universidade de Sydney.
Materiais
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
Referências
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575 (2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101 (2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335 (2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117 (2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336 (2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. . The mouse brain in stereotaxic coordinates. , (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26 (2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados