Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Application de bruit stochastique pour l'évaluation de la sensibilité de neurone vestibulaire médial de noyau in Vitro
Dans cet article
Résumé
La stimulation vestibulaire galvanique chez l'homme montre des améliorations dans la fonction vestibulaire. Cependant, on ne sait pas comment ces effets se produisent. Ici, nous décrivons comment appliquer le bruit électrique sinusoïdal et stochastique et évaluons les amplitudes appropriées de stimulus dans les neurones médiibulaires individuels de noyau vestibulaire dans la souris c57BL/6.
Résumé
La stimulation vestibulaire galvanique (GVS) a été montrée pour améliorer des mesures d'équilibre dans les individus avec l'équilibre ou les affaiblissements vestibulaires. Ceci est proposé pour être dû au phénomène de résonance stochastique (SR), qui est défini comme l'application d'un stimulus de bas niveau/sous-seuil à un système non linéaire pour augmenter la détection des signaux plus faibles. Cependant, on ne sait toujours pas comment SR montre ses effets positifs sur l'équilibre humain. C'est l'une des premières démonstrations des effets du bruit sinusoïdal et stochastique sur les neurones individuels. L'utilisation de l'électrophysiologie de pince de correction de cellules entières, du bruit sinusoïdal et stochastique peut être appliquée directement aux neurones individuels dans le noyau vestibulaire médial (MVN) des souris de C57BL/6. Ici nous démontrons comment déterminer le seuil des neurones de MVN afin de s'assurer que les stimulus sinusoïdal et stochastic sont sous-seuil et de ceci, déterminent les effets que chaque type de bruit a sur le gain neuronal de MVN. Nous montrons que le bruit sinusoïdal et stochastique de sous-seuil peut moduler la sensibilité des neurones individuels dans le MVN sans affecter des taux basiques de tir.
Introduction
Le système vestibulaire (ou équilibre) contrôle notre sens de l'équilibre en intégrant des informations auditives, proprioceptives, somatosensorielles et visuelles. La dégradation du système vestibulaire s'est avérée se produire en fonction de l'âge et peut entraîner des déficits d'équilibre1,2. Cependant, les thérapies ciblant le fonctionnement du système vestibulaire sont rares.
La stimulation vestibulaire galvaïque (GVS) a été montrée pour améliorer des mesures d'équilibre, le fonctionnement autonome et d'autres modalités sensorielles chez les humains3,4,5,6. Ces améliorations seraient dues au phénomène de résonance stochastique (SR), qui est l'augmentation de la détection des signaux plus faibles dans les systèmes non linéaires par l'application du bruit de sous-seuil7,8. Ces études ont montré des améliorations dans statique9,10 et dynamique11,12 équilibre, et les tests de sortie vestibulaire tels que Le compteur oculaire (OCR)13. Cependant, beaucoup de ces études ont utilisé différentes combinaisons de paramètres de stimulus tels que le bruit blanc9, bruit coloré13, différentes gammes de fréquences de stimulus et des techniques de seuil. Par conséquent, les paramètres de stimulation optimaux restent inconnus et ce protocole peut aider à déterminer les paramètres les plus efficaces. Outre les paramètres de stimulation, le type de stimulus est également important dans l'efficacité thérapeutique et expérimentale. Le travail ci-dessus chez l'homme a été effectué à l'aide de stimuli sonores électriques, tandis qu'une grande partie du travail animal in vivo a utilisémécanique 14,15 ou optogénétique16 stimuli sonores. Ce protocole utilisera le bruit électrique pour examiner les effets sur les noyaux vestibulaires.
Précédemment, l'application de GVS pour stimuler les afferents vestibulaires primaires a été exécutée in vivo chez les singes écureuils17, chinchillas18, embryons de poulet15 et cobayes14. Cependant, seulement deux de ces études ont examiné l'effet de GVS sur le gain des afferents vestibulaires primaires14,15. Ces expériences ont été réalisées in vivo, ce qui signifie que les modèles précis de stimulation imposés sur les noyaux vestibulaires ne peuvent pas être déterminés. À notre connaissance, une seule autre étude a appliqué le bruit stochastique aux neurones enzymatiquement dissociés individuels dans le système nerveux central19. Cependant, aucune expérience n'a été effectuée dans les noyaux vestibulaires centraux pour évaluer les paramètres de stimulation appropriés et les techniques de seuil, ce qui rend ce protocole plus précis dans la détermination des effets de stimulus sur les neurones individuels dans le vestibulaire Noyaux.
Ici, nous décrivons comment appliquer le bruit sinusoïdal et stochastique (électrique) directement aux neurones individuels dans le noyau vestibulaire médial (MVN), déterminer le seuil neuronal et mesurer les changements dans le gain/sensibilité.
Access restricted. Please log in or start a trial to view this content.
Protocole
Tous les protocoles expérimentaux décrits ont été approuvés par le Comité d'éthique animale de l'Université de Sydney (numéro de protocole approuvé : 2018/1308).
1. Animaux
REMARQUE: Des souris ont été obtenues du Centre australien de rongeur (ARC ; Perth, Australie) et s'est tenue à la Medical Foundation Building Animal Facility de l'Université de Sydney.
- Maintenir les souris sur un cycle normal de 12 h de lumière/obscurité avec l'enrichissement environnemental.
- Utilisez des souris C57BL/6 mâles et femelles (de 3 à 5 semaines) pour toutes les expériences.
2. Préparation de solutions
- Préparer 1 L de liquide céphalo-rachidien artificiel (ACSF) composé de 29 mM NaHCO3, 11 mM de glucose, 120 mM NaCl, 3,3 mM KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2.
- Préparer 200 mL de saccharose-ACSF (sACSF) contenant 29 mM NaHCO3, 11 mM de glucose, 241,5 mM de saccharose, 3,3 mM KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2. Avant l'inclusion de CaCl2 à l'ACSF et au sACSF, gazez les solutions avec carbogen (95 % O2 et 5 % CO2) pour établir un pH de 7,4 et éviter les précipitations de calcium (nébulosité).
- Préparer la solution intracellulaire à base de KetK composé de 70 mM de gluconate de potassium, 70 mM KCl, 2 mM NaCl, 10 mM HEPES, 4 mM EGTA, 4 mM Mg2-ATP, 0,3 mM Na3-GTP; avec un pH final de 7,3 (ajusté à l'aide de KOH).
REMARQUE : Il est recommandé de filtrer les solutions intracellulaires avec des filtres de 0,22 m et de stocker 0,5 ml d'aliquots de la solution à -20 oC.
3. Préparation du tronc cérébral
- Avant l'extraction du tronc cérébral, équilibrez le sACSF avec du carbogen et refroidissez à -80 oC pendant 25 min afin qu'une boue de glace se forme.
- Anesthésier la souris avec de l'isoflurane (3 à 5 %) saturés en oxygène (3 ml/min). Une fois que les réflexes de patte arrière sont absents, décapiter la souris avec des ciseaux en acier inoxydable pointus.
- Exposer le crâne en faisant une incision sagittale dans la peau à l'aide d'une lame de rasoir (#22 arrondie).
- En utilisant l'extrémité pointue d'une paire de ciseaux à motif standard faire une petite incision à l'lambda et couper le long de la fissure longitudinale.
- Réfléchissez soigneusement les os pariétals appariés et les os occipitaux à l'aide d'une paire de rongeurs Pearson peu profonds.
REMARQUE: Pendant toute cette procédure, le cerveau est continuellement baigné in situ à l'aide de la boue sACSF glacée préparée précédemment. - Isoler le tronc cérébral de l'avant-cerveau et son enturage osseuse à l'aide d'une lame de rasoir (#11 droite) pour couper le sulcus parieux-occipital et à la médulle caudale.
- Montez l'extrémité ventrale isolée du tronc cérébral vers le bas sur un bloc de polystyrène trapézoïdal précédemment coupé. Enlever l'excès de liquide autour du tissu disséqué avec une mèche de papier de soie pour assurer une bonne adhérence tissulaire à l'étape de coupe.
REMARQUE: Le bloc de polystyrène est coupé en forme trapézoïdale, pour s'assurer que l'extrémité rostrale du cerveau moyen s'adapte et s'effiloche dans la moelle épinière. - Utilisez de la colle cyanoacrylate pour fixer le bloc de polystyrène avec l'extrémité rostral du tronc cérébral attaché jusqu'au stade de coupe.
- À l'aide d'une vitesse d'avance de 0,16 mm/s et d'une amplitude vibratoire de 3,00 mm, préparez des tranches transversales de 200 m du MVN.
REMARQUE: L'emplacement du MVN est déterminé à l'aide de l'atlas du cerveau de la souris Paxinos et Franklin (figures 79-89)20. Le MVN (listé comme MVe dans l'atlas) se trouve immédiatement ventrolatéral au 4e ventricule et est le plus grand juste avant l'attachement du cervelet (entre le colliculi inférieur et l'obex). - Utilisez une pipette en plastique pour transférer des tranches sur un disque de papier filtre assis dans l'ACSF carbogenated à 25 oC pendant au moins 30 minutes avant l'enregistrement.
4. Instruments
- Utilisez une configuration électrophysiologique standard pour effectuer des techniques de pince de patch à cellules entières21.
- Préparer les micropipettes à l'aide d'un protocole en deux étapes (étape de chaleur 1: 70; étape de chaleur 2: 45) sur un puller micropipette (voir le tableau des matériaux). Les micropipettes doivent avoir une résistance finale allant de 3 à 5 M avec solution interne lorsqu'elles sont placées dans le bain.
REMARQUE: Les réglages utilisés peuvent varier en fonction de la température dans la pièce et peuvent changer assez fréquemment.
5. Électrophysiologie de pince de timbre de cellules entières
- Pour obtenir des enregistrements de pinces de patch à cellules entières à partir de neurones individuels dans le MVN, une solution interne basée surKest utilisée dans la pipette d'enregistrement.
- Transférer une seule tranche de tissu de la chambre d'incubation à la chambre d'enregistrement et fixer la tranche à l'aide d'un fil de nylon sur un poids en forme de U. Perfil le cours de la chambre d'enregistrement avec un ACSF carbogenated à 25 oC à un débit de 3 ml/min.
- Après avoir rempli une micropipette avec une solution interne, localiser le MVN à l'aide d'une lentille objective de faible puissance (10x). À l'aide d'un objectif de haute puissance (40x), des neurones individuels dans le MVN peuvent être localisés.
REMARQUE: La qualité des cellules est essentielle pour assurer la qualité des enregistrements et la durabilité de la cellule lorsque vous tentez d'atteindre la configuration de l'ensemble de la cellule. Une bonne cellule démontrera une forme sphérique, une membrane cellulaire réfléchissante et un noyau invisible. Une mauvaise cellule aura un grand noyau visible (comme un œuf) et un aspect gonflé/rétréci. - Avant de percer le tissu avec la pipette, appliquez une petite pression positive pour pousser les débris loin de la pointe de la pipette.
- Déplacez la pipette à l'aide du micromanipulateur vers le neurone choisi et une petite fossette devrait se former sur la membrane neuronale. Relâchez une pression positive et appliquez une petite pression négative.
- Une fois qu'un joint de 1 G est réalisé, appliquez une pression positive douce courte et forte sur le porte-pipette s'agite par le port d'aspiration pour rompre la membrane et créer une configuration à cellules entières.
- Faire des enregistrements de pinces à courant à cellules entières en utilisant des techniques standard21,22.
6. Appliquer le bruit sinusoïdal et stochastique aux neurones individuels du noyau vestibulaire médial
- Appliquer le bruit stochastique et sinusoïdal à une gamme d'amplitudes de 3 à 24 pA pour déterminer le seuil neuronal et le taux de tir.
- Déterminer le seuil sensoriel en regroupant des intensités de stimulus inférieures et plus élevées et effectuer un ANOVA pour observer les différences (comme le montre la figure supplémentaire 1).
- Calculer le taux de tir moyen au cours de la période de 10 s où l'étape actuelle de dépolarisation a été/sera injectée pour chaque niveau actuel individuel (c.-à-d. 7 épisodes totaux; Figure 1).
- Utilisez les valeurs moyennes de taux de tir pour générer un taux de tir par rapport à la parcelle actuelle et effectuez une analyse de régression linéaire pour déterminer le gradient de la ligne de meilleur ajustement. Le gradient de la ligne de meilleur ajustement est indicatif du gain neuronal22.
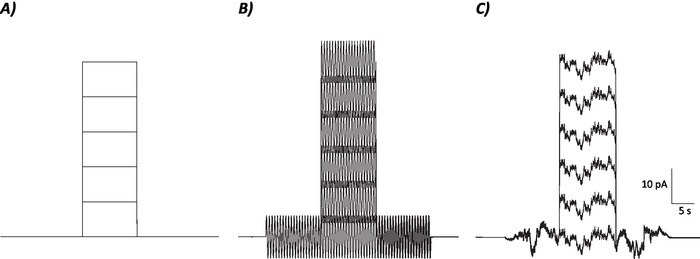
Figure 1 : Profils schématiques des protocoles de contrôle, de sinusoïdal et de bruit stochastique. (A) Protocoles de contrôle (sans bruit) appliqués aux neurones MVN. (B) Protocole de bruit sinusoïdal avec une fréquence de 2 Hz. (C) Protocoles de bruit stochastique où la majorité du spectre de puissance est de 2 Hz. Chaque protocole présenté ici a une amplitude de 6 pA avec un courant de dépolarisation de 10 s augmentant de 10 pA jusqu'à 50 pA. Le véritable stimulus n'a pas une étape de dépolarisation actuelle et est donc le premier épisode de ces protocoles pour déterminer les changements de gain neuronal. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Access restricted. Please log in or start a trial to view this content.
Résultats
Les enregistrements initiaux peuvent fournir des informations sur les effets que le bruit sinusoïdal et stochastique ont sur les taux de tir basique des neurones MVN individuels et comment les stimuli effet le gain des neurones. La figure 2 montre que ni le bruit sinusoïdal ni le bruit stochastique ne modifient les taux de tir basal des neurones MVN par rapport aux enregistrements de contrôle (sans bruit). Cette information est cruciale pour déterminer le seuil des ne...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les effets de la stimulation vestibulaire galvaïque (GVS) sur le système vestibulaire a été mis en évidence in vivo chez l'homme3,13,23, cobayes14, rongeurs18 et primates non humains24. Cependant, aucune de ces études n'a évalué l'impact direct du bruit électrique sur la sensibilité des neurones individuels dans le système vestibulaire. Ici nous d...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d'intérêts.
Remerciements
SPS a reçu le soutien de la bourse de recherche postdoctorale de l'Université de Sydney.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
Références
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon