Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Стохастический шум приложение для оценки медианных Вестибулярный нейрон чувствительность в Vitro
В этой статье
Резюме
Гальваническая вестибулярная стимуляция у человека демонстрирует улучшение работы вестибулярной. Тем не менее, неизвестно, как эти эффекты происходят. Здесь мы описываем, как применять синусоидальный и стохастический электрический шум и оценивать соответствующие амплитуды стимула в отдельных медиалярных нейронах вестибуляйного ядра в мыши C57BL/6.
Аннотация
Гальваническая вестибулярная стимуляция (ГВС) улучшает показатели баланса у людей с нарушениями равновесия или вестибулярных нарушений. Это предлагается из-за стохастической резонанс (SR) явление, которое определяется как применение низкого уровня / подпорогстимула к нелинейной системы для увеличения обнаружения слабых сигналов. Тем не менее, до сих пор неизвестно, каким образом СР проявляет свое положительное влияние на человеческий баланс. Это одна из первых демонстраций воздействия синусоидального и стохастического шума на отдельные нейроны. Использование цельноклеточного патч зажима электрофизиологии, синусоидального и стохасального шума может быть применен непосредственно к отдельным нейронам в медиальном вестибулярном ядре (MVN) мышей C57BL/6. Здесь мы демонстрируем, как определить порог нейронов MVN для того, чтобы обеспечить синусоидальные и стохастические стимулы являются подпороговыми и из этого, определить влияние, которое каждый тип шума оказывает на mVN нейронов усиления. Мы показываем, что подпорогсиневый синусоидальный и стохастический шум может модулировать чувствительность отдельных нейронов в MVN, не влияя на базальные показатели стрельбы.
Введение
Вестибулярная (или балансовая) система контролирует наше чувство равновесия, интегрируя слуховую, проприоцептивную, соматосенсорную и визуальную информацию. Деградация вестибулярной системы, как было показано, происходит как функция возраста и может привести к дефициту баланса1,2. Однако методов лечения, ориентированных на функционирование вестибулярной системы, не хватает.
Гальванические вестибулярной стимуляции (GVS) было показано, улучшить баланс меры, вегетативные функционирования и других сенсорных условий в организме человека3,4,5,6. Эти улучшения, как говорят, связано с феноменом Stochastic Resonance (SR), который является увеличение мегвения слабых сигналов в нелинейных системах через применение подпорогового шума7,8. Эти исследования показали улучшенияв статической 9,10 и динамических11,12 баланс, и вестибулярные выходные тесты, такие как ocular Counter Roll (OCR)13. Тем не менее, многие из этих исследований использовали различные комбинации параметров стимула, таких как белый шум9, цветной шум13, различные диапазоны частот стимулов и методы порога. Таким образом, оптимальные параметры стимула остаются неизвестными, и этот протокол может помочь в определении наиболее эффективных параметров. Помимо параметров стимула, тип стимула также имеет важное значение в терапевтической и экспериментальной эффективности. Вышеработа работа в организме человека была выполнена с использованием электрических стимулов шума, в то время как большая часть работы in vivo животных использовала механические14,15 или оптогенетические16 шумовых стимулов. Этот протокол будет использовать электрический шум для изучения воздействия на вестибулярные ядра.
Ранее применение GVS для стимулирования первичных вестибулярных афферентов проводилось в vivo у белок обезьян17,шиншилл18,куриных эмбрионов15 и морских свинок14. Тем не менее, только два из этих исследований рассмотрели влияние GVS оказывает на получение первичных вестибулярных афферентов14,15. Эти эксперименты проводились in vivo, что означает, что точные модели стимуляции, навязанные вестибулярным ядрам, не могут быть определены. Насколько нам известно, только одно другое исследование применило стохастический шум к отдельным ферментативно диссоциированным нейронам в центральной нервной системе19. Тем не менее, никаких экспериментов не было проведено в центральных вестибулярных ядер для оценки соответствующих параметров стимула и методов порога, что делает этот протокол более точным в определении стимула воздействие на отдельные нейроны в вестибулярной Ядер.
Здесь мы описываем, как применять синусоидальный и стохастический (электрический) шум непосредственно к отдельным нейронам в медиальной вестибуляционном ядре (MVN), определить порог нейронов и измерить изменения в выигрыше/чувствительности.
Access restricted. Please log in or start a trial to view this content.
протокол
Все описанные экспериментальные протоколы были утверждены Комитетом по этике животных Университета Сиднея (утвержденный номер протокола: 2018/1308).
1. Звери
ПРИМЕЧАНИЕ: Мыши были получены из Австралийского центра грызунов (ARC; Перт, Австралия) и проводится в Медицинском фонде Строительство животных фонда в Университете Сиднея.
- Поддерживайте мышей на нормальном 12-ч светлом/темном цикле с обогащением окружающей среды.
- Используйте мужские и женские мыши C57BL/6 (3-5 недель) для всех экспериментов.
2. Подготовка решений
- Подготовка 1 l искусственной спинномозговой жидкости (ACSF) состоит из 29 мм NaHCO3, 11 мм глюкозы, 120 мМ NaCl, 3,3 мм ККЛ, 1,4 мм2PO4, 2,2 мм MgCl2, 2,77 мм CaCl2.
- Подготовка 200 мл сахарозы-ACSF (sACSF), содержащий 29 мм NaHCO3, 11 мм глюкозы, 241,5 мм сахарозы, 3,3 мм ККЛ, 1,4 мм2PO4, 2,2 мМ MgCl2, 2,77 мм CCl2. До включения CaCl2 в ACSF и SACSF, газ растворы с карбогеном (95 % O2 и 5 % CO2) установить рН 7,4 и избежать осадков кальция (облачность).
- Подготовкавнутриклеточного раствора на основе K- на основе 70 мм глюконата калия, 70 мМ КЛ, 2 мМ NaCl, 10 мМ HEPES, 4 мМ EGTA, 4 мМ Мм2-АТП, 0,3 мм На3-GTP; с окончательным рН 7,3 (скорректированы с использованием KOH).
ПРИМЕЧАНИЕ: Рекомендуется фильтровать внутриклеточные растворы с фильтрами 0,22 мкм и хранить 0,5 мл аликвотов раствора при -20 градусов по Цельсию.
3. Подготовка Мозгового
- Перед извлечением ствола мозга, уравновешить sACSF с карбогеном и охладить при -80 градусов по Цельсию в течение 25 минут, так что ледяной шлам формируется.
- Анестезия мыши с изофлуран (3-5 %) насыщены кислородом (3 мл/мин). После того, как задние лапы рефлексы отсутствуют, обезглавить мышь с острыми ножницами из нержавеющей стали.
- Разоблачить череп, сделав сагитальный разрез в коже с помощью лезвия бритвы (#22 округлены).
- Используя заостренный конец пары стандартных ножниц шаблона сделать небольшой разрез на лямбда и вырезать вдоль продольной трещины.
- Тщательно отражайте парные теменные кости и затылочной кости, используя пару мелкой изгиба Pearson rongeurs.
ПРИМЕЧАНИЕ: В течение всей этой процедуры мозг постоянно купается на месте с помощью ранее подготовленного ледяного sACSF суспензии. - Изолировать ствол мозга от головного мозга и его костлявые encasing с помощью лезвия бритвы (#11 прямо), чтобы сократить parieto-затылочной слизи и на caudal medulla.
- Установите изолированный ствол ствола вентраль конец вниз на ранее вырезать трапециевидный полистирол блока. Удалить избыток жидкости вокруг расчлененных тканей с фитильом бумаги для обеспечения хорошей ткани прилипения к стадии резки.
ПРИМЕЧАНИЕ: Блок полистирола разрезается в трапециевидной форме, чтобы обеспечить ростральное окончание среднего мозга подходит и сужается в спинной мозг. - Используйте клей цианоакрилата, чтобы исправить блок полистирола с прикрепленным стволом мозга rostral конец до стадии резки.
- Используя передовую скорость 0,16 мм/с и амплитуду вибрации 3,00 мм, приготовьте 200 мкм поперечные ломтики MVN.
ПРИМЕЧАНИЕ: Местоположение MVN определяется с помощью атласа мозга мыши Paxinos и Franklin (рисунки 79-89)20. MVN (перечисленное как MVe в атласе) лежит немедленно ventrolateral к 4th желудочку и самое большое справедливо перед прикреплением мозжечка (между более низкимcolliculi и obex). - Используйте пластиковую пипетку для переноса ломтиков на диск фильтровальной бумаги, сидящий в карбогенированном ACSF при 25 градусах Цельсия в течение по крайней мере 30 минут до записи.
4. Инструменты
- Используйте стандартную электрофизиологическую установку для выполнения цельноклеточных методов зажима21.
- Подготовка микропайпетов с помощью двухступенчатого протокола (тепловой шаг 1: 70; шаг тепла 2: 45) на выдвижной микропайпет (см. таблицуматериалов). Микропайпеты должны иметь окончательное сопротивление в диапазоне 3-5 МЗ с внутренним раствором при размещении в ванне.
ПРИМЕЧАНИЕ: Настройки, используемые могут варьироваться в зависимости от температуры в комнате и может меняться довольно часто.
5. Цельнокленочная патч зажим электрофизиологии
- Для получения записей зажима цельноклеточного зажима от отдельных нейронов в MVN, внутри пипетки на основеK-основе используется внутреннее решение.
- Перенесите один кусочек ткани из инкубационного камеры в камеру записи и закрепите срез с помощью нейлоновой нити на U-образном весе. Непрерывно пронизывает ежекамерную камеру карбогенированным-ACSF при скорости потока 3 мл/мин.
- После заполнения микропайпета внутренним раствором, найдите MVN с помощью объектива с низкой мощностью (10x) объективной линзы. Используя высокомощный (40x) цель, отдельные нейроны в пределах MVN могут быть расположены.
ПРИМЕЧАНИЕ: Качество клеток имеет важное значение для обеспечения качества записей и долговечности ячейки при попытке достичь конфигурации всей ячейки. Хорошая клетка продемонстрирует сферическую форму, отражающую клеточную мембрану и невидимое ядро. Плохая клетка будет иметь большое видимое ядро (яйцо-как) и опухшие / сжатые внешний вид. - Перед нарушением ткани с пипеткой, применить небольшое количество положительного давления, чтобы оттолкнуть мусор анатички от кончика пипетки.
- Переместите пипетку с помощью микроманипулятора к выбранному нейрону, и на нейронной мембране должна образовываться небольшая ямочка. Отпустите положительное давление и примените небольшое количество отрицательного давления.
- Как только уплотнение 1 ГЗ будет достигнуто, нанесите нежное короткое и резкое положительное давление на держатель пипетки через порт всасывания, чтобы разорвать мембрану и создать конфигурацию цельноклеточных элементов.
- Сделать цельноклеточные записи зажима с использованием стандартных методов21,22.
6. Применение синусоидального и стохасального шума к индивидуальным медиальным нейронам ядер ядер
- Применяйте стохастический и синусоидальный шум на диапазоне амплитуд от 3 до 24 pA для определения порога нейронов и скорости стрельбы.
- Определить сенсорный порог, группируя более низкую и более высокую интенсивность стимула и выполнять ANOVA наблюдать любые различия (как показано на дополнительнойрисунке 1).
- Рассчитать среднюю скорость стрельбы в течение 10 с период, когда деполяризирующий текущий шаг был/будет введен для каждого отдельного текущего уровня (т.е. 7 общих эпизодов; Рисунок 1).
- Используйте значения средней скорости стрельбы для генерации скорости стрельбы по сравнению с текущим графиком и выполняйте линейный регрессионный анализ для определения градиента линии наилучшего соответствия. Градиент линии наилучшей подгонки свидетельствует о нейронной усилении22.
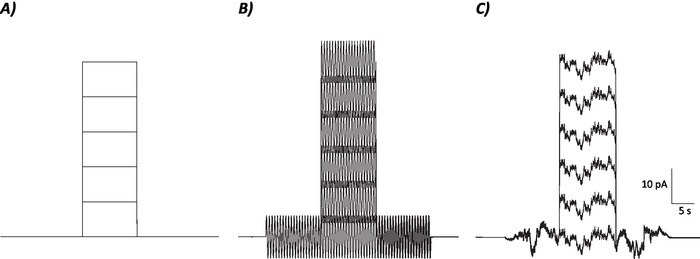
Рисунок 1: Диаграммные профили контрольных, синусоидальных и стохастических шумовых протоколов. (A) Контроль (без шума) протоколы применяются к MVN нейронов. (B) Синусоидальный протокол шума с частотой 2 Гц . (C) С ) Стохастический шум протоколов, где большая часть спектра мощности составляет 2 Гц. Каждый протокол, представленный здесь, имеет амплитуду в размере 6 pA с 10 s деполяризующим током, увеличивающимся на 10 pA до 50 pA. Истинный стимул не имеет деполяризации текущего шага и, следовательно, первый эпизод этих протоколов для определения нейронов изменения усиления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Access restricted. Please log in or start a trial to view this content.
Результаты
Первоначальные записи могут предоставить информацию о воздействии, что синусоидальный и стохастический шум на базальные скорость стрельбы отдельных нейронов MVN и как стимулы эффект усиления нейронов. Рисунок 2 показывает, что ни синусоидальный, ни стохастич...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Влияние гальванической вестибулярной стимуляции (GVS) на вестибулярную системубыло выделено в vivo у людей 3,13,23,морских свинок14, грызунов18 и нечеловеческих приматов24. Однако ни одно из этих исследов?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы не заявляют о конфликте интересов.
Благодарности
SPS была поддержана Университетом Сиднея аспирантуры научно-исследовательской стипендии.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
Ссылки
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены