需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
随机噪声在Vitro内评估中庭前核神经元敏感性的随机噪声应用
摘要
人类前庭刺激显示前庭功能改善。然而,不知道这些影响是如何发生的。在这里,我们描述如何应用正弦和随机电噪声,并评估C57BL/6小鼠中单个内庭核神经元中适当的刺激幅度。
摘要
电前庭刺激(GVS)已被证明改善平衡措施的个人与平衡或前庭损伤。建议是由于随机共振 (SR) 现象,该现象被定义为将低电平/子阈值刺激应用于非线性系统,以增加对较弱信号的检测。然而,SR如何表现出其对人类平衡的积极影响,目前仍不得而知。这是正弦和随机噪声对单个神经元影响的首次演示之一。使用全细胞贴片夹电生理学,正弦噪声和随机噪声可以直接应用于C57BL/6小鼠的中庭前庭核(MVN)的单个神经元。在这里,我们演示如何确定 MVN 神经元的阈值,以确保正弦和随机刺激是亚阈值,并因此确定每种类型的噪声对 MVN 神经元增益的影响。结果表明,亚阈值正弦噪声和随机噪声可以调节MVN中单个神经元的灵敏度,而不影响基底发射速率。
引言
前庭(或平衡)系统通过整合听觉、自体、躯体感觉和视觉信息来控制我们的平衡感。前庭系统的退化已被证明是作为年龄的函数发生的,并可能导致平衡赤字1,2。然而,针对前庭系统功能的疗法很少。
电前庭刺激(GVS)已被证明改善平衡措施,自主功能和其他感官模式在人类3,4,5,6。这些改进据说是由于随机共振(SR)现象,即通过应用亚阈值噪声7,8来检测非线性系统中较弱的信号。这些研究表明,静态9、10和动态11、12平衡和前庭输出测试(如眼计数器卷(OCR)13)有所改善。然而,许多这些研究使用了不同的刺激参数组合,如白噪声9,彩色噪声13,不同的刺激频率范围和阈值技术。因此,最佳刺激参数仍未知,该协议有助于确定最有效的参数。除了刺激参数,刺激的类型在治疗和实验疗效也很重要。上述工作在人类中是使用电噪声刺激进行的,而大部分体内动物的工作都使用了机械14、15或光遗传学16噪声刺激。该协议将使用电噪声来检查对前庭核的影响。
此前,在松鼠猴体内进行了GVS刺激原发性前庭亲子手术,在松鼠猴17只、钦奇利亚18只、鸡胚胎15只和豚鼠14只身上进行了手术。然而,这些研究中只有两项研究审查了GVS对原位前庭14、15的增益的影响。这些实验是在体内进行的,这意味着不能确定前庭核上施加的确切刺激模式。据我们所知,只有另外一项研究将随机噪声应用于中枢神经系统中个别酶分离的神经元19。然而,在中央前庭核没有进行任何实验来评估适当的刺激参数和阈值技术,使得该协议在确定刺激作用对前庭内单个神经元的影响时更加精确核。
在这里,我们描述如何将正弦和随机(电)噪声直接应用于中前庭核(MVN)中的单个神经元,确定神经元阈值并测量增益/灵敏度的变化。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验协议均获得悉尼大学动物伦理委员会的批准(批准协议号:2018/1308)。
1. 动物
注:老鼠是从澳大利亚啮齿动物中心获得的。珀斯,澳大利亚),并在悉尼大学医学基金会建设动物设施举行。
- 保持小鼠正常12小时光/暗循环与环境富集。
- 使用雄性和雌性C57BL/6小鼠(3~5周大)进行所有实验。
2. 准备解决方案
- 制备 1 L 人工脑脊液 (ACSF),由 29 mM NaHCO3、 11 mM 葡萄糖、 120 mM NaCl、3.3 mM KCl、1.4 mM NaH2PO4、2.2 mM MgCl 2、2.77 mM CaCl2组成。
- 制备 200 mL 的蔗糖-ACSF (sACSF) 含有 29 mM NaHCO3, 11 mM 葡萄糖, 241.5 mM 蔗糖, 3.3 mM KCl, 1.4 mM NaH2PO4, 2.2m MgCl2,2.77 mM CaCl2.在将 CaCl2纳入 ACSF 和 sACSF 之前,使用碳素(95 % O2和 5% CO2)气体溶液,以建立 7.4 的 pH 值并避免钙沉淀(云量)。
- 制备 K+基于细胞内的溶液,由 70 mM 葡萄糖酸钾、70 mM KCl、2 mM NaCl、10 mM HEPES、4 mM Mg2-ATP、0.3 mM Na3-GTP 组成;最终pH值为7.3(使用KOH调整)。
注:建议使用0.22 μm过滤器过滤细胞内溶液,并在-20°C下储存0.5 mL等分。
3. 脑干的准备
- 在脑干提取之前,将sACSF与核素平衡,并在-80°C下冷却25分钟,从而形成冰浆。
- 用无二苯还麻醉小鼠(3-5%)氧气饱和(3 mL/min)。一旦后爪反射不存在,用锋利的不锈钢剪刀将鼠标斩首。
- 使用剃须刀(#22圆形)在皮肤上进行下垂切口,露出颅骨。
- 使用一对标准图案剪刀的尖端在 lambda 处做一个小切口,然后沿着纵向裂缝切割。
- 用一对浅弯的皮尔逊龙骨仔细反射成对的骨骼和骨骼。
注:在整个过程中,大脑使用先前准备的冰冷的sACSF浆料在原地持续沐浴。 - 使用剃刀刀(#11直)从前脑及其骨质中分离脑干,以切割胆囊硫酸盐和胆囊。
- 将孤立的脑干通管端安装在先前切割的梯形聚苯乙烯块上。用纸巾芯去除解剖组织周围的多余液体,以确保良好的组织附着力到切割阶段。
注:聚苯乙烯块被切成梯形形状,以确保中脑的玫瑰端适合和锥化到脊髓。 - 使用氰丙烯酸酯胶水固定聚苯乙烯块与附加的脑干罗斯拉尔端到切割阶段。
- 使用 0.16 mm/s 的前进速度和 3.00 mm 的振动振幅,准备 200 μm MVN 横片。
注:MVN的位置是使用帕克西诺斯和富兰克林小鼠大脑地图集(图79-89)20确定。MVN(在地图集中列为MVVe)立即位于第4个心室的侧边,是小脑附着(在劣质小孔和奥贝克斯之间)之前最大的一个。 - 使用塑料修剪的移液器将切片转移到在 25°C 的卡博格化 ACSF 中,在录制前至少 30 分钟。
4. 仪器
- 使用标准电生理设置执行全细胞贴片钳技术21。
- 使用微移液器拉拔器上的两步协议(热步骤 1:70;热步骤 2:45)准备微移液器(参见材料表)。微移液器在置于浴缸中时,其最终电阻范围应为 3~5 MΩ,并带有内部溶液。
注:使用的设置可能因室内温度而异,并且可能会频繁更改。
5. 全细胞贴片夹电生理学
- 为了从MVN中的单个神经元获得全细胞贴片夹记录,在记录移液器中使用基于K+的内部溶液。
- 将单个组织切片从孵育室转移到记录室,并使用 U 形重量上的尼龙螺纹固定切片。在25°C下以3 mL/min的流速连续注入记录室。
- 用内部溶液填充微移液后,使用低功耗(10x)物镜定位MVN。使用高功率 (40x) 目标,可以定位 MVN 中的单个神经元。
注:在尝试实现全细胞配置时,细胞质量对于确保细胞的质量记录和耐用性至关重要。一个好的细胞将展示球形,反射细胞膜和无形的细胞核。坏细胞将有一个大的可见细胞核(像鸡蛋一样)和肿胀/收缩的外观。 - 在用移液器破坏组织之前,施加少量正压,将碎屑从移液器尖端推开。
- 使用微操作器将移液器移向所选神经元,在神经元膜上应形成一个小酒窝。释放正压并施加少量负压。
- 一旦达到 1 GΩ 密封,通过吸口向移液器支架施加轻柔的短而尖锐的正压,以破裂膜并创建全单元配置。
- 使用标准技术21,22进行全细胞电流钳位录音。
6. 将正弦噪声和随机噪声应用于单个内向核神经元
- 在 3 到 24 pA 的振幅范围内应用随机噪声和正弦噪声,以确定神经元阈值和发射速率。
- 通过对较低和较高的刺激强度进行分组来确定感觉阈值,并执行 ANOVA 以观察任何差异(如补充图 1所示)。
- 计算在 10 s 期间,每个单个电流水平(即 7 个总发作)注入去极化电流步长/将注入的平均发射速率;图 1.
- 使用平均发射速率值生成与当前图的触发率,并执行线性回归分析以确定最佳拟合线的渐变。最佳拟合线的梯度表示神经元增益22。
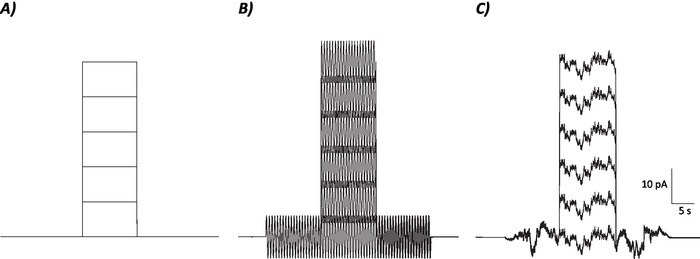
图1:控制图谱、正弦噪声和随机噪声协议。(A) 控制(无噪声)协议适用于 MVN 神经元.(B) 频率为 2 Hz 的正弦噪声协议 . (C) 随机噪声协议,其中大多数功率谱为 ±2 Hz。此处介绍的每个协议都有 ±6 pA 的振幅,10 s 去极化电流增加 10 pA 到 50 pA。真正的刺激没有去极化电流步骤,因此是这些协议的第一集,以确定神经元增益的变化。请点击此处查看此图的较大版本。
Access restricted. Please log in or start a trial to view this content.
结果
初始记录可以提供有关正弦噪声对单个 MVN 神经元基底发射速率的影响以及刺激如何影响神经元增益的信息。图2显示,与对照(无噪声)记录相比,正弦噪声和随机噪声均无变化MVN神经元的基底发射速率。此信息对于确定单个神经元的阈值至关重要。在将电前庭刺激应用于人类过程中,执行感官阈值任务,以确保刺激是亚阈值13。亚阈值刺激...
Access restricted. Please log in or start a trial to view this content.
讨论
电前庭刺激(GVS)对前庭系统的影响在人类体内已经突出3,13,23,豚鼠14,啮齿动物18和非人类灵长类动物24。然而,这些研究都没有评估电噪声对前庭系统中单个神经元敏感性的直接影响。在这里,我们演示了随机噪声首次在体外应用,直接应用于单个内向前庭核(MVN)?...
Access restricted. Please log in or start a trial to view this content.
披露声明
提交人声明没有利益冲突。
致谢
SPS 得到了悉尼大学研究生研究奖学金的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
参考文献
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。