Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Stochastische Lärmanwendung zur Beurteilung der medialen vestibulären Nukleus-Neuron-Empfindlichkeit in vitro
In diesem Artikel
Zusammenfassung
Die galvanische vestibuläre Stimulation beim Menschen zeigt Verbesserungen in der vestibulären Funktion. Es ist jedoch nicht bekannt, wie diese Effekte auftreten. Hier beschreiben wir, wie man sinusförmiges und stochastisches elektrisches Rauschen aufträgt und geeignete Stimulusamplituden in einzelnen medialen vestibulären Nukleusneuronen in der C57BL/6-Maus auswertet.
Zusammenfassung
Es hat sich gezeigt, dass die galvanische vestibuläre Stimulation (GVS) die Gleichgewichtsmaße bei Personen mit Gleichgewichts- oder vestibulären Beeinträchtigungen verbessert. Dies wird aufgrund des Stochastischen Resonanzphänomens (SR) vorgeschlagen, das als Anwendung eines Low-Level-/Unterschwellenreizes auf ein nichtlineares System definiert ist, um die Erkennung schwächerer Signale zu erhöhen. Es ist jedoch noch nicht bekannt, wie SR seine positiven Auswirkungen auf das menschliche Gleichgewicht zeigt. Dies ist eine der ersten Demonstrationen der Auswirkungen von sinusförmigen und stochastischen Lärm auf einzelne Neuronen. Mit Hilfe der Ganzzell-Patchklemmenelektrophysiologie können sinusförmige und stochastische Geräusche direkt auf einzelne Neuronen im medialen vestibulären Kern (MVN) von C57BL/6-Mäusen angewendet werden. Hier zeigen wir, wie die Schwelle von MVN-Neuronen zu bestimmen, um sicherzustellen, dass die sinusförmigen und stochastischen Reize unterschwellig sind und daraus die Auswirkungen bestimmen, die jede Art von Rauschen auf den neuronalen Gewinn von MVN hat. Wir zeigen, dass unterschwelliges sinusförmiges und stochastisches Rauschen die Empfindlichkeit einzelner Neuronen im MVN modulieren kann, ohne die Basalfeuerraten zu beeinflussen.
Einleitung
Das vestibuläre (oder Gleichgewichts-)System steuert unseren Gleichgewichtssinn durch die Integration von auditiven, propriozeptiven, somatosensorischen und visuellen Informationen. Die Verschlechterung des vestibulären Systems hat sich als Funktion des Alters erwiesen und kann zu Gleichgewichtsdefiziten1,2führen. Therapien, die auf das Funktionieren des vestibulären Systems abzielen, sind jedoch rar.
Galvanische Vestibuläre Stimulation (GVS) hat gezeigt, dass Balance-Maßnahmen zu verbessern, autonome Funktion und andere sensorische Modalitäten beim Menschen3,4,5,6. Diese Verbesserungen sind angeblich auf das Phänomen der Stochastischen Resonanz (SR) zurückzuführen, das die Zunahme der Detektion schwächerer Signale in nichtlinearen Systemen durch die Anwendung von Unterschwellenrauschen7,8ist. Diese Studien haben Verbesserungenbei statischen 9,10 und dynamischen11,12 Balance- und vestibulären Ausgangstests wie Ocular Counter Roll (OCR)13gezeigt. Viele dieser Studien haben jedoch verschiedene Kombinationen von Stimulusparametern wie weißes Rauschen9, farbiges Rauschen13, verschiedene Stimulusfrequenzbereiche und Schwellenwerttechniken verwendet. Daher bleiben optimale Stimulusparameter unbekannt und dieses Protokoll kann bei der Bestimmung der effektivsten Parameter helfen. Neben Stimulusparametern ist die Art des Stimulus auch bei der therapeutischen und experimentellen Wirksamkeit wichtig. Die oben genannten Arbeiten beim Menschen wurden mit elektrischen Lärmreizen durchgeführt, während ein Großteil der in vivo Tierischen Arbeit mechanische14,15 oder optogenetische16 Lärmreize verwendet hat. Dieses Protokoll wird elektrisches Rauschen verwenden, um die Auswirkungen auf vestibuläre Kerne zu untersuchen.
Zuvor wurde die Anwendung von GVS zur Stimulierung der primären vestibulären Afferents in vivo bei Eichhörnchenaffen17, Chinchillas18, Hühnerembryonen15 und Meerschweinchen14durchgeführt. Allerdings untersuchten nur zwei dieser Studien die Auswirkungen von GVS auf den Gewinn von primären vestibulären Afferents14,15. Diese Experimente wurden in vivo durchgeführt, was bedeutet, dass die genauen Stimulationsmuster, die vestibulären Kernen auferlegt werden, nicht bestimmt werden können. Unserer Kenntnis nach hat nur eine andere Studie stochastisches Rauschen auf einzelne enzymatisch dissoziierte Neuronen im Zentralnervensystem angewendet19. Es wurden jedoch keine Experimente in den zentralen vestibulären Kernen durchgeführt, um geeignete Stimulusparameter und Schwellenwerttechniken zu bewerten, wodurch dieses Protokoll bei der Bestimmung der Stimuluseffekte auf einzelne Neuronen innerhalb der vestibulären Kerne.
Hier beschreiben wir, wie man sinusförmiges und stochastisches (elektrisches) Rauschen direkt auf einzelne Neuronen im medialen vestibulären Kern (MVN) aufträgt, die neuronale Schwelle bestimmt und Veränderungen der Gewinn-/Empfindlichkeit misst.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle beschriebenen Experimentellen Protokolle wurden von der Animal Ethics Committee der University of Sydney genehmigt (genehmigte Protokollnummer: 2018/1308).
1. Tiere
HINWEIS: Mäuse wurden aus dem Australian Rodent Centre (ARC; Perth, Australien) und in der Medical Foundation Building Animal Facility der University of Sydney.
- Halten Sie die Mäuse auf einem normalen 12 h Licht/Dunkel-Zyklus mit Umweltanreicherung.
- Verwenden Sie männliche und weibliche C57BL/6-Mäuse (3–5 Wochen alt) für alle Experimente.
2. Vorbereitung von Lösungen
- Bereiten Sie 1 L künstliche Zerebrospinalflüssigkeit (ACSF) bestehend aus 29 mM NaHCO3, 11 mM Glukose, 120 mM NaCl, 3,3 mM KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2.
- Bereiten Sie 200 ml Saccharose-ACSF (sACSF) mit 29 mM NaHCO3, 11 mM Glukose, 241,5 mM Saccharose, 3,3 mM KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2vor. Vor der Aufnahme von CaCl2 in die ACSF und sACSF, Gas die Lösungen mit Carbogen (95 % O2 und 5 % CO2 ), um einen pH-Wert von 7,4 zu etablieren und Kalziumfällung (Trübung) zu vermeiden.
- Bereiten K+-basierte intrazelluläre Lösung bestehend aus 70 mM Kaliumgluconat, 70 mM KCl, 2 mM NaCl, 10 mM HEPES, 4 mM EGTA, 4 mM Mg2-ATP, 0,3 mM Na3-GTP; mit einem endgültigen pH-Wert von 7,3 (angepasst mit KOH).
HINWEIS: Es wird empfohlen, intrazelluläre Lösungen mit 0,22 m Filtern zu filtern und 0,5 ml Aliquots der Lösung bei -20 °C zu speichern.
3. Vorbereitung des Brainstem
- Vor der Hirnstammextraktion den sACSF mit Carbogen ausstatten und bei -80 °C 25 min abkühlen lassen, so dass eine Eisschlämme gebildet wird.
- Anästhesisieren Sie die Maus mit Isofluran (3–5 %) sauerstoffgesättigt (3 ml/min). Sobald die Hinterpfotenreflexe fehlen, enthaupten Sie die Maus mit einer scharfen Edelstahlschere.
- Setzen Sie den Schädel aus, indem Sie einen sagittalen Schnitt in der Haut mit einer Rasierklinge (#22 abgerundet) machen.
- Mit dem spitzen Ende eines PaarStandard-Muster Schere machen einen kleinen Schnitt am Lambda und entlang der Längsspalte geschnitten.
- Reflektieren Sie vorsichtig die gepaarten parietalen Knochen und die okzipitalen Knochen mit einem Paar flach-biegsamer Pearson-Rongeurs.
HINWEIS: Während dieses gesamten Eingriffs wird das Gehirn kontinuierlich vor Ort mit der zuvor vorbereiteten eiskalten SACSF-Gülle gebadet. - Isolieren Sie den Hirnstamm aus dem Vorderhirn und seine knöcherne Ummantelung mit einer Rasierklinge (#11 gerade), um den parieto-okzipitalen Sulcus und an der kaudalen Medulla zu schneiden.
- Montieren Sie das isolierte Brainstem ventrale Ende auf einem zuvor geschnittenen trapezförmigen Polystyrolblock. Entfernen Sie überschüssige Flüssigkeit um das sezierte Gewebe mit einem Docht aus Gewebepapier, um eine gute Gewebehaftung an der Schneidstufe zu gewährleisten.
HINWEIS: Der Polystyrolblock wird in trapezförmiger Form geschnitten, um sicherzustellen, dass das rostrale Ende des Mittelhirns in das Rückenmark passt und verjüngen. - Verwenden Sie Cyanoacrylatkleber, um den Polystyrolblock mit dem angeschlossenen Brainstem rostralen Ende bis zur Schnittstufe zu fixieren.
- Bereiten Sie mit einer Vorgeschwindigkeit von 0,16 mm/s und einer Schwingungsamplitude von 3,00 mm 200 m Querscheiben des MVN vor.
HINWEIS: Die Position des MVN wird mit dem Paxinos- und Franklin-Maus-Gehirnatlas (Abbildungen 79–89)20bestimmt. Das MVN (im Atlas als MVe aufgeführt) liegt unmittelbar ventrolateral zum 4. Ventrikel und ist der größte direkt vor der Befestigung des Kleinhirns (zwischen dem minderwertigen Colliculi und dem Obex). - Verwenden Sie eine kunststoffbeschnittene Pipette, um Scheiben vor der Aufnahme mindestens 30 min lang in einem karbogenierten ACSF bei 25 °C zu übertragen.
4. Instrumente
- Verwenden Sie ein elektrophysiologisches Standard-Setup, um ganzzellige Patchklemmen-Techniken durchzuführen21.
- Bereiten Sie Mikropipetten mit einem zweistufigen Protokoll (Wärmeschritt 1: 70; Wärmeschritt 2: 45) auf einem Mikropipette-Puller vor (siehe Materialtabelle). Mikropipetten sollten einen Endwiderstand zwischen 3 und 5 M und interner Lösung aufweisen, wenn sie in das Bad gelegt werden.
HINWEIS: Die verwendeten Einstellungen können je nach Temperatur im Raum variieren und können sich recht häufig ändern.
5. Ganzzellige Patchklemme Elektrophysiologie
- Um Ganzzell-Patchklemmenaufnahmen von einzelnen Neuronen im MVN zu erhalten, wird innerhalb der Aufnahmepipette eine K +-basierte interne Lösung verwendet.
- Übertragen Sie eine einzelne Gewebescheibe aus der Inkubationskammer in die Aufnahmekammer und sichern Sie die Scheibe mit einem Nylonfaden auf einem U-förmigen Gewicht. Kontinuierliche durchdringen die Aufnahmekammer mit Karbogenat-ACSF bei 25 °C bei einem Durchfluss von 3 ml/min.
- Nachdem Sie eine Mikropipette mit interner Lösung gefüllt haben, lokalisieren Sie den MVN mit einer low power (10x) Objektivlinse. Mit einem Hochleistungsobjektiv (40x) können einzelne Neuronen innerhalb des MVN lokalisiert werden.
HINWEIS: Die Zellqualität ist entscheidend, um die Qualität der Aufnahmen und die Haltbarkeit der Zelle zu gewährleisten, wenn sie versucht, die Ganzzellenkonfiguration zu erreichen. Eine gute Zelle zeigt sphärische Form, eine reflektierende Zellmembran und einen unsichtbaren Kern. Eine schlechte Zelle hat einen großen sichtbaren Kern (ei-like) und ein geschwollenes/geschrumpftes Aussehen. - Bevor Sie das Gewebe mit der Pipette durchbrechen, wenden Sie eine kleine Menge an positivem Druck an, um Schmutz von der Pipettenspitze wegzuschieben.
- Bewegen Sie die Pipette mit dem Mikromanipulator in Richtung des gewählten Neurons und ein kleines Dimple sollte sich auf der neuronalen Membran bilden. Lassen Sie positiven Druck los und wenden Sie eine kleine Menge an Unterdruck an.
- Sobald eine 1 G-Zoll-Dichtung erreicht ist, wenden Sie einen sanften kurzen und scharfen positiven Druck auf den Pipettenhalter durch den Sauganschluss an, um die Membran zu brechen und eine Ganzzellkonfiguration zu erstellen.
- Machen Sie Ganzzellstromklemmenaufnahmen mit Standardtechniken21,22.
6. Anwendung von sinusförmigem und stochastischem Rauschen auf einzelne mediale Vestibularnukleus Neuronen
- Wenden Sie das stochastische und sinusförmige Rauschen bei einer Reihe von Amplituden von 3 bis 24 pA an, um die neuronale Schwelle und Die Feuerrate zu bestimmen.
- Bestimmen Sie den sensorischen Schwellenwert, indem Sie niedrigere und höhere Stimulusintensitäten gruppieren, und führen Sie eine ANOVA durch, um Unterschiede zu beobachten (siehe Ergänzende Abbildung 1).
- Berechnen Sie die durchschnittliche Abschussrate über den 10 s-Zeitraum, in dem der depolarisierende Stromschritt für jede einzelne aktuelle Stufe injiziert wurde/wird (d. h. 7 Gesamtepisoden; Abbildung 1).
- Verwenden Sie die durchschnittlichen Brennrate-Werte, um eine Brennrate im Vergleich zum aktuellen Diagramm zu generieren, und führen Sie eine lineare Regressionsanalyse durch, um den Gradienten der Linie der besten Anpassung zu bestimmen. Der Gradient der Linie der besten Passung ist bezeichnend für den neuronalen Gewinn22.
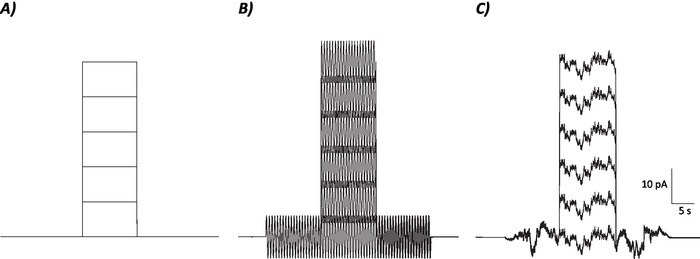
Abbildung 1: Diagrammprofile von Steuerungs-, sinusförmigen und stochastischen Rauschprotokollen. (A) Kontrollprotokolle (kein Rauschen) werden auf MVN-Neuronen angewendet. (B) Sinusförmiges Rauschprotokoll mit einer Frequenz von 2 Hz. (C) Stochastische Rauschprotokolle, bei denen der größte Teil des Leistungsspektrums 2 Hz beträgt. Jedes hier vorgestellte Protokoll hat eine Amplitude von 6 pA mit einem Depolarisierungsstrom von 10 s, der um 10 pA bis zu 50 pA ansteigt. Der wahre Stimulus hat keinen depolarisierenden aktuellen Schritt und ist daher die erste Episode dieser Protokolle, um neuronale Gain-Änderungen zu bestimmen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Erste Aufnahmen können Informationen über die Auswirkungen liefern, die sinusförmiges und stochastisches Rauschen auf die Basalfeuerraten einzelner MVN-Neuronen haben und wie die Reize den Gewinn von Neuronen wirken. Abbildung 2 zeigt, dass weder sinusförmige noch stochastische Geräusche die Basalfeuerraten von MVN-Neuronen im Vergleich zu Kontrollaufzeichnungen (kein Rauschen) verändern. Diese Informationen sind entscheidend für die Bestimmung der Schwelle der ein...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Auswirkungen der galvanischen vestibulären Stimulation (GVS) auf das vestibuläre System wurde in vivo beim Menschen hervorgehoben3,13,23, Meerschweinchen14, Nagetiere18 und nicht-menschliche Primaten24. Jedoch, keine dieser Studien haben die direkten Auswirkungen von elektrischem Rauschen auf die Empfindlichkeit der einzelnen Neuronen im vestibulären ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
SPS wurde vom postgradualen Forschungsstipendium der University of Sydney unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
Referenzen
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten