È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Applicazione di rumore stocastico per la valutazione della sensibilità mediale del neurone del nucleo in vitro
In questo articolo
Riepilogo
La stimolazione vestibolare galvanica nell'uomo presenta miglioramenti nella funzione vestibolare. Tuttavia, non è noto come si verificano questi effetti. Qui, descriviamo come applicare il rumore elettrico sinusoidale e stocastico e valutare le appropriate ampiezze di stimolo nei singoli neuroni del nucleo vestibolare mediale nel topo C57BL/6.
Abstract
La stimolazione vestibolare galvanica (GVS) ha dimostrato di migliorare le misure di equilibrio negli individui con deficit di equilibrio o vestibolare. Ciò è stato proposto per essere dovuto al fenomeno di risonanza stocastica (SR), che è definito come l'applicazione di uno stimolo di basso livello / sottosoglia a un sistema non lineare per aumentare il rilevamento dei segnali più deboli. Tuttavia, non è ancora noto come la SR mostri i suoi effetti positivi sull'equilibrio umano. Questa è una delle prime dimostrazioni degli effetti del rumore sinusoidale e stocastico sui singoli neuroni. L'utilizzo di elettrofisiologia a morsetto a morsetto a tutta cellula, il rumore sinusoidale e stocastico può essere applicato direttamente ai singoli neuroni nel nucleo vestibolare mediale (MVN) dei topi C57BL/6. Qui dimostriamo come determinare la soglia dei neuroni MVN al fine di garantire che gli stimoli sinusoidali e stocastici siano sottosoglia e da questo, determinare gli effetti che ogni tipo di rumore ha sul guadagno neuronale MVN. Mostriamo che il rumore sinusoidale e stocastico sottosoglia può modulare la sensibilità dei singoli neuroni nel MVN senza influenzare i tassi di cottura basale.
Introduzione
Il sistema vestibolare (o equilibrio) controlla il nostro senso dell'equilibrio integrando informazioni uditive, propriocettive, somatosensoriali e visive. È stato dimostrato che la degradazione del sistema vestibolare si verifica in funzione dell'età e può comportare disavanzi di bilancio1,2. Tuttavia, le terapie che mirano al funzionamento del sistema vestibolare sono scarse.
Galvanic Vestibular Stimulation (GVS) ha dimostrato di migliorare le misure di equilibrio, il funzionamento autonomo e altre modalità sensoriali all'interno di esseri umani3,4,5,6. Si dice che questi miglioramenti siano dovuti al fenomeno risonanza stocastica (SR), che è l'aumento del rilevamento di segnali più deboli nei sistemi non lineari attraverso l'applicazione di rumore sottosoglia7,8. Questi studi hanno mostrato miglioramenti nei test statici9,10 e dinamici11,12 di bilanciamento e nei test di output vestibolare come Ocular Counter Roll (OCR)13. Tuttavia, molti di questi studi hanno utilizzato diverse combinazioni di parametri di stimolo come il rumore bianco9, rumore colorato13, diverse gamme di frequenza di stimolo e tecniche di soglia. Pertanto, i parametri di stimolo ottimali rimangono sconosciuti e questo protocollo può aiutare a determinare i parametri più efficaci. Oltre ai parametri di stimolo, il tipo di stimolo è importante anche nell'efficacia terapeutica e sperimentale. Il lavoro di cui sopra negli esseri umani è stato eseguito utilizzando stimoli di rumore elettrico, mentre gran parte del lavoro animale in vivo ha utilizzato stimoli meccanici14,15 o optogenetici16 rumore. Questo protocollo utilizzerà il rumore elettrico per esaminare gli effetti sui nuclei vestiboli.
In precedenza, l'applicazione di GVS per stimolare gli afferenti vestiboli primari era stata eseguita in vivo nelle scimmie scoiattolo17, cincillà18, embrioni di pollo15 e porcellini d'India14. Tuttavia, solo due di questi studi hanno esaminato l'effetto che GVS ha sul guadagno degli afferenti vestiboliprimari primari14,15. Questi esperimenti sono stati eseguiti in vivo, il che significa che non è possibile determinare i modelli precisi di stimolazione imposti ai nuclei vestibolici. A nostra conoscenza, solo un altro studio ha applicato il rumore stocastico ai singoli neuroni enzimaticamente dissociati nel sistema nervoso centrale19. Tuttavia, non sono stati effettuati esperimenti nei nuclei vestiboliri centrali per valutare i parametri di stimolo appropriati e le tecniche di soglia, rendendo questo protocollo più preciso nel determinare gli effetti di stimolo sui singoli neuroni all'interno del vestibolare Nuclei.
Qui, descriviamo come applicare il rumore sinusoidale e stocastico (elettrico) direttamente ai singoli neuroni nel nucleo vestibolare mediale (MVN), determinare la soglia neuronale e misurare i cambiamenti nel guadagno/sensibilità.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti i protocolli sperimentali descritti sono stati approvati dal Comitato Etico Animale dell'Università di Sydney (numero di protocollo approvato: 2018/1308).
1. Animali
NOT: I topi sono stati ottenuti dall'Australian Rodent Centre (ARC; Perth, Australia) e si è tenuto presso la Medical Foundation Building Animal Facility presso l'Università di Sydney.
- Mantenere i topi su un normale ciclo di luce/buio da 12 h con arricchimento ambientale.
- Utilizzare topi C57BL/6 maschi e femmine (3-5 settimane) per tutti gli esperimenti.
2. Preparazione delle soluzioni
- Preparare 1 L di liquido cerebrospinale artificiale (ACSF) composto da 29 mM NaHCO3, 11 mM di glucosio, 120 mM NaCl, 3,3 mM KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2.
- Preparare 200 mL di saccarosio-ACSF (sACSF) contenente 29 mM NaHCO3, glucosio di 241,5 mM, 3,3 mM di KCl, 1,4 mM NaH2PO4, 2,2 mM MgCl2, 2,77 mM CaCl2. Prima dell'inclusione di CaCl2 nell'ACSF e nella sACSF, gas aree di macchina con carbogeno (95 % O2 e 5 % CO2)per stabilire un pH di 7,4 ed evitare la precipitazione di calcio (nuvolosità).
- Preparare la soluzione intracellulare basata suK,composta da glucona di potassio da 70 mM, 70 mM KCl, 2 mM NaCl, 10 mM HEPES, 4 mM EGTA, 4 mM Mg2-ATP, 0,3 mM Na3-GTP; con un pH finale di 7,3 (regolato utilizzando KOH).
NOTA: Si consiglia di filtrare le soluzioni intracellulari con filtri da 0,22 m e di conservare 0,5 mL della soluzione a -20 gradi centigradi.
3. Preparazione del tronco encefalico
- Prima dell'estrazione del tronco encefalico, ecloclabisci la sACSF con carbogen e raffredda a -80 gradi centigradi per 25 minuti in modo da formare un liquame di ghiaccio.
- Anestesizzare il topo con isoflurane (3-5 %) saturi di ossigeno (3 mL/min). Una volta assenti i riflessi della zampa posteriore, decapitare il topo con forbici affilate in acciaio inossidabile.
- Esporre il cranio facendo un'incisione sagittale nella pelle utilizzando una lama di rasoio (#22 arrotondata).
- Utilizzando l'estremità appuntita di una coppia di forbici modello standard fare una piccola incisione alla lambda e tagliare lungo la fessura longitudinale.
- Riflettere accuratamente le ossa parietali accoppiate e le ossa occipitali utilizzando un paio di Pearson rongeurs poco profondi.
NOT: Durante tutta questa procedura il cervello viene continuamente bagnato in situ utilizzando il liquame sACSF ghiacciato precedentemente preparato. - Isolare il tronco encefalico dal prosencefalo e la sua incasso osseo utilizzando una lama di rasoio (#11 dritto) per tagliare il solco parieto-occipitale e alla medulla caudale.
- Montare il ventrale del tronco encefalico isolato terminare su un blocco di polistirolo trapezoidale precedentemente tagliato. Rimuovere il liquido in eccesso intorno al tessuto sezionato con uno stoppino di carta velina per garantire una buona adesione del tessuto alla fase di taglio.
NOT: Il blocco di polistirolo viene tagliato in una forma trapezoidale, per garantire l'estremità rostrale del midbrain si adatta e si assottiglia nel midollo spinale. - Utilizzare colla cianoacrilata per fissare il blocco di polistirolo con il tronco encefalico attaccato fine rostrale fino alla fase di taglio.
- Utilizzando una velocità di avanzamento di 0,16 mm/s e un'ampiezza di vibrazione di 3,00 mm, preparate 200 m di sezione trasversale del MVN.
NOT: La posizione del MVN viene determinata utilizzando l'atlante del cervello di paxinos e Franklin (Figura 79-89)20. L'MVN (elencato come MVe in atlante) si trova immediatamente ventrolaterale al ventricolo 4th ed è più grande proprio prima dell'attaccamento del cervelletto (tra colliculi inferiori e obex). - Utilizzare una pipetta tagliata in plastica per trasferire le fette su un disco di carta filtrante seduto in ACSF carbogenato a 25 gradi centigradi per almeno 30 minuti prima della registrazione.
4. Strumenti
- Utilizzare una configurazione elettrofisiologica standard per eseguire tecniche di morsetto delle patch intercellulari21.
- Preparare le micropipette utilizzando un protocollo in due fasi (passaggio di calore 1: 70; passaggio di calore 2: 45) su un eseguitore a micropipette (vedere la tabella dei materiali). Le micropipette devono avere una resistenza finale che va da 3 a 5 M, con soluzione interna quando vengono collocate nella vasca da bagno.
NOT: Le impostazioni utilizzate possono variare a seconda della temperatura all'interno della stanza e possono cambiare abbastanza frequentemente.
5. Elettrofisiologia del Mordo patch a cellule intere
- Per ottenere registrazioni di morsetti a tutta cell da singoli neuroni nel MVN, all'interno della pipetta di registrazione viene utilizzata una soluzione interna basata suK.
- Trasferire una singola fetta di tessuto dalla camera di incubazione alla camera di registrazione e fissarla utilizzando un filo di nylon su un peso a forma di U. Perfecane continuamente la camera di registrazione con carbogenated-ACSF a 25 gradi centigradi ad una portata di 3 mL/min.
- Dopo aver riempito una micropipetta con soluzione interna, individuare l'MVN utilizzando un obiettivo a bassa potenza (10x). Utilizzando un obiettivo ad alta potenza (40x), singoli neuroni all'interno del MVN possono essere localizzati.
NOT: La qualità delle celle è essenziale per garantire registrazioni di qualità e durata della cella quando si tenta di ottenere la configurazione dell'intera cella. Una buona cellula dimostrerà la forma sferica, una membrana cellulare riflettente e un nucleo invisibile. Una cellula cattiva avrà un grande nucleo visibile (uovo-come) e un aspetto gonfio / ridotto. - Prima di rompere il tessuto con la pipetta, applicare una piccola quantità di pressione positiva per spingere i detriti lontano dalla punta della pipetta.
- Spostare la pipetta utilizzando il micromanipolatore verso il neurone scelto e una piccola fossetta dovrebbe formarsi sulla membrana neuronale. Rilasciare una pressione positiva e applicare una piccola quantità di pressione negativa.
- Una volta raggiunta una leggera guargonza da 1 G, applicare una leggera pressione positiva corta e tagliente al supporto della pipetta attraverso la porta di aspirazione per far risaltare la membrana e creare una configurazione a celle intere.
- Effettuare registrazioni di morsetti di corrente a tutta cell utilizzando tecniche standard21,22.
6. Applicazione del rumore sinusoidale e stocastico ai singoli neuroni del nucleo commerciale mediale
- Applicare il rumore stocastico e sinusoidale a una gamma di ampiezza da 3 a 24 pA per determinare la soglia neuronale e la velocità di cottura.
- Determinare la soglia sensoriale raggruppando intensità di stimolo sempre più in alto ed eseguire un ANOVA per osservare eventuali differenze (come mostrato nella figura supplementare 1).
- Calcolare il tasso medio di cottura nel periodo di 10 s in cui il passo corrente depolarizzante è stato / sarà iniettato per ogni singolo livello attuale (cioè, 7 episodi totali; Figura 1).
- Utilizzare i valori della velocità di attivazione media per generare una velocità di attivazione rispetto al grafico corrente ed eseguire un'analisi di regressione lineare per determinare la sfumatura della linea di adattamento migliore. Il gradiente della linea di migliore vestibilità è indicativo del guadagno neuronale22.
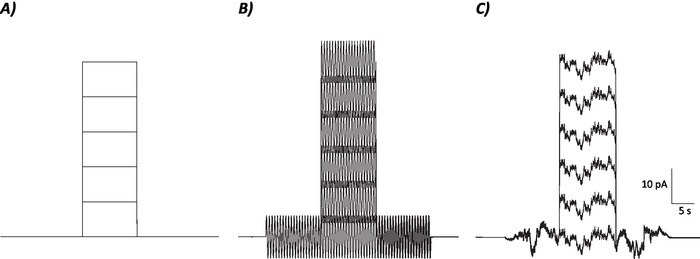
Figura 1: profili di controllo, protocolli di rumore sinusoidale e stocastico. (A) Protocolli di controllo (nessun rumore) applicati ai neuroni MVN. (B) Protocollo di rumore sinusoidale con una frequenza di 2 Hz. (C) Protocolli di rumore stocastico in cui la maggior parte dello spettro di potenza è di 2 Hz. Ogni protocollo qui presentato ha un'ampiezza di 6 pA con una corrente depolarizzante di 10 s aumentando di 10 pA fino a 50 pA. Il vero stimolo non ha un passo corrente depolarizzante ed è quindi il primo episodio di questi protocolli per determinare i cambiamenti di guadagno neuronale. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
Le registrazioni iniziali possono fornire informazioni sugli effetti che il rumore sinusoidale e stocastico hanno sui tassi di cottura basali dei singoli neuroni MVN e su come gli stimoli effetto il guadagno dei neuroni. La figura 2 mostra che né il rumore sinusoidale né quello stocastico cambiano i tassi di cottura basale dei neuroni MVN rispetto alle registrazioni di controllo (senza rumore). Queste informazioni sono cruciali per determinare la soglia dei singoli neur...
Access restricted. Please log in or start a trial to view this content.
Discussione
Gli effetti della stimolazione vestibolare galvanica (GVS) sul sistema vestibolare sono stati evidenziati in vivo in esseri umani3,13,23, cavie14, roditori18 e primati non umani24. Tuttavia, nessuno di questi studi ha valutato l'impatto diretto del rumore elettrico sulla sensibilità dei singoli neuroni nel sistema vestibolare. Qui dimostriamo la prima appli...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
SPS è stato sostenuto dalla borsa di studio di ricerca post-laurea dell'Università di Sydney.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| CaCl | Scharlau | CA01951000 | Used for ACSF and sACSF |
| D-(+)-Glucose | Sigma | G8270 | Used for ACSF and sACSF |
| EGTA | Sigma | E0396-25G | Used for K-based intracellular solution |
| HEPES | Sigma | H3375-25G | Used for K-based intracellular solution |
| KCl | Chem-supply | PA054-500G | Used for ACSF, sACSF and intracellular solution |
| K-gluconate | Sigma | P1847-100G | Used for K-based intracellular solution |
| Mg-ATP | Sigma | A9187-500MG | Used for K-based intracellular solution |
| MgCl | Chem-supply | MA00360500 | Used for ACSF and sACSF |
| Na3-GTP | Sigma | G8877-100MG | Used for K-based intracellular solution |
| NaCl | Chem-supply | SO02270500 | Use for ACSF and intracellular solution |
| NaH2PO4•2H2O | Ajax | AJA471-500G | Used for ACSF and sACSF |
| NaHCO3 | Sigma | S5761-1KG | Used for ACSF and sACSF |
| Sucrose | Chem-supply | SA030-500G | Used for sACSF |
| Isoflurane | Henry Schein | 1169567762 | Used for anaesthetising mice |
| EQUIPMENT | |||
| Borosilicate glass capillaries | Warner instruments | GC150T-7.5 | 1.5 mm OD, 1.16 mm ID, 7.5 cm length |
| Data acquisition software | Axograph | Used for electrophysiology and analysis | |
| Friedmen-Pearson Rongeurs | World precision instruments | 14089 | Used for dissection |
| Micropipette puller | Narishige | PP-830 | Used for micropipette |
| Multiclamp amplifier | Axon instruments | 700B | Used for electrophysiology |
| pH meter | Sper scientific | 860033 | Used for internal solution |
| Standard pattern scissors | FST | 14028-10 | Used for dissection |
| Sutter micromanipulator | Sutter | MP-225/M | Used for electrophysiology |
| Upright microscope | Olympus | BX51WI | Used for electrophysiology |
| Vibratome | Leica | VT1200 | Used for slicing brain tissue |
Riferimenti
- Amiridis, I. G., Hatzitaki, V., Arabatzi, F. Age-induced modifications of static postural control in humans. Neuroscience Letters. 350 (3), 137-140 (2003).
- Iwasaki, S., Yamasoba, T. Dizziness and imbalance in the elderly: age-related decline in the vestibular system. Aging and disease. 6 (1), (2015).
- Fujimoto, C., et al. Noisy galvanic vestibular stimulation induces a sustained improvement in body balance in elderly adults. Scientific Reports. 6, 37575(2016).
- Breen, P. P., et al. Peripheral tactile sensory perception of older adults improved using subsensory electrical noise stimulation. Medical Engineering & Physics. 38 (8), 822-825 (2016).
- Yamamoto, Y., Struzik, Z. R., Soma, R., Ohashi, K., Kwak, S. Noisy vestibular stimulation improves autonomic and motor responsiveness in central neurodegenerative disorders. Annals of Neurology. 58 (2), 175-181 (2005).
- Soma, R., Nozaki, D., Kwak, S., Yamamoto, Y. 1/f noise outperforms white noise in sensitizing baroreflex function in the human brain. Physical Review Letters. 91 (7), 078101(2003).
- Wiesenfeld, K., Moss, F. Stochastic resonance and the benefits of noise: from ice ages to crayfish and SQUIDs. Nature. 373 (6509), 33-36 (1995).
- Moss, F., Ward, L. M., Sannita, W. G. Stochastic resonance and sensory information processing: a tutorial and review of application. Clinical Neurophysiology. 115 (2), 267-281 (2004).
- Goel, R., et al. Using low levels of stochastic vestibular stimulation to improve balance function. PloS one. 10 (8), e0136335(2015).
- Inukai, Y., et al. Effect of noisy galvanic vestibular stimulation on center of pressure sway of static standing posture. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 11 (1), 85-93 (2018).
- Mulavara, A. P., et al. Using low levels of stochastic vestibular stimulation to improve locomotor stability. Frontiers in Systems Neuroscience. 9, 117(2015).
- Iwasaki, S., et al. Noisy vestibular stimulation increases gait speed in normals and in bilateral vestibulopathy. Brain stimulation. 11 (4), 709-715 (2018).
- Serrador, J. M., Deegan, B. M., Geraghty, M. C., Wood, S. J. Enhancing vestibular function in the elderly with imperceptible electrical stimulation. Scientific Reports. 8 (1), 336(2018).
- Kim, J., Curthoys, I. S. Responses of primary vestibular neurons to galvanic vestibular stimulation (GVS) in the anaesthetised guinea pig. Brain Research Bulletin. 64 (3), 265-271 (2004).
- Flores, A., et al. Stochastic resonance in the synaptic transmission between hair cells and vestibular primary afferents in development. Neuroscience. 322, 416-429 (2016).
- Huidobro, N., et al. Brownian Optogenetic-Noise-Photostimulation on the Brain Amplifies Somatosensory-Evoked Field Potentials. Frontiers in Neuroscience. 11, 464-464 (2017).
- Goldberg, J., Ferna, C., Smith, C. Responses of vestibular-nerve afferents in the squirrel monkey to externally applied galvanic currents. Brain Research. 252 (1), 156-160 (1982).
- Baird, R., Desmadryl, G., Fernandez, C., Goldberg, J. The vestibular nerve of the chinchilla. II. Relation between afferent response properties and peripheral innervation patterns in the semicircular canals. Journal of Neurophysiology. 60 (1), 182-203 (1988).
- Remedios, L., et al. Effects of Short-Term Random Noise Electrical Stimulation on Dissociated Pyramidal Neurons from the Cerebral Cortex. Neuroscience. 404, 371-386 (2019).
- Paxinos, G., Franklin, K. B. The mouse brain in stereotaxic coordinates. , Gulf professional publishing. (2004).
- Camp, A. J., Callister, R. J., Brichta, A. M. Inhibitory synaptic transmission differs in mouse type A and B medial vestibular nucleus neurons in vitro. Journal of Neurophysiology. 95 (5), 3208-3218 (2006).
- Camp, A., et al. Attenuated glycine receptor function reduces excitability of mouse medial vestibular nucleus neurons. Neuroscience. 170 (1), 348-360 (2010).
- Iwasaki, S., et al. Effect of Noisy Galvanic Vestibular Stimulation on Ocular Vestibular-Evoked Myogenic Potentials to Bone-Conducted Vibration. Front in Neurology. 8, 26(2017).
- Goldberg, J., Smith, C. E., Fernandez, C. Relation between discharge regularity and responses to externally applied galvanic currents in vestibular nerve afferents of the squirrel monkey. Journal of Neurophysiology. 51 (6), 1236-1256 (1984).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon