A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد وتوصيف أنواع الحمض المناعي للرنا في مسببات الحساسية HDM التي تعدل التهاب الرئة اليوزيوزي
In This Article
Summary
غالبًا ما تحتوي المواد المسببة للحساسية البيئية مثل عث الغبار في المنزل (HDM) على مواد ميكروبية تنشط الاستجابات المناعية الفطرية لتنظيم التهاب الحساسية. البروتوكول المقدم هنا يوضح تحديد أنواع dsRNA في المواد المسببة للحساسية HDM وتوصيف أنشطتها المناعية في تعديل التهاب الرئة اليوزيني.
Abstract
مسببات الحساسية البيئية مثل عث الغبار المنزل (HDM) وغالبا ما تكون في أشكال معقدة تحتوي على كل من البروتينات الحساسية التي تدفع ردود من النوع 2 الشاذة والمواد الميكروبية التي تحفز الاستجابات المناعية الفطرية. تلعب هذه المكونات الميكروبية المرتبطة بالحساسية دورًا مهمًا في تنظيم تطور الحالات الالتهابية من النوع 2 مثل الربو التحسسي. غير أن الآليات الأساسية لا تزال غير محددة إلى حد كبير. البروتوكول المعروض هنا يحدد الخصائص الهيكلية ونشاط في الجسم الحي من الحمض النووي الريبي المسبب للحساسية المرتبطة بالمناعة. على وجه التحديد، يتم فحص المواد المسببة للحساسية المشتركة لوجود دنا مزدوجة التي تقطعت بها السبل (dsRNA) الأنواع التي يمكن أن تحفز ردود IFN في الرئتين وكبح جماح تطور يهون الرئة الحادة في نموذج الماوس من الربو التحسسي الناجم عن HDM. هنا، قمنا بتضمين ثلاثة فحوصات التالية: نقطة لطخة لإظهار هياكل DSRNA في مجموع الحمض النووي الريبي معزولة من مسببات الحساسية بما في ذلك أنواع HDM، RT-qPCR لقياس أنشطة HDM RNA في الجينات محفزة إنترفيرون (ISGs) التعبير في الرئتين الماوس وتحليل القوات المسلحة الكونغولية لتحديد آثار الحمض النووي HDM على عدد من الحمض النووي في BAL والرئة، على التوالي.
Introduction
استنادا إلى فرضية النظافة المقترحة أصلا من قبل ستراكان1, في مرحلة مبكرة من الطفولة التعرض للعوامل الميكروبية البيئية مثل الانستوكين يمكن أن تحمي ضد تطور الاضطرابات التحسسية2,3. أثناء الالتهابات الميكروبية، على سبيل المثال، العدوى الفيروسية، والكشف المناعي الفطري للأحماض النووية الأجنبية (RNA/DNA) يؤدي إلى استجابات الدفاع المضيف4،5،6. ومع ذلك ، فإن وجود وانتشار الأحماض النووية المناعية مثل أنواع الحمض النووي الريبي (DSRNA) الطويلة التي تقطعت بها السبل في عث الغبار المنزلية (HDM) أو مسببات الحساسية الأخرى للحشرات لا تزال غير معروفة. تم تصميم هذا البروتوكول لتحديد ما إذا كان HDM أو مسببات الحساسية الحشرية وغير الحشرية تحتوي على أنواع طويلة من dsRNA التي يمكن أن تنشط استجابة مناعية وقائية لمواجهة تطور التهاب الرئة اليوسينوفيلي الحاد في نموذج فأر للربو التحسسي. هنا، ونحن نقدم ثلاث طرق بسيطة وسريعة لتقييم المحددات الهيكلية في رنا هد إم مجموع التي هي مطلوبة لتنظيم التهاب الرئة النيوزنوفيلي الناجم عن مسببات الحساسية.
الجهاز المناعي المخاطي هو أكبر جهاز مناعي في الجسم ويعمل كخط أول للدفاع المضيف ضد كل من الالتهابات الميكروبية والشتائم التحسسية7,8. وdsRNA طويلة، ووسيط تكرار العديد من الفيروسات، ومن المعروف أن تعمل كنمط الجزيئية المرتبطة بعوامل الأمراض (PAMP) لتحفيز الاستجابات الفطرية بقوة عبر حصيلة مثل مستقبلات 3 (TLR3) للحث على التعبير عن الجينات محفزة إنترفيرون (ISGs)9،10،11،12،13،14. لقد أظهرنا مؤخرا أن RNA هد ام الكلي يحتوي على هياكل dsRNA، والتي upregulated التعبير عن ISGs والحد من التهاب الرئة يهونوسوسي شديد عندما تدار عن طريق تقطير داخلtracheal في نموذج مورين من الربو التحسسي الناجمة عن مقتطفات HDM15. يتم تحديد شدة التهابات الرئة عن طريق تحليل أنواع الخلايا المناعية في bronchoalveolar lavage (BAL) والأنسجة الرئوية عن طريق تدفق16،17،18،19،20.
ويتضمن هذا البروتوكول ثلاثة مقايسات: 1) الكشف السريع عن هياكل DSRNA مع لطخة نقطة RNA باستخدام جسم مضاد أحادي النسيلة الماوس J2 الذي يربط على وجه التحديد إلى dsRNA (≥40bp) بطريقة مستقلة عن تسلسل؛ 2) تقييم سريع لمؤثرات vivo من الحمض المناعي الريبي في الرئتين الماوس عن طريق قياس تحريض ISGs باستخدام RT-qPCR؛ 3) القياس الكمي الدقيق للويوزنوفيليات في BAL والرئة في سياق التهاب الرئة الناجم عن HDM باستخدام تحليل تدفق قياس الخلايا.
يمكن استخدام التشايسات أعلاه لدراسة ليس فقط أمراض الرئة التحسسية ، ولكن أيضًا الالتهابات البكتيرية والفيروسية التنفسية. على سبيل المثال، يمكن أيضا أن تستخدم الأجسام المضادة J2 DSRNA محددة في تطبيقات أخرى مثل الكروماتوغرافيا المناعية، وhistochemistry المناعية، والمناعة المرتبطة الانزيم المقايسة (ELISA) والمناعة21،22،23. وبالإضافة إلى ذلك، يمكن استخدام العديد من التطبيقات المصب من جمع السوائل BAL لتحديد كمي المحتويات القابلة للذوبان مثل السيتوكينات و chemokines باستخدام ELISA، والتنسخ التنميط للخلايا في الشعب الهوائية (على سبيل المثال، الضامة السنخية). على الرغم من وجود مجموعة متنوعة من البروتوكولات المتاحة في المؤلفات لتقييم حالات الرئة، فإن معظم هذه البروتوكولات غالباً ما تركز على التحقق من الصحة المستهدفة. يمكن تطبيق الإجراءات الموضحة هنا لتحديد المكونات في المواد المسببة للحساسية البيئية المهمة لتنظيم تطور أمراض الحساسية.
Protocol
تمت الموافقة على الإجراءات التجريبية الموصوفة هنا من قبل لجنة الرعاية واستخدام الحيوانات المؤسسية في جامعة تكساس للصحة سان أنطونيو.
1. نقطة لطخة لإظهار وجود هياكل DSRNA في الجيش الملكي النيبالي هد أم مجموع
- عزل الحمض النووي الريبي الكلي عن مسببات الحساسية والحشرات وغير المسببة للحساسية
- وضع HDM، والحشرات، أو غير الحشرات الحيوانات التي تم جمعها على قيد الحياة أو الحصول عليها تجاريا في أنابيب 50 مل، وتجميد بسرعة مع السائل-N2. ثم تخزين في -70 درجة مئوية لعزل RNA الكلي اللاحقة.
ملاحظة: في هذه التجربة، تم اختيار HDM، الحشرات، والحيوانات غير الحشرات لأنها معروفة لتكون مصادر شائعة من المواد المسببة للحساسية. وعلاوة على ذلك، لا تزال وظيفة التحفيز المناعي للرنا الرنا الخاصة بهم غير واضحة. - نقل كمية مناسبة (ما يعادل 100 ميكرولتر في حجم أو أقل) من HDM، والحشرات أو الحيوانات غير الحشرات المخزنة في -70 درجة مئوية في أنبوب 2 مل تحتوي على الخرز (1.4 ملم مجالات السيراميك)، ثم تجميد الأنابيب في حاوية السائل N2 لمدة ~ 10 دقيقة.
- لعزلة RNA الكلي، إضافة 1 مل من guanidinium thiocyanate القائم على RNA العزل كاشف24 إلى كل أنبوب، ثم كسر الحشرة وغير الحشرات الحيوانات الصغيرة مع تعطيل خلية عالية الطاقة في السرعة القصوى لمدة 45 s والبرد على الجليد. كرر هذه الخطوة مرتين.
- نقل الحل من الخطوة 1.1.3 إلى أنبوب جديد 1.5 مل وإضافة 200 ميكرولتر من الكلوروفورم إلى كل أنبوب ودوامة. أنابيب الطرد المركزي في 14،000 س ز لمدة 14 دقيقة في 4 درجة مئوية.
- بمجرد اكتمال الطرد المركزي، نقل المرحلة مائي العلوي (200 ميكرولتر) إلى أنبوب جديد 1.5 مل تحتوي على 500 ميكرولتر من الايزوبروبانول لترسب بيليه RNA. لا تزعج بين الطورين. نسبة الحجم الموصى بها للمرحلة العليا مقابل الإيزوبروبانول هي 1:2.5 نسبة.
- مزيج من دوامة لطيف، ثم أنابيب الطرد المركزي في 14،000 س ز لمدة 14 دقيقة في 4 درجة مئوية.
- اشعاع ة المابير بحذر ثم غسل بيليه RNA مع 500 ميكرولتر من 75٪ الإيثانول والطرد المركزي في 7500 × ز لمدة 10 دقيقة في 4 درجة مئوية. إزالة جميع السائل مع الحذر، والهواء الجاف بيليه وحل بيليه الجيش الملكي النيبالي مع 20-50 ميكرولتر من RNase خالية H2O.
- قياس تركيز الحمض النووي الريبي مع مقياس الطيف باستخدام المعلمات التالية:
- افتح البرنامج المرتبط وحدد نوع الأحماض النووية لقياسها. تغيير نوع العينة إلى RNA.
- قم بإجراء القياسات الفارغة مع 1-2 ميكرولتر من H2O. الخالية2من RNase. الآن، الأداة جاهزة للقياس.
- قم بتحميل 1-2 ميكرولتر من عينة الحمض النووي الريبي وقياس تركيز الحمض النووي الريبي (μg/μL).
ملاحظة: نسبة الامتصاص عند 260 و 280 نانومتر (A260/280) في ~ 2.0 (1.9-2.2) مقبولة عموما باعتبارها "نقية" للرنا الملكي النيبالي. إذا لم يتم معالجتها على الفور، وتخزين عينات RNA في -70 درجة مئوية وتجنب دورات التجميد ذوبان للحفاظ على الحمض النووي الريبي سليمة.
- وضع HDM، والحشرات، أو غير الحشرات الحيوانات التي تم جمعها على قيد الحياة أو الحصول عليها تجاريا في أنابيب 50 مل، وتجميد بسرعة مع السائل-N2. ثم تخزين في -70 درجة مئوية لعزل RNA الكلي اللاحقة.
- الكشف عن هيكل dsRNA في مجموع RNA باستخدام DSRNA الأجسام المضادة J2 محددة
- إعداد عينتين 20 ميكرولتر من الحمض النووي الريبي (200 نانوغرام/ميكرولتر). واحد مع RNase-III العلاج (1 ميكرولتر ل 1 ميكروغرام RNA، احتضان في 37 درجة مئوية لمدة 60 دقيقة)، والآخر دون RNase-III العلاج.
ملاحظة: يستخدم RNase الثالث هنا لتتحلل على وجه التحديد dsRNA، ولكن ليس RNA25التي تقطعت بها السبل واحد. - استخدام قلم رصاص لرسم الشبكات حيث سيتم لطخ عينات RNA على الغشاء.
- بقعة 2 ميكرولتر من 200 نانوغرام/ميكرولتر من عينة الحمض النووي الريبي على غشاء النايلون المشحون إيجابيا.
- ربط العينات بالغشاء عند 1200 ميكروجول س 100 في وصلة فوق البنفسجية. كرر الخطوات 1.2.3 و 1.2.4 مرتين أكثر في مكان العينة. وسيؤدي ذلك إلى ما مجموعه 0.8 ميكروغرام لكل بقعة.
ملاحظة: لا بقعة أكثر من 2 ميكرولتر من عينة RNA على الغشاء في وقت. - كتلة الربط غير محددة مع 5٪ الحليب في TBS-T لمدة 1 ساعة مع اهتزاز في درجة حرارة الغرفة. إزالة حل حظر من الخطوة 1.2.5 وإضافة المضادة DSRNA J2 المضادة في 1:1،000 تخفيف في 1% الحليب في TBS-T واحتضان بين عشية وضحاها مع اهتزاز في 4 درجة مئوية.
- غسل الغشاء مع TBS-T لمدة 5 دقائق وكرر هذه الخطوة لمدة 3 مرات. إضافة الأجسام المضادة الثانوية (الفوستخافتة القلوية-مترافق IgG المضادة للماوس المخفف في 1% الحليب 1:5,000) واحتضان لمدة 1 ساعة على شاكر في درجة حرارة الغرفة. غسل الغشاء مع TBS-T لمدة 5 دقائق وكرر هذه الخطوة ل3x.
- إضافة الركيزة (BCIP / NBT) واحتضان لمدة 5-15 دقيقة حتى إشارة المرجوة مرئية.
- وقف رد الفعل عن طريق شطف الغشاء مع ddH2O.
- جفف الغشاء على أوراق الأنسجة والتقط صورة باستخدام الهاتف الذكي (تظهر نتيجة تمثيلية في الشكل 1).
- إعداد عينتين 20 ميكرولتر من الحمض النووي الريبي (200 نانوغرام/ميكرولتر). واحد مع RNase-III العلاج (1 ميكرولتر ل 1 ميكروغرام RNA، احتضان في 37 درجة مئوية لمدة 60 دقيقة)، والآخر دون RNase-III العلاج.
2. RT-qPCR لقياس قدرة رنا هد إم الكلي في تحفيز التعبير ISGs الرئة
- عزل الحمض النووي الريبي من أنسجة الرئة الفئران
ملاحظة: تم الاحتفاظ بالفئران (أنثى، عمرها 8-12 أسبوعًا، C57BL/6J) في ظروف محددة خالية من مسببات الأمراض.- لفترة وجيزة تخدير الحيوان مع ايزوفلوران وتدار عن طريق تقطير داخلtracheal مع 5 ميكروغرام (المخفف في 80 ميكرولتر PBS) من RNAs HDM تعامل مع أو بدون RNase الثالث.
- بعد 16-18 ح بعد HDM العلاج RNA، التضحية الماوس عن طريق CO2 استنشاق لبضع دقائق. ثم، ضع الماوس على منصة ودبابيس أطرافها مع الإبر.
- تطهير الماوس مع الإيثانول 70٪ ثم قطع الجلد بدءا من البطن إلى الرقبة مع مقص معقمة.
- إصلاح الجلد بالإبر وقطع الأضلاع لفضح الرئتين. إزالة الرئتين كلها وغسلها مع برنامج تلفزيوني الباردة. ضع الرئتين على أوراق الأنسجة واكوس قطعة صغيرة واحدة من كل فص رئوي في أنبوب 2 مل يحتوي على حبات (200-300 ميكرولتر في الحجم، 1.4 ملم مجالات السيراميك).
ملاحظة: الغرض من استخدام الخرز السيراميك هو لطحن أنسجة الرئة بأكملها - تجميد عينات الرئة عن طريق وضع أنابيب في حاوية السائل-N2 لمدة 10 دقيقة~ .
- إضافة 500 ميكرولتر من guanidinium thiocyanate القائم على كاشف العزلة RNA إلى كل أنبوب وكسر أنسجة الرئة مع التجانس لمدة 45 s. البرد على الجليد بين كل خطوة. كرر هذه الخطوة مرتين.
- اتبع الخطوات 1.1.4-1.1.7 لعزلة RNA الرئة.
- الهواء الجافة بيليه وحل بيليه الجيش الملكي النيبالي مع كمية مناسبة من RNase خالية H2O (~ 20-30 ميكرولتر).
- قياس تركيز RNA كما هو موضح في الخطوة 1.1.8.
- RT-qPCR لتحديد قدرة الحمض النووي الريبي HDM في تحفيز التعبير الجيني للرئة.
- باستخدام 100 نانوغرام /μL من RNA المستخرجة من أنسجة الرئة كما القالب، وتنفيذ التوليف cDNA وفقا للبروتوكولالمشار إليه 26.
- إعداد رد فعل RT-qPCR في 10 ميكرولتر/بئر لطبقة 384-جيدا باستخدام cDNA ولدت أعلاه وأزواج التمهيدي الجينات محددة(الجدول 1 والجدول 2).
- ختم الآبار بإحكام مع فيلم لاصق شفاف ودوامة لوحة لمدة 30 s. تدور لوحة في 1000 س ز لمدة 30 s لجمع العينات في الجزء السفلي من الآبار.
- قم بتحميل اللوحة على جهاز RT-qPCR وابدأ في تشغيل تفاعل RT-qPCR باستخدام بروتوكول الدورة الحرارية(الجدول 3).
- تصدير النتائج إلى ملف جدول بيانات أو تحليل البيانات باستخدام البرنامج المقدم من قبل تصنيع بعد اكتمال البرنامج (يتم عرض نتيجة تمثيلية في الشكل 2).
3. تحليل FACS لتحديد آثار الجيش الملكي النيبالي HDM على تسلل الحمضات في BAL والرئة
- BAL جمع السوائل لتحليل FACS
- القتل الرحيم الفئران (أنثى، 8-12 أسابيع من العمر، C57BL/6J) التي تم علاجها مع مقتطفات الحساسية HDM (وفقا للتصميم التجريبي هو مبين في الشكل 3B)عن طريق استنشاق CO2.
- ضع الماوس على منصة ودبابيس أطرافها بالإبر.
- تطهير الماوس مع الإيثانول 70٪. استخدم المقص لقطع الجلد من المنطقة العليا من البطن إلى الرقبة.
- بلطف، سحب الغدد اللعابية والعضلات sternohyoid بعناية وبصرف النظر باستخدام ملقط لفضح القصبة الهوائية. ضع سلسلة نايلون (~ 10 سم) تحت القصبة الهوائية باستخدام ملقط.
- إجراء شق في القصبة الهوائية (~ 2 مم تحت الحنجرة) فقط بما فيه الكفاية لإدراج قنية. لا تقطع من خلال القصبة الهوائية. عقدة السلسلة حول القصبة الهوائية وقنية.
- تحميل حقنة مع 1 مل من برنامج تلفزيوني + EDTA وإرفاقه إلى نهاية القنية. حقن 1 مل من برنامج تلفزيوني + EDTA في الرئة وpirate تماما الحل. فصل الحقنة من القنية بعناية ونقل الحل إلى أنبوب 15 مل على الجليد.
- أعد تحميل الحقنة مع برنامج تلفزيوني جديد + EDTA وكرر هذه الخطوة 2x.
- الطرد المركزي أنبوب يحتوي على BAL مجمعة التي تم الحصول عليها في الخطوة 3.1.7 إلى بيليه الخلايا في 500 × ز لمدة 7 دقائق في 4 درجة مئوية. سجل حجم سائل BAL ثم نقل supernatant إلى اثنين من أنابيب 1.5 مل دون إزعاج بيليه.
ملاحظة: يمكن تخزين المالب من BAL في -70 درجة مئوية للتحليل في المستقبل على سبيل المثال، ELISA. - في حالة وجود RBCs في بيليه بسبب التهاب الرئة الحاد، بعد إزالة نابيرانت، إضافة 500 μL من العازلة تحلل RBC ومزيج جيد عن طريق resuspension. نقل الحل إلى أنبوب جديد 1.5 مل والطرد المركزي لمدة 7 دقائق في سرعة 500 × ز في 4 درجة مئوية.
- إزالة فائقة و resuspend بيليه في 150 ميكرولتر من عازلة FACS.
- نقل 150 ميكرولتر من العينة resuspended إلى 96-جيدا لوحة والطرد المركزي لوحة لمدة 7 دقائق في سرعة 500 × ز في 4 درجة مئوية.
- بسرعة، عكس لوحة على أوراق الأنسجة لجمع الخلايا المقيمين في الجزء السفلي من الآبار.
- وصمة عار الخلايا مع الأجسام المضادة في العازلة FACS في وجود 2.4G2 حظر الأجسام المضادة (2.5 ميكروغرام / 100 ميكرولتر). احتضان لوحة في درجة حرارة الغرفة لمدة 30 دقيقة في مكان مظلم.
- بعد تلطيخ، الطرد المركزي لوحة إلى بيليه الخلايا في 500 × ز لمدة 7 دقائق في 4 °C.
- إزالة حل تلطيخ عن طريق عكس لوحة على ورقة الأنسجة ثم غسلها عن طريق resuspending مع 100 ميكرولتر من FACS العازلة. وبعد ذلك، الطرد المركزي لوحة مرة أخرى في 500 × ز لمدة 7 دقائق في 4 درجة مئوية وإزالة العازلة FACS عن طريق عكس لوحة على ورق الأنسجة.
- إعادة تعليق العينات في 150 ميكرولتر من مخزن احتياطي FACS ونقل العينات إلى أنابيب FACS التي تحتوي على 350 ميكرولتر من مخزن احتياطي FACS. إضافة 25 μL من الخرز العد لكل عينة. العينات جاهزة الآن لتحليل تدفق العمليات.
ملاحظة: تم تصنيف أنواع مختلفة من الخلايا في سائل BAL بالأجسام المضادة كما هو مبين. تمت إضافة حبات العد قبل تشغيل FACS. تم تحليل بيانات قياس التدفق باستخدام برنامج متاح تجاريًا. الرجوع إلى الشكل 3 والجدول 4 لاستراتيجية البوابات.
- هضم أنسجة الرئة لتحليل FACS
- اتبع الخطوات 3.1.1 - 3.1.3.
- قطع الجلد بدءا من البطن إلى الرقبة مع مقص معقمة. إصلاح الجلد بالإبر وقطع الأضلاع لفضح الرئتين.
- إزالة الرئتين كلها وغسلها مع برنامج تلفزيوني الباردة. ضع عينات في أنبوب 1.5 مل يحتوي على 50 ميكرولتر من محلول هضم الرئة.
- ينم أنسجة الرئة إلى قطع صغيرة مع مقص منحني. نقل أنسجة الرئة إلى لوحة 6-جيدا، ثم إضافة 8 مل من حل هضم الرئة. ضع اللوحة على شاكر في حاضنة 37 درجة مئوية لمدة 45 دقيقة.
- بعد الحضانة، استخدم الجزء العلوي من أنبوب 1.5 مل لطحن أنسجة الرئة. ضع مصافي 70 ميكرومتر على لوحة جديدة 6-جيدا وتطبيق العينة من خلال مرشح 0.22 ميكرومتر.
- نقل الحل المصفاة إلى أنبوب 15 مل، ثم الطرد المركزي الأنابيب في 500 × ز لمدة 7 دقائق في 4 درجة مئوية. التعرق وssuspend بيليه في 1 مل من العازلة تحلل RBC وتركها على الجليد لمدة 3 دقائق.
- نقل العينة إلى أنبوب 1.5 مل والطرد المركزي في 500 × ز لمدة 7 دقائق في 4 درجة مئوية. كرر 2x
- اغسل خلايا الرئة بـ 2x بمخزن فاكس 1 مل. pirate االنبير و resuspend بيليه في 1 مل من العازلة FACS، ومن ثم نقل 100 ميكرولتر من العينة في 96 لوحة جيدا.
- جهاز طرد مركزي لوحة لمدة 7 دقائق في سرعة 500 × ز في 4 درجة مئوية. اتبع الخطوات الموضحة في جمع السوائل بالل لتحليل FACS (3.1.13 إلى 3.1.16) لتلطيخ خلايا عينات أنسجة الرئة المهضمة.
ملاحظة: تم تصنيف اليوسينوفيليات في الرئتين بالأجسام المضادة كما هو مبين، ثم تم خلطها مع حبات العد لمزيد من تحليل FACS. تم تحليل بيانات قياس التدفق باستخدام البرامج المرتبطة. الرجوع إلى الشكل 3 لتقييم الاستجابات المناعية التي يسببها الحمض النووي الريبي HDM.
4 - التحليل الإحصائي
- إجراء تحليل إحصائي باستخدام برنامج متاح تجاريًا.
- تحديد قيم p بواسطة اختبار t الطالب ذو الذيلين غير المُدَد وغير المُدَد للمقارنة بين مجموعتين.
- حساب الأرقام المطلقة من eosinophils على أساس الخرز المرجعي (اللوحة العليا) باستخدام الصيغة
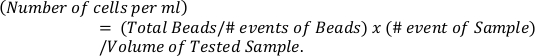
- تحديد قيم p بواسطة ANOVA 2-الاتجاه و اختبار مقارنات متعددة الخاصة Sidak للمقارنة بين أكثر من مجموعتين.
- النظر في قيمة p أصغر من 0.05 كقيمة ذات دلالة إحصائية. تتم الإشارة إلى قيم p على المخططات على أنها *p <0.05 و**p<0.01 و***p<0.001 و****p<0.0001.
ملاحظة: يتم توفير كافة الوصفات المخزن المؤقت في الجدول 5.
النتائج
تم فحص وجود هياكل طويلة من DSRNA في HDM والحشرات والحيوانات الصغيرة غير الحشرية بواسطة لطخة نقطة باستخدام جسم مضاد أحادي النسيلة للماوس خاص بـ dsRNA J2 (≥ 40bp). وقد استخدم RNase الثالث لهضم dsRNA في 12-15 شظايا BP dsRNA، والتي كانت غير قابلة للكشف من قبل J2(الشكل 1).
تم تحليل قدرة RNA...
Discussion
يصف البروتوكول الحالي كيفية تقييم خصائص التحفيز المناعي للحمض النووي الميكروبي المرتبط بالحساسية وتأثيراتها على تطور التهاب الرئة اليوزيني في نموذج الماوس للربو التحسسي. على الرغم من أن dsRNAs طويلة معروفة وسيطة النسخ المتماثل من العديد من الفيروسات التي يمكن أن تنشط بقوة استجابات الإنتر?...
Disclosures
ليس لدينا ما نكشف عنه
Acknowledgements
ونشكر السيدة كارلا غورينا على المساعدة التقنية في عملية استئصال الانسياب. يدعم L.S. مجلس المنح الدراسية الصيني ومؤسسة الابتكار في مقاطعة هونان للدراسات العليا (CX201713068). ويدعم سموه قسم علوم المختبرات السريرية، كلية العلوم الطبية التطبيقية، جامعة الجوف، ساكاكا، المملكة العربية السعودية. ويدعم X.D.L. من قبل UT الصحة سان انطونيو الصحة كلية الطب بدء تشغيل صندوق وماكس وميني فويلكر الصندوق.
Materials
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
References
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved