È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Identificazione e caratterizzazione delle specie di RNA immunogenico negli allergeni HDM che modulano l'infiammazione polmonare eosinofila
In questo articolo
Riepilogo
Gli allergeni ambientali come gli acari della polvere domestica (HDM) spesso contengono sostanze microbiche che attivano risposte immunitarie innate per regolare l'infiammazione allergica. Il protocollo qui presentato dimostra l'identificazione delle specie di dsRNA negli allergeni HDM e la caratterizzazione delle loro attività immunogeniche nella modulazione dell'infiammazione polmonare eosinofila.
Abstract
Gli allergeni ambientali come gli acari della polvere domestica (HDM) sono spesso in forme complesse contenenti sia proteine allergiche che guidano risposte aberranti di tipo 2 che sostanze microbiche che inducono risposte immunitarie innate. Questi componenti microbici associati agli allergeni svolgono un ruolo importante nella regolazione dello sviluppo di condizioni infiammatorie di tipo 2 come l'asma allergica. Tuttavia, i meccanismi sottostanti rimangono in gran parte indefiniti. Il protocollo qui presentato determina le caratteristiche strutturali e l'attività in vivo dell'RNA immunostimulatory associato agli allergeni. In particolare, vengono esaminati gli allergeni comuni per la presenza di specie di RNA a doppio filamento (dsRNA) che possono stimolare le risposte IFN nei polmoni e frenare lo sviluppo di eosinofilia polmonare grave in un modello murino di asma allergica indotta dall'HDM. Qui, abbiamo incluso i seguenti tre saggi: Dot blot per mostrare le strutture di dsRNA in RNA totale isolate dagli allergeni tra cui le specie MH, RT-qPCR per misurare le attività dell'RNA HDM nei geni che stimolano l'interferone (ISG) espressione nei polmoni dei topi e nell'analisi FACS per determinare gli effetti dell'RNA HDM sul numero di eosinofili in BAL e nei polmoni, rispettivamente.
Introduzione
Sulla base dell'ipotesi igienica originariamente proposta da Strachan1, l'esposizione della prima infanzia a fattori microbici ambientali come l'endotossina può proteggere contro lo sviluppo di disturbi allergici2,3. Durante le infezioni microbiche, ad esempio le infezioni virali, il rilevamento immunitario innato degli acidi nucleici estranei (RNA/DNA) innesca risposte alla difesa dell'ospite4,5,6. Tuttavia, l'esistenza e la prevalenza di acidi nucleici immunogenici come le specie di RNA a doppio filamento (dsRNA) lunghe in acari della polvere domestica (HDM) o altri allergeni da insetti rimangono sconosciuti. Questo protocollo è stato progettato per determinare se gli allergeni HDM o insetti e non insetti contengono specie di dsRNA lungo che possono attivare una risposta immunitaria protettiva per contrastare lo sviluppo di una grave infiammazione polmonare eosinofila in un modello murino di asma allergica. Qui, forniamo tre metodi semplici e veloci per valutare i determinanti strutturali nell'RNA totale HDM che sono necessari per regolare l'infiammazione del polmone eosinofilo indotta da allergeni.
Il sistema immunitario mucosale è il più grande organo immunitario del corpo e serve come prima linea di difesa dell'ospite contro sia le infezioni microbiche che gli insulti allergici7,8. Il lungo dsRNA, il intermedio di replicazione di molti virus, è noto per funzionare come un modello molecolare patogeno-associato (PAMP) per stimolare potentemente le risposte innate tramite Toll come il recettore 3 (TLR3) per indurre l'espressione di geni stimolati interferone (ISG)9,10,11,12,13,14.11 Recentemente abbiamo dimostrato che l'RNA totale dell'HDM conteneva strutture di dsRNA, che hanno aumentato l'espressione degli ISG e ridotto grave infiammazione polmonare eosinofila quando somministrato tramite l'instillazione intratratracheale in un modello murino di asma allergica indotta dagli estratti HDM15. La gravità delle infiammazioni polmonari è determinata analizzando i tipi di cellule immunitarie nello slavao bronchoalveolar (BAL) e nel tessuto polmonare attraverso la citometria di flusso16,17,18,19,20.
Questo protocollo include tre saggi: 1) rilevamento rapido delle strutture di dsRNA con macchia di punto di RNA utilizzando un anticorpo monoclonale del topo J2 che si lega specificamente al dsRNA (40bp) in modo indipendente dalla sequenza; 2) valutazione rapida degli effetti in vivo dell'RNA immunostimulatoroy nei polmoni murini misurando l'induzione di ISG utilizzando RT-qPCR; 3) quantificazione accurata degli eosinofili in BAL e nel polmone nel contesto dell'infiammazione polmonare indotta dall'HDM mediante l'analisi della citometria del flusso.
I saggi di cui sopra possono essere utilizzati per studiare non solo le malattie polmonari allergiche, ma anche le infezioni batteriche e virali respiratorie. Ad esempio, l'anticorpo J2 specifico del dsRNA può essere utilizzato anche in altre applicazioni come la cromatografia dell'immunoaffinità, l'immunostochimica, il saggio immunosorbente legato agli enzimi (ELISA) e l'immunostaining21,22,23. Inoltre, diverse applicazioni a valle della raccolta di fluidi BAL possono essere utilizzate per quantificare contenuti solubili come citochine e chemiochine utilizzando ELISA e profilazione trascrizionale delle cellule nelle vie respiratorie (ad esempio, macrofagi alveolar). Anche se ci sono una varietà di protocolli disponibili in letteratura per valutare le condizioni polmonari, la maggior parte di questi protocolli spesso si concentrano sulla convalida del bersaglio. Le procedure qui descritte possono essere applicate per identificare i componenti negli allergeni ambientali che sono importanti per regolare lo sviluppo di malattie allergiche.
Protocollo
Le procedure sperimentali descritte qui sono state approvate dal Institutional Animal Care and Use Committee dell'Università del Texas Health San Antonio.
1. Dot blot per mostrare la presenza di strutture dsRNA nell'RNA totale HDM
- Isolamento totale dell'RNA da allergeni, insetti e allergeni non insetti
- Metti HDM, insetti o animali non insetti raccolti vivi o ottenuti commercialmente in tubi da 50 mL e congela rapidamente con il liquido-N2. Quindi conservare a -70 gradi centigradi per il successivo isolamento totale dell'RNA.
NOTA: In questo esperimento, sono stati selezionati animali HDM, insetti e non insetti perché sono noti per essere fonti comuni di allergeni. Inoltre, una funzione immunostimulatoria dei loro RNA non è ancora chiara. - Trasferire una quantità adeguata (equivalente a 100 L in volume o meno) di HDM, insetti o animali non insetti immagazzinati a -70 s C in un tubo da 2 mL contenente perline (1,4 mm sfere di ceramica), quindi congelare i tubi in un contenitore liquido-N2 per 10 min.
- Per l'isolamento totale dell'RNA, aggiungere 1 mL di reagente di isolamento RNA basato su ghiaccio24 per ogni tubo, quindi rompere l'insetto e non-insetto piccoli animali con un disgregatore di cellule ad alta energia alla velocità massima per 45 s e raffreddare sul ghiaccio. Ripetere questo passaggio due volte.
- Trasferire la soluzione dal passaggio 1.1.3 in un nuovo tubo da 1,5 mL e aggiungere 200 L di cloroformio ad ogni tubo e vortice. Centrifuga tubi a 14.000 x g per 14 min a 4 gradi centigradi.
- Una volta completata la centrifugazione, trasferire la fase acquosa superiore (200-L) in un nuovo tubo da 1,5 mL contenente 500 -L di isopropanolo per precipitare il pellet di RNA. Non disturbare l'interfase. Il rapporto di volume consigliato tra la fase superiore e l'isopropanolo è 1:2.5 ratio.
- Mescolare con vortice delicato, quindi centrifugare i tubi a 14.000 x g per 14 min a 4 gradi centigradi.
- Aspirare il supernatante con cautela poi lavare il pellet di RNA con 500 l un'intera di 75% di etanolo e centrifugare a 7.500 x g per 10 min a 4 gradi centigradi. Rimuovere tutto il liquido con cautela, asciugare ad aria il pellet e sciogliere il pellet di RNA con 20-50 -L di RNase-free H2O.
- Misurare la concentrazione di RNA con uno spettrofotometro utilizzando i seguenti parametri:
- Aprire il software associato e selezionare il tipo di acidi nucleici da misurare. Modificare il tipo di campione in RNA.
- Eseguire la misura in bianco con 1-2 l di RNase-free H2O. Wipe off il RNase-free H2O. Ora, lo strumento è pronto per la misurazione.
- Carico 1-2 L del campione di RNA e misurare la concentrazione di RNA (G/L).
NOTA: Il rapporto tra l'assorbimento a 260 e 280 nm (A260/280) a 2,0 USD (1,9-2,2) è generalmente accettato come "puro" per l'RNA. Se non vengono elaborati immediatamente, conservare i campioni di RNA a -70 gradi centigradi ed evitare i cicli di congelamento-scongelamento per mantenere intatto l'RNA.
- Metti HDM, insetti o animali non insetti raccolti vivi o ottenuti commercialmente in tubi da 50 mL e congela rapidamente con il liquido-N2. Quindi conservare a -70 gradi centigradi per il successivo isolamento totale dell'RNA.
- Rilevamento della struttura del dsRNA nell'RNA totale utilizzando l'anticorpo J2 specifico del dsRNA
- Preparare due campioni di 20 -L di RNA (200 ng/L). Uno con trattamento RNase-III (1 OL per 1 g di RNA, incuba a 37 gradi centigradi per 60 min), e l'altro senza trattamento RNase-III.
NOTA: RNase III è qui usato per degradare specificamente dsRNA, ma non RNA a filamento singolo25. - Utilizzare una matita per disegnare griglie in cui i campioni di RNA saranno macchiati sulla membrana.
- Sulla membrana di nylon caricata positivamente, è possibile sfondare 2 l del campione di 200 ng/-L del campione di RNA.
- Collegare i campioni alla membrana a 1.200 microjoule x 100 in un parainterruttore UV. Ripetere i passaggi 1.2.3 e 1.2.4 altre due volte nel punto campione. Questo si tradurrà in totale di 0,8 g per macchia.
NOTA: Non individuare più di 2 - L di campione di RNA sulla membrana alla volta. - Bloccare il legame non specifico con il 5% di latte in TBS-T per 1 h con agitazione a temperatura ambiente. Rimuovere la soluzione di blocco dal passaggio 1.2.5 e aggiungere l'anticorpo anti-dsRNA J2 alla diluizione 1:1.000 nel latte dell'1% in TBS-T e incubare durante la notte con agitazione a 4 gradi centigradi.
- Lavare la membrana con TBS-T per 5 min e ripetere questo passaggio per 3 volte. Aggiungere l'anticorpo secondario (Alkaline fosfoase-coniugato Anti-Mouse IgG diluito in 1% latte 1:5,000) e incubare per 1 h su uno shaker a temperatura ambiente. Lavare la membrana con TBS-T per 5 min e ripetere questo passaggio per 3x.
- Aggiungere il substrato (BCIP/NBT) e incubare per 5-15 min fino a quando un segnale desiderato è visibile.
- Fermare la reazione risciacquando la membrana con ddH2O.
- Asciugare la membrana su carta velina e scattare una fotografia utilizzando uno smartphone (un risultato rappresentativo è mostrato nella Figura 1).
- Preparare due campioni di 20 -L di RNA (200 ng/L). Uno con trattamento RNase-III (1 OL per 1 g di RNA, incuba a 37 gradi centigradi per 60 min), e l'altro senza trattamento RNase-III.
2. RT-qPCR per misurare la capacità dell'RNA totale HDM nello stimolare l'espressione degli ISG polmonari
- Isolamento dell'RNA dai tessuti polmonari dei topi
NOTA: I topi (femmina, 8-12 settimane, C57BL/6J) sono stati mantenuti in condizioni specifiche prive di agenti patogeni.- Anestesizzare brevemente l'animale con isoflurane e somministrarlo tramite l'instillazione intratracheale con 5 g (diluiti in 80 PBS) di RNA HDM trattati con o senza RNase III.
- Dopo 16-18 h dopo il trattamento dell'RNA HDM, sacrificare il topo per inalazione di CO2 per alcuni minuti. Quindi, posizionare il mouse su una piattaforma e fissare gli arti con gli aghi.
- Disinfettare il topo con il 70% di etanolo, quindi tagliare la pelle a partire dall'addome al collo con una forbice sterilizzata.
- Fissare la pelle con gli aghi e tagliare le costole per esporre i polmoni. Rimuovere tutti i polmoni e lavarli con PBS freddo. Posizionare i polmoni su carta vessata e accisare un piccolo pezzo di ogni lobo polmonare in un tubo da 2 mL contenente perline (200-300 -L in volume, sfere ceramiche da 1,4 mm).
NOTA: Lo scopo dell'utilizzo di perline ceramiche è quello di macinare interi tessuti polmonari - Congelare i campioni polmonari mettendo i tubi in un contenitore liquido-N2 per 10 min.
- Aggiungere 500 l di reagente di isolamento dell'RNA a base di guaniofonio ad ogni tubo e rompere i tessuti polmonari con un omogeneizzatore per 45 s. Raffreddare sul ghiaccio tra ogni passo. Ripetere questo passaggio due volte.
- Seguire i passi 1.1.4- 1.1.7 per l'isolamento dell'RNA polmonare.
- Asciugare ad aria il pellet e sciogliere il pellet di RNA con una quantità adeguata di RNase-free H2O (20-30 l).
- Misurare la concentrazione di RNA come descritto al punto 1.1.8.
- RT-qPCR per determinare la capacità dell'RNA HDM nello stimolare l'espressione genica polmonare.
- Utilizzando come modello 100 ng/L L di RNA estratto dai tessuti polmonari, eseguire la sintesi cDNA secondo il protocollo di riferimento26.
- Impostare una reazione RT-qPCR a 10 gradi centigradi per una piastra di 384 pozzetti utilizzando cDNA generata sopra e le coppie di primer specifiche del gene (Tabella 1 e Tabella 2).
- Sigillare i pozze con una pellicola adesiva trasparente e vortice la piastra per 30 s. Ruotare la piastra a 1.000 x g per 30 s per raccogliere i campioni nella parte inferiore dei pozzi.
- Caricare la piastra su una macchina RT-qPCR e iniziare a eseguire la reazione RT-qPCR utilizzando il protocollo del ciclore termico (Tabella 3).
- Esportare i risultati in un file di foglio di calcolo o analizzare i dati utilizzando il software fornito dalla fabbricazione dopo il completamento del programma (un risultato rappresentativo è mostrato nella Figura 2).
3. Analisi FACS per determinare gli effetti dell'RNA HDM sull'infiltrazione di eosinofili in BAL e nei polmoni
- Raccolta di liquidi BAL per l'analisi FACS
- Topi eutanasi (femmina, 8-12 settimane, C57BL/6J) che sono stati trattati con estratti di allergeni HDM (secondo il disegno sperimentale mostrato nella Figura 3B) con inalazione di CO2.
- Posizionare il mouse su una piattaforma e fissare gli arti con gli aghi.
- Disinfettare il topo con il 70% di etanolo. Utilizzare le forbici per tagliare la pelle dalla zona superiore dell'addome al collo.
- Tirare delicatamente le ghiandole salivari e il muscolo sternoioide accuratamente a parte utilizzando le pinze per esporre la trachea. Mettete una corda di nylon (10 cm) sotto la trachea usando le pinze.
- Fare un'incisione nella trachea (2 mm sotto la larynx) quanto basta per inserire una cannula. Non tagliare la trachea. Nodo la corda intorno trachea e cannula.
- Caricare la siringa con 1 mL di PBS-EDTA e collegarla alla fine della cannula. Iniettare 1 mL di PBS-EDTA nel polmone e aspirare completamente la soluzione. Staccare la siringa dalla cannula con attenzione e trasferire la soluzione in un tubo da 15 mL sul ghiaccio.
- Ricaricare la siringa con la nuova PBS-EDTA e ripetere questo passaggio 2x.
- Centrifugare il tubo contenente il BAL in pool ottenuto al passo 3.1.7 per pellet le cellule a 500 x g per 7 min a 4 gradi centigradi. Registrare il volume del liquido BAL, quindi trasferire il supernatale a due tubi da 1,5 mL senza disturbare il pellet.
NOTA: Il supernatante di BAL può essere conservato a -70 gradi centigradi per analisi future, ad esempio ELISA. - Nel caso in cui ci siano RBC presenti nel pellet a causa di una grave infiammazione polmonare, dopo aver rimosso il supernatante, aggiungere 500 l di tampone di lisi RBC e mescolare bene con la sospensione. Trasferire la soluzione in un nuovo tubo da 1,5 mL e centrifugare per 7 min alla velocità di 500 x g a 4 gradi centigradi.
- Rimuovere il supernatante e sospendere nuovamente il pellet in 150 l di tampone FACS.
- Trasferire i 150 l del campione risospeso in piastra 96-pozzetto e centrifugare la piastra per 7 min alla velocità di 500 x g a 4 gradi centigradi.
- Rapidamente, invertire la piastra su carta velina per raccogliere le cellule che risiedano sul fondo dei pozzi.
- Macchiare le cellule con anticorpi nel buffer FACS in presenza di 2,4G2 anticorpi di blocco (2,5 g / 100 l). Incubare la piastra a temperatura ambiente per 30 min in un luogo buio.
- Dopo la colorazione, centrificare la piastra per pellet le cellule a 500 x g per 7 min a 4 gradi centigradi.
- Rimuovere la soluzione di colorazione invertendo la piastra sulla carta velina, quindi lavare con una riastrazione con 100 l di tampone FACS. Successivamente, centrificare nuovamente la piastra a 500 x g per 7 min a 4 gradi centigradi e rimuovere il buffer FACS invertendo la piastra su carta velina.
- Risospendere i campioni in 150 l di tampone FACS e trasferire i campioni ai tubi FACS contenenti 350 - L di tampone FACS. Aggiungere 25 l di perline di conteggio ad ogni campione. I campioni sono ora pronti per l'analisi della citometria del flusso.
NOTA: Vari tipi di cellule nel fluido BAL sono stati etichettati con anticorpi come indicato. Perline di conteggio sono stati aggiunti prima della corsa FACS. I dati della citometria di flusso sono stati analizzati utilizzando un software disponibile in commercio. Fare riferimento a Figura 3 e Tabella 4 per la strategia di gating.
- Digestione del tessuto polmonare per l'analisi FACS
- Seguire i passaggi 3.1.1 - 3.1.3.
- Tagliare la pelle partendo dall'addome al collo con una forbice sterilizzata. Fissare la pelle con gli aghi e tagliare le costole per esporre i polmoni.
- Rimuovere tutti i polmoni e lavarli con PBS freddo. Collocare i campioni nel tubo da 1,5 mL contenente 50 l di soluzione per la digestione polmonare.
- Mito i tessuti polmonari in piccoli pezzi con una forbice curva. Trasferire i tessuti polmonari in una piastra di 6 pozzetti, quindi aggiungere 8 mL di soluzione di digestione polmonare. Mettere la piastra su uno shaker in un'incubatrice a 37 gradi centigradi per 45 min.
- Dopo l'incubazione, utilizzare la parte superiore del tubo da 1,5 mL per macinare i tessuti polmonari. Mettete un ceppo di 70 m su una nuova piastra a 6 pozze e applicate il campione fino a 0,22 m.
- Trasferire la soluzione filtrata in un tubo da 15 mL, quindi centrifugare i tubi a 500 x g per 7 min a 4 gradi centigradi. Aspirare il supernatante e risospendere il pellet in 1 mL di tampone di lisi RBC e lasciarlo sul ghiaccio per 3 min.
- Trasferire il campione in tubo da 1,5 mL e centrifugare a 500 x g per 7 min a 4 gradi centigradi. Ripeti 2x
- Lavare le cellule polmonari 2x con buffer FACS da 1 mL. Aspirare il supernatante e risospendere il pellet in 1 mL di tampone FACS, quindi trasferire 100 l l del campione in 96 pozzetti.
- Centrifugare la piastra per 7 min alla velocità di 500 x g a 4 gradi centigradi. Seguire i passaggi descritti nella raccolta di liquidi BAL per l'analisi FACS (da 3.1.13 a 3.1.16) per macchiare le cellule dei campioni di tessuto polmonare digerito.
NOTA: Gli eosinofili nei polmoni sono stati etichettati con anticorpi come indicato, quindi mescolati con perline di conteggio per ulteriori analisi FACS. I dati della citometria del flusso sono stati analizzati utilizzando il software associato. Fare riferimento alla Figura 3 per la valutazione delle risposte immunitarie indotte dall'RNA HDM.
4. Analisi statistica
- Eseguire analisi statistiche utilizzando un software disponibile in commercio.
- Determinare i valori p dal test Student a due code non accoppiato per il confronto di due gruppi.
- Calcolare il numero assoluto di eosinofili in base a perline di riferimento (pannello superiore) utilizzando la formula
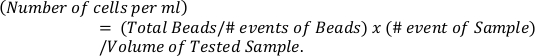
- Determinare i valori p tramite test di confronto multipli bidirezionali ANOVA e Sidak per il confronto di più di due gruppi.
- Considerare un valore p inferiore a 0,05 come statisticamente significativo. I valori di p sono indicati nei grafici come "p" <0.05, "p<0,01", "p<0.001" e "p<0.001".
NOTA: tutte le ricette di buffer sono riportate nella tabella 5.
Risultati
La presenza di lunghe strutture di dsRNA in HDM, insetti e piccoli animali non insetti è stata esaminata da una macchia a punti utilizzando un anticorpo monoclonale del topo specifico del dsRNA J2 (a 40 pb). RNase III è stato usato per digerire dsRNA in frammenti di dsRNA da 12 a 15 bp, che non erano rilevabili da J2 (Figura 1).
La capacità dell'RNA totale HDM di stimolare una risposta immunitaria innata nei polmoni di topo in modo dipendente dalla dose è stat...
Discussione
Il protocollo attuale descrive come valutare le proprietà immunostimulatoriche dell'RNA microbico associato agli allergeni e il loro impatto sullo sviluppo dell'infiammazione polmonare eosinofila in un modello murino di asma allergica. Anche se lunghi dsRNA sono noti come gli intermedi di replicazione di molti virus che possono potentemente attivare le risposte di interferone nelle cellule dei mammiferi, le loro presenze negli allergeni HDM sono state sconosciute fino al nostro recente lavoro15. ...
Divulgazioni
Non abbiamo niente da rivelare.
Riconoscimenti
Ringraziamo la signora Karla Gorena per l'assistenza tecnica nella citometria di flusso. L.S. è sostenuta dal China Scholarship Council e dalla Hunan Provincial Innovation Foundation for Postgraduate (CX201713068). H.H.A. è supportato dal Department of Clinical Laboratory Sciences, College of Applied Medical Sciences, Jouf University, Sakaka, Arabia Saudita. X.D.L. è supportato dal FONDO UT Health San Antonio School of Medicine Startup Fund e dal Max and Minnei Voelcker Fund.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
Riferimenti
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon