このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
好酸球性肺炎症を調節するHDMアレルゲンにおける免疫原性RNA種の同定と特性評価
要約
ハウスダニ(HDM)などの環境アレルゲンには、アレルギー性炎症を調節するために自然免疫応答を活性化する微生物物質が含まれていることが多い。ここで示したプロトコルは、好酸球性肺の炎症を調節する際のHDMアレルゲンにおけるdsRNA種の同定と免疫原性活性の特徴を示す。
要約
ハウスダニ(HDM)などの環境アレルゲンは、異常な2型応答を駆動するアレルギータンパク質と自然免疫応答を誘導する微生物物質の両方を含む複雑な形態であることが多い。これらのアレルゲン関連微生物成分は、アレルギー性喘息などの2型炎症性疾患の発症を調節する上で重要な役割を果たす。ただし、基礎となるメカニズムはほとんど定義されていません。ここで提示されるプロトコルは、アレルゲン関連免疫刺激RNAの構造的特性およびインビボ活性を決定する。具体的には、肺におけるIFN応答を刺激し、HDM誘発性アレルギー性喘息のマウスモデルにおける重度の肺好酸球症の発症を抑制することができる二本鎖RNA(dsRNA)種の存在について調べられる。ここでは、HDM種を含むアレルゲンから単離された全RNA中のdsRNA構造を示すドットブロット、マウス肺におけるインターフェロン刺激遺伝子(ISG)発現におけるHDM RNAの活動を測定するRT-qPCR、およびBALおよび肺における好酸球数に対するHDM RNAの影響を決定するFACS分析の3つのアッセイを含む。
概要
ストラチャン1が当初提案した衛生仮説に基づいて、内毒素などの環境微生物因子への幼児期の暴露は、アレルギー障害の発症から22、33を防ぐ。微生物感染の間、例えば、ウイルス感染、外来核酸の自然免疫検出(RNA/DNA)は宿主防御応答44、5、65,6を引き起こす。しかし、ハウスダニ(HDM)や他の昆虫アレルゲン中の長い二本鎖RNA(dsRNA)種などの免疫原性核酸の存在と有病率は不明のままである。このプロトコルは、HDMまたは昆虫および非昆虫アレルゲンが、アレルギー性喘息のマウスモデルにおける重度の好酸球性肺炎症の発症を打ち消すために保護免疫応答を活性化することができる長いdsRNA種を含むかどうかを決定するために設計された。ここでは、アレルゲン誘導性好酸球性肺の炎症を調節するために必要なHDM全RNAの構造決定因子を評価するための3つの簡単かつ迅速な方法を提供する。
粘膜免疫系は、体内で最大の免疫器官であり、微生物感染とアレルギー侮辱77,88の両方に対する宿主防御の第一線として機能する。長いdsRNAとは、多くのウイルスの複製中間体であり、病原体関連分子パターン(PAMP)として機能し、インターフェロン刺激遺伝子(ISGs)9、10、11、12、13、14の発現を誘導する9,10,11,12,13,14トール様受容体3(TLR3)を介して生来応答を強力に刺激することが知られている。我々は最近、HDM全RNAにdsRNA構造が含まれていることを示し、HDM抽出物15によって誘発されるアレルギー性喘息のマウスモデルにおいて、ISGの発現をアップレギュレートし、重度の好酸球性肺炎症を減少させた。肺の炎症の重症度は、フローサイトメ,トリー16、17、18、19、20を介して気管支肺胞洗浄16,17,18(BAL)および肺組織における免疫細胞タイプ19を20分析することによって決定される。
このプロトコルには、3つのアッセイが含まれています:1)特異的に配列に依存しない方法でdsRNA(≥40bp)に結合するマウスモノクローナル抗体J2を使用してRNAドットブロットを用いるdsRNA構造の迅速な検出;2) マウス肺における免疫刺激RNAのインビボ効果の迅速な評価は、RT-qPCRを用いてISGの誘導を測定する;3) フローサイトメトリー解析を用いたHDM誘発肺炎症の文脈におけるBALおよび肺における好酸球の正確な定量化。
上記のアッセイは、アレルギー性肺疾患だけでなく、呼吸器細菌およびウイルス感染の研究にも使用することができる。例えば、dsRNA特異的J2抗体は、免疫親和性クロマトグラフィー、免疫体化学、酵素結合免疫吸着測定法(ELISA)および免疫染色21、22、2322,などの他の21用途にも使用することができる。23加えて、BAL流体採取の下流にあるいくつかの用途は、ELISAを用いてサイトカインおよびケモカインなどの可溶性内容物を定量化するために利用することができ、また、気道における細胞の転写プロファイリング(例えば、肺胞マクロファージ)である。文献には肺の状態を評価するために利用できるさまざまなプロトコルがありますが、これらのプロトコルのほとんどはしばしばターゲット検証に焦点を当てています。ここで説明する手順は、アレルギー疾患の発症を調節するために重要な環境アレルゲン中の成分を同定するために適用することができる。
プロトコル
ここで説明する実験的な手順は、テキサス大学健康サンアントニオ校の施設動物ケアと使用委員会によって承認されました.
1. DSRNA構造のHDM総RNAにおける存在を示すドットブロット
- アレルゲン、昆虫、非昆虫アレルゲンからのRNAの全絶縁
- HDM、昆虫、または非昆虫動物を生きて採取または商業的に得られた50mLチューブに入れ、液体-N2で素早く凍結する。その後、-70°Cで保管し、その後のトータルRNA分離を行います。
注:この実験では、アレルギーの一般的な供給源であることが知られているため、HDM、昆虫、および非昆虫動物が選択されました。さらに、RNAの免疫刺激機能は不明のままである。 - -70°Cで保存されたHDM、昆虫または非昆虫動物の適正量(体積100μL以下)をビーズ(1.4mmセラミック球)を含む2mLチューブに移し、10分間液体N2容器にチューブを凍結します。
- RNAの全絶縁については、各チューブにグアニジニウム・チオシアネートベースのRNA分離試薬24を1mL加え、高エネルギー細胞破壊器で昆虫および非昆虫小動物を45秒間、氷上で冷やします。この手順を 2 回繰り返します。
- ステップ1.1.3から新しい1.5 mLチューブに溶液を移し、各チューブと渦に200 μLのクロロホルムを加えます。遠心管14,000xgで4°Cで14分間。 x g
- 遠心分離が完了したら、上の水相(200 μL)を500 μLのイソプロパノールを含む新しい1.5 mLチューブに移し、RNAペレットを沈殿させます。フェーズ間を乱さない。上相対イソプロパノールの推奨体積比は1:2.5比です。
- 穏やかな渦で混ぜ、遠心管を14,000 x gで4°Cで14分間混ぜます。
- 上清を吸い込み、75%エタノール500μL、遠心分離機を7,500xgで4°Cで10分間洗浄します。 x gすべての液体を慎重に取り除き、ペレットを空気乾燥し、RNAペレットを20〜50 μLのRNase-フリーH2Oで溶解します。
- 以下のパラメータを使用して、分光光度計でRNA濃度を測定します。
- 関連するソフトウェアを開き、測定する核酸の種類を選択します。サンプルタイプをRNAに変更します。
- RNaseフリーH2O.1-2 μLでブランク測定を行います。2これで、計測器は測定の準備が整いました。
- RNAサンプルの1〜2μLをロードし、RNA濃度(μg/μL)を測定します。
注:〜2.0(1.9-2.2)で260および280 nm(A260/280)の吸光度の比率は、一般的にRNAの「純粋」として受け入れられています。すぐに処理されない場合は、RNAサンプルを-70°Cに保存し、凍結融解サイクルを避けてRNAをそのまま維持します。
- HDM、昆虫、または非昆虫動物を生きて採取または商業的に得られた50mLチューブに入れ、液体-N2で素早く凍結する。その後、-70°Cで保管し、その後のトータルRNA分離を行います。
- dsRNA特異的J2抗体を用いた全RNA中のdsRNA構造の検出
- 20 μL の RNA サンプル(200 ng/μL)を2つ用意します。RNase-III処理(1μG RNAの1μL、60分間37°Cでインキュベート)を用いたもの、RNase-III処理を行わないもの。
注: RNase III は、dsRNA を特異的に分解するために使用されますが、一本鎖 RNA25は使用されません。 - 鉛筆を使用して、RNAサンプルが膜上に吸い込まれるグリッドを描画します。
- 200 ng/μLのRNAサンプルを正に帯電したナイロン膜に2μLのスポット。
- UV架橋器で1,200マイクロジュールx 100で膜にサンプルを架橋します。サンプルスポットでステップ1.2.3と1.2.4を2回繰り返します。これは、ブロットあたり合計0.8 μgになります。
注:膜上のRNAサンプルを2μL以上一度に見つけないでください。 - 非特異的結合をTBS-Tで5%の牛乳で1時間ブロックし、室温で揺れます。ステップ1.2.5からブロッキング溶液を取り除き、TBS-Tの1%ミルク中の1:1,000希釈で抗dsRNA J2抗体を添加し、4°Cで振盪して一晩インキュベートする。
- 膜をTBS-Tで5分間洗浄し、このステップを3回繰り返します。二次抗体(アルカリホスファターゼ共役抗マウスIgGを1%乳1:5,000に希釈)を加え、室温でシェーカーに1時間インキュベートします。膜をTBS-Tで5分間洗浄し、このステップを3倍に繰り返します。
- 基板(BCIP/NBT)を加え、所望の信号が見えるまで5〜15分間インキュベートします。
- 膜をddH2Oですすいで反応を止める。
- 組織紙の膜を乾かして、スマートフォンを使って写真を撮ります(代表的な結果を図1に示します)。
- 20 μL の RNA サンプル(200 ng/μL)を2つ用意します。RNase-III処理(1μG RNAの1μL、60分間37°Cでインキュベート)を用いたもの、RNase-III処理を行わないもの。
2. 肺ISG発現を刺激するHDM総RNAの能力を測定するRT-qPCR
- マウス肺組織からのRNA分離
注:マウス(雌、8-12週齢、C57BL/6J)は、特定の病原体を含まない状態で維持された。- イオフルランで動物を短時間麻酔し、RNase IIIの有無にかかわらず治療したHDM RNAの5μg(80 μL PBSで希釈)で気管内の内植在を介して投与する。
- HDM RNA処理後16-18時間後、数分間CO2吸入によりマウスを犠牲にする。次に、マウスをプラットフォーム上に置き、手足を針でピン留めします。
- 70%エタノールでマウスを消毒し、腹部から首まで皮を殺菌したはさみで切る。
- 針で皮膚を固定し、肺を露出させるために肋骨をカットします。肺全体を取り除き、冷たいPBSでそれらを洗います。肺を組織紙に置き、各肺葉の小片をビーズを含む2mLチューブ(体積200〜300μL、1.4mmセラミック球)に切除します。
注:セラミックビーズを使用する目的は、肺組織全体を粉砕することです - チューブを液体-N2容器に入れ、肺サンプルを10分間凍らせます。
- 500 μLのグアニジニウム・チオシアネートベースのRNA分離試薬を各チューブに加え、各ステップの間の氷上での冷却を45秒のホモジナイザーで肺組織を破壊します。この手順を 2 回繰り返します。
- 肺RNAの分離のためのステップ1.1.4- 1.1.7に従ってください。
- ペレットをエアドライし、RNAペレットを適切な量のRNaseフリーH2O(〜20〜30 μL)で溶解します。
- ステップ1.1.8に記載されたRNA濃度を測定する。
- RT-qPCRは、肺遺伝子発現を刺激するHDM RNAの能力を決定する。
- 肺組織から抽出したRNAの100ng/μLをテンプレートとして用いて、参照プロトコル26に従ってcDNA合成を行う。
- 上記で生成したcDNAと遺伝子特異的プライマーペアを用いて、384ウェルプレートに対して10μL/wellでRT-qPCR反応を設定する(表1および表2)。
- 透明な粘着フィルムでウェルをしっかりと密封し、プレートを30 sの渦で密着させ、プレートを1,000 x gで30 s回転させ、ウェルの底部でサンプルを収集します。
- プレートを RT-qPCR マシンにロードし、サーマルサイクラー プロトコルを使用して RT-qPCR 反応を実行し始める (表 3)。
- 結果をスプレッドシート ファイルにエクスポートするか、プログラムの完了後に製造者が提供するソフトウェアを使用してデータを分析します (代表的な結果を図 2に示します)。
3. BALおよび肺における好酸球の浸潤に対するHDM RNAの影響を決定するためのFACS分析
- FACS 解析用の BAL 流体収集
- CO2吸入によりHDMアレルゲン抽出物(図3Bに示す実験計画に従って)で治療したマウス(雌、8-12週齢、C57BL/6J)を安楽死させる。
- マウスをプラットフォーム上に置き、手足を針で固定します。
- 70%エタノールでマウスを消毒する。はさみを使って腹部の上の部分から首まで皮膚を切ります。
- 静かに、気管を露出させるために鉗子を使用して唾液腺とステルノイド筋肉を慎重に引き離します。鉗子を使用して気管の下にナイロンひも(約10cm)を置きます。
- カニューレを挿入するのに十分な気管(喉頭下で約2mm)の切開を行います。気管を切り抜けないでください。気管とカニューレの周りにひもを結ぶ。
- PBS+EDTAの1 mLで注射器をロードし、カニューレの端に取り付けます。PBS+EDTAを1mLの肺に注入し、溶液を完全に吸引する。慎重にカニューレから注射器を取り外し、氷の上の15 mLチューブに溶液を移します。
- 新鮮な PBS+EDTA でシリンジをリロードし、このステップ 2x を繰り返します。
- ステップ3.1.7で得られたプールBALを含むチューブを遠心分離し、4°Cで7分間500xgで細胞をペレットする。BAL液の体積を記録し、ペレットを邪魔することなく上清を2つの1.5 mLチューブに移します。
注:BALの上清は、ELISAなどの将来の分析のために-70°Cで保存することができます。 - 重度の肺炎症のためにペレット中にRBCが存在する場合は、上清を除去した後、RBCライシスバッファーの500 μLを加え、再懸濁によってよく混合する。4°Cで500×gの速度で7分間、新しい1.5 mLチューブと遠心分離機に溶液を移します。
- 上清を取り外し、150 μLのFACSバッファでペレットを再懸濁します。
- 再懸濁したサンプルの150 μLを96ウェルプレートに移し、4°Cで500 x gの速度で7分間遠心分離します。
- すぐに、組織紙のプレートを反転して、ウェルの底に存在する細胞を収集します。
- 2.4G2ブロッキング抗体(2.5μg/100 μL)の存在下でFACSバッファー内の抗体を用いて細胞を染色する。暗い場所で30分間室温でプレートをインキュベートします。
- 染色後、プレートを遠心分離し、4°Cで7分間500xgで細胞をペレット化する。
- ティッシュペーパーのプレートを反転させて染色液を取り除き、100 μLのFACSバッファーで再懸濁して洗浄します。次に、4°Cで7分間500xgでプレートを再び遠心分離し、ティッシュペーパー上のプレートを反転させることでFACSバッファーを取り除いた。
- サンプルを150 μLのFACSバッファに再中断し、350 μLのFACSバッファを含むFACSチューブにサンプルを転送します。各サンプルに25 μLのカウントビードを加えます。サンプルはフローサイトメトリー解析の準備が整いました。
注:BAL液中の様々な細胞タイプは、示されたとおり抗体で標識された。FACS が実行される前に、カウントビードが追加されました。フローサイトメトリーデータは、市販のソフトウェアを用いて分析した。ギャティングストラテジーについては、図3と表4を参照してください。
- FACS分析のための肺組織消化
- 手順 3.1.1 ~ 3.1.3 に従ってください。
- 腹部から首まで皮を切り、滅菌したはさみで切ります。針で皮膚を固定し、肺を露出させるために肋骨をカットします。
- 肺全体を取り除き、冷たいPBSでそれらを洗います。50 μL の肺消化液を含む 1.5 mL チューブにサンプルを入れます。
- 肺組織を湾曲したはさみで小片にミンチします。肺組織を6ウェルプレートに移し、8 mLの肺消化液を加える。37°Cインキュベーターで45分間、プレートをシェーカーの上に置きます。
- インキュベーション後、肺組織を粉砕するために1.5 mLチューブの上部を使用してください。新しい6ウェルプレートに70 μmのストレーナーを置き、0.22 μmフィルターを通してサンプルを塗布します。
- 濾過した溶液を15mLチューブに移し、500 x gでチューブを遠心分離して4°Cで7分間移動します。上清を吸引し、RBCリシスバッファーの1 mLにペレットを再懸濁し、氷の上に3分間放置します。
- サンプルを1.5mLチューブに、遠心分離機を500xgで4°Cで7分間移します。2倍の繰り返し
- 肺細胞2xを1 mL FACSバッファーで洗浄します。上清を吸引し、ペレットを1 mLのFACSバッファーに再懸濁し、サンプル100μLを96ウェルプレートに移します。
- 4°Cで500×gの速度で7分間プレートを遠心分離します。FACS 解析用の BAL 液収集 (3.1.13 ~ 3.1.16) で説明されている手順に従って、消化された肺組織サンプルの細胞を染色します。
注:肺内の好酸球は示されているように抗体で標識し、さらにFACS分析のためにカウントビーズと混合した。フローサイトメトリーデータは、関連ソフトウェアを用いて分析した。HDM RNA誘導免疫応答の評価については図3を参照してください。
4. 統計分析
- 市販のソフトウェアを使用して統計解析を実行します。
- 2 つのグループの比較のためにペアになっていない両側のスチューデント t 検定でp値を決定します。
- 式を使用して、参照ビーズ(上部パネル)に基づいて好酸球の絶対数を計算します。
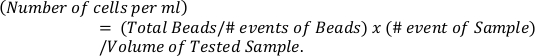
- 2つのグループの比較のための双方向のANOVAとシダックの多重比較検定によってp値を決定します。
- 0.05 より小さいp値は統計的に有意であると考えてください。p値はプロットで *p <0.05、**p<0.01、***p<0.001、および ****p<0.0001 として示されます。
注: すべてのバッファレシピは、表 5に示されています。
結果
HDM、昆虫および非昆虫小動物における長いdsRNA構造の存在を、dsRNA特異的マウスモノクローナル抗体J2(≥ 40bp)を用いてドットブロットによって調べた。RNase IIIは、DsRNAを12-15 bp dsRNA断片に消化するために使用され、これはJ2では検出できなかった(図1)。
用量依存的にマウス肺における自然免疫応答を刺激するHDM総RNAの能力をRT-qPCR(図2、<...
ディスカッション
現在のプロトコルは、アレルギー性喘息のマウスモデルにおける好酸球性肺炎症の発症に対するアレルゲン関連微生物RNAの免疫刺激特性およびそれらの影響を評価する方法を記述する。長いdsRNAは哺乳動物細胞におけるインターフェロン応答を強力に活性化することができる多くのウイルスの複製中間体として知られているが、HDMアレルゲンにおけるそれらの存在は我々の最近の研究
開示事項
開示するものは何もありません。
謝辞
フローサイトメトリーの技術支援をしてくれたカーラ・ゴレナさんに感謝します。L.S.は、中国奨学金協議会と湖南省大学院イノベーション財団(CX201713068)の支援を受けています。H.H.A.は、サウジアラビアのサカカ大学ジュフ大学応用医科学部臨床検査科学科の支援を受けています。X.D.L.は、UTヘルスサンアントニオ医学スタートアップファンドとマックスとミニーボーカー基金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
参考文献
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved