A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי ואפיון של מינים החיסוני של RNA ב-HDM אלרגנים לווסת דלקת ריאות אאוזינופילית
In This Article
Summary
אלרגנים סביבתיים כגון קרדית אבק הבית (HDM) מכילים לעתים קרובות חומרים מיקרוביאלית המפעילים תגובות החיסונית מולדים לווסת דלקת אלרגית. הפרוטוקול המוצג כאן ממחיש את הזיהוי של מינים dsRNA ב אלרגנים HDM ואפיון של הפעילות החיסונית שלהם בדלקת ריאות אאוזינופילית.
Abstract
אלרגנים סביבתיים כגון קרדית אבק הבית (HDM) הם לעתים קרובות בצורות מורכבות המכילות גם חלבונים אלרגיים כי כונן מסוג שני תגובות וחומרים מיקרוביאלית לגרום לתגובות החיסונית מולדים. הרכיבים הקשורים לאלרגן בתחום החיידקים ממלאים תפקיד חשוב בוויסות ההתפתחות של מצבים דלקתיים מסוג 2 כגון אסתמה אלרגית. עם זאת, המנגנונים הבסיסיים נשארים בלתי מוגדרים ברובו. הפרוטוקול המוצג כאן קובע את המאפיינים המבבניים ובפעילות vivo של האלרגן הקשורים חיסוני מגירוי RNA. במיוחד, אלרגנים נפוצות נבדקים לנוכחות של כפול תקוע RNA (dsRNA) מינים שיכולים לעורר תגובות IFN בריאות ולרסן את ההתפתחות של הריאה הקשה אאוזינווליה במודל העכבר של אסטמה מושרה HDM. הנה, כללנו את שלושת: המילים הבאות שאומרות נקודה חשופה להראות את מבנים dsRNA בסך הכל RNA מבודדים אלרגנים כולל מינים HDM, RT-qPCR כדי למדוד את הפעילויות של ה-RNA HDM ב אינטרפרון מגרה גנים (ISGs) הביטוי בריאות העכבר ניתוח FACS כדי לקבוע את ההשפעות של ה-RNA HDM על מספר אאוזינופילים באל, בהתאמה
Introduction
מבוסס על השערת היגיינה המוצע במקור על ידי strachan1, החשיפה המוקדמת לגיל הסביבה גורמים מיקרוביאלית כגון אנדוטוקסין יכול להגן מפני פיתוח של הפרעות אלרגיות2,3. במהלך זיהומים מיקרוביאלית, למשל, זיהומים ויראליים, זיהוי החיסונית מולדת של חומצות גרעין זרות (RNA/DNA) מפעיל תגובות הביטחון מארח4,5,6. עם זאת, הקיום והשכיחות של חומצות גרעין החיסונית כגון כפול מסוג RNA (dsRNA) מינים של קרדית אבק הבית (HDM) או אלרגנים אחרים חרקים נשארים לא ידועים. פרוטוקול זה נועד לקבוע אם HDM או חרקים ואלרגנים שאינם חרקים מכילים מינים dsRNA ארוך שיכול להפעיל תגובה חיסונית הגנה לנטרל את ההתפתחות של דלקת ריאות אאוזינופילית חמורה במודל העכבר של אסתמה אלרגית. כאן, אנו מספקים שלוש שיטות פשוטות ומהירות כדי להעריך את דטרמיננטים מבניים ב-RNA הכולל HDM הדרושים עבור ויסות הנגרמת אלרגן לדלקת ריאות אאוזינופילית.
מערכת החיסון רירית היא האיבר החיסונית הגדול ביותר בגוף ומשמש כשורה הראשונה של הגנה מארחים מפני זיהומים מיקרוביאלית ועלבונות אלרגיות7,8. Dsrna ארוך, שכפול ביניים של וירוסים רבים, ידוע לתפקד כדפוס מולקולרי הקשורים הפתוגן (pamp) כדי לעורר בסיפוק תגובות מולדים באמצעות אגרה כמו קולטן 3 (TLR3) כדי לגרום לביטוי של אינטרפרון מגורה גנים (isgs)9,10,11,12,13,14. לאחרונה הראו כי HDM סך הכל RNA הכיל מבנים dsRNA, אשר upregulated הביטוי של ISGs ומופחת דלקת ריאות אאוזינופילית חמורה כאשר מנוהל באמצעות intratracheal במודל מורטין של אסתמה אלרגית הנגרמת על ידי מחלץ HDM15. חומרת דלקות ריאות נקבעת על-ידי ניתוח סוגי התאים החיסוניים בעזרת ברונכשיים (BAL) ורקמת ריאות דרך הזרימה cy,16,17,18,19,20.
פרוטוקול זה כולל שלוש assays: 1) זיהוי מהיר של מבנים dsrna עם כתם כתמי RNA באמצעות העכבר נוגדן בטיים אשר במיוחד נקשר dsrna (≥ 40bp) באופן עצמאי רצף; 2) הערכה מהירה להשפעות vivo של RNA מגירוי חיסוני בריאות העכבר על ידי מדידת אינדוקציה של ISGs באמצעות RT-qPCR; 3) כימות מדויק של אאוזיפרלס באל וריאה בהקשר של דלקת ריאות HDM המושרה באמצעות הזרימה cy, לנסות.
האמור לעיל ניתן להשתמש כדי ללמוד לא רק אלרגיות מחלות ריאות, אלא גם זיהומים בקטריאליים ונגיפי הנשימה. לדוגמה, הנוגדן J2 ספציפי של dsrna יכול לשמש גם ביישומים אחרים כגון כרומטוגרפיה של זיקה חיסוני, אימונוהיסטוכימיה, חיסוני מקושר אנזים (אליסה) ו מכתים חיסוני21,22,23. בנוסף, מספר יישומים במורד איסוף נוזל BAL יכול להיות מנוצל עבור כימות תוכן מסיסים כגון ציטוקינים ו נוגדנים באמצעות אליסה, ו הטרנססקריפט פרופיל של תאים באיירווייז (למשל, מכתשי מקרופאגים). למרות שיש מגוון פרוטוקולים הזמינים בספרות להערכת תנאי הריאות, רוב הפרוטוקולים הללו מתמקדים לעתים קרובות באימות היעד. ניתן ליישם את ההליכים המתוארים כאן על מנת לזהות רכיבים באלרגנים סביבתיים החשובים לוויסות ההתפתחות של מחלות אלרגיות.
Protocol
הליכים ניסיוניים שתוארו כאן אושרו על ידי טיפול בעלי חיים מוסדיים והשתמש הוועדה של אוניברסיטת טקסס בריאות סן אנטוניו.
1. כתם נקודה כדי להראות נוכחות של מבנים dsRNA ב-RNA הכולל של HDM
- סה כ בידוד RNA מאלרגנים, חרקים ואלרגנים שאינם חרקים
- לשים HDM, חרקים, או בעלי חיים שאינם חרקים שנאספו בחיים או השיגו מסחרית לתוך 50 mL צינורות, ובמהירות להקפיא עם נוזל N2. ואז לאחסן ב-70 ° c עבור בידוד הכולל RNA בהמשך.
הערה: בניסוי זה, HDM, חרקים, ובעלי חיים שאינם חרקים נבחרו משום שהם ידועים כמקורות נפוצים של אלרגנים. יתר על כן, תפקוד חיסוני של RNAs שלהם נשאר ברור. - העברת כמות ראויה (שווה ערך ל-100 μL בנפח או פחות) של HDM, חרקים או חיות שאינן חרקים מאוחסנים ב-70 ° c לתוך שפופרת 2 mL המכילה חרוזים (1.4 מילימטר כדורי קרמיקה), לאחר מכן להקפיא צינורות במיכל נוזלי N2 עבור ~ 10 דקות.
- עבור בידוד RNA הכולל, להוסיף 1 מ ל של guanidinium מבוסס רנ א בידוד מגיב24 לכל צינור, ולאחר מכן לשבור את החרק בעלי חיים קטנים ללא חרקים עם שפופרת תא אנרגיה גבוהה במהירות המקסימלית עבור 45 s ו להירגע על קרח. חזור על שלב זה פעמיים.
- להעביר את הפתרון משלב 1.1.3 לתוך צינור חדש 1.5 mL ולהוסיף 200 μL של כלורופורם לכל צינור מערבולת. צינורות צנטריפוגה ב 14,000 x g עבור 14 דקות ב 4 ° c.
- לאחר צנטריפוגה הושלמה, להעביר את השלב העליון מימית (200 μL) לתוך צינור חדש 1.5 mL המכיל 500 μL של איזופנול כדי לזרז את הגלולה RNA. . אל תפריע לשלב הפנימי יחס אמצעי האחסון המומלץ של השלב העליון לעומת איזופנול הוא יחס של 1:2.5.
- לערבב על ידי בעדינות vortexing, ואז צינורות צנטריפוגה ב 14,000 x g עבור 14 דקות ב 4 ° c.
- מטפי את supernatant עם זהירות ולאחר מכן לשטוף את הגלולה RNA עם 500 μL של 75% אתנול ו צנטריפוגה ב 7,500 x g עבור 10 דקות ב 4 ° c. להסיר את כל הנוזל עם זהירות, אוויר יבש את הגלולה ולפזר את הגלולה RNA עם 20-50 μL של RNase-H חינם2O.
- למדוד את הריכוז RNA עם ספקטרוסקופיה באמצעות הפרמטרים הבאים:
- פתח את התוכנה המשויכת ובחר את סוג חומצות הגרעין כדי למדוד. שנה את סוג המדגם ל-RNA.
- בצע את המדידה הריקה עם 1-2 μL של RNase-H חינם2o. לנגב את rnase-h חינם2o. עכשיו, המכשיר מוכן למדידה.
- טען 1-2 μL של מדגם RNA ולמדוד את הריכוז RNA (μg/μL).
הערה: יחס הספיגה ב260 ו 280 nm (A260/280) בשעה ~ 2.0 (1.9-2.2) מקובל בדרך כלל כ"טהורה" עבור RNA. אם לא עיבוד מיידי, לאחסן דגימות RNA ב-70 ° צ' ולהימנע הקפאת ההפשרה מחזורים כדי לשמור על RNA שלמים.
- לשים HDM, חרקים, או בעלי חיים שאינם חרקים שנאספו בחיים או השיגו מסחרית לתוך 50 mL צינורות, ובמהירות להקפיא עם נוזל N2. ואז לאחסן ב-70 ° c עבור בידוד הכולל RNA בהמשך.
- זיהוי של מבנה dsRNA בסך הכל RNA באמצעות dsRNA מסוים J2 נוגדן
- להכין 2 20 μL של בדיקות RNA (200 ng/μL). אחד עם טיפול RNase-III (1 μL עבור 1 μg RNA, דגירה ב 37 ° c עבור 60 דקות), והשני ללא טיפול RNase-III.
הערה: RNase III משמש כאן במיוחד לבזות dsRNA, אבל לא אחד-RNA תקוע25. - השתמש בעיפרון כדי לצייר רשתות שבו דגימות RNA יהיה להימחק על הקרום.
- ספוט 2 μL של 200 ng/μL של ה-RNA לדוגמה על קרום הניילון טעונה חיובי.
- מרובי קשר את הדגימות לקרום ב 1,200 מיקרוז'לס x 100 בקרולינק UV. חזור על הצעדים 1.2.3 ו 1.2.4 פעמיים במקום הספוט לדוגמה. זה יגרום סך הכל 0.8 μg לאבן חשופה.
הערה: אל ספוט יותר מ 2 μL של המדגם RNA על הקרום בכל פעם. - לחסום איגוד לא ספציפי עם 5% חלב ב-TBS-T עבור 1 h עם טלטול בטמפרטורת החדר. הסר את פתרון חסימת משלב 1.2.5 ולהוסיף את הנוגדן נגד dsRNA J2 ב 1:1000 דילול ב 1% חלב ב-TBS-T ו-דגירה לילה עם טלטול 4 ° c.
- לשטוף את הקרום עם TBS-T עבור 5 דקות ולחזור על שלב זה 3 פעמים. הוסף את הנוגדן המשני (בסיסי פוספספטאז-מצועם אנטי עכבר IgG מדולל ב 1% חלב 1:5000) ו דגירה עבור 1 h על שייקר בטמפרטורת החדר. לשטוף את הקרום עם TBS-T עבור 5 דקות ולחזור על שלב זה עבור 3x.
- הוסף את המצע (BCIP/NBT) ו-דגירה עבור 5-15 דקות עד האות הרצוי גלוי.
- להפסיק את התגובה על ידי שטיפה את הקרום עם ddH2O.
- נגב את הקרום על ניירות טישו וצלם באמצעות הטלפון החכם (תוצאה מייצגת מוצג באיור 1).
- להכין 2 20 μL של בדיקות RNA (200 ng/μL). אחד עם טיפול RNase-III (1 μL עבור 1 μg RNA, דגירה ב 37 ° c עבור 60 דקות), והשני ללא טיפול RNase-III.
2. RT-qPCR כדי למדוד את היכולת של ה-RNA הכולל של HDM ב מגרה ISGs ריאות ביטוי
- בידוד RNA מרקמות ריאות של עכברים
הערה: עכברים (נקבה, 8-12 בן שבועות, C57BL/6J) שמרו בתנאים מסוימים ללא הפתוגן.- בקצרה לדלל את בעל החיים עם isof, לנהל באמצעות הקשר intratracheal עם 5 μg (מדולל ב 80 μL PBS) של HDM RNAs מטופלים עם או בלי RNase III.
- לאחר 16-18 h לאחר הטיפול ב-HDM, להקריב את העכבר על ידי CO2 שאיפת לכמה דקות. לאחר מכן, למקם את העכבר על מצע ולהצמיד גפיים עם מחטים.
- לחטא את העכבר עם 70% אתנול ואז לחתוך את העור החל מהבטן לצוואר עם מספריים מעוקר.
- לתקן את העור עם מחטים ולחתוך את הצלעות כדי לחשוף את הריאות. להסיר את כל הריאות ולשטוף אותם עם הצטננות. מניחים את הריאות על ניירות טישו וחתיכה אחת קטנה של האונה הריאה לתוך שפופרת 2 mL המכילה חרוזים (200-300 μL בנפח, 1.4 מ"מ כדורים קרמיקה).
הערה: מטרת השימוש בחרוזי קרמיקה היא לטחון רקמות ריאות שלמות - להקפיא את דגימות הריאות על ידי הצבת צינורות לתוך נוזל-N2 מכולה עבור ~ 10 דקות.
- הוסף 500 μL של guanidinium מבוסס RNA בידוד מגיב לכל צינור ולשבור את רקמות הריאות עם הומוגניצר עבור 45 s.. תירגעו על הקרח בין כל שלב חזור על שלב זה פעמיים.
- בצע את השלבים 1.1.4-1.1.7 לבידוד לריאות RNA.
- אוויר-יבש את הגלולה ולפזר את הגלולה RNA עם כמות נאותה של RNase-H חינם2O (~ 20-30 μl).
- למדוד את הריכוז RNA כפי שמתואר בשלב 1.1.8.
- RT-qPCR כדי לקבוע את היכולת של רנ א HDM מגרה ביטוי גן הריאות.
- שימוש 100 ng/μL של RNA שחולצו מרקמות הריאה כתבנית, לבצע סינתזה cDNA על פי הפרוטוקול המופנה26.
- הגדרת התגובה RT-qPCR ב 10 μL/ובכן עבור צלחת 384-באר באמצעות cDNA שנוצר לעיל את הזוגות הספציפיים לגנים (שולחן 1 ושולחן 2).
- חותם את הבארות בחוזקה עם סרט דביק שקוף ומערבולת את הצלחת 30 s. ספין את הצלחת ב 1,000 x g עבור 30 s כדי לאסוף דגימות בתחתית הבארות.
- טען את הצלחת אל מכונת RT-qPCR והתחל להריץ את תגובת RT-qPCR באמצעות פרוטוקול הציקלייר התרמי (שולחן 3).
- יצא את התוצאות לקובץ גיליון אלקטרוני או נתח את הנתונים באמצעות התוכנה שסופקה על-ידי הייצור לאחר השלמת התוכנית (תוצאת מייצג מוצגת באיור 2).
3. FACS ניתוח כדי לקבוע את ההשפעות של ה-RNA HDM על חדירה של אאוזינופילים ב באל ובריאות
- איסוף נוזלי BAL לניתוח FACS
- עכברים המתת חסד (נקבה, 8-12 שבועות, C57BL/6J) שטופלו בתמציות אלרגן HDM (על פי העיצוב הניסיוני המוצג באיור 3B) על ידי שאיפת CO2 .
- הניחו את העכבר על מצע והצמד גפיים עם מחטים.
- לחטא את העכבר עם 70% אתנול. להשתמש במספריים כדי לחתוך את העור מהאזור העליון של הבטן עד הצוואר.
- בעדינות, למשוך את בלוטות הרוק ואת שריר הלשון בזהירות בנפרד באמצעות מלקחיים לחשוף את קנה הנשימה. מניחים מחרוזת ניילון (~ 10 ס מ) תחת קנה הנשימה באמצעות מלקחיים.
- לעשות חתך בקנה הנשימה (~ 2 מ"מ מתחת לגרון) בדיוק מספיק כדי להוסיף צינורית. . אל תחתוך את קנה הנשימה קשר את המיתר סביב קנה הנשימה. והצינורית
- טען את המזרק באמצעות 1 מ ל של PBS + EDTA וחבר אותו לקצה הצינורית. הכנס 1 mL של PBS + EDTA לתוך הריאה ולגמרי לשאת את הפתרון. נתק את המזרק מהצינורית בזהירות והעבר את הפתרון לשפופרת של 15 מ ל בקרח.
- טען מחדש את המזרק באמצעות ה-PBS הטרי + EDTA וחזור על שלב זה 2x.
- צנטריפוגה את הצינור המכיל את בל במאגר שהושג צעד 3.1.7 כדי לצנפה את התאים ב 500 x g עבור 7 דקות ב 4 ° c. להקליט את הנפח של נוזל BAL ולאחר מכן להעביר את supernatant שני 1.5 מ"ל צינורות מבלי להפריע את הגלולה.
הערה: הסופרנטנט של BAL יכול להיות מאוחסן ב-70 ° c לניתוח עתידי לדוגמה, אליסה. - במקרה יש RBCs נוכח הגלולה עקב דלקת ריאות חמורה, לאחר הסרת supernatant, להוסיף 500 μL של מאגר הליזה RBC ולערבב היטב על ידי השעיה מחדש. להעביר את הפתרון לתוך שפופרת חדש 1.5 mL ו צנטריפוגה עבור 7 דקות במהירות של 500 x g ב 4 ° c.
- הסר את הסופרנטאנט והשהה מחדש את הגלולה ב-150 μL של מאגר FACS.
- העברת 150 μL של המדגם מחדש לתוך 96-באר צלחת וצנטריפוגה את הצלחת 7 דקות במהירות של 500 x g ב 4 ° c.
- במהירות, להפוך את הצלחת על ניירות רקמות כדי לאסוף את התאים המתגוררים בתחתית הבארות.
- כתם את התאים עם נוגדנים במאגר FACS בנוכחות של 2.4 מג חסימת נוגדן (2.5 μg/100 μL). מודקת את הצלחת בטמפרטורת החדר במשך 30 דקות במקום חשוך.
- לאחר הצביעת, צנטריפוגה את הצלחת כדי לצנפי את התאים ב 500 x g עבור 7 דקות ב 4 ° c.
- הסר את הפתרון מכתים ידי היפוך הצלחת על נייר טישו ולאחר מכן לשטוף על ידי השעיית מחדש עם 100 μL של מאגר FACS. הבא, צנטריפוגה את הצלחת שוב ב 500 x g עבור 7 דקות ב 4 ° c ולהסיר את מאגר facs על ידי היפוך הצלחת על נייר טישו.
- השהה דגימות מחדש לתוך 150 μL של מאגר FACS ודגימות העברה לצינורות FACS המכילים 350 μL של מאגר FACS. הוסף 25 μL של חרוזי ספירה לכל דוגמה. הדגימות מוכנות כעת לניתוח.
הערה: סוגי תאים שונים בנוזלי BAL סומנו בנוגדנים כמצוין. חרוזי ספירה נוספו לפני הפעלת ה-FACS. הנתונים של cy, הזרמת מידע נותחו באמצעות תוכנה זמינה מסחרית. התייחס לאיור 3 ולטבלה 4 לצורך האסטרטגיה.
- העיכול לרקמת הריאה לניתוח ה-FACS
- בצע את השלבים 3.1.1-3.1.3.
- חותכים את העור החל מהבטן לצוואר עם מספריים מעוקרים. לתקן את העור עם מחטים ולחתוך את הצלעות כדי לחשוף את הריאות.
- להסיר את כל הריאות ולשטוף אותם עם הצטננות. מניחים דגימות בצינור 1.5 mL המכיל 50 μL של פתרון לעיכול ריאות.
- האוהב את רקמות הריאות לחתיכות קטנות עם מספריים עקומים. להעביר את רקמות הריאות לצלחת 6-היטב, ולאחר מכן להוסיף 8 mL של פתרון לעיכול הריאה. מניחים את הצלחת על שייקר בחממה 37 ° c עבור 45 דקות.
- לאחר דגירה, להשתמש בחלק העליון של 1.5 mL שפופרת לטחון את רקמות הריאות. מקום מוחילות 70 יקרומטר על צלחת חדשה 6-באר ולהחיל את המדגם באמצעות מסנן יקרומטר 0.22.
- העבר את הפתרון המסונן לתוך שפופרת 15 מ"ל, ולאחר מכן צנטריפוגה את הצינורות ב 500 x g עבור 7 דקות ב 4 ° c. ומכה את הגלולה ב 1 מ ל של מאגר הליזה RBC ולהשאיר אותו על הקרח עבור 3 דקות.
- העבר את המדגם לתוך שפופרת 1.5 mL ו צנטריפוגה ב 500 x g עבור 7 דקות ב 4 ° c. חזור על 2x
- שטוף את תאי הריאה 2x עם מאגר FACS 1 mL. ולאחר מכן העבר את הגלולה ב 1 מ ל של מאגר FACS, ולאחר מכן להעביר 100 μL של המדגם לתוך 96 צלחת טובה.
- צנטריפוגה את הצלחת עבור 7 דקות במהירות של 500 x g ב 4 ° c. בצע את השלבים המתוארים באוסף הנוזלים BAL עבור ניתוח FACS (3.1.13 to 3.1.16) כדי להכתים את התאים של דגימות ריאות מתעכל רקמות.
הערה: אאוזינופילים בריאות היו מסומנים בנוגדנים כמצוין, ואז מעורבב עם חרוזי ספירה עבור ניתוח FACS נוסף. הנתונים של cy, הזרמת מידע נותחו באמצעות תוכנות משויכות. עיין באיור 3 להערכת תגובות החיסון hdm המושרה.
4. אנליזה סטטיסטית
- בצע ניתוח סטטיסטי באמצעות תוכנה זמינה מסחרית.
- קבע את ערכי ה- p על-ידי בדיקת סטודנט דו-זנבית בלתי משויכת עבור השוואה בין שתי קבוצות.
- לחשב את המספרים המוחלט של אאוזינופילים על בסיס חרוזי ייחוס (הלוח העליון) באמצעות הנוסחה
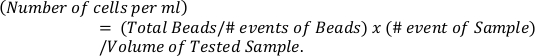
- קבע את ערכי p על-ידי השוואות מרובות של ANOVA ו-sidak עבור השוואה של יותר משתי קבוצות.
- שקול ערך p קטן מ-0.05 כמשמעותי מבחינה סטטיסטית. ערכי p מצוינים על מגרשים כמו * p < 0.05, * * p < 0.01, * * * p < 0.001, ו * * * * p < 0.0001.
הערה: כל מתכוני המאגרים ניתנים בטבלה 5.
תוצאות
הנוכחות של מבנים dsRNA ארוך ב HDM, חרקים ובעלי חיים קטנים שאינם חרקים נבדק על ידי אבן חשופה באמצעות העכבר הספציפי dsRNA נוגדן J2 (≥ 40bp). RNase III שימש כדי לעכל dsRNA לתוך 12-15 שברי הלחץ bp, אשר היו בלתי ניתן לגילוי על ידי J2 (איור 1).
היכולת של ה-RNA הכולל של HDM כדי לעורר תגובה חיסוני...
Discussion
הפרוטוקול הנוכחי מתאר כיצד להעריך את תכונות הגירוי החיסוני של מיקרוביאלית הקשורים אלרגן-RNA וההשפעות שלהם על התפתחות דלקת ריאות אאוזינופילית במודל העכבר של אסתמה אלרגית. למרות dsRNAs ארוך ידועים כintermediates השכפול של וירוסים רבים שיכולים להפעיל בסיפוק אינטרפרון תגובות בתאי היונקים, הנוכחות של?...
Disclosures
. אין לנו מה לגלות
Acknowledgements
אנו מודים לגב קרלה גורנה לקבלת סיוע טכני בזרימה ציטואסינסה. L.S. נתמכת על ידי מועצת המלגות סין והקרן לחדשנות מחוזי הונאן לתארים מתקדמים (CX201713068). H.H.A. נתמכת על ידי המחלקה למדעי המעבדה הקלינית, המכללה למדעי הרפואה היישומית, אוניברסיטת ג'ול, סאקקה, ערב הסעודית. X.D.L. נתמך על ידי בריאות UT סן אנטוניו בית הספר לרפואה הפעלה של הקרן מקס ו מינין Voelcker.
Materials
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
References
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved