JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
호산성 폐 염증을 조절하는 HDM 알레르겐의 면역원성 RNA 종의 식별 및 특성화
요약
집 먼지 진드기 (HDM)와 같은 환경 알레르겐은 종종 알레르기 염증을 조절하기 위해 선천적 인 면역 반응을 활성화하는 미생물 물질을 함유하고 있습니다. 여기에 제시된 프로토콜은 HDM 알레르겐에서 dsRNA 종의 식별과 호산성 폐 염증을 조절하는 면역원성 활동의 특성화를 보여줍니다.
초록
집 먼지 진드기 (HDM)와 같은 환경 알레르겐은 종종 비정상적인 유형 2 반응을 구동하는 알레르기 성 단백질과 타고난 면역 반응을 유도하는 미생물 물질을 포함하는 복잡한 형태로 종종 있습니다. 이러한 알레르겐 관련 미생물 성분은 알레르기 성 천식과 같은 타입-2 염증 조건의 발달을 조절하는 데 중요한 역할을합니다. 그러나 기본 메커니즘은 크게 정의되지 않은 상태로 유지됩니다. 여기서 제시된 프로토콜은 알레르겐 관련 면역 자극RNA의 구조적 특성 및 생체 내 활성을 결정한다. 구체적으로, 일반적인 알레르겐은 폐에서 IFN 반응을 자극하고 HDM 유도 알레르기 천식의 마우스 모델에서 중증 폐 호산구의 발달을 억제할 수 있는 이중 좌초 RNA(dsRNA) 종의 존재를 검사한다. 여기서, 우리는 다음과 같은 세 가지 분석을 포함했다: HDM 종을 포함한 알레르겐으로부터 분리된 총 RNA에서 dsRNA 구조를 보여주는 도트 블롯, RT-qPCR은 마우스 폐및 FACS 분석에서 인터페론 자극 유전자(ISGs) 발현에서 HDM RNA의 활동을 측정하여 각각 BAL및 폐, 폐의 EOSinophils수에 대한 HDM RNA의 효과를 결정한다.
서문
스트라찬1이원래 제안한 위생 가설에 기초하여, 내독소와 같은 환경 미생물 인자에 대한 유아 노출은 알레르기 장애2,,3의발달로부터 보호 할 수 있습니다. 미생물 감염 중, 예를 들어, 바이러스 감염, 외국 핵산(RNA/DNA)의 선천적인 면역 검출은 호스트 방어 반응을4,,5,,6을유발한다. 그러나, 집먼지 진드기(HDM) 또는 다른 곤충 알레르겐에서 긴 이중 좌초 RNA(dsRNA) 종과 같은 면역원성 핵산의 존재 그리고 유병률은 알려지지 않은 채로 남아 있다. 이 프로토콜은 HDM 또는 곤충 및 비 곤충 알레르겐이 알레르기 성 천식의 마우스 모델에서 심각한 호산성 폐 염증의 발달을 중화하기 위해 보호 면역 반응을 활성화 할 수있는 긴 dsRNA 종을 포함 여부를 결정하기 위해 설계되었습니다. 여기서, 우리는 알레르겐 유도 호산성 폐 염증을 조절하는 데 필요한 HDM 총 RNA에서 구조적 결정요인을 평가하는 세 가지 간단하고 빠른 방법을 제공한다.
점막 면역 계통은 바디에서 가장 큰 면역 기관이고 미생물 감염 및 알레르기성 모욕 둘 다에 대하여 호스트 방어의 첫번째 선 역할을7,,8. 긴 dsRNA는, 많은 바이러스의 복제 중간체로서, 인터페론 자극 유전자(ISGs)9,,10,,,11,12,,13,14의발현을 유도하기 위해 수용체 3(TLR3)와 같은 톨을 통해 선천적 반응을 강력하게 자극하는 병원균 관련 분자 패턴(PAMP)으로 기능하는 것으로 알려져있다. 최근에는 HDM 총 RNA가 DSRNA 구조를 함유하고 있으며, 이는 ISGs의 발현을 조절하고 HDM 추출물에 의해 유도된 알레르기 성 천식의 뮤린 모델에서 내내 주입을 통해 투여될 때 심한 호산성 폐 염증을감소시켰다. 폐 염증의 중증도는 혈류,세포측정제16,,17,18,19,,20을통해 기관지알래 라베이지(BAL) 및 폐 조직에서 면역 세포 유형을 분석하여 결정된다.,
이 프로토콜은 3개의 분석서를 포함합니다: 1) 특이하게 dsRNA (≥40bp)에 서열 독립적인 방식으로 결합하는 마우스 단클론 항체 J2를 사용하여 RNA 도트 블롯을 가진 dsRNA 구조물의 신속한 검출; 2) RT-qPCR을 사용하여 ISGs의 유도를 측정하여 마우스 폐에서 면역 자극 RNA의 생체 내 효과에 대한 빠른 평가; 3) 혈류 세포측정 분석을 이용하여 HDM 유도 폐 염증의 맥락에서 BAL 및 폐에서 호산구의 정확한 정량화.
위의 에세이는 알레르기 성 폐 질환뿐만 아니라 호흡기 세균 및 바이러스 감염을 연구하는 데 사용할 수 있습니다. 예를 들어, dsRNA 특이적 J2 항체는 면역화성 크로마토그래피, 면역히스토케, 효소-연결된 면역소벤트 분석법(ELISA) 및 면역염색21,,22,,23과같은 다른 응용 분야에서도 사용될 수 있다. 또한, BAL 유체 수집의 하류에 여러 응용 분야는 ELISA를 사용하여 사이토카인 및 케모킨과 같은 용용성 함량을 정량화하고, 기도내 세포의 전사 프로파일링(예를 들어, 폐포 대식세포)에 활용될 수 있다. 폐 상태를 평가하기 위해 문헌에서 사용할 수있는 다양한 프로토콜이 있지만, 이러한 프로토콜의 대부분은 종종 대상 유효성 검사에 초점을 맞춥니다. 여기에 설명된 절차는 알레르기 성 질병의 발달을 조절하는 데 중요한 환경 알레르겐의 구성 요소를 식별하기 위해 적용 될 수 있습니다.
프로토콜
여기에 설명 된 실험 절차는 텍사스 건강 샌 안토니오 대학의 기관 동물 관리 및 사용위원회에 의해 승인되었다.
1. HDM 총 RNA에서 dsRNA 구조의 존재를 보여주는 도트 블롯
- 알레르겐, 곤충 및 비 곤충 알레르겐으로부터의 총 RNA 절연
- HDM, 곤충 또는 비곤충 동물을 살아 있거나 상업적으로 50mL 튜브에 넣고 액체 N2로신속하게 동결하십시오. 그런 다음 후속 총 RNA 절연을 위해 -70 °C에 저장하십시오.
참고: 이 실험에서는 HDM, 곤충 및 곤충이 아닌 동물이 알레르겐의 일반적인 공급원으로 알려져 있기 때문에 선택되었습니다. 또한, 그들의 RNA의 면역 자극 기능은 불분명한 남아 있습니다. - -70°C에 저장된 HDM, 곤충 또는 비곤충 동물의 적당량(부피 100 μL 이하)을 구슬(1.4mm 세라믹 구체)이 들어 있는 2mL 튜브로 옮은 다음 액체-N2 용기에 튜브를 10분 동안 동결한다.
- 총 RNA 절연을 위해, 각 튜브에 구니디늄 티오야네이트 계 RNA 격리 시약24의 1mL를 추가한 다음, 곤충과 비곤충 소동물을 고에너지 세포 파괴기로 분해하고 얼음에 차가운. 이 단계를 두 번 반복합니다.
- 1.1.3 단계에서 새로운 1.5mL 튜브로 용액을 옮기고 각 튜브및 소용돌이에 200 μL의 클로로폼을 추가합니다. 원심분리기 튜브는 4°C에서 14분 동안 14,000 x g의 원심분리기 튜브입니다.
- 원심분리가 완료되면, 상수상(200 μL)을 RNA 펠릿침을 침전시키기 위해 이소프로판올 500 μL을 포함하는 새로운 1.5mL 튜브로 이송한다. 단계 간을 방해하지 마십시오. 상층 대 상층의 권장 물량 비율은 1:2.5 비율입니다.
- 부드러운 소용돌이로 섞은 다음 원심분리기 튜브를 14,000 x g에서 14분 동안 4°C로 섞습니다.
- 주체를 주의 깊게 흡인한 다음 RNA 펠릿을 75% 에탄올과 원심분리기의 500 μL로 4°C에서 10분 동안 7,500 x g로 세척합니다. 모든 액체를 조심스럽게 제거하고 펠릿을 공기 건조시키고 RNA 펠릿을 RNase 가 없는 H2O의 20-50 μL로 용해하십시오.
- 다음 매개 변수를 사용하여 분광계로 RNA 농도를 측정합니다.
- 관련 소프트웨어를 열고 측정할 핵산유형을 선택한다. 샘플 유형을 RNA로 변경합니다.
- RNase 가 없는 H2O. RNase 프리 H2O. 스 와이프의 1-2 μL로 빈 측정을 수행합니다. 이제 계측기는 측정할 준비가 되었습니다.
- RNA 시료의 1-2 μL을 적재하고 RNA 농도(μg/μL)를 측정합니다.
참고: ~2.0(1.9-2.2)에서 260 및 280 nm(A260/280)에서 흡광도의 비율은 일반적으로 RNA에 대해 "순수"로 받아들여진다. 즉시 처리되지 않으면 RNA 샘플을 -70°C에 저장하고 동결 해동 주기를 피하여 RNA를 그대로 유지하십시오.
- HDM, 곤충 또는 비곤충 동물을 살아 있거나 상업적으로 50mL 튜브에 넣고 액체 N2로신속하게 동결하십시오. 그런 다음 후속 총 RNA 절연을 위해 -70 °C에 저장하십시오.
- dsRNA 특이적 J2 항체를 사용하여 전체 RNA에서 dsRNA 구조의 검출
- RNA 샘플 20μL(200 ng/μL)를 준비합니다. 하나는 RNase-III 치료 (1 μg RNA에 대한 1 μL, 60 분 동안 37 °C에서 배양), 및 RNase-III 치료없이 다른 하나.
참고 : RNase III는 구체적으로 dsRNA를 저하하기 위해 여기에 사용되지만 단일 좌초 RNA(25)는아닙니다. - 연필을 사용하여 RNA 샘플이 멤브레인에 블랜츠되는 그리드를 그립니다.
- RNA 샘플의 200 ng/μL의 2 μL을 양전하 나일론 멤브레인에 반점한다.
- UV 크로스링커에서 1,200 마이크로줄 x 100에서 멤브레인에 샘플을 교차 연결합니다. 샘플 스팟 장소에서 1.2.3 및 1.2.4 단계를 두 번 더 반복합니다. 이로 인해 블롯당 총 0.8 μg가 발생합니다.
참고: 한 번에 멤브레인에 RNA 샘플의 2 μL 이상을 발견하지 마십시오. - 실온에서 흔들림으로 1h에 TBS-T에서 5%의 우유로 비특이적 결합을 차단합니다. 차단용액을 1.2.5단계에서 제거하고 1:1,000 희석에서 항dsRNA J2 항체를 TBS-T의 1% 우유에 추가하고 4°C에서 흔들림으로 하룻밤 동안 배양한다.
- 5 분 동안 TBS-T로 멤브레인을 씻고이 단계를 3 번 반복하십시오. 이차 항체(알칼리성 인산염-공주 방지 마우스 IgG를 1% 우유 1:5,000으로 희석) 및 실온에서 셰이커에 1시간 동안 배양한다. 5 분 동안 TBS-T로 멤브레인을 씻고3 x에 대한이 단계를 반복합니다.
- 기판(BCIP/NBT)을 추가하고 원하는 신호가 표시될 때까지 5-15분 동안 배양합니다.
- ddH2O로 멤브레인을 헹구어 반응을 중지합니다.
- 조직 용지에 멤브레인을 건조하고 스마트 폰을 사용하여 사진을 찍습니다 (대표적인 결과는 도 1에표시됩니다).
- RNA 샘플 20μL(200 ng/μL)를 준비합니다. 하나는 RNase-III 치료 (1 μg RNA에 대한 1 μL, 60 분 동안 37 °C에서 배양), 및 RNase-III 치료없이 다른 하나.
2. 폐 ISGs 발현을 자극하는 HDM 총 RNA의 능력을 측정하는 RT-qPCR
- 마우스 폐 조직에서 RNA 절연
참고: 마우스(여성, 8-12주, C57BL/6J)는 특정 병원균 없는 조건하에서 유지되었다.- 이소플루란으로 동물을 간략하게 마취하고 RNase III 유무에 관계없이 처리된 HDM RNA의 5 μg(80μL PBS에서 희석)로 장내 주입을 통해 관리한다.
- 후 16-18 h 포스트 HDM RNA 치료 후, 몇 분 동안 CO2 흡입에 의해 마우스를 희생. 그런 다음, 플랫폼에 마우스를 놓고 바늘로 팔다리를 고정합니다.
- 70% 에탄올로 마우스를 소독한 다음 살균된 가위로 복부에서 목까지 피부를 자른다.
- 바늘로 피부를 고정하고 갈비뼈를 잘라 폐를 노출합니다. 전체 폐를 제거하고 차가운 PBS로 씻어. 폐를 조직 용지에 놓고 각 폐 로브의 작은 조각을 구슬이 들어 있는 2mL 튜브(부피 200-300 μL, 세라믹 구체 1.4mm)에 소비합니다.
참고: 세라믹 구슬을 사용하는 목적은 전체 폐 조직을 분쇄하는 것입니다. - 폐 샘플을 액체 N2 용기에 넣고 ~10 분 동안 동결하십시오.
- 각 튜브에 500 μL의 구아니디늄 티오세네이트 계 RNA 절연 시약을 추가하고 각 단계 사이의 얼음에 45 s. 진정균제로 폐 조직을 깰. 이 단계를 두 번 반복합니다.
- 폐 RNA 절연을 위한 단계 1.1.4- 1.1.7단계를 따르십시오.
- 펠릿을 공기 건조시키고 적절한 양의 RNase 프리 H2O(~20-30 μL)로 RNA 펠릿을 용해합니다.
- 단계 1.1.8에 설명된 바와 같이 RNA 농도를 측정한다.
- RT-qPCR은 폐 유전자 발현을 자극하는 HDM RNA의 능력을 결정한다.
- 폐 조직에서 추출한 RNA의 100 ng/μL을 템플릿으로 사용하여, 참조된프로토콜(26)에따라 cDNA 합성을 수행한다.
- 위에서 생성된 cDNA및 유전자 특이적 프라이머쌍(표 1 및 표 2)을사용하여 384웰 플레이트에 대해 10 μL/well에 RT-qPCR 반응을 설정한다.
- 투명한 접착 필름으로 우물을 단단히 밀봉하고 30 s. 30 s에 대한 1,000 x g에서 플레이트를 회전하여 우물 바닥에 샘플을 수집합니다.
- 플레이트를 RT-qPCR 기계에 로드하고 열 사이클러프로토콜(표 3)을사용하여 RT-qPCR 반응을 실행하기 시작합니다.
- 결과를 스프레드시트 파일로 내보내거나 프로그램이 완료된 후 제조에서 제공하는 소프트웨어를 사용하여 데이터를 분석합니다(대표적인 결과는 도 2에도시됨).
3. BAL 과 폐에서 호산구의 침투에 HDM RNA의 효과를 결정하는 FACS 분석
- FACS 분석을 위한 BAL 유체 수집
- HDM 알레르겐 추출물(도 3B에도시된 실험 설계에 따라)으로 치료된 마우스(여성, 8-12주 전, C57BL/6J)를CO2 흡입에 의해 안락사하였다.
- 플랫폼에 마우스를 놓고 바늘로 팔다리를 고정합니다.
- 70%의 에탄올로 마우스를 소독합니다. 가위를 사용하여 복부의 상부 부위에서 목까지 피부를 자른다.
- 부드럽게 침샘과 스테르노하이드 근육을 조심스럽게 떼어 내어 기관지를 노출시합니다. 집게를 사용하여 기관 아래에 나일론 끈(~10cm)을 놓습니다.
- 캐뉼라를 삽입하기에 충분할 정도로 기관 (후두 아래 ~ 2mm)에 절개를합니다. 기관을 잘라하지 마십시오. 기관지와 캐뉼라 주위에 끈을 매듭.
- PBS+EDTA의 1mL로 주사기를 적재하고 캐뉼라 끝에 부착합니다. PBS+EDTA 1mL을 폐에 주입하고 용액을 완전히 흡인시합니다. 주사기를 캐뉼라에서 조심스럽게 분리하고 용액을 얼음 위에 15mL 튜브로 옮겨 넣습니다.
- 신선한 PBS+EDTA로 주사기를 다시 로드하고 이 단계를 2배 반복합니다.
- 4°C에서 7분 동안 500 x g에서 세포를 펠렛하는 3.1.7 단계에서 얻은 풀링된 BAL을 함유한 튜브원심분리기. BAL 유체의 부피를 기록한 다음 펠릿을 방해하지 않고 2개의 1.5mL 튜브로 상수체를 전송합니다.
참고: BAL의 상체는 미래 분석(예: ELISA)을 위해 -70°C에 저장할 수 있습니다. - 심한 폐 염증으로 인해 펠릿에 RBC가 존재하는 경우, 상복부을 제거 한 후 RBC 리시스 버퍼의 500 μL을 추가하고 재서스펜션에 의해 잘 섞는다. 4°C에서 500 x g의 속도로 7분 동안 새로운 1.5mL 튜브 및 원심분리기로 용액을 옮긴다.
- 상체를 제거하고 FACS 버퍼의 150 μL에서 펠릿을 다시 분리합니다.
- 재중단 된 샘플의 150 μL을 96 웰 플레이트로 옮기고 4 °C에서 500 x g의 속도로 7 분 동안 플레이트를 원심 분리합니다.
- 신속하게, 우물의 바닥에 거주하는 세포를 수집하기 위해 조직 논문에 접시를 반전.
- 2.4G2 차단 항체(2.5 μg/100 μL)의 존재시 FACS 완충제에서 항체를 가진 세포를 얼룩지게 한다. 어두운 곳에서 30 분 동안 실온에서 접시를 배양하십시오.
- 염색 후, 원심분리판은 4°C에서 7분 동안 500 x g로 세포를 펠릿으로 한다.
- 티슈 페이퍼의 플레이트를 반전시켜 염색 용액을 제거한 다음 FACS 버퍼 100μL로 다시 세척하여 세척합니다. 다음으로, 4°C에서 7분 동안 500 x g에서 플레이트를 다시 원심분리하고 티슈 페이퍼상에 플레이트를 반전시켜 FACS 버퍼를 제거한다.
- 샘플을 150μL의 FACS 버퍼로 재일시 중단하고 샘플을 FACS 버퍼 350μL를 포함하는 FACS 튜브로 이송합니다. 각 샘플에 구슬 을 계산하는 25 μL을 추가합니다. 이제 샘플은 유동 세포 측정 분석을 위한 준비가 되었습니다.
참고: BAL 유체의 다양한 세포 유형은 표시된 바와 같이 항체로 표시되었다. SCS가 실행되기 전에 구슬 계산이 추가되었습니다. 유동 세포측정 데이터는 시판되는 소프트웨어를 사용하여 분석되었다. 게이팅 전략에 대한 그림 3 및 표 4를 참조하십시오.
- FACS 분석을 위한 폐 조직 소화
- 3.1.1 - 3.1.3 단계를 따르십시오.
- 살균 된 가위로 복부에서 목까지 피부를 잘라냅니다. 바늘로 피부를 고정하고 갈비뼈를 잘라 폐를 노출합니다.
- 전체 폐를 제거하고 차가운 PBS로 씻어. 폐 소화 용액 의 50 μL을 포함하는 1.5 mL 튜브에 샘플을 놓습니다.
- 폐 조직을 곡선 가위로 작은 조각으로 다진다. 폐 조직을 6웰 플레이트로 옮은 다음 폐 소화 용액 8mL를 추가합니다. 37°C 인큐베이터에 접시를 45분 동안 놓습니다.
- 잠복 후, 폐 조직을 분쇄하기 위해 1.5 mL 튜브의 상단을 사용합니다. 새로운 6웰 플레이트에 70 μm 스트레이너를 놓고 0.22 μm 필터를 통해 샘플을 적용합니다.
- 여과 된 용액을 15mL 튜브로 옮긴 다음 튜브를 500 x g에서 4 °C에서 7 분 동안 원심 분리합니다. 슈퍼네티를 흡인하고 RBC 용해 버퍼의 1mL에서 펠릿을 다시 중단하고 3 분 동안 얼음에 둡니다.
- 샘플을 1.5mL 튜브및 원심분리기로 500 x g에서 4°C에서 7분 동안 옮긴다. 2배 반복
- 폐 세포를 1mL FACS 버퍼로 2배 세척합니다. 슈퍼네티를 흡인하고 FACS 버퍼의 1mL에서 펠릿을 재연한 다음 샘플의 100 μL을 96 개의 웰 플레이트로 옮기십시오.
- 4°C에서 500 x g의 속도로 7분 동안 플레이트원심분리기를 합니다. FACS 분석을 위한 BAL 유체 수집에 기재된 단계를 따르십시오(3.1.13 받는사람은 3.1.16) 소화된 폐 조직 샘플의 세포를 얼룩지게 한다.
참고: 폐에 있는 호산구는 표시된 대로 항체로 표시된 다음 추가 FACS 분석을 위해 구슬을 계산하는 것과 혼합되었습니다. 흐름 세포측정 데이터는 관련 소프트웨어를 사용하여 분석되었다. HDM RNA 유도 면역 반응을 평가하기 위한 도 3을 참조하십시오.
4. 통계 분석
- 상용 소프트웨어를 사용하여 통계 분석을 수행합니다.
- 두 그룹의 비교를 위해 쌍이 없는 두 꼬리 학생 t 테스트를 통해 p 값을 결정합니다.
- 수식을 사용하여 참조 구슬(상단 패널)을 기반으로 호산구의 절대 수를 계산합니다.
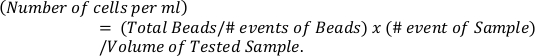
- 두 개 이상의 그룹을 비교하기 위해 양방향 ANOVA 및 Sidak의 여러 비교 테스트로 p 값을 결정합니다.
- 0.05보다 작은 p 값을 통계적으로 유의하다고 생각해 보십시오. p 값은 플롯에 *p&0.05, **p&0.01, ***p&0.001, ****p&0.0001로 표시됩니다.
참고: 모든 버퍼 레시피는 표 5에제공됩니다.
결과
HDM, 곤충 및 비 곤충 작은 동물에서 긴 dsRNA 구조의 존재는 dsRNA 특이적 마우스 단일 클론 항체 J2 (≥ 40bp)를 사용하여 점 블롯에 의해 검사되었다. RNase III는 DsRNA를J2(도1)에 의해 검출할 수 없는 12-15 bp dsRNA 단편으로 소화하는 데 사용하였다.
HDM 총 RNA의 능력은 용량 의존적 방식으로 마우스 폐에서 선천적인 면역 반응을 자극하는 RT-qPCR(도2,<...
토론
현재 프로토콜은 알레르기 성 천식의 마우스 모형에 있는 호산성 폐 염증의 발달에 알레르기성 관련 미생물 RNA의 면역 자극성 속성 및 그들의 충격을 평가하는 방법을 설명합니다. 긴 dsRNAs는 포유류 세포에 있는 인터페론 반응을 강력하게 활성화할 수 있는 많은 바이러스의 복제 중간체로 알려져 있더라도, HDM 알레르겐에 있는 그들의 존재는 우리의 최근 일15까지알려지지 않았?...
공개
우리는 공개 할 것이 없습니다.
감사의 말
카를라 고레나(Karla Gorena) 씨는 유동 세포측정에 대한 기술 지원을 해 주셔서 감사합니다. L.S.는 중국 장학위원회와 후난지방혁신재단(CX201713068)의 지원을 받고 있습니다. H.H.A.는 사우디아라비아 주 사카카 주 응용 의학 대학 임상 실험실 과학과의 지원을 받고 있습니다. X.D.L.은 UT 헬스 샌안토니오 의과 대학 스타트업 펀드와 맥스 및 미니시 보엘커 기금의 지원을 받고 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
참고문헌
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유