Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Identifizierung und Charakterisierung immunogener RNA-Arten in HDM-Allergenen, die eosinophile Lungenentzündungen modulieren
In diesem Artikel
Zusammenfassung
Umweltallergene wie Hausstaubmilben (HDM) enthalten oft mikrobielle Substanzen, die angeborene Immunreaktionen aktivieren, um allergische Entzündungen zu regulieren. Das hier vorgestellte Protokoll zeigt die Identifizierung von dsRNA-Arten in HDM-Allergenen und die Charakterisierung ihrer immunogenen Aktivitäten bei der Modulation eosinophiler Lungenentzündungen.
Zusammenfassung
Umweltallergene wie Hausstaubmilben (HDM) sind oft in komplexen Formen, die sowohl allergische Proteine enthalten, die aberrante Typ-2-Antworten antreiben, als auch mikrobielle Substanzen, die angeborene Immunreaktionen auslösen. Diese allergenassoziierten mikrobiellen Komponenten spielen eine wichtige Rolle bei der Regulierung der Entwicklung von Typ-2-Entzündlichen Erkrankungen wie allergischem Asthma. Die zugrunde liegenden Mechanismen bleiben jedoch weitgehend undefiniert. Das hier vorgestellte Protokoll bestimmt die strukturellen Eigenschaften und die In-vivo-Aktivität allergenassoziierter immunostimulatorischer RNA. Insbesondere werden häufige Allergene auf das Vorhandensein von doppelsträngigen RNA-Arten (dsRNA) untersucht, die IFN-Reaktionen in der Lunge stimulieren und die Entwicklung schwerer Lungeneosinophilie in einem Mausmodell von HDM-induziertem allergischem Asthma hemmen können. Hier haben wir die folgenden drei Assays aufgenommen: Dot blot, um die dsRNA-Strukturen in der gesamten RNA zu zeigen, die von Allergenen einschließlich HDM-Arten isoliert sind, RT-qPCR zur Messung der Aktivitäten von HDM-RNA in interferonstimulierender Gene (ISGs) Expression in der Mauslunge und FACS-Analyse zur Bestimmung der Auswirkungen von HDM-RNA auf die Anzahl der Eosinophile in BAL bzw. Lunge.
Einleitung
Basierend auf der ursprünglich von Strachan1vorgeschlagenen Hygienehypothese kann die frühkindliche Exposition gegenüber mikrobiellen Umweltfaktoren wie Endotoxin vor der Entwicklung allergischer Erkrankungen schützen2,3. Bei mikrobiellen Infektionen, z.B. Virusinfektionen, löst der angeborene Immundetektion von Fremdnukleinsäuren (RNA/DNA) Wirtsabwehrreaktionen4,5,6aus. Die Existenz und Prävalenz immunogener Nukleinsäuren wie lange doppelsträngige RNA-Arten (dsRNA) in Hausstaubmilben (HDM) oder anderen Insektenallergenen bleibt jedoch unbekannt. Dieses Protokoll wurde entwickelt, um festzustellen, ob HDM oder Insekten- und Nicht-Insektenallergene lange dsRNA-Arten enthalten, die eine schützende Immunantwort aktivieren können, um der Entwicklung einer schweren eosinophilen Lungenentzündung in einem Mausmodell von allergischem Asthma entgegenzuwirken. Hier bieten wir drei einfache und schnelle Methoden zur Bewertung der strukturellen Determinanten in HDM-Gesamt-RNA, die zur Regulierung allergeninduzierter eosinophiler Lungenentzündungen erforderlich sind.
Das Mukosal-Immunsystem ist das größte Immunorgan im Körper und dient als erste Linie der Wirtsabwehr gegen mikrobielle Infektionen und allergische Beleidigungen7,8. Die lange dsRNA, das Replikationszwischenprodukt vieler Viren, ist dafür bekannt, als pathogenassoziiertes molekulares Muster (PAMP) zu fungieren, um angeborene Reaktionen über Toll wie Rezeptor 3 (TLR3) wirksam zu stimulieren, um die Expression von Interferon-stimulierten Genen (ISGs)9,10,11,12,13,14zu induzieren. Wir haben vor kurzem gezeigt, dass HDM-Gesamt-RNA dsRNA-Strukturen enthielt, die die Expression von ISGs hochregulierten und eine schwere eosinophile Lungenentzündung reduzierten, wenn sie über die intratracheale Instillation in einem murinen Modell von allergischem Asthma verabreicht wurde, das durch HDM-Extrakte induziert wurde15. Die Schwere der Lungenentzündungen wird durch die Analyse der Immunzelltypen in bronchoalveolarer Spülung (BAL) und Lungengewebe mittels Durchflusszytometrie16,17,18,19,20bestimmt.
Dieses Protokoll enthält drei Assays: 1) schnelles Detektion von dsRNA-Strukturen mit RNA-Punktfleck mit einem mausmonoklonalen Antikörper J2, der speziell sequenzunabhängig an die dsRNA bindet; 2) schnelle Auswertung der In-vivo-Effekte immunostimulierender RNA in der Mauslunge durch Messung der Induktion von ISGs mit RT-qPCR; 3) genaue Quantifizierung von Eosinophilen in BAL und Lunge im Kontext von HDM-induzierten Lungenentzündungen mittels Flow-Zytometrie-Analyse.
Die oben genannten Assays können verwendet werden, um nicht nur allergische Lungenerkrankungen zu untersuchen, sondern auch respiratorische bakterielle und virale Infektionen. Beispielsweise kann der dsRNA-spezifische J2-Antikörper auch in anderen Anwendungen wie Immunaffinitätschromatographie, Immunhistochemie, enzymgebundenem Immunsorbent-Assay (ELISA) und Immunostaining21,22,23eingesetzt werden. Darüber hinaus können mehrere Anwendungen nach der BAL-Flüssigkeitssammlung zur Quantifizierung löslicher Inhalte wie Zytokine und Chemokine mit ELISA und Transkriptionsprofilierung von Zellen in den Atemwegen (z. B. Alveolarmakrophagen) genutzt werden. Obwohl es eine Vielzahl von Protokollen in der Literatur zur Bewertung von Lungenerkrankungen gibt, konzentrieren sich die meisten dieser Protokolle häufig auf die Zielvalidierung. Die hier beschriebenen Verfahren können angewendet werden, um Komponenten in Umweltallergenen zu identifizieren, die für die Regulierung der Entwicklung allergischer Krankheiten wichtig sind.
Protokoll
Die hier beschriebenen experimentellen Verfahren wurden vom Institutional Animal Care and Use Committee der University of Texas Health San Antonio genehmigt.
1. Dot Blot, um das Vorhandensein von dsRNA-Strukturen in HDM-Gesamt-RNA zu zeigen
- Vollständige RNA-Isolierung von Allergenen, Insekten und Nichtinsektenallergenen
- HDM,-Insekten oder Nicht-Insektentiere, die lebend gesammelt oder kommerziell gewonnen wurden, in 50 ml-Rohre geben und schnell mit Flüssig-N2einfrieren. Dann bei -70 °C für die nachfolgende vollständige RNA-Isolierung lagern.
HINWEIS: In diesem Experiment wurden HDM-, Insekten- und Nichtinsektentiere ausgewählt, da sie als häufige Allergenquellen bekannt sind. Darüber hinaus bleibt eine immunstimulierende Funktion ihrer RNAs unklar. - Übertragen Sie eine angemessene Menge (entspricht 100 l im Volumen oder weniger) von HDM-, Insekten- oder Nichtinsektentieren, die bei -70 °C gelagert werden,2 in ein 2 ml-Rohr mit Perlen (1,4 mm Keramikkugeln), dann Gefrierrohre in einem Flüssigkeits-N2-Behälter für 10 min.
- Für die gesamte RNA-Isolierung 1 ml Guanidinium-Thiocyanat-basiertes RNA-Isolationsreagenz24 in jede Röhre geben, dann das Insekt und nicht-insektierte Kleintiere mit einem hochenergetischen Zellstörer mit der maximalen Geschwindigkeit von 45 s brechen und auf Eis chillen. Wiederholen Sie diesen Schritt zweimal.
- Übertragen Sie die Lösung von Schritt 1.1.3 in ein neues 1,5 ml-Rohr und fügen Sie jedem Rohr und Wirbel 200 l Chloroform hinzu. Zentrifugenrohre bei 14.000 x g für 14 min bei 4 °C.
- Nach Abschluss der Zentrifugation die obere wässrige Phase (200 l) in ein neues 1,5 ml-Rohr mit 500 l Isopropanol übertragen, um das RNA-Pellet auszustoßen. Stören Sie die Interphase nicht. Das empfohlene Volumenverhältnis der oberen Phase im Vergleich zu Isopropanol beträgt 1:2,5 Verhältnis.
- Mischen Sie durch sanftes Wirbeln, dann Zentrifugenrohre bei 14.000 x g für 14 min bei 4 °C.
- Den Überstand mit Vorsicht ansaugen und dann das RNA-Pellet mit 500 l 75% Ethanol und Zentrifuge bei 7.500 x g 10 min bei 4 °C waschen. Entfernen Sie alle Flüssigkeiten mit Vorsicht, trocknen Sie das Pellet lufttrocken und lösen Sie das RNA-Pellet mit 20-50 l RNase-freiH2O auf.
- Messen Sie die RNA-Konzentration mit einem Spektralphotometer anhand der folgenden Parameter:
- Öffnen Sie die zugehörige Software und wählen Sie die Art der zu messenden Nukleinsäuren aus. Ändern Sie den Probentyp in RNA.
- Führen Sie die Leermessung mit 1-2 l RNase-frei H2O durch. Wischen Sie die RNase-freie H2O ab. Jetzt ist das Gerät für die Messung bereit.
- Laden Sie 1-2 l der RNA-Probe und messen Sie die RNA-Konzentration (g/l).
ANMERKUNG: Das Verhältnis der Absorption bei 260 und 280 nm (A260/280) bei 2,0 (1,9-2,2) wird allgemein als "rein" für RNA akzeptiert. Wenn sie nicht sofort verarbeitet werden, speichern Sie RNA-Proben bei -70 °C und vermeiden Sie die Gefrier-Tau-Zyklen, um die RNA intakt zu halten.
- HDM,-Insekten oder Nicht-Insektentiere, die lebend gesammelt oder kommerziell gewonnen wurden, in 50 ml-Rohre geben und schnell mit Flüssig-N2einfrieren. Dann bei -70 °C für die nachfolgende vollständige RNA-Isolierung lagern.
- Nachweis der dsRNA-Struktur in der gesamten RNA mit dsRNA-spezifischem J2-Antikörper
- Bereiten Sie zwei 20 L RNA-Proben (200 ng/L) vor. Eine mit RNase-III-Behandlung (1 l für 1 g RNA, Inkubation bei 37 °C für 60 min) und die andere ohne RNase-III-Behandlung.
HINWEIS: RNase III wird hier verwendet, um dsRNA gezielt zu degradieren, aber nicht einsträngige RNA25. - Verwenden Sie einen Bleistift, um Gitter zu zeichnen, in denen RNA-Proben auf der Membran ausgelöscht werden.
- Spot 2 l der 200 ng/l der RNA-Probe auf die positiv geladene Nylonmembran.
- Vernetzen Sie die Proben mit der Membran bei 1.200 Mikrojoule x 100 in einem UV-Vernetzen. Wiederholen Sie die Schritte 1.2.3 und 1.2.4 zwei weitere Male am Beispielpunkt. Dies führt zu einer Gesamtmenge von 0,8 g pro Blot.
ANMERKUNG: Stellen Sie nicht mehr als 2 l RNA-Probe auf der Membran zu einem Zeitpunkt. - Unspezifische Bindung mit 5% Milch in TBS-T für 1 h mit Schütteln bei Raumtemperatur blockieren. Entfernen Sie die Blockierlösung aus Schritt 1.2.5 und fügen Sie den Anti-dsRNA J2-Antikörper bei der Verdünnung von 1:1.000 in 1% Milch in TBS-T hinzu und inkubieren Sie ihn über Nacht mit Schütteln bei 4 °C.
- Waschen Sie die Membran mit TBS-T für 5 min und wiederholen Sie diesen Schritt für 3 Mal. Fügen Sie den sekundären Antikörper (Alkaline phosphatase-konjugierte Anti-Maus IgG in 1% Milch 1:5.000) und inkubieren für 1 h auf einem Shaker bei Raumtemperatur. Waschen Sie die Membran mit TBS-T für 5 min und wiederholen Sie diesen Schritt für 3x.
- Fügen Sie das Substrat (BCIP/NBT) hinzu und inkubieren Sie 5-15 min, bis ein gewünschtes Signal sichtbar ist.
- Stoppen Sie die Reaktion, indem Sie die Membran mit ddH2O spülen.
- Trocknen Sie die Membran auf Tissuepapieren und fotografieren Sie mit dem Smartphone (ein repräsentatives Ergebnis ist in Abbildung 1dargestellt).
- Bereiten Sie zwei 20 L RNA-Proben (200 ng/L) vor. Eine mit RNase-III-Behandlung (1 l für 1 g RNA, Inkubation bei 37 °C für 60 min) und die andere ohne RNase-III-Behandlung.
2. RT-qPCR zur Messung der Fähigkeit der HDM-Gesamt-RNA bei der Stimulierung der Lungen-ISGs-Expression
- RNA-Isolierung von Mäusen Lungengewebe
HINWEIS: Mäuse (weiblich, 8-12 Wochen alt, C57BL/6J) wurden unter spezifischen pathogenfreien Bedingungen gehalten.- Das Tier kurz mit Isofluran ansien und über die intratracheale Instillation mit 5 g (verdünnt in 80 l PBS) von HDM-RNAs, die mit oder ohne RNase III behandelt werden, verabreichen.
- Nach 16-18 h nach der HDM-RNA-Behandlung, opfern Sie die Maus durchCO2-Inhalation für ein paar Minuten. Legen Sie dann die Maus auf eine Plattform und heften Gliedmaßen mit Nadeln.
- Desinfizieren Sie die Maus mit 70% Ethanol und schneiden Sie dann die Haut vom Bauch bis zum Hals mit einer sterilisierten Schere.
- Fixieren Sie die Haut mit Nadeln und schneiden Sie die Rippen, um die Lunge freizulegen. Entfernen Sie die gesamte Lunge und waschen Sie sie mit kaltem PBS. Legen Sie die Lunge auf Tissuepapiere und verbrauchen Sie ein kleines Stück von jedem Lungenlappen in ein 2 ml-Rohr mit Perlen (200-300 l im Volumen, 1,4 mm Keramikkugeln).
HINWEIS: Der Zweck der Verwendung von Keramikperlen ist es, ganze Lungengewebe zu schleifen - Einfrieren der Lungenproben, indem Sie2 die Tuben für 10 min in einen Flüssigkeits-N2-Behälter legen.
- Fügen Sie jedem Röhrchen 500 l Guanidinium-Thiocyanat-basiertes RNA-Isolationsreagenz hinzu und brechen Sie das Lungengewebe mit einem Homogenisator für 45 s. Chill auf Eis zwischen jedem Schritt. Wiederholen Sie diesen Schritt zweimal.
- Befolgen Sie die Schritte 1.1.4- 1.1.7 für die Isolierung der Lungen-RNA.
- Das Pellet lufttrocknen und das RNA-Pellet mit der richtigen Menge an RNase-freiemH2O (ca. 20-30 'L) auflösen.
- Messen Sie die RNA-Konzentration, wie in Schritt 1.1.8 beschrieben.
- RT-qPCR zur Bestimmung der Fähigkeit von HDM-RNA bei der Stimulierung der Lungengenexpression.
- Führen Sie die cDNA-Synthese gemäß dem referenzierten Protokoll26durch.
- Richten Sie eine RT-qPCR-Reaktion bei 10 l/well für eine 384-Well-Platte mit oben erzeugter cDNA und den genspezifischen Primerpaaren ein (Tabelle 1 und Tabelle 2).
- Versiegeln Sie die Brunnen fest mit einem transparenten Klebefilm und wirbeln Sie die Platte für 30 s. Drehen Sie die Platte bei 1.000 x g für 30 s, um Proben an der Unterseite der Brunnen zu sammeln.
- Laden Sie die Platte auf eine RT-qPCR-Maschine und starten Sie die RT-qPCR-Reaktion mit dem Thermocycler-Protokoll (Tabelle 3).
- Exportieren Sie die Ergebnisse in eine Tabellenkalkulationsdatei oder analysieren Sie die Daten mithilfe der Software, die von der Herstellung nach Abschluss des Programms bereitgestellt wird (ein repräsentatives Ergebnis ist in Abbildung 2dargestellt).
3. FACS-Analyse zur Bestimmung der Auswirkungen von HDM-RNA auf die Infiltration von Eosinophilen in
- BAL-Flüssigkeitssammlung für FACS-Analyse
- Euthanisieren Sie Mäuse (weiblich, 8-12 Wochen alt, C57BL/6J), die mit HDM-Allergenextrakten (nach dem experimentellen Design in Abbildung 3B)durchCO2-Inhalation behandelt wurden.
- Legen Sie die Maus auf eine Plattform und pin Gliedmaßen mit Nadeln.
- Desinfizieren Sie die Maus mit 70% Ethanol. Verwenden Sie eine Schere, um die Haut aus dem oberen Bereich des Bauches bis zum Hals zu schneiden.
- Ziehen Sie vorsichtig die Speicheldrüsen und den Sternohyoid-Muskel vorsichtig auseinander mit den Zangen, um die Luftröhre freizulegen. Legen Sie eine Nylonschnur (ca. 10 cm) unter die Luftröhre mit Zangen.
- Machen Sie einen Schnitt in der Luftröhre (ca. 2 mm unter dem Kehlkopf) gerade genug, um eine Kanüle einzusetzen. Schneiden Sie die Luftröhre nicht durch. Knoten Sie die Schnur um Luftröhre und Kanüle.
- Die Spritze mit 1 ml PBS+EDTA beladen und am Ende der Kanüle befestigen. 1 ml PBS+EDTA in die Lunge injizieren und die Lösung vollständig ansaugen. Die Spritze vorsichtig von der Kanüle lösen und die Lösung in ein 15 ml Rohr auf Eis übertragen.
- Laden Sie die Spritze mit dem frischen PBS+EDTA nach und wiederholen Sie diesen Schritt 2x.
- Zentrifugieren Sie das Rohr mit dem gepoolten BAL, das in Schritt 3.1.7 erhalten wurde, um die Zellen bei 500 x g für 7 min bei 4 °C zu pellet. Zeichnen Sie das Volumen der BAL-Flüssigkeit auf und übertragen Sie den Überstand dann auf zwei 1,5 ml-Rohre, ohne das Pellet zu stören.
HINWEIS: Der Überstand von BAL kann bei -70 °C für zukünftige Analysen, z.B. ELISA, gelagert werden. - Falls es RBCs im Pellet aufgrund einer schweren Lungenentzündung gibt, nach dem Entfernen des Überstandes, fügen Sie 500 l RBC-Lysepuffer hinzu und mischen Sie gut durch Resuspension. Übertragen Sie die Lösung für 7 min bei einer Geschwindigkeit von 500 x g bei 4 °C in ein neues 1,5 ml Rohr und eine Neue Zentrifuge.
- Entfernen Sie den Überstand und setzen Sie das Pellet in 150 L FACS-Puffer wieder auf.
- Die 150 l der resuspendierten Probe in 96-Well-Platte geben und die Platte 7 min bei einer Geschwindigkeit von 500 x g bei 4 °C zentrifugieren.
- Schnell, invertieren Sie die Platte auf Gewebepapiere, um die Zellen zu sammeln, die sich an der Unterseite der Brunnen befinden.
- Stain die Zellen mit Antikörpern im FACS-Puffer in Gegenwart von 2.4G2 blockierenden Antikörpern (2,5 g / 100 l). Inkubieren Sie die Platte bei Raumtemperatur für 30 min an einem dunklen Ort.
- Zentrifugieren Sie die Platte nach der Färbung, um die Zellen bei 500 x g für 7 min bei 4 °C zu pellet.
- Entfernen Sie die Färbelösung, indem Sie die Platte auf Tissuepapier invertieren und dann waschen, indem Sie sie mit 100 l FACS-Puffer wieder aufhängen. Anschließend zentrieren Sie die Platte wieder bei 500 x g für 7 min bei 4 °C und entfernen Sie den FACS-Puffer, indem Sie die Platte auf Tissuepapier invertieren.
- Resuspend Proben in 150 L FACS-Puffer und übertragen Proben in die FACS-Röhren mit 350 L FACS-Puffer. Fügen Sie jeder Probe 25 L Zählperlen hinzu. Proben sind nun für die Analyse der Durchflusszytometrie bereit.
HINWEIS: Verschiedene Zelltypen in BAL-Flüssigkeit wurden wie angegeben mit Antikörpern gekennzeichnet. Vor dem FACS-Lauf wurden Zählperlen hinzugefügt. Die Flusszytometriedaten wurden mit einer kommerziell erhältlichen Software analysiert. Siehe Abbildung 3 und Tabelle 4 für die Gating-Strategie.
- Lungengewebeverdauung für die FACS-Analyse
- Befolgen Sie die Schritte 3.1.1 - 3.1.3.
- Schneiden Sie die Haut vom Bauch bis zum Hals mit einer sterilisierten Schere. Fixieren Sie die Haut mit Nadeln und schneiden Sie die Rippen, um die Lunge freizulegen.
- Entfernen Sie die gesamte Lunge und waschen Sie sie mit kaltem PBS. Legen Sie Proben in das 1,5 ml-Rohr, das 50 l Lungenverdauungslösung enthält.
- Mit einer gebogenen Schere das Lungengewebe in kleine Stücke zerkleinern. Übertragen Sie das Lungengewebe in eine 6-Well-Platte, dann fügen Sie 8 ml Lungenverdauungslösung hinzu. Legen Sie die Platte 45 min auf einen Shaker in 37 °C Inkubator.
- Nach der Inkubation verwenden Sie die Oberseite von 1,5 ml Röhrchen, um das Lungengewebe zu mahlen. Legen Sie ein 70'm-Siebe auf eine neue 6-Well-Platte und tragen Sie die Probe durch 0,22 m Filter auf.
- Die gefilterte Lösung in ein 15 ml-Rohr geben, dann die Rohre bei 500 x g 7 min bei 4 °C zentrieren. Den Überstand ansaugen und das Pellet in 1 ml RBC-Lysepuffer wieder aufsetzen und 3 min auf dem Eis lassen.
- Die Probe in 1,5 ml Röhrchen und Zentrifuge bei 500 x g für 7 min bei 4 °C geben. Wiederholen 2x
- Waschen Sie die Lungenzellen 2x mit 1 ml FACS Puffer. Den Überstand ansaugen und das Pellet in 1 ml FACS-Puffer wieder aufhängen und dann 100 l der Probe in 96 Well-Platte übertragen.
- Zentrifugieren Sie die Platte für 7 min bei einer Geschwindigkeit von 500 x g bei 4 °C. Befolgen Sie die in der BAL-Flüssigkeitssammlung für die FACS-Analyse (3.1.13 bis 3.1.16) beschriebenen Schritte, um die Zellen von verdauten Lungengewebeproben zu färben.
HINWEIS: Eosinophile in der Lunge wurden mit Antikörpern wie angegeben gekennzeichnet und dann mit Zählperlen für weitere FACS-Analysen gemischt. Die Flusszytometriedaten wurden mit zugehöriger Software analysiert. Siehe Abbildung 3 zur Bewertung von HDM-RNA-induzierten Immunantworten.
4. Statistische Analyse
- Führen Sie statistische Analysen mit einer kommerziell verfügbaren Software durch.
- Bestimmen Sie die p-Werte durch den ungepaarten zweischwanzigen Schüler-t-Test für den Vergleich zweier Gruppen.
- Berechnen Sie die absolute Anzahl von Eosinophilen basierend auf Referenzperlen (oberes Panel) mit der Formel
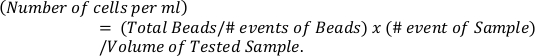
- Bestimmen Sie die p-Werte durch zweiseitig angelegten ANOVA- und Sidak-Mehrfachvergleichstest für den Vergleich von mehr als zwei Gruppen.
- Betrachten Sie einen p-Wert kleiner als 0,05 als statistisch signifikant. Die p-Werte werden in Diagrammen als *p <0.05, **p<0.01, ***p<0.001 und ****p<0.0001 angegeben.
HINWEIS: Alle Pufferrezepte sind in Tabelle 5aufgeführt.
Ergebnisse
Das Vorhandensein von langen dsRNA-Strukturen in HDM, Insekten und Nicht-Insekten-Kleintieren wurde mit einem dsRNA-spezifischen Mausmonoklon-Antikörper J2 (ca. 40bp) mit Punktblot untersucht. RNase III wurde verwendet, um dsRNA in 12–15 bp dsRNA-Fragmente zu verdauen, die durch J2 nicht nachweisbar waren (Abbildung 1).
Die Fähigkeit der HDM-Gesamt-RNA, eine angeborene Immunantwort in der Mauslunge dosisabhängig zu stimulieren, wurde mit RT-qPCR analysiert (<...
Diskussion
Das aktuelle Protokoll beschreibt, wie die immunstimulierenden Eigenschaften allergenassoziierter mikrobieller RNA und ihre Auswirkungen auf die Entwicklung von eosinophiler Lungenentzündung in einem Mausmodell von allergischem Asthma bewertet werden können. Obwohl lange dsRNAs als Replikationszwischenprodukte vieler Viren bekannt sind, die Interferon-Reaktionen in Säugetierzellen wirksam aktivieren können, waren ihre Präsenz in HDM-Allergenen bis zu unserer jüngsten Arbeitunbekannt 15. Die ...
Offenlegungen
Wir haben nichts zu verraten.
Danksagungen
Wir danken Frau Karla Gorena für die technische Unterstützung in der Durchflusszytometrie. L.S. wird vom China Scholarship Council und der Hunan Provincial Innovation Foundation for Postgraduate (CX201713068) unterstützt. H.H.A. wird vom Department of Clinical Laboratory Sciences, College of Applied Medical Sciences, Jouf University, Sakaka, Saudi-Arabien unterstützt. X.D.L. wird vom UT Health San Antonio School of Medicine Startup Fund und dem Max and Minnei Voelcker Fund unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
Referenzen
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten