需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
HDM过敏原中免疫原RNA物种的识别和特征,可调节嗜酸性肺炎
摘要
环境过敏原,如家庭尘虫(HDM),通常含有微生物物质,激活先天免疫反应,以调节过敏性炎症。此处提出的协议演示了 HDM 过敏原中 dsRNA 物种的识别,并表征了其在调节嗜酸性肺炎症时免疫原性活动。
摘要
环境过敏原,如家庭尘虫(HDM)通常以复杂形式,既含有过敏性蛋白质,驱动异常2型反应,又含有诱导先天免疫反应的微生物物质。这些过敏原相关的微生物成分在调节过敏性哮喘等2型炎症疾病的发展方面起着重要作用。然而,基本机制基本上仍未确定。此处提出的协议确定了过敏原相关免疫刺激RNA的结构特征和体内活性。具体来说,在HDM引起的过敏性哮喘小鼠模型中,对常见过敏原检查是否存在双链RNA(dsRNA)物种,这些物种可以刺激肺的 IFN 反应,并抑制严重肺嗜酸性病的发展。在这里,我们包括以下三种检测方法:点印显示从包括HDM物种在内的过敏原中分离出的DNA中的dsRNA结构;RT-qPCR测量HDM RNA在小鼠肺部干扰素刺激基因(ISG)表达(ISG)中的活动;FACS分析,分别确定HDM RNA对BAL和肺嗜酸性生物数量的影响。
引言
根据Strachan1最初提出的卫生假说,幼儿接触环境微生物因素,如内毒素可以防止过敏性疾病2,3,的发展。在微生物感染期间,例如病毒感染,异核酸(RNA/DNA)的先天免疫检测触发宿主防御反应4,4,5,6。,6然而,免疫原核酸的存在和流行,如长双链RNA(dsRNA)物种在家庭尘虫(HDM)或其他昆虫过敏原仍然未知。该协议旨在确定HDM或昆虫和非昆虫过敏原是否含有长dsRNA物种,可以激活保护性免疫反应,以抵消过敏性哮喘小鼠模型中严重嗜酸性肺炎症的发展。在这里,我们提供三种简单而快速的方法来评估HDM总RNA的结构决定因素,这些决定因素是调节过敏原诱发的嗜酸性肺炎症所需的。
粘膜免疫系统是人体最大的免疫器官,是抵御微生物感染和过敏侮辱的第,一道防线。长dsRNA,许多病毒的复制中间体,被称为病原体相关的分子模式(PAMP),通过像3(TLR3)这样的收费受体(TLR3)有效刺激先天反应,以诱导干扰素刺激基因(ISG)9、10、11、12、13、14,10,11,12,13的表达。我们最近表明,HDM总RNA含有dsRNA结构,当通过心内注射在HDM提取物引起的过敏性哮喘的murine模型中施用时,可调节 ISG 的表达,减少严重的嗜酸性肺炎。肺炎症的严重程度是通过分析支气管(BAL)和肺组织的免疫细胞类型,通过流细胞学16,17,18,19,2016,17,18,19确定肺炎症的严重程度。
该协议包括三种检测:1)使用小鼠单克隆抗体J2快速检测具有RNA点印迹的dsRNA结构,该抗体以与序列无关的方式与dsRNA(±40bp)结合;2) 使用RT-qPCR测量 ISG 的诱导,快速评估小鼠肺部免疫刺激RNA的体内效应;3) 使用流量细胞学分析,在HDM引起的肺部炎症背景下准确定量BAL和肺的嗜酸性。
上述检测不仅可用于研究过敏性肺病,还可用于研究呼吸道细菌和病毒感染。例如,dsRNA特异性J2抗体也可用于其他应用,如免疫仿彩色谱、免疫组织化学、酶链接免疫吸附剂测定(ELISA)和免疫染色21、22、23。21,22,23此外,BAL流体收集下游的几种应用可用于使用ELISA量化可溶性物质,如细胞因子和化疗素,以及气道细胞的转录分析(如道道巨噬细胞)。虽然文献中提供了多种评估肺病的协议,但大多数协议通常侧重于目标验证。此处描述的程序可用于识别环境过敏原中对调节过敏性疾病发展非常重要的成分。
研究方案
这里描述的实验程序得到了德克萨斯大学圣安东尼奥分校机构动物护理和使用委员会的批准。
1. 点印,以显示 HDM 总 RNA 中存在 dsRNA 结构
- 与过敏原、昆虫和非昆虫过敏原的总RNA分离
- 将活捉或商业获得的 HDM、昆虫或非昆虫动物放入 50 mL 管中,然后快速用液体-N2 冻结。然后在-70°C储存,以进行后续总RNA分离。
注:在这个实验中,HDM,昆虫和非昆虫动物被选择,因为它们是众所周知的过敏原的常见来源。此外,其RNA的免疫刺激功能仍不清楚。 - 将储存在-70°C的昆虫或非昆虫动物的HM、昆虫或非昆虫动物的合适量(相当于100μL或更少的体积)转移到含有珠子(1.4毫米陶瓷球体)的2 mL管中,然后在液体-N2容器中冷冻管约10分钟。
- 对于总RNA分离,在每管中加入1mL的硫化基的RNA分离试剂24,然后用高能细胞干扰剂以45 s的最大速度打破昆虫和非昆虫小动物,并在冰上冷却。重复此步骤两次。
- 将溶液从步骤1.1.3转移到新的1.5 mL管中,并将200μL的氯仿添加到每个管和涡中。14,000 x g 的离心管,在 4 °C 下 14 分钟。
- 离心完成后,将上水相(200 μL)转移到含有500μL异丙醇的新的1.5 mL管中,以沉淀RNA颗粒。不要打扰相间。上相与异丙醇的推荐容积比为1:2.5比。
- 通过温和的涡旋混合,然后在14,000 x g的离心管在4°C下14分钟。
- 小心吸制上一液,然后用 500 μL 的 75% 乙醇清洗 RNA 颗粒,并在 4 °C下以 7,500 x g 离心 10 分钟。小心地去除所有液体,风干颗粒,用 20-50 μL 无 RNase H 2 O 溶解RNA颗粒。
- 使用以下参数使用分光光度计测量RNA浓度:
- 打开相关软件,选择要测量的核酸类型。将样品类型更改为RNA。
- 使用 1-2 μL 无 RNase H2O 执行空白测量。擦去无 RNase H2O。现在,仪器已准备好进行测量。
- 加载RNA样品1-2μL并测量RNA浓度(μg/μL)。
注:260 nm 和 280 nm (A260/280) 的吸光比在 +2.0 (1.9-2.2) 时被普遍接受为 RNA 的"纯"。如果不立即处理,将RNA样品储存在-70°C,避免冷冻-解冻循环,以保持RNA完好无损。
- 将活捉或商业获得的 HDM、昆虫或非昆虫动物放入 50 mL 管中,然后快速用液体-N2 冻结。然后在-70°C储存,以进行后续总RNA分离。
- 使用 dsRNA 特异性 J2 抗体检测总RNA中的 dsRNA 结构
- 制备两个 20 μL 的 RNA 样品(200 ng/μL)。一种为RNase-III治疗(1 μL,1μg RNA,在37°C孵育60分钟),另一个未经RNase-III治疗。
注:RNase III 在这里专门降解 dsRNA,但不是单链 RNA25。 - 用铅笔绘制RNA样品在膜上被污污的网格。
- 将RNA样品的2μL的2μL斑到带正向尼龙膜上。
- 在紫外线交联器中,以 1,200 微焦耳 x 100 将样品与膜交联。在采样点处再重复步骤 1.2.3 和 1.2.4 两次。这将导致每印迹总计 0.8 μg。
注:每次不要在膜上发现超过2μL的RNA样本。 - 在室温下摇晃时,用5%牛奶在TBS-T中阻断非特异性结合1小时。从步骤1.2.5中去除阻消溶液,在TBS-T的1%牛奶中加入抗dsRNA J2抗体,并在4°C下摇动过夜孵育。
- 用 TBS-T 清洗膜 5 分钟,重复此步骤 3 次。加入二级抗体(碱性磷酸酶结合抗小鼠IgG稀释在1%牛奶1:5,000)和孵育1小时在室温的摇床上。用 TBS-T 清洗膜 5 分钟,然后重复此步骤 3 次。
- 加入基板(BCIP/NBT),孵育5-15分钟,直到所需信号可见。
- 使用 ddH 2 O 冲洗膜,停止反应。
- 擦干纸巾上的膜并使用智能手机拍照(图 1 中显示了代表性的结果)。
- 制备两个 20 μL 的 RNA 样品(200 ng/μL)。一种为RNase-III治疗(1 μL,1μg RNA,在37°C孵育60分钟),另一个未经RNase-III治疗。
2. RT-qPCR测量HDM总RNA在刺激肺 ISG 表达方面的能力
- 从小鼠肺组织分离的RNA
注:小鼠(雌性,8-12周大,C57BL/6J)在特定的无病原体条件下保持。- 用异氟兰进行简单麻醉,通过静脉注射,用5μg(在80μL PBS中稀释)的HDMRNA进行麻醉,用或不用RNase III进行治疗。
- 经过16-18小时HDMRNA治疗后,通过CO2吸入牺牲小鼠几分钟。然后,将鼠标放在平台上,用针固定四肢。
- 用70%乙醇对小鼠进行消毒,然后用消毒剪刀将皮肤从腹部切到颈部。
- 用针头固定皮肤,割断肋骨以暴露肺部。取出整个肺,用冷 PBS 清洗。将肺放在纸巾上,将每个肺叶的一小块切成含有珠子的 2 mL 管(体积为 200-300 μL,陶瓷球体为 1.4 mm)。
注:使用陶瓷珠的目的是研磨整个肺组织 - 将管子放入液-N2容器中,冷冻肺样本约10分钟。
- 在每个管中加入500μL的硫化铀基RNA分离试剂,用均质剂将肺组织分解,每一步之间在冰上冷却45 s。重复此步骤两次。
- 按照步骤1.1.4-1.1.7进行肺RNA分离。
- 空气干燥颗粒,用适当数量的无 RNase H2O (+20-30 μL) 溶解RNA颗粒。
- 测量步骤1.1.8中描述的RNA浓度。
- RT-qPCR,用于确定HDMRNA在刺激肺基因表达方面的能力。
- 以从肺组织中提取的100纳克/μLRNA为模板,根据参考方案26进行cDNA合成。
- 使用上面生成的 cDNA 和基因特异性底向对(表 1 和表2),在 10 μL/well 下设置 RT-qPCR 反应。Table 1
- 用透明胶膜将水井紧紧密封,将板旋转30 s。旋转板在1000 x g,30 s,以收集井底的样品。 x g
- 将板加载到RT-qPCR机器上,然后开始使用热循环器协议运行RT-qPCR反应(表3)。
- 将结果导出到电子表格文件中,或使用制造部门在程序完成后提供的软件分析数据(图 2 中显示了代表性的结果)。
3. FACS 分析,以确定 HDM RNA 对 BAL 和肺中嗜酸性蛋白素渗透的影响
- 用于 FACS 分析的 BAL 流体收集
- 通过CO2吸入用HDM过敏原提取物(根据图3B所示的实验设计)对小鼠(雌性,8-12周大,C57BL/6J)进行安乐死。2
- 将鼠标放在平台上,用针固定四肢。
- 用70%乙醇对鼠标进行消毒。用剪刀将皮肤从腹部的上部区域剪到颈部。
- 轻轻地,用钳子小心地将唾液腺和胸腺肌肉拉开,以暴露气管。用钳子将尼龙绳(±10厘米)放在气管下。
- 在气管(喉下±2毫米)进行切口,足以插入一个管。不要切开气管。在气管和气管周围打结绳子。
- 用 1 mL 的 PBS+EDTA 加载注射器,并将其连接到管的端。将 1 mL 的 PBS+EDTA 注射到肺部,并完全吸气溶液。小心地将注射器从管子中分离,将溶液转移到冰上 15 mL 管中。
- 使用新鲜的 PBS+EDTA 重新加载注射器,然后重复此步骤 2x。
- 将含有步骤 3.1.7 中获得的池状 BAL 的管离心,在 4 °C下以 500 x g 的 500 x g 进行 7 分钟颗粒状。记录BAL液体的体积,然后将上流液转移到两个1.5 mL管,而不会干扰颗粒。
注:BAL的上半液可以储存在-70°C,供将来分析,例如ELISA。 - 如果颗粒中存在由于严重的肺部炎症而存在的 RBC,在去除上经剂后,加入 500 μL 的 RBC 裂解缓冲液,通过再增液混合。将溶液转移到新的 1.5 mL 管中,在 4 °C下以 500 x g 的速度离心 7 分钟。
- 去除上流剂,将颗粒重新在 150 μL 的 FACS 缓冲液中。
- 将重新浓缩样品的 150 μL 转移到 96 井板中,并在 4 °C下以 500 x g 的速度将板离心 7 分钟。
- 快速,将板在纸巾上反转,收集位于井底的细胞。
- 在2.4G2阻断抗体(2.5μg/100μL)存在的情况下,用FACS缓冲液中的抗体染色细胞。在室温下在黑暗的地方孵育板30分钟。
- 染色后,将板离心,在 4 °C下以 500 x g 的 7 分钟对细胞进行颗粒。
- 通过将板倒置在纸巾上,然后用 100 μL 的 FACS 缓冲液重新洗涤,去除染色溶液。接下来,在 4 °C下以 500 x g 再次离心板 7 分钟,并在纸巾上反转板,取出 FACS 缓冲液。
- 将样品重新放入 150 μL 的 FACS 缓冲液中,将样品传输到含有 350 μL 的 FACS 缓冲液的 FACS 管中。向每个样品添加 25 μL 的计数珠。样品现已准备好进行流式细胞学分析。
注:BAL流体中的各种细胞类型都标有抗体。在 FACS 运行之前添加了计数磁珠。使用市售软件对流式细胞仪数据进行了分析。有关浇注策略,请参阅图 3 和表 4。
- 用于 FACS 分析的肺组织消化
- 按照步骤 3.1.1 - 3.1.3 操作。
- 用消毒剪刀从腹部到颈部切割皮肤。用针头固定皮肤,割断肋骨以暴露肺部。
- 取出整个肺,用冷 PBS 清洗。将样品放在含有50μL肺消化液的1.5 mL管中。
- 用弯曲的剪刀将肺组织切成小块。将肺组织转移到6井板中,然后加入8mL的肺消化液。将板放在 37 °C 培养箱中的摇床上 45 分钟。
- 孵育后,使用1.5 mL管的顶部研磨肺组织。将 70 μm 滤株放在新的 6 井板上,并通过 0.22 μm 过滤器应用样品。
- 将过滤溶液转移到 15 mL 管中,然后在 4 °C下以 500 x g 离心管 7 分钟。吸制上一液,在1mL的RBC解液缓冲液中重新暂停颗粒,并放在冰上3分钟。
- 将样品转移到 1.5 mL 管中,在 4 °C下以 500 x g 的离心机进行 7 分钟。重复 2x
- 用1 mL FACS缓冲液清洗肺细胞2倍。将上流液吸进,在1 mL的FACS缓冲液中重新制备颗粒,然后将100μL的样品转移到96井板中。
- 在 4 °C 下以 500 x g 的速度离心板 7 分钟。按照 BAL 液体收集中描述的步骤进行 FACS 分析 (3.1.13 到 3.1.16) 来染色消化的肺组织样本的细胞。
注:肺部的嗜酸性果蝇被标记成抗体,然后与计数珠混合,以进行进一步的FACS分析。使用相关软件对流式细胞仪数据进行了分析。有关评估HDM RNA诱导的免疫反应,请参阅图 3。
4. 统计分析
- 使用市售软件执行统计分析。
- 通过未配对的双尾学生 t 测试确定p值,以便比较两个组。
- 使用公式根据参考珠(顶板)计算嗜酸性果蝇的绝对数量
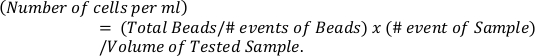
- 通过双向 ANOVA和 Sidak 的多个比较测试确定 p 值,以便比较两个多个组。
- 将小于 0.05 的p值视为具有统计显著性。p 值在绘图上指示为 *p <0.05、**p<0.01、***p<0.001 和***p<0.0001。
注:所有缓冲区配方都列在表 5 中。
结果
使用 dsRNA 特异性小鼠单克隆抗体 J2(±40bp)对HDM、昆虫和非昆虫小动物中长 dsRNA 结构的存在进行了点印检查。RNase III 用于将 dsRNA 消化成 12~15 bp dsRNA 片段,J2 检测不到这些片段(图 1)。
RT-qPCR分析了HDM总RNA以剂量依赖的方式刺激小鼠肺部先天免疫反应的能力(图2,上部)。RNase III 治疗废除了 HDM 总 RNA 的免疫刺激活性,表明 HDM ?...
讨论
目前的协议描述了如何评估过敏原相关微生物RNA的免疫刺激特性及其对过敏性哮喘小鼠模型中嗜酸性肺炎症发展的影响。虽然长dsRNA被称为许多病毒的复制中间体,可以有力地激活哺乳动物细胞中的干扰素反应,它们在HDM过敏原中的存在一直未知,直到我们最近的工作15。本手稿中介绍的RNA点印迹、RT-qPCR和FACS分析的组合,可能为解剖先天成分(如环境过敏原中的 dsRNA 物种)提供...
披露声明
我们没有什么可透露的。
致谢
我们感谢卡拉·戈雷纳女士在流动细胞学方面提供技术援助。L.S. 得到中国奖学金理事会和湖南省研究生创新基金会 (CX201713068) 的支持。H.H.A. 由沙特阿拉伯萨卡卡朱夫大学应用医学学院临床实验室科学系提供支持。X.D.L. 由 UT 健康圣安东尼奥医学院创业基金和马克斯和明奈沃尔克基金支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
参考文献
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。