Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Identification et caractérisation des espèces d’ARN immunogéniques chez les allergènes HDM qui modulent l’inflammation pulmonaire éosinophile
Dans cet article
Résumé
Les allergènes environnementaux tels que les acariens domestiques (HDM) contiennent souvent des substances microbiennes qui activent les réponses immunitaires innées pour réguler l’inflammation allergique. Le protocole présenté ici démontre l’identification des espèces de dsRNA dans les allergènes de HDM et la caractérisation de leurs activités immunogéniques en modulant l’inflammation des poumons éosinophiles.
Résumé
Les allergènes environnementaux tels que les acariens domestiques (HDM) sont souvent sous des formes complexes contenant à la fois des protéines allergiques qui entraînent des réponses aberrantes de type 2 et des substances microbiennes qui induisent des réponses immunitaires innées. Ces composants microbiens associés aux allergènes jouent un rôle important dans la régulation du développement de conditions inflammatoires de type 2 telles que l’asthme allergique. Cependant, les mécanismes sous-jacents restent largement indéfinis. Le protocole présenté ici détermine les caractéristiques structurelles et l’activité in vivo de l’ARN immunostimularisé associé aux allergènes. Plus précisément, les allergènes communs sont examinés pour la présence d’espèces à double BRIN d’ARN (dsRNA) qui peuvent stimuler les réponses IFN dans les poumons et freiner le développement de l’éosinophilie pulmonaire grave dans un modèle de souris de l’asthme allergique induit par HDM. Ici, nous avons inclus les trois essais suivants: Dot blot pour montrer les structures dsRNA dans l’ARN total isolé des allergènes, y compris les espèces HDM, RT-qPCR pour mesurer les activités de l’ARN HDM dans l’expression des gènes stimulants de l’interféron (ISGs) dans les poumons de souris et l’analyse FACS pour déterminer les effets de l’ARN HDM sur le nombre d’éosinophiles dans BAL et poumon, respectivement.
Introduction
Sur la base de l’hypothèse d’hygiène initialement proposée par Strachan1, l’exposition de la petite enfance à des facteurs microbiens environnementaux tels que l’endotoxine peut protéger contre le développement de troubles allergiques2,3. Pendant les infections microbiennes, par exemple, les infections virales, la détection immunitaire innée des acides nucléiques étrangers (ARN/ADN) déclenche les réponses de défense de l’hôte4,5,6. Cependant, l’existence et la prévalence d’acides nucléiques immunogènes tels que les longues espèces d’ARN à double brin (ARN) dans les acariens domestiques (HDM) ou d’autres allergènes d’insectes demeurent inconnues. Ce protocole a été conçu pour déterminer si le HDM ou les allergènes d’insectes et de non-insectes contiennent de longues espèces de dsRNA qui peuvent activer une réponse immunitaire protectrice pour contrer le développement d’une inflammation pulmonaire éosinophile grave dans un modèle de souris d’asthme allergique. Ici, nous fournissons trois méthodes simples et rapides pour évaluer les déterminants structurels dans l’ARN total de HDM qui sont exigés pour réguler l’inflammation des poumons éosinophiles allergènes induites.
Le système immunitaire muqueuse est le plus grand organe immunitaire dans le corps et sert de première ligne de défense de l’hôte contre les infections microbiennes et les insultes allergiques7,8. Le long dsRNA, l’intermédiaire de réplication de nombreux virus, est connu pour fonctionner comme un modèle moléculaire associé à un pathogène (PAMP) pour stimuler puissamment les réponses innées via toll comme le récepteur 3 (TLR3) pour induire l’expression des gènes stimulés par l’interféron (ISGs)9,10,11,1212,13,14. Nous avons récemment montré que l’ARN total hdm contenait des structures dsRNA, qui ont upregulated l’expression des ISGs et réduit l’inflammation pulmonaire éosinophile grave lorsqu’il est administré par l’instillation intratrachéale dans un modèle murin d’asthme allergique induit par les extraits de HDM15. La gravité des inflammations pulmonaires est déterminée par l’analyse des types de cellules immunitaires dans le lavage bronchoalvéolaire (BAL) et le tissu pulmonaire par cytométrie de flux16,17,18,19,20.
Ce protocole comprend trois essais : 1) détection rapide des structures dsRNA avec tache de point d’ARN à l’aide d’un anticorps monoclonal de souris J2 qui se lie spécifiquement à l’ARN (≥40bp) d’une manière séquence-indépendante ; 2) évaluation rapide des effets in vivo de l’ARN immunostimularisant dans les poumons de souris en mesurant l’induction des ISG à l’aide de RT-qPCR; 3) quantification précise des éosinophiles dans le BAL et le poumon dans le contexte de l’inflammation pulmonaire induite par hdm utilisant l’analyse de cytométrie de flux.
Les tests ci-dessus peuvent être utilisés pour étudier non seulement les maladies pulmonaires allergiques, mais aussi les infections bactériennes et virales respiratoires. Par exemple, l’anticorps J2 spécifique à l’ARND peut également être utilisé dans d’autres applications telles que la chromatographie d’immunoaffinité, l’immunohistorichemisme, l’analyse immunosorbent liée aux enzymes (ELISA) et l’immunostaining21,22,23. En outre, plusieurs applications en aval de la collecte de liquides BAL peuvent être utilisées pour quantifier les contenus solubles tels que les cytokines et les chimiokines à l’aide d’ELISA, et le profilage transcriptionnel des cellules dans les voies respiratoires (p. ex., macrophages alvéolaires). Bien qu’il existe une variété de protocoles disponibles dans la littérature pour évaluer les affections pulmonaires, la plupart de ces protocoles se concentrent souvent sur la validation cible. Les procédures décrites ici peuvent être appliquées pour identifier les composants des allergènes environnementaux qui sont importants pour réguler le développement de maladies allergiques.
Protocole
Les procédures expérimentales décrites ici ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université du Texas Health San Antonio.
1. Tache de point pour montrer la présence des structures dsRNA dans l’ARN total de HDM
- Isolement total de l’ARN contre les allergènes, les insectes et les allergènes autres insectes
- Mettre le HDM, les insectes ou les animaux non-insectes recueillis vivants ou obtenus commercialement dans des tubes de 50 mL, et congeler rapidement avec du liquide-N2. Ensuite, conserver à -70 °C pour l’isolement total de l’ARN ultérieur.
REMARQUE : Dans cette expérience, les animaux HDM, les insectes et les animaux non insectes ont été sélectionnés parce qu’ils sont connus pour être des sources courantes d’allergènes. En outre, une fonction immunostimulatoire de leurs ARN restent peu claires. - Transférer une quantité appropriée (équivalente à 100 μL en volume ou moins) de HDM, d’insectes ou d’animaux non insectes stockés à -70 °C dans un tube de 2 ml contenant des perles (sphères de céramique de 1,4 mm), puis congeler des tubes dans un contenant liquide-N2 pendant environ 10 min.
- Pour l’isolement total de l’ARN, ajoutez 1 ml de réactif d’isolement à base de guanidinium à base de thiocyanate24 à chaque tube, puis brisez les petits animaux insectes et non-insectes avec un perturbateur cellulaire à haute énergie à la vitesse maximale de 45 s et refroidissez sur la glace. Répétez cette étape deux fois.
- Transférer la solution de l’étape 1.1.3 dans un nouveau tube de 1,5 mL et ajouter 200 μL de chloroforme à chaque tube et vortex. Tubes de centrifugeuse à 14 000 x g pendant 14 min à 4 °C.
- Une fois la centrifugation terminée, transférer la phase aqueuse supérieure (200 μL) dans un nouveau tube de 1,5 mL contenant 500 μL d’isopropanol pour précipiter le granulé d’ARN. Ne pas déranger l’interphase. Le rapport volume recommandé de la phase supérieure par rapport à l’isopropanol est de 1:2,5 ratio.
- Mélanger par vortex doux, puis tubes de centrifugeuse à 14.000 x g pendant 14 min à 4 °C.
- Remplacer le supernatant avec prudence, puis laver le granulé d’ARN avec 500 μL d’éthanol à 75 % et la centrifugeuse à 7 500 x g pendant 10 min à 4 °C. Retirer tout liquide avec prudence, sécher à l’air le granulé et dissoudre le granulé d’ARN avec 20-50 μL de H2O sans RNase.
- Mesurer la concentration d’ARN à l’aide d’un spectrophotomètre à l’aide des paramètres suivants :
- Ouvrez le logiciel associé et sélectionnez le type d’acides nucléiques à mesurer. Modifiez le type d’échantillon en ARN.
- Effectuez la mesure vierge avec 1-2 μL de H2O sans RNase.2 Maintenant, l’instrument est prêt pour la mesure.
- Chargez 1 à 2 μL de l’échantillon d’ARN et mesurez la concentration d’ARN (μg/μL).
REMARQUE : Le rapport de l’absorption à 260 et 280 nm (A260/280) à ~2,0 (1,9-2,2) est généralement accepté comme « u » pour l’ARN. S’il n’est pas traité immédiatement, conserver les échantillons d’ARN à -70 °C et éviter les cycles de gel-dégel pour garder l’ARN intact.
- Mettre le HDM, les insectes ou les animaux non-insectes recueillis vivants ou obtenus commercialement dans des tubes de 50 mL, et congeler rapidement avec du liquide-N2. Ensuite, conserver à -70 °C pour l’isolement total de l’ARN ultérieur.
- Détection de la structure dsRNA dans l’ARN total à l’aide d’anticorps J2 spécifiques à dsRNA
- Préparer deux échantillons d’ARN de 20 μL (200 ng/μL). L’un avec le traitement RNase-III (1 μL pour 1 μg d’ARN, incuber à 37 °C pendant 60 min), et l’autre sans traitement RNase-III.
REMARQUE : RNase III est utilisé ici pour dégrader spécifiquement l’ARN ds, mais pas l’ARN25à brin unique . - Utilisez un crayon pour dessiner des grilles où les échantillons d’ARN seront effacés sur la membrane.
- Placez 2 μL des 200 ng/μL de l’échantillon d’ARN sur la membrane de nylon chargée positivement.
- Croisez les échantillons à la membrane à 1 200 microjoules x 100 dans un crosslinker UV. Répétez les étapes 1.2.3 et 1.2.4 deux fois de plus à l’échantillon. Cela se traduira par un total de 0,8 μg par tache.
REMARQUE : Ne pas repérer plus de 2 μL d’échantillon d’ARN sur la membrane à la fois. - Bloquer la liaison non spécifique avec 5% de lait dans le TBS-T pendant 1 h avec des secousses à température ambiante. Retirez la solution de blocage de l’étape 1.2.5 et ajoutez l’anticorps anti-dsRNA J2 à la dilution de 1:1 000 dans 1 % de lait dans le SCT-T et incuber toute la nuit en secouant à 4 °C.
- Laver la membrane avec le SCT-T pendant 5 min et répéter cette étape pendant 3 fois. Ajouter l’anticorps secondaire (IgG anti-souris conjuguée alcaline à la phosphatase dilué dans 1 % de lait 1:5 000) et incuber pendant 1 h sur un shaker à température ambiante. Laver la membrane avec le SCT-T pendant 5 min et répéter cette étape pendant 3x.
- Ajouter le substrat (BCIP/NBT) et incuber pendant 5-15 min jusqu’à ce qu’un signal désiré soit visible.
- Arrêtez la réaction en rinçant la membrane avec ddH2O.
- Séchez la membrane sur des papiers de tissu et prenez une photo à l’aide d’un smartphone (un résultat représentatif est indiqué à la figure 1).
- Préparer deux échantillons d’ARN de 20 μL (200 ng/μL). L’un avec le traitement RNase-III (1 μL pour 1 μg d’ARN, incuber à 37 °C pendant 60 min), et l’autre sans traitement RNase-III.
2. RT-qPCR pour mesurer la capacité de l’ARN total de HDM en stimulant l’expression des ISGs pulmonaires
- Isolement de l’ARN des tissus pulmonaires des souris
REMARQUE : Les souris (femelles, âgées de 8 à 12 semaines, C57BL/6J) ont été maintenues dans des conditions spécifiques sans pathogènes.- Anesthésiez brièvement l’animal avec de l’isoflurane et administrez par l’instillation intratrachéale avec 5 μg (dilués dans 80 μL PBS) d’ARN HDM traités avec ou sans RNase III.
- Après 16-18 h après le traitement de l’ARN HDM, sacrifier la souris par inhalation de CO2 pendant quelques minutes. Ensuite, placez la souris sur une plate-forme et épinglez les membres avec des aiguilles.
- Désinfecter la souris avec 70% d’éthanol puis couper la peau à partir de l’abdomen au cou avec un ciseau stérilisé.
- Fixer la peau avec des aiguilles et couper les côtes pour exposer les poumons. Retirez les poumons entiers et lavez-les avec pbs froid. Placez les poumons sur des papiers de tissu et excisez un petit morceau de chaque lobe de poumon dans un tube de 2 ml contenant des perles (200-300 μL en volume, 1,4 mm sphères en céramique).
NOTE: Le but de l’utilisation de perles en céramique est de moudre des tissus pulmonaires entiers - Congeler les échantillons pulmonaires en plaçant des tubes dans un contenant liquide-N2 pendant environ 10 min.
- Ajouter 500 μL de réactif d’isolation de l’ARN à base de thiocyanate de guanidinium à chaque tube et casser les tissus pulmonaires avec un homogénéisant pendant 45 s. Refroidir sur la glace entre chaque étape. Répétez cette étape deux fois.
- Suivez les étapes 1.1.4- 1.1.7 pour l’isolement de l’ARN pulmonaire.
- Séchez à l’air le granulé et dissolvent le granulé d’ARN avec une quantité appropriée de H2O sans RNase (~20-30 μL).
- Mesurer la concentration d’ARN décrite à l’étape 1.1.8.
- RT-qPCR pour déterminer la capacité de l’ARN HDM en stimulant l’expression des gènes pulmonaires.
- En utilisant 100 ng/μL d’ARN extrait des tissus pulmonaires comme modèle, effectuer la synthèse de l’ADC selon le protocole référencé26.
- Mettre en place une réaction RT-qPCR à 10 μL/puits pour une plaque de 384 puits à l’aide de l’ADD créé ci-dessus et des paires d’amorces spécifiques au gène (tableau 1 et tableau 2).
- Sceller les puits hermétiquement à l’aide d’un film adhésif transparent et vortexer la plaque pendant 30 s. Faire tourner la plaque à 1 000 x g pour 30 s afin de recueillir des échantillons au fond des puits.
- Chargez la plaque sur une machine RT-qPCR et commencez à exécuter la réaction RT-qPCR à l’aide du protocole de cycleur thermique (tableau 3).
- Exporter les résultats dans un fichier de feuille de calcul ou analyser les données à l’aide du logiciel fourni par la fabrication une fois le programme terminé (un résultat représentatif est indiqué à la figure 2).
3. Analyse facs pour déterminer les effets de l’ARN HDM sur l’infiltration d’éosinophiles dans le BAL et les poumons
- Collecte de fluides BAL pour l’analyse FACS
- Euthanasize les souris (femelles, 8-12 semaines, C57BL/6J) qui ont été traitées avec des extraits d’allergènes HDM (selon la conception expérimentale montrée à la figure 3B) par inhalation de CO2.
- Placez la souris sur une plate-forme et épinglez les membres avec des aiguilles.
- Désinfecter la souris avec 70% d’éthanol. Utilisez des ciseaux pour couper la peau de la partie supérieure de l’abdomen au cou.
- Tirez doucement les glandes salivaires et le muscle sternohyoïde soigneusement à part en utilisant les forceps pour exposer la trachée. Placer une ficelle de nylon (~10 cm) sous la trachée à l’aide de forceps.
- Faire une incision dans la trachée (~2 mm sous le larynx) juste assez pour insérer une canule. Ne coupez pas à travers la trachée. Nouez la ficelle autour de la trachée et de la canule.
- Chargez la seringue avec 1 mL de PBS+EDTA et attachez-la à l’extrémité de la canule. Injecter 1 mL de PBS+EDTA dans le poumon et apirate complètement la solution. Détachez soigneusement la seringue de la canule et transférez la solution dans un tube de 15 ml sur glace.
- Rechargez la seringue avec le PBS+EDTA frais et répétez cette étape 2x.
- Centrifuge le tube contenant le BAL mis en commun obtenu à l’étape 3.1.7 pour pelleter les cellules à 500 x g pendant 7 min à 4 °C. Enregistrez le volume de liquide BAL puis transférez le supernatant sur deux tubes de 1,5 mL sans perturber le granulé.
REMARQUE : Le supernatant de BAL peut être stocké à -70 °C pour une analyse future, par exemple, ELISA. - Dans le cas où il ya rbcs présents dans le granulé en raison de l’inflammation pulmonaire grave, après avoir enlevé le supernatant, ajouter 500 μL de tampon de lyse RBC et bien mélanger par resuspension. Transférer la solution dans un nouveau tube de 1,5 m L et une centrifugeuse pendant 7 min à la vitesse de 500 x g à 4 °C.
- Retirez le supernatant et resuspendez le granulé dans 150 μL de tampon FACS.
- Transférer les 150 μL de l’échantillon réesspensé dans une plaque de 96 puits et centrifuger la plaque pendant 7 min à la vitesse de 500 x g à 4 °C.
- Rapidement, inversez la plaque sur les papiers de tissu pour recueillir les cellules résidant au fond des puits.
- Tacher les cellules avec des anticorps dans la mémoire tampon FACS en présence d’anticorps bloquants 2,4G2 (2,5 μg / 100 μL). Incuber la plaque à température ambiante pendant 30 min dans un endroit sombre.
- Après la coloration, centrifuge la plaque pour les granuler à 500 x g pendant 7 min à 4 °C.
- Retirez la solution de coloration en inversant la plaque sur du papier de soie, puis lavez-les en résutilisant avec 100 μL de tampon FACS. Ensuite, centrifugez la plaque à nouveau à 500 x g pendant 7 min à 4 °C et retirez le tampon FACS en inversant la plaque sur du papier de soie.
- Réutiler les échantillons en 150 μL de tampon FACS et transférer des échantillons vers les tubes FACS contenant 350 μL de tampon FACS. Ajouter 25 μL de perles de comptage à chaque échantillon. Les échantillons sont maintenant prêts pour l’analyse de cytométrie de flux.
REMARQUE : Divers types de cellules dans le liquide BAL ont été étiquetés avec des anticorps comme indiqué. Des perles de comptage ont été ajoutées avant la course facs. Les données de cytométrie de flux ont été analysées à l’aide d’un logiciel disponible dans le commerce. Reportez-vous à la figure 3 et au tableau 4 pour la stratégie de gating.
- Digestion des tissus pulmonaires pour l’analyse FACS
- Suivez les étapes 3.1.1 - 3.1.3.
- Couper la peau à partir de l’abdomen au cou avec un ciseau stérilisé. Fixer la peau avec des aiguilles et couper les côtes pour exposer les poumons.
- Retirez les poumons entiers et lavez-les avec pbs froid. Placer des échantillons dans le tube de 1,5 mL contenant 50 μL de solution de digestion pulmonaire.
- Hacher les tissus pulmonaires en petits morceaux avec un ciseaux incurvé. Transférer les tissus pulmonaires dans une plaque de 6 puits, puis ajouter 8 mL de solution de digestion pulmonaire. Placer la plaque sur un shaker dans un incubateur à 37 °C pendant 45 min.
- Après l’incubation, utilisez le tube supérieur de 1,5 mL pour moudre les tissus pulmonaires. Placez une passoires de 70 μm sur une nouvelle plaque de 6 puits et appliquez l’échantillon dans un filtre de 0,22 μm.
- Transférer la solution filtrée dans un tube de 15 mL, puis centrifuger les tubes à 500 x g pendant 7 min à 4 °C. Remplacer le supernatant et réutiliser le granulé dans 1 mL de tampon de lyse RBC et le laisser sur la glace pendant 3 min.
- Transférer l’échantillon dans un tube de 1,5 mL et une centrifugeuse à 500 x g pendant 7 min à 4 °C. Répéter 2x
- Laver les cellules pulmonaires 2x avec 1 mL TAMPON FACS. Remplacer le supernatant et resuspender le granulé dans 1 mL de tampon FACS, puis transférer 100 μL de l’échantillon dans une plaque de puits de 96.
- Centrifuge la plaque pendant 7 min à la vitesse de 500 x g à 4 °C. Suivez les étapes décrites dans la collecte de liquides BAL pour l’analyse facs (3.1.13 à 3.1.16) pour tacher les cellules des échantillons de tissus pulmonaires digérés.
REMARQUE : Les éosinophiles dans les poumons ont été étiquetés avec des anticorps comme indiqué, puis mélangés avec des perles de comptage pour une analyse plus approfondie de FACS. Les données de cytométrie de flux ont été analysées à l’aide d’un logiciel associé. Reportez-vous à la figure 3 pour évaluer les réponses immunitaires induites par l’ARN du HDM.
4. Analyse statistique
- Effectuer une analyse statistique à l’aide d’un logiciel disponible dans le commerce.
- Déterminez les valeurs p par test étudiant à deux queues non apparié pour la comparaison de deux groupes.
- Calculer le nombre absolu d’éosinophiles en fonction des perles de référence (panneau supérieur) à l’aide de la formule
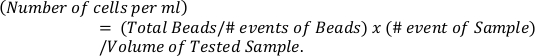
- Déterminez les valeurs p par test de comparaisons multiples d’ANOVA bidirectionnel et de Sidak pour la comparaison de plus de deux groupes.
- Considérez une valeur p inférieure à 0,05 comme statistiquement significative. Les valeurs p sont indiquées sur les parcelles comme *p <0,05, **p<0.01, ***p<0,001 et ****p<0.0001.
REMARQUE : Toutes les recettes tampons sont fournies dans le tableau 5.
Résultats
La présence de structures longues d’ARN dans le HDM, les insectes et les petits animaux non-insectes a été examinée par tache de point à l’aide d’un anticorps monoclonal de souris spécifique à dsRNA J2 (≥ 40bp). RNase III a été utilisé pour digérer l’ARN de 12 à 15 pb fragments d’ARN, qui étaient indétectables par J2 (Figure 1).
La capacité de l’ARN total de HDM pour stimuler une réponse immunitaire innée dans les poumons de souris d...
Discussion
Le protocole actuel décrit comment évaluer les propriétés immunostimulatoires de l’ARN microbien associé aux allergènes et leurs impacts sur le développement de l’inflammation des poumons éosinophiles dans un modèle de souris d’asthme allergique. Bien que les longs DsARN soient connus comme les intermédiaires de réplication de nombreux virus qui peuvent activer efficacement les réponses à l’interféron dans les cellules de mammifères, leurs présences dans les allergènes HDM ont été inconnues jus...
Déclarations de divulgation
Nous n’avons rien à révéler.
Remerciements
Nous remercions Mme Karla Gorena pour son assistance technique en cytométrie des flux. L.S. est soutenu par le China Scholarship Council et la Hunan Provincial Innovation Foundation for Postgraduate (CX201713068). H.H.A. est soutenu par le Département des sciences du laboratoire clinique, College of Applied Medical Sciences, Jouve University, Sakaka, Arabie Saoudite. X.D.L. est soutenu par l’UT Health San Antonio School of Medicine Startup Fund et le Fonds Max et Minnei Voelcker.
matériels
| Name | Company | Catalog Number | Comments |
| 0.40 µm Falcon Cell Strainer | Thermo Fisher Scientific | 08-771-1 | |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | |
| 15 mL Tube | TH.Geyer | 7696702 | |
| 50 mL Tube | TH.Geyer | 7696705 | |
| 70% ethanol | Decon Labs | 2701 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| ACK-RBC lysing buffer | Lonza | 10-548E | |
| Amersham Hybond-N+ Membrane | GE Healthcare | RPN203B | |
| Ant | San Antonio | Note: Locally collected | |
| Antibody dilution buffer | (see Table 5 for recipe) | ||
| Anti-Mouse CD11b V450 Rat (clone M1/70) | BD Bioscience | 560456 | 1 to 200 dilution |
| Anti-Mouse CD11c PE-Cy7 (clone N418) | BioLegend | 117317 | 1 to 200 dilution |
| Anti-Mouse CD19 Alexa Flour 647 (clone 1D3) | eBioscience | 15-0193-81 | 1 to 200 dilution |
| Anti-Mouse CD3e APC (clone 145-2C11) | Invitrogen | 15-0031-81 | 1 to 200 dilution |
| Anti-Mouse CD45 APC-Cy7 (clone: 30-F11) | BioLegend | 103130 | 1 to 200 dilution |
| Anti-Mouse Fixable Viabillity Dye eFluor 506 | Invitrogen | 65-0866-14 | 1 to 200 dilution |
| Anti-Mouse IgG (H+L), AP Conjugate | Promega | S3721 | |
| Anti-Mouse Ly-6G FITC (clone RB6-8C5) | Invitrogen | 11-5931-82 | 1 to 200 dilution |
| Anti-Mouse MHC II APC-eFluor 780 (clone M5/114.15.2) | eBioscience | 47-5321-80 | 1 to 200 dilution |
| Anti-Mouse Siglec-F PE (clone E50-2440) | BD Pharmingen | 552126 | 1 to 200 dilution |
| BCIP/NBT substrate | Thermo Fisher Scientific | PI34042 | |
| Blocking Buffer | (see Table 5 for recipe) | ||
| Cannual, 20G X 1.5” | CADENCE SCIENCE | 9920 | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| CFX384 Touch Real-Time PCR Detection System | Bio-Rad Laboratories | 1855485 | |
| Chloroform | Thermo Fisher Scientific | C298-500 | |
| Cockroach | Greer Laboratories | B26 | |
| Counting beads | Thermo Fisher Scientific | 01-1234-42 | |
| D. farinae | Greer Laboratories | B81 | |
| D. pteronyssinus | Greer Laboratories | B82 | |
| Denville Cell Culture Plates with lid, 96 well cell culture plate | Thomas Scientific | 1156F03 | |
| Digital Dry Bath - Four Blocks | Universal Medical, Inc. | BSH1004 | |
| Earthworm | San Antonio | Note: Locally collected | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | E6511 | |
| FACS buffer | (see recipe in Table 5) | ||
| Falcon Round-Bottom Polypropylene Tubes, 5 mL | STEMCELLTM TECHNOLOGIES | 38056 | |
| Flow cytometer (BD FACS Celesta) | BD Biosciences | ||
| Fly | Greer Laboratories | B8 | |
| Forceps | Roboz Surgical Instrument | RS-5135 | |
| Hemocytometer | Hausser Scientific | 3110 | |
| HT-DNA | Sigma | D6898 | |
| In Vivo MAb anti-mouse CD16/CD32 (clone: 2.4G2) | Bio X Cell | BE0307 | |
| iScript cDNA Synthesis Kit | Bio-Rad Laboratories | 1708891 | |
| Isoflurane | Abbott Labs | sc-363629Rx | |
| Isopropanol | Thermo Fisher Scientific | BP2618500 | |
| J2 anti-dsRNA monoclonal antibody | SCICONS | 10010200 | |
| Lung digestion solution | (see recipe in Table 5) | ||
| Lysing Matrix D | MP Biomedicals | 116913050-CF | |
| Lysing Matrix D, 2 mL tube | MP Biomedicals | SKU:116913100 | |
| Mice (female, 8-12 weeks old, C57BL/6J) | Jackson Laboratory | #000664 | |
| Microcentrifuge tube 1.5 mL | Sigma-Aldrich | 30120.094 | |
| Microscope | Olympus | CK30 | |
| Mini-BeadBeater | Homogenizers | SKU:BS:607 | |
| Mini-Beadbeater-16 | Biospec | 607 | |
| Mosquito | Greer Laboratories | B55 | |
| NanoDrop 2000C | Thermo Scientific Spectophotometer Medex Supply | TSCND2000C | |
| Needle, 21 G x 1 1/2 in | BD Biosciences | 305167 | |
| Non-fat milk | Bio-Rad Laboratories | 1706404 | |
| Nylon string | Dynarex | 3243 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | |
| RNase III | Thermo Fisher Scientific | AM2290 | |
| RNase T1 | Thermo Fisher Scientific | AM2283 | |
| Scissors | Roboz Surgical Instrument | RS-6802 | |
| Shaker or Small laboratory mixer | Boekel Scientific | 201100 | |
| SPHERO AccuCount Fluorescent | Spherotech | ACFP-70-5 | 1 to 10 dilution |
| Spider | San Antonio | Note: Locally collected | |
| TBS | (see recipe in Table 5) | ||
| TBS-T | (see recipe in Table 5) | ||
| Total cell medium | (see recipe in Table 5) | ||
| TRIzol Reagent | Thermo Fisher Scientific | 15596018 | |
| Tween 20 | Sigma-Aldrich | P9416 | |
| UV Stratalinker 2400 UV | LabX | 20447 | |
| Wasp | San Antonio | Note: Locally collected |
Références
- Strachan, D. P. Hay fever, hygiene, and household size. BMJ. 299, 1259-1260 (1989).
- Schuijs, M. J., et al. Farm dust and endotoxin protect against allergy through A20 induction in lung epithelial cells. Science. 349, 1106-1110 (2015).
- Stein, M. M., et al. Innate Immunity and Asthma Risk in Amish and Hutterite Farm Children. New England Journal of Medicine. 375, 411-421 (2016).
- Roers, A., Hiller, B., Hornung, V. Recognition of Endogenous Nucleic Acids by the Innate Immune System. Immunity. 44, 739-754 (2016).
- Schlee, M., Hartmann, G. Discriminating self from non-self in nucleic acid sensing. Nature Reviews Immunology. 16, 566-580 (2016).
- Wu, J., Chen, Z. J. Innate immune sensing and signaling of cytosolic nucleic acids. Annual Reviews Immunology. 32, 461-488 (2014).
- O'Hara, A. M., Shanahan, F. The gut flora as a forgotten organ. EMBO Reports. 7 (7), 688-693 (2006).
- . Focused Meeting 2018: Microbes and Mucosal Surfaces Available from: https://microbiologysociety.org/event/society-events-and-meetings/focused-meeting-2018-microbes-and-mucosal-surfaces.html (2018)
- Weber, F., et al. Double-stranded RNA is produced by positive-strand RNA viruses and DNA viruses but not in detectable amounts by negative-strand RNA viruses. Journal of Virology. 80, 5059-5064 (2006).
- Barral, P. M., et al. Functions of the cytoplasmic RNA sensors RIG-I and MDA-5: Key regulators of innate immunity. Pharmacology and Therapeutics. 124, 219-234 (2009).
- Netea, M. G., et al. From the Th1/Th2 paradigm towards a Toll-like receptor/T-helper bias. Antimicrobial Agents and Chemotherapy. 49, 3991-3996 (2005).
- McNally, B., et al. Intranasal administration of dsRNA analog poly(I:C) induces interferon-alpha receptor-dependent accumulation of antigen experienced T cells in the airways. PLoS One. 7, 51351 (2012).
- Seya, T., Takeda, Y., Matsumoto, M. Tumor vaccines with dsRNA adjuvant ARNAX induces antigen-specific tumor shrinkage without cytokinemia. Oncoimmunology. 5, 1043506 (2016).
- Toussi, D. N., Massari, P. Immune Adjuvant Effect of molecularly defined Toll-Like Receptor Ligands. Vaccines (Basel). 2, 323-353 (2014).
- She, L., et al. Immune Sensing of Aeroallergen-Associated Double-Stranded RNA Triggers an IFN Response and Modulates Type 2 Lung Inflammation. Journal of Immunology. 203, 2520-2531 (2019).
- Fujimoto, Y., et al. Pulmonary inflammation and cytokine dynamics of bronchoalveolar lavage fluid from a mouse model of bronchial asthma during A(H1N1)pdm09 influenza infection. Science Reports. 7, 9128 (2017).
- Yao, Y., et al. Induction of Autonomous Memory Alveolar Macrophages Requires T Cell Help and Is Critical to Trained Immunity. Cell. 175, 1634-1650 (2018).
- Dua, K., Shukla, S. D., Hansbro, P. M. Aspiration techniques for bronchoalveolar lavage in translational respiratory research: Paving the way to develop novel therapeutic moieties. Journal of Biological Methods. 4, 73 (2017).
- Van Hoecke, L., et al. Bronchoalveolar Lavage of Murine Lungs to Analyze Inflammatory Cell Infiltration. Journal of Visualized Experiments. (123), e55398 (2017).
- Salahuddin, S., et al. Processing of Bronchoalveolar Lavage Fluid and Matched Blood for Alveolar Macrophage and CD4+ T-cell Immunophenotyping and HIV Reservoir Assessment. Journal of Visualized Experiments. (148), e59427 (2019).
- Son, K. N., Liang, Z., Lipton, H. L. Double-Stranded RNA Is Detected by Immunofluorescence Analysis in RNA and DNA Virus Infections, Including Those by Negative-Stranded RNA Viruses. Journal of Virology. 89, 9383-9392 (2015).
- Monsion, B., et al. Efficient Detection of Long dsRNA in Vitro and in Vivo Using the dsRNA Binding Domain from FHV B2 Protein. Front Plant Sci. 9, 70 (2018).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. American Journal of Physiology-Lung Cellular and Molecular Physiology. 301, 510-518 (2011).
- Card, J. W., et al. Gender differences in murine airway responsiveness and lipopolysaccharide-induced inflammation. Journal of Immunology. 177, 621-630 (2006).
- Gueders, M. M., et al. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflammation Research. 58, 845-854 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon