Method Article
مواصفات السلف الكبدي من الخلايا الجذعية متعددة القدرات باستخدام نظام تمييز محدد
In This Article
Summary
الهدف من هذه المقالة هو توفير نهج موحد للحث على التمايز السلف الكبدي البشري من الخلايا الجذعية متعددة القدرات. تطوير هذا الإجراء مع تركيبات وسائل الإعلام الجاهزة للاستخدام تقدم للمستخدم نظام سهل لتوليد خلايا الكبد البشري للبحوث الطبية الحيوية والترجمة.
Abstract
أمراض الكبد هي قضية صحية عالمية متصاعدة. في حين أن زرع الكبد هو وسيلة فعالة للعلاج، فقد زاد معدل وفيات المرضى بسبب النقص في توافر الأعضاء المانحة. كما تؤثر ندرة الأعضاء على الإمداد الروتيني بالخلايا الكبدية البشرية للأبحاث الأساسية والعيادة. لذلك ، فإن تطوير مصادر متجددة لخلايا السلف الكبد البشري أمر مرغوب فيه وهو الهدف من هذه الدراسة. ولتطوير نظام تمايز السلف الكبدي القابل للتكرار لكي يكون قادرا على توليد ونشر السلف الكبدية البشرية على نطاق واسع. يساعد هذا البروتوكول على الإعادة إنتاج تجريبية بين المستخدمين في مجموعة من أشكال الخلايا الاستزراع ويسمح التمايز باستخدام كل من, الإنسان الجنينية والمحرضة خطوط الخلايا الجذعية متعددة القدرات. هذه هي مزايا هامة على نظم التمايز الحالية التي من شأنها تعزيز البحوث الأساسية ويمكن أن تمهد الطريق نحو تطوير المنتجات السريرية.
Introduction
أمراض الكبد تمثل تحديا صحيا عالميا، مما تسبب في ما يقرب من 2 مليون حالة وفاة سنويا في جميع أنحاء العالم1. على الرغم من وجود عدد من النظم النموذجية لدراسة الأمراض الكبدية والتدخل سريريا، إلا أن الاستخدام الروتيني للأنظمة القائمة على الخلايا محدود بسبب عيوب كبيرة (للمراجعة انظر Szkolnicka et al.2). تمثل ثقافة الخلايا الجذعية البشرية المتقدمة متعددة القدرات وأساليب تمايز الخلايا الجسدية تقنيات واعدة لتطوير أدوات للبحوث الطبية الحيوية الأساسية والمصادر المتجددة للخلايا المتمايزة للعيادة3و4.
حتى الآن، تم تطوير بروتوكولات متعددة للخلية الشبيهة بالخلايا الكبدية (HLC)5و6و7و8. هذه البروتوكولات محاولة لإعادة جوانب من نمو الكبد البشري باستخدام مزيج من جزيئات صغيرة وعوامل النمو9،10. تتكون معظم البروتوكولات من عملية تمايز تدريجية ، حيث يتم إعداد hPSCs إلى endoderm نهائي ، تليها مواصفات السلف الكبدي11و12و13وتنتهي بمواصفات HLC. تعرض مركبات الكربون الهيدروفلورية التي تنتجها هذه البروتوكولات مزيجا من الأنماط الظاهرية للجنين والبالغين. وهذا يشمل التعبير عن ألفا fetoprotein (وكالة الصحافة الفرنسية), مثل علامات خلايا الكبد مثل HNF4α والألبومين (ALB), فضلا عن قدرة استقلاب المخدرات14,15,16. ويمكن أن يختلف التمايز بين المختبرات؛ لذلك، من الضروري وضع بروتوكولات موحدة. وهذا سيمكن الباحثين من توليد وتطبيق مركبات الكربون الهيدروفلورية المشتقة من الخلايا الجذعية على نطاق واسع للبحوث الأساسية والسريرية.
تم تطوير نظام تمايز السلف الكبدي الذي يمكن تطبيقه على كل من خطوط الخلايا الجذعية الجنينية البشرية والمحرضة متعددة القدرات باستخدام إرشادات سهلة المتابعة. ينتج عن هذا الإجراء مجموعات متجانسة من السلف الكبدي في أشكال مختلفة من أدوات الثقافة ، بدءا من قوارير زراعة الخلايا إلى 96 لوحة بئر. ويرد أدناه بروتوكول لإنتاج سلفات كبدية مشتقة من الخلايا الجذعية في 24 و96 شكلا من أشكال الآبار.
يتم تحديد كثافة الخلية المستخدمة في البروتوكول المعروض أدناه لإحدى البئرات من صفيحة بئر 24 و96 على التوالي (انظر الجدول 1). مطلوب الأمثل من رقم الخلية البداية لتنسيقات لوحة ثقافة الخلية المختلفة وخطوط الخلية. مقترح بدء كثافة الخلية لتحسين البروتوكول هو 2 × 105 خلايا / سم2. لتحسين الكثافة، يمكن اختبار العديد من كثافات الخلايا بإضافة ± 50,000 خلية/سم2 في المرة.
Protocol
1. صيانة الخلايا الجذعية البشرية متعددة القدرات (hPSC) على صفمين-521
- الحفاظ على خلايا بشرية متعددة القدرات (hPSCs) عند 37 درجة مئوية و 5٪ CO2 في لوحة بئر 6 على الصفيحة-521 (LN-521). تغذية الخلايا يوميا مع 2 مل من الخلايا الجذعية صيانة المتوسطة (أي mTeSR1 المتوسطة) لكل بئر من لوحة بئر 6 تصل إلى يوم البذر المختار للتمايز (اليوم 0).
- تأكد من أن التقاء الخلية المطلوب من 70-80٪ يتحقق قبل حصاد الخلايا.
2. إعداد لامينين-521 متعددةويل وبذر hPSC للتمايز
ملاحظة: بالنسبة ل hPSCs غير المحتفظ بها على LN-521 (على سبيل المثال، matrigel أو فيبروكتين)، تقسيم hPSCs على LN-521 والثقافة لمدة أسبوع واحد قبل تمريرها واستخلاص التمايز لتحسين كفاءة العملية15،17،18.
- إعداد لوحة مغلفة باللامينين
- إذابة قارورة من LN-521 المؤتلف (100 ميكروغرام/مل) عند 4 درجات مئوية لمدة 2 ساعة أو بين عشية وضحاها.
- إعداد محلول 8 ميكروغرام / مل عن طريق تمييع LN-521 المذاب في الجليد البارد 1x DPBS مع Ca2 +/ Mg2 +.
- أضف 0.25 مل من محلول LN-521 8 ميكروغرام/مل لكل بئر من لوحة بئر 24 أو 0.05 مل لكل بئر من لوحة بئر 96. صخرة لوحة بلطف من جانب إلى آخر لمعطف بالتساوي الآبار مع حل LN-521.
ملاحظة: بالنسبة لتنسيق لوحة البئر 96، يمكن إجراء توزيع وحدات التخزين، وبذر الخلايا، والتغييرات المتوسطة باستخدام خط أنابيب شبه مؤتمت. للاطلاع على التفاصيل انظر Meseguer-Ripolles وآخرون19. - ختم لوحات LN-521 المغلفة مع فيلم شبه شفاف ومرن وتخزينها في 4 درجة مئوية بين عشية وضحاها قبل الاستخدام.
ملاحظة: يمكن استخدام لوحات LN-521 المغلفة لمدة تصل إلى أسبوعين عند تخزينها عند درجة حرارة 4 درجات مئوية. تجنب أي تجفيف للأبار المغلفة باللحنين.
- في يوم بذر الخلية، قم بإحماء اللوحات الجاهزة في حاضنة ثقافة الخلية عند 37 درجة مئوية لمدة 30-60 دقيقة.
- يستنشق حل LN-521.
ملاحظة: تجنب الاتصال المباشر للطامح مع الجزء السفلي من البئر لمنع الأضرار التي لحقت طلاء LN-521. - الاستغناء عن 0.5 مل من الخلايا الجذعية صيانة المتوسطة مع تكملة حديثا 10 ميكرومتر rho المرتبطة كيناز (ROCK) مثبط Y27632 إلى كل بئر من لوحة بئر 24 أو 0.05 مل إلى كل بئر من لوحة بئر 96. ضع اللوحة في الحاضنة حتى تصبح جاهزة لزرع الخلايا.
- في يوم البذر المجدول (اليوم 0) ومع التقاء hPSC بين 70-80٪، ضع علامة على أي مناطق من التمايز التلقائي في الجزء السفلي من آبار لوحة البئر 6.
ملاحظة: يمكن تصور التمايز التلقائي من خلال تغيير إجمالي في حجم الخلية و / أو وجود مورفولوجيا خلايا مختلفة باستخدام المجهر التباين المرحلي. - أسبيرات وتجاهل المناطق المميزة للتمايز والمتوسطة المستهلكة من الآبار. غسل كل بئر مع 1 مل من DPBS دون Ca2 +/ ملغ2 + في درجة حرارة الغرفة (RT).
- أضف 1 مل من كاشف التفكك الخالي من الإنزيم (انظر جدول المواد)إلى كل بئر واحتضنه عند 37 درجة مئوية لمدة 8-10 دقائق حتى تنفصل الخلايا بشكل واضح عن اللوحة.
- استخدام مكشطة الخلية لفصل بلطف الخلايا من الآبار. ماصة محتويات كل بئر صعودا وهبوطا 2-4x مع ماصة P1000 لتسفر عن تعليق خلية واحدة. لكل خط الخلية، تجمع الخلايا من جميع آبار الصيانة في أنبوب معقم 50 مل.
- غسل كل إفراغ جيدا مع 1 مل من الخلايا الجذعية صيانة المتوسطة. إضافة يغسل إلى أنبوب المقابلة التي تحتوي على الخلايا المجمعة من خط الخلية المناسبة.
- لكل خط الخلية، تنفيذ ثلاثة خلية قابلة للحياة على العينات المجمعة. حساب متوسط عدد الخلايا الحية (الخلايا الحية/مل) لكل خط خلية.
- الطرد المركزي العينات المجمعة في 250 × ز لمدة 5 دقائق في RT. أسبيرات العملاقة، ثم إعادة إنفاق بيليه الخلية في 1-3 مل من RT متوسطة صيانة الخلايا الجذعية، تكمل حديثا مع 10 ميكرومتر روك مثبط Y27632.
- لكل خط خلية، حساب عدد الخلايا المطلوبة لكل عدد من الآبار المعدة في الخطوة 2.4 (انظر الجدول 1). Resuspend رقم الخلية المطلوبة مع صيانة الخلايا الجذعية المتوسطة تستكمل حديثا مع 10 ميكرومتر روك المانع Y27632.
- إضافة حجم محسوب (ق) في آبار لوحات المعدة والمكتنة مسبقا من الخطوة 2.4 دون إزالة حجم المضافة سابقا. سيكون الحجم الإجمالي لكل بئر 1 مل لطبق بئر 24 و 0.1 مل للوحة بئر 96. صخرة بلطف لوحات من جانب إلى آخر وذهابا وإيابا لضمان تشتت الخلية حتى في جميع أنحاء البئر.
ملاحظة: توزيع الخلية حتى عبر البئر هو المفتاح لضمان البذر الخلية متجانسة والتمايز الناجح. - ضع الصفائح المصنفة في الحاضنة وهز على الفور الصفائح المصنفة بلطف ذهابا وإيابا ومن جانب إلى آخر لتوزيع الخلايا بالتساوي والحفاظ على الثقافات عند 37 درجة مئوية و 5٪ CO2.
3. التفريق بين hPSCs والذرى الكبدية على النعناع-521
- إعداد وسائل الإعلام لتحريض endoderm نهائي (المرحلة 1) باستخدام متوسطة البازل Endoderm تكملها الإضافات الصحيحة.
- في اليوم 0، إذابة زجاجة من متوسطة إندوديرم باسال بين عشية وضحاها في 4 °C.
- إعداد المرحلة 1 متوسطة 1 (للاستخدام في اليوم 1) حسب الحاجة.
- ذوبان الملحق MR وملحق CJ على الجليد.
- تمييع الملحق MR وملحق CJ 1:100 في المتوسطة القاعدية Endoderm.
- إعداد المرحلة 1 المتوسطة 2 للاستخدام في الأيام 2-4 حسب الحاجة.
- المخفف الملحق CJ 1:100 في المتوسطة البازل Endoderm.
- إعداد الوسائط لمواصفات خلايا السلف الكبدي اللاحقة (المرحلة 2) التمايز باستخدام وسيط السلف الكبدي.
- في اليوم 4، إذابة زجاجة من سلف الكبد المتوسط بين عشية وضحاها في 4 °C.
ملاحظة: استخدم 1٪ من البنسلين/الستريبتومايسين (تركيزات نهائية من 100 وحدة في اللولب/مل و100 ميكروغرام/مل على التوالي) لهذه التجربة. المضادات الحيوية ليست مطلوبة. استخدام المضادات الحيوية هو في تقدير المستخدم.
- في اليوم 4، إذابة زجاجة من سلف الكبد المتوسط بين عشية وضحاها في 4 °C.
- في اليوم الأول من التمايز، قم بإزالة وسيط صيانة الخلايا الجذعية المستهلك مع 10 ميكرومتر ROCKi Y-27632 متوسط من الآبار واستبدالها ب 0.5 مل من المرحلة الكاملة 1 متوسطة 1 لكل بئر من لوحة بئر 24 و0.1 مل لكل بئر من لوحة بئر 96.
- في الأيام 2 و 3 و 4، قم بإزالة الوسط المستهلك واطعم كل بئر ب 0.5 مل من المرحلة 1 متوسطة 2 لكل بئر للحصول على طبق بئر 24 أو 0.1 مل لكل بئر من لوحة بئر 96.
- في اليوم الخامس، قم بإصلاح الآبار لتحليل تمايز بطانة الرحم النهائي عن طريق الكيمياء المناعية. بالنسبة للنواب المتبقية، قم بإزالة الوسيط المستهلك واطعم كل بئر ب 0.5 مل من متوسط تمايز السلف الكبدي لكل بئر للحصول على طبق بئر 24 أو 0.1 مل لكل بئر من صفيحة بئر 96. قم بتحديث الوسيطة مرة أخرى في الأيام 6 و7 و9.
- في اليوم العاشر، حصاد الآبار لتحليل تمايز السلف الكبدي أو المضي قدما في مزيد من التمايز الخلوي الشبيه بالخلايا الكبدية.
ملاحظة: في هذه المرحلة الزمنية، تم إما إصلاح العينات مع 4٪ بارافورمالديهايد (PFA) لتحليل الكيمياء المناعية أو تم جمع الناموستات الفائقة ل ELISA وتم جمع الخلايا للقياس الكمي للبروتين.
4. توصيف ثقافات التمايز السلف الكبدي المتولدة من hPSCs على صفمين-521
- في اليوم الخامس، اكتشف التعبير عن علامات محددة محددة للاندوديرم باستخدام التثبيط المناعي.
- في اليوم العاشر، اكتشف التعبير عن علامات خاصة بالسلف الكبدي باستخدام التخبؤ المناعي.
- في اليوم 10، قياس وكالة فرانس برس وLB إفراز عبر ELISA باستخدام عدة اتباع تعليمات الشركة المصنعة وتطبيع لكل بروتين ملغ كما يحددها حمض البيسينشونينيك (BCA) اختبار البروتين.
- تقييم تقلب السلف الكبدي للوحة البئر 96 عن طريق تحديد النسبة المئوية للخلايا الإيجابية HNF4α لكل بئر.
5. الكيمياء المناعية واكتساب الصورة
- في اليومين 5 و 10 من التمايز، تغسل الخلايا 3x مع 1x DPBS، مع 0.5 مل لكل بئر من لوحة بئر 24 و 0.1 مل لكل بئر من لوحة بئر 96. احتضان لوحة مع اهتزاز لطيف لمدة 2-5 دقائق في RT.
ملاحظة: استخدم DPSB بدون Ca2+/ Mg2+ للكيمياء المناعية. - إصلاح الخلايا مع 4٪ بارافورمالديهايد (PFA) في RT لمدة 15-30 دقيقة عن طريق إضافة 0.3 مل من PFA لكل بئر للوحة بئر 24 و 0.1 مل لكل بئر من لوحة بئر 96.
- اغسل 3x مع 1x DPBS كما هو موضح في الخطوة 5.1.
- Permeabilize الغشاء مع برنامج تلفزيوني باستخدام 0.1٪ توين، 1x DPBS واحتضان لمدة 20 دقيقة في RT عن طريق إضافة 0.3 مل من PBST لكل بئر من لوحة بئر 24 و 0.1 مل لكل بئر من لوحة بئر 96.
- أداء كتلة البروتين عن طريق احتضان الخلايا مع 10٪ BSA في PBST لمدة 1 ساعة، مضيفا 0.3 مل من BSA لكل بئر من لوحة بئر 24 و 0.1 مل من BSA لكل بئر من لوحة بئر 96، تهتز بلطف باستخدام شاكر لوحة.
- بعد حجب البروتين، استبدل محلول الحجب بالأجسام المضادة الأولية المخففة في 1٪ BSA في PBST واحتضانها عند 4 درجات مئوية مع اهتزاز لطيف بين عشية وضحاها.
ملاحظة: لا تغسل بين كتلة البروتين وإضافة الأجسام المضادة. - بعد 24 ساعة، يغسل الآبار 3x مع برنامج تلفزيوني.
- إضافة الأجسام المضادة الثانوية في 1٪ BSA في PBST. احتضان 1 ساعة في RT في الظلام مع اهتزاز لطيف.
- بعد حضانة الأجسام المضادة الثانوية ، اغسل الآبار 3x مع 1x DPBS والاستغناء عن وصمة عار Hoechst وفقا لتعليمات الشركة المصنعة لمدة 10 دقائق في RT في الظلام مع اهتزاز لطيف.
- اغسل 3x مع 1x DPBS. اللوحات جاهزة الآن للتصوير.
ملاحظة: تخزين لوحات في 4 درجة مئوية في الظلام حتى التصوير. - صورة لوحة متعددة بويل باستخدام مجهر التصوير عالية المحتوى بعد الكيمياء المناعية. يوصى بالحصول على صورة للعديد من مجالات الرؤية للحصول على تمثيل حقيقي للبلي. تم تقييم التعبير عن علامات مختلفة عن طريق تحليل تجزئة الخلية باستخدام البرمجيات التجارية (انظر جدول المواد) (الشكل 1).
ملاحظة: يمكن أيضا إجراء تجزئة الخلية باستخدام تحليل صورة برمجيات مفتوحة المصدر مثل CellProfiler أو فيجي20،21.
النتائج
تم تنفيذ تمايز السلف الكبدي من كل من خطوط hESC (H9) و hiPSC (P106) بعد البروتوكول التدريجي الموصوف في الشكل 2. هنا، تم زرع الخلايا الجذعية متعددة القدرات كخلايا واحدة في لوحات LN-521 المغلفة قبل بدء التمايز. التقاء الخلايا هو المفتاح لتمايز قوي وقابل للاستنساخ. وبمجرد تحقيق التقاء الحق (الشكل 2) ، بدأ التمايز. في اليوم 5 ، تم تقييم مواصفات endoderm النهائية عبر تعبير Sox17. في كلا الخطين الخلية، تم التعبير عن Sox17 للغاية مع 80٪ ± 0.5٪ و 87.8٪ ± 0.5٪ SEM من الخلايا الإيجابية سوكس17 لH9 و P106، على التوالي(الشكل 3). في اليوم العاشر، عرضت السلف الكبدية مورفولوجيا تشبه الحصى(الشكل 2). بالإضافة إلى ذلك، تم تقييم مواصفات السلف الكبدي لتعبير HNF4α و AFP و ALB و cytokeratin-19 (CK19) وكذلك افراز البروتين من وكالة فرانس برس وALB10و15و22 (الشكل 4). وعبرت كل من ثقافات السلف الكبدي H9 وP106 عن علامات كبدية جنينية مثل HNF4α (91٪ ± 0.5٪ و 90٪ ± 0.2٪)، وكالة الصحافة الفرنسية (89.7٪ ± ± 1.8٪ و86٪ ± 1.2٪)، وCK19 (78.5٪ ± 3.2٪ و83.6 ± 1.8٪) تم الكشف عن إفراز وكالة فرانس برس في اليوم 10 في كلا الخطين الخلويين (32.4 ± 1.6 و 47.8 ± 5.9 نانوغرام / مل / ملغ / 24 ساعة) (الشكل 5). لوحظ تركيب الألبومين عند مستويات أدنى (30.7٪ ± 1.8٪ و 27.2٪ ± 1.1٪) (الشكل 4) ولم يتم اكتشافه عبر ELISA(الشكل 5).
وسمح البروتوكول بالإنتاج الموحد للذريات الكبدية من 24 بئرا إلى 96 صفيحة بئر. تم استخدام خط أنابيب شبه آلي لإنتاج 96 صفيحة بئر من السلف الكبدي من خطوط خلايا H9 و P106 كما وصف سابقا17. تم تقييم تقلب عدد الخلايا وكفاءة تمايز السلف الكبدي عن طريق القياس الكمي لتعبير HNF4α. تم إجراء تجزئة الخلايا من أجل تحديد كم البروتين عن طريق الفلورة المناعية باستخدام أداة تصوير عالية المحتوى(الشكل 1). في اليوم العاشر، لم تظهر السلف الكبدية أي تباين كبير عبر الصفوف مع >94٪ من الخلايا الإيجابية HNF4α لكل بئر للخلايا H9 و 97٪ HNF4α إيجابية ل P106 (الشكل 6).

الشكل 1: نظرة عامة على خط أنابيب تجزئة الخلية. (أ) باستخدام الصورة الأصلية ،(ب)تم استخدام التلطيخ النووي لتقسيم النوى. (ج)تم تنفيذ خطوة مراقبة جودة التقسيم النووي على أساس الشكل والحجم لتحديد النوى المجزأة بوضوح فقط. (د)بعد ذلك، تم قياس النوى الموجبة الملطخة ب HNF4α كميا. وأخيرا،استخدمت عتبة قائمة على الكثافة لتحديد الخلايا المعبرة عن HNF4α. في C و E، تمثل النوى الخضراء خلايا مختارة وتشير نواة أرجوانية إلى الخلايا المهملة. مقياس الشريط = 50 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2:تمايز السلف الكبدي عن hPSCs. (A) التمثيل التخطيطي لبروتوكول تمايز السلف الكبدي. (ب) صور تمثيلية تسلط الضوء على التغيرات المورفولوجية أثناء التمايز. في اليوم 0 (D0)، قدمت hPSCs طبقة أحادية معبأة من الخلايا. بعد ذلك ، تم تجهيز hPSCs في endoderm نهائي في اليوم 5 (D5). وأعقب ذلك تمايز السلف الكبدي في اليوم العاشر (D10). عرضت السلف الكبدية مورفولوجيا خلايا تشبهالحصى. مقياس الشريط = 75 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
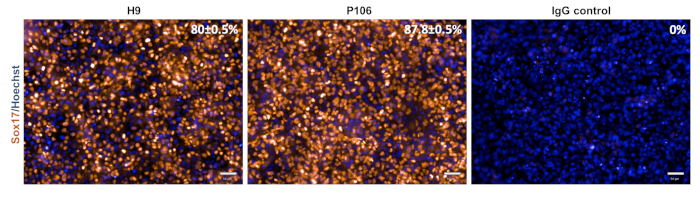
الشكل 3: توصيف مواصفات الاندوديرم النهائية. في اليوم الخامس، كانت الخلايا ملطخة ب Sox17، وهي علامة إندوديرم نهائية. وكانت النسبة المئوية للخلايا الإيجابية سوكس17 80 ± 0.5٪ لH9 و 87.8 ± 0.5٪ لP106. واستندت النسبة المئوية للقياس الكمي إلى 10 آبار منفصلة مع 6 مجالات رؤية لكل بئر. تظهر البيانات كمتوسط ± SEM. Scale bar = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: توصيف السلف الكبدي. في اليوم العاشر، كانت السلف الكبدية ملطخة بعلامات الكبد(A)HNF4α،(B)AFP، و (C) ALB. بالنسبة ل H9، كانت النسبة المئوية للخلايا الإيجابية 91٪ ± 0.4٪، و 89.7٪ ± 1.8٪، و 30.7٪ ± 1.8٪ لHNF4α و AFP و ALB على التوالي. بالنسبة ل P106، كانت النسبة المئوية للخلايا الإيجابية 90٪ ± 0.2٪، و 86٪ +/- 1.2٪، و 27.2٪ ± 1.1٪ لHNF4α و AFP و ALB على التوالي. (د)تم تقييم إمكانات نسب Cholangiocyte عبر تعبير CK19؛ وأعرب السلف الكبدية المشتقة من فيروس H9 عن 78.5 في المائة ± 3.2 في المائة من الخلايا الإيجابية ل CK19، في حين لوحظ وجود 83.6 في المائة ± 1.8 في المائة من الخلايا الإيجابية للكويك19 بالنسبة للذرى الكبدية P106. تم استخدام تلطيخ الغلوبولين المناعي G (IgG) كتحكم في التلطيخ. واستندت النسبة المئوية للقياس الكمي إلى 10 آبار منفصلة مع 6 مجالات رؤية لكل بئر. تظهر البيانات كمتوسط ± SEM. Scale bar = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5:تحليل إفراز بروتين السلف الكبدي. تم تحليل إفراز ألفا فيتوبروتين (AFP) والألبومين (ALB) في ثقافات السلف الكبدي في اليوم العاشر في H9 و P109. وتمثل البيانات ثلاث نسخ بيولوجية متماثلة وتمثل أشرطة الخطأ البروتينات المفرزة SD. وقد تم قياسها كميا من 24 ساعة متوسطة الثقافة كما نانوغرام من البروتين المفرز لكل مل لكل ملغ من البروتين، ن = 3؛ ND = لم يتم الكشف عنها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
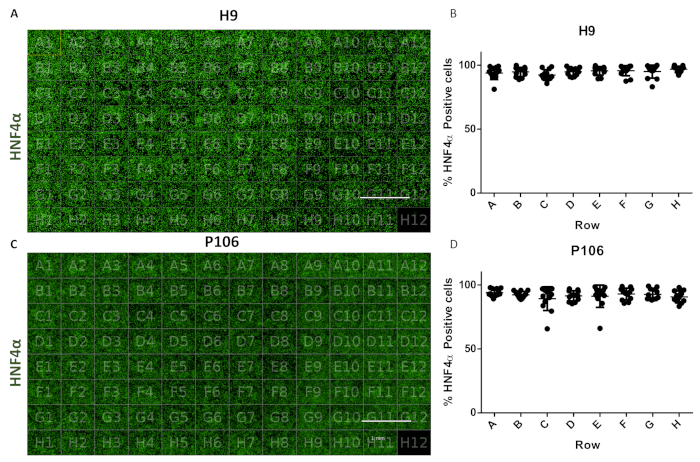
الشكل 6:تقييم التغير من بئر إلى بئر في 96 لوحة بئر. (أ) تصور رؤية 96 لوحة بئر من السلف الكبدي المشتقة من H9 الملطخة HNF4α. (ب)تحديد كمية الخلايا الإيجابية HNF4α. متوسط عدد الخلايا لكل بئر في الصفوف، من ستة مجالات رؤية لكل كمي جيد. وكان متوسط عدد الخلايا عبر لوحة 94.81٪ ± 0.22 SEM HNF4α الخلايا الإيجابية لكل بئر. ولم تلاحظ أي اختلافات ذات دلالة إحصائية بين الآبار. (C) تصور رؤية 96 لوحة بئر من السلف الكبدي مشتق P106 ملطخة HNF4α. (د)تحديد كمية الخلايا الإيجابية HNF4α. متوسط عدد الخلايا لكل بئر في الصفوف، من ستة حقول رؤية لكل بئر وكميا. وكان متوسط عدد الخلايا عبر لوحة 97.7٪ ± 0.57 SEM HNF4α الخلايا الإيجابية لكل بئر. ولم تلاحظ أي اختلافات ذات دلالة إحصائية بين الصفوف. كذلك تم استخدام H12 كتحكم المناعة الغلوبولين G (IgG) تلطيخ. شريط المقياس = 1 مم. تم توظيف ANOVA في اتجاه واحد مع الاختبارات الإحصائية اللاحقة ل Tukey. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| تنسيق اللوحة | مساحة السطح (cm2) | الخلايا لكل سم2 | مجموع الخلايا لكل بئر | وحدة تخزين الاستغناء (مل) | تركيز الخلية (خلايا/مل) |
| 24-لوحة جيدا | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| لوحة 96 جيدا | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
الجدول 1:كثافة الخلايا الموصى بها لتنسيقات اللوحات المختلفة لخطوط خلايا hPSC المستخدمة في هذا البروتوكول.
Discussion
ويمكن أن يمثل توليد خلايا السلف الكبدية البشرية من الخلايا الجذعية المتعددة القدرات على نطاق واسع بديلا واعدا للمواد المشتقة من الجثث. توحيد البروتوكول وقابلية النسخ هما المفتاح لضمان ترجمة التكنولوجيا وتأثيرها على البحوث الطبية الحيوية. ولمعالجة هذا، ركز العمل السابق على تطوير بروتوكول تمييز تدريجي من hESC و iPSCs باستخدام إضافات ومصفوفات محددة15و23و24و25و26و27و28. من خلال القيام بذلك ، تم تحسين النمط الظاهري للخلايا الكبدية وقابلية الاستنساخ ، مما يسمح بأتمتة شبه عملية التمايز19. يتم تعزيز النظام المقدم من خلال تركيبته مع وسائل الإعلام ثقافة الخلية الجاهزة ونظام تمايز خلايا الكبد سهلة.
في السابق ، تم تسليط الضوء على كثافة الخلايا متعددة القدرات قبل بدء بروتوكول التمايز كمتغير رئيسي لتحقيق مجموعة متجانسة من خلايا السلف الكبدي26. باستخدام هذا الإجراء أكثر دقة، فمن الممكن لتوليد أعداد كبيرة من السلف الكبدية المشتقة من الخلايا الجذعية بطريقة تدريجية باستخدام مجموعة من كثافات الخلايا بدءا(الجدول 1). في اليوم 5، تم التحقق من صحة التعريفي endoderm نهائي من قبل Sox17 تلطيخ (الشكل 3). تم تحقيق التمايز الفعال والقوية في endoderm نهائي مع كل من اختبار ESC وخطوط iPSC، مع أكثر من 80٪ التعبير عن Sox17(الشكل 3). في اليوم العاشر، أظهرت السلف الكبدية مورفولوجيا موحدة تشبه الحصى، وكانت علامات الخلايا الجذعية الكبدية غنية للغاية لكل من وكالة الصحافة الفرنسية وHNF4α (>86٪، الشكل 4). باستخدام مزيج من التكنولوجيات اليدوية وشبه الآلية كان من الممكن لأداء التمايز في أشكال لوحة متعددة19.
في شكله الحالي، تمايز الخلية هو مناسبة للتجارب في المختبر القائم. ومع ذلك، من المرجح أن تكون هناك حاجة إلى إثراء الخلايا قبل التطبيق السريري لضمان إعداد مجموعة متجانسة من السلف الكبدية للولادة.
وفي الختام، يوفر البروتوكول الموصوف هنا المجال بنهج موحد لإنتاج السلف الكبدية على نطاق واسع. وستركز الأعمال المستقبلية على إنتاج وسيلة جديدة للتمايز والنضج والصيانة اللاحقة ل HLC.
Disclosures
ديفيد سي هاي هو أحد مؤسسي ومساهمي شركة Stemnovate Ltd. ويصدق بقية أصحاب البلاغ على عدم وجود تضارب في المصالح في الموضوع أو المواد التي نوقشت في هذه المادة.
Acknowledgements
وقد تم دعم هذه الدراسة بجوائز من شراكة تدريب الدكتوراه MRC (MR/K501293/1) ومنصة الطب التجديدي في المملكة المتحدة (MRC MR/L022974/1 وMR/K026666/1)، ومكتب كبير العلماء (TCS/16/37).
Materials
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
References
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved