Method Article
Tanımlanmış Bir Farklılaşma Sistemi Kullanarak Pluripotent Kök Hücrelerden Hepatik Progenitör Spesifikasyonu
Bu Makalede
Özet
Bu makalenin amacı, insan hepatik progenitörlerin pluripotent kök hücrelerden farklılaşmasına neden olmak için standartlaştırılmış bir yaklaşım sağlamaktır. Bu prosedürün kullanıma hazır ortam formülasyonları ile geliştirilmesi, kullanıcıya biyomedikal araştırma ve çeviri için insan karaciğer hücreleri üretmek için bir facile sistemi sunmaktadır.
Özet
Karaciğer hastalığı küresel sağlık sorunudur. Karaciğer nakli etkili bir tedavi şekli olmakla birlikte, donör organ mevcudiyetindeki eksiklikler nedeniyle hasta ölümleri artmıştır. Organ kıtlığı, temel araştırmalar ve klinik için insan hepatositlerinin rutin tedarikini de etkiler. Bu nedenle, insan karaciğeri progenitör hücrelerinin yenilenebilir kaynaklarının geliştirilmesi arzu edilir ve bu çalışmanın amacıdır. İnsan karaciğer atalarını büyük ölçekte etkili bir şekilde üretebilmek ve konuşlandırabilmek için tekrarlanabilir bir hepatik progenitör farklılaşma sistemi geliştirilmiştir. Bu protokol, çeşitli hücre kültürleri formatlarında kullanıcılar arasında deneysel tekrarlanabilirliğe yardımcı olur ve hem insan embriyonik hem de indüklenmiş pluripotent kök hücre çizgilerini kullanarak farklılaşmalara izin eder. Bunlar, temel araştırmaları geliştirecek ve klinik ürün geliştirmeye giden yolu açabilecek mevcut farklılaşma sistemlerine göre önemli avantajlardır.
Giriş
Karaciğer hastalığı küresel bir sağlık zorluğunu temsil eder ve dünya çapında yılda yaklaşık 2 milyon ölüme neden olur1. Hepatik hastalıkları incelemek ve klinik olarak müdahale etmek için bir dizi model sistemi mevcut olsa da, hücre bazlı sistemlerin rutin kullanımı önemli dezavantajlarla sınırlıdır (bir inceleme için bkz. Szkolnicka vd.2). Gelişmiş insan pluripotent kök hücre (hPSC) kültürü ve somatik hücre farklılaşmayöntemleri,klinik için temel biyomedikal araştırmalar ve farklılaştırılmış hücrelerin yenilenebilir kaynakları için araçlar geliştirmek için umut verici teknolojileri temsil eder3,4.
Bugüne kadar, hepatosit benzeri hücre (HLC) farklılaşması için birden fazla protokol geliştirilmiştir5,6,7,8. Bu protokoller, küçük moleküller ve büyüme faktörlerinin bir kombinasyonunu kullanarak insan karaciğer gelişiminin yönlerini yeniden yaratmaya çalışır9,10. Çoğu protokol, hPSC'lerin kesin endoderm için astarlandığı, ardından hepatik progenitör spesifikasyonu11 , 12,13ve HLC spesifikasyonu ile biten adımsal bir farklılaşma işleminden oluşur. Bu protokoller tarafından üretilen HLC'ler fetal ve yetişkin fenotiplerinin bir karışımını gösterir. Bu, HNF4α ve albümin (ALB) gibi hepatosit belirteçleri gibi alfa fetoprotein (AFP) ifadesinin yanı sıra14 , 15,16ilaç metabolizasyon kapasitesini içerir. Laboratuvarlar arasında HLC farklılaşması değişebilir; bu nedenle, standartlaştırılmış protokollerin geliştirilmesi gereklidir. Bu, araştırmacıların kök hücre türevi HC'leri temel ve klinik araştırmalar için büyük ölçekte etkili bir şekilde üretmelerini ve uygulamalarını sağlayacaktır.
Takip edilmesi kolay kılavuzlar kullanılarak hem insan embriyonik hem de indüklenmiş pluripotent kök hücre hatlarına uygulanabilen hepatik progenitör farklılaşma sistemi geliştirilmiştir. Bu prosedür, hücre kültürü şişelerinden 96 kuyu plakasına kadar değişen kültürsel formatlarda homojen hepatik progenitör popülasyonları verir. Aşağıda kök hücre türevi hepatik progenitörlerin 24 ve 96 kuyu formatlarında üretilmesi protokolü verilmiştir.
Aşağıda sunulan protokolde kullanılan hücre yoğunluğu sırasıyla 24 ve 96 kuyu plakasının bir kuyusu için belirtilmiştir (bkz. Tablo 1). Farklı hücre kültürü plaka biçimleri ve hücre çizgileri için başlangıç hücre numarasının en iyi duruma getirilmesi gerekir. Protokol optimizasyonu için önerilen başlangıç hücresi yoğunluğu 2 x 105 hücre/cm2'dir. Yoğunluk optimizasyonu için, aynı anda 50.000 hücre/cm2 ± eklenerek birkaç hücre yoğunluğu test edilebilir.
Protokol
1. Laminin-521'de insan pluripotent kök hücre (hPSC) bakımı
- laminin-521 (LN-521) üzerinde 6 kuyu plakasında insan pluripotent hücrelerini (hPSC) 37 °C ve %5 CO 2'de tutun. Hücreleri günlük olarak, farklılaşma için seçilen tohumlama gününe kadar 6 kuyu plakası başına 2 mL kök hücre bakım ortamı (yani mTeSR1 ortamı) ile besleyin (gün 0).
- Hücre hasadından önce istenen %70-80 hücre konflüensinin sağlandığından emin olun.
2. Laminin-521 çokwell hazırlama ve farklılaşma için hPSC tohumlama
NOT: LN-521'de (örneğin matrigel veya fibronektin) korunmayan hPSC'ler için, hPSC'leri LN-521'e bölün ve sürecin verimliliğini artırmak için farklılaşmayı geçirmeden ve ortaya çıkarmadan önce 1 hafta boyunca kültür15,17,18.
- Laminin kaplı plaka hazırlama
- Bir şişe rekombinant LN-521'i (100 μg/mL) 4 °C'de 2 saat veya gece boyunca çözün.
- Buz gibi 1x DPBS'de çözülen LN-521'i Ca 2+/Mg2+ile seyrelterek 8 μg/mL çözelti hazırlayın.
- 8 μg/mL LN-521 çözeltisinin 0,25 mL'lik kısmını 24 kuyu plakasının her kuyusuna veya 96 kuyu plakasının her kuyusuna 0,05 mL ekleyin. LN-521 çözümü ile kuyuları eşit şekilde kaplamak için plakayı bir yandan diğer yana hafifçe sallayın.
NOT: 96 kuyu plakası formatı için, yarı otomatik bir işlem hattı kullanılarak hacim dağıtımı, hücre tohumlama ve orta değişiklikler yapılabilir. Ayrıntılar için Bkz. Meseguer-Ripolles vd.19. - LN-521 kaplamalı plakaları yarı saydam, esnek bir filmle kapatın ve kullanmadan önce gece boyunca 4 °C'de saklayın.
NOT: LN-521 kaplamalı plakalar 4 °C'de saklandığında 2 haftaya kadar kullanılabilir. Laminin kaplı kuyuların kurumasından kaçının.
- Hücre tohumlama gününde, önceden kaplanmış plakaları 37 °C'de bir hücre kültürü inkübatörinde 30-60 dakika ısıtın.
- LN-521 çözümünü aspire edin.
NOT: LN-521 kaplamasının zarar görmesini önlemek için aspiratöre kuyunun altı ile doğrudan temastan kaçının. - 24 kuyu plakasının her kuyusuna 0,5 mL kök hücre bakım ortamı ve taze takviyeli 10 μM Rho ilişkili kinaz (ROCK) inhibitörü Y27632 veya 96 kuyu plakasının her kuyusuna 0,05 mL dağıtın. Plakayı hücre tohumlama için hazır olana kadar inkübatöre yerleştirin.
- Planlanan tohumlama gününde (0 gün) ve % 70-80 arasında bir hPSC konflüansı ile, 6 kuyu plakasının kuyularının dibindeki spontan farklılaşma bölgelerini işaretleyin.
NOT: Spontan farklılaşma, faz kontrastı mikroskopisi kullanılarak hücre boyutunda ve/veya farklı hücre morfolojilerinin varlığında büyük bir değişiklikle görselleştirilebilir. - İşaretli farklılaşma bölgelerini ve harcanan ortamı kuyulardan aspire edin ve atın. Her birini oda sıcaklığında (RT) Ca 2+ /Mg2+olmadan1 mL DPBS ile yıkayın.
- Her kuyuya 1 mL enzimsiz ayrışma reaktifi ekleyin (bkz. Malzeme Tablosu)ve hücreler plakadan gözle görülür şekilde kopana kadar 8-10 dakika boyunca 37 °C'de kuluçkaya yatırın.
- Hücreleri kuyulardan nazikçe ayırmak için bir hücre kazıyıcı kullanın. Pipet her kuyunun içeriğini tek hücreli bir süspansiyon elde etmek için bir P1000 pipet ile 2-4x yukarı ve aşağı. Her hücre hattı için, tüm bakım kuyularından havuz hücreleri steril 50 mL tüp haline.
- Boşaltılan her bir kuyuyu 1 mL kök hücre bakım ortamı ile yıkayın. Yıkamaları, uygun hücre hattından havuza alınan hücreleri içeren ilgili tüpe ekleyin.
- Her hücre satırı için, havuza alınan örnekler üzerinde üç uygun hücre sayısı gerçekleştirin. Her hücre satırı için ortalama canlı hücre sayısını (canlı hücreler/mL) hesaplayın.
- Havuza alınan numuneleri RT'de 5 dakika boyunca 250 x g'da santrifüjleyin.
- Her hücre satırı için, adım 2.4'te hazırlanan kuyu sayısı başına gereken hücre numarasını hesaplayın (bkz. Tablo 1). Gerekli hücre numarasını 10 μM ROCK inhibitörü Y27632 ile taze takviye edilen kök hücre bakım ortamı ile yeniden başlatın.
- Daha önce eklenen hacmi çıkarmadan, 2.4. Kuyu başına toplam hacim 24 kuyu plakası için 1 mL ve 96 kuyu plakası için 0,1 mL olacaktır. Kuyu boyunca eşit hücre dağılımını sağlamak için plakaları bir yandan diğer yana ve ileri geri hafifçe sallayın.
NOT: Kuyu boyunca eşit hücre dağılımı, homojen hücre tohumlama ve başarılı farklılaşma sağlamak için anahtardır. - Tohumlu plakaları inkübatöre yerleştirin ve hücreleri eşit bir şekilde dağıtmak ve kültürleri 37 ° C ve% 5 CO2'dekorumak için tohumlu plakaları hemen ileri geri ve bir yandan diğer yana hafifçe sallayın.
3. HPSC'leri laminin-521'deki hepatik progenitörlere ayırt etmek
- Doğru katkı maddeleri ile desteklenmiş Endoderm Bazal Medium kullanarak medyayı kesin endoderm indüksiyonu (aşama 1) için hazırlayın.
- 0. günde, Endoderm Bazal Medium şişesini 4 °C'de bir gecede çözün.
- Aşama 1 Orta 1'i (1. günde kullanım için) gerektiği gibi hazırlayın.
- Buz üzerinde EK MR ve Ek CJ çözün.
- Endoderm Bazal Medium'da Ek MR ve Ek CJ 1:100'u seyreltin.
- Aşama 1 Orta 2'i gerektiğinde 2-4 gün boyunca kullanıma hazırlayın.
- Endoderm Bazal Medium'da Ek CJ 1:100'u seyreltin.
- Hepatik Progenitör Ortamı kullanarak sonraki hepatik progenitör hücre spesifikasyonu (Aşama 2) farklılaşması için ortam hazırlayın.
- 4. günde, Hepatik Progenitor Medium şişesini 4 °C'de bir gecede çözün.
NOT: Bu deney için %1 penisilin/streptomisinin (sırasıyla 100 IU/mL ve 100 μg/mL'lik son konsantrasyonlar) kullanıldığına dikkat çekildi. Antibiyotik gerekli değildir; antibiyotik kullanımı kullanıcının takdirine bağlıdır.
- 4. günde, Hepatik Progenitor Medium şişesini 4 °C'de bir gecede çözün.
- Farklılaşmanın 1. gününde, harcanan kök hücre bakım ortamını kuyulardan 10 μM ROCKi Y-27632 ortamı ile çıkarın ve 24 kuyu plakasının kuyusu başına 0,5 mL komple Sahne 1 Orta 1 ve 96 kuyu plakasının kuyusu başına 0,1 mL ile değiştirin.
- 2, 3 ve 4.
- 5. günde, immünosetokmya yoluyla kesin endoderm farklılaşma analizi için kuyuları sabitle. Kalan kuyular için, harcanan ortamı çıkarın ve her kuyuyu kuyu başına 0,5 mL Hepatik Progenitör Farklılaşma Ortamı ile 24 kuyu plakası veya 96 kuyu plakasının kuyusu başına 0,1 mL ile besleyin. Ortamı 6, 7 ve 9.
- 10. günde, hepatik progenitör farklılaşma analizi için kuyuları hasat edin veya daha fazla hepatosit benzeri hücre farklılaşması ile devam edin.
NOT: Bu dönemde örnekler immünosimya analizi için %4 paraformaldehit (PFA) ile sabitlenmiş veya ELISA için süpernatant toplanmış ve protein nicelemesi için hücreler toplanmıştır.
4. Laminin-521'de hPSC'lerden oluşturulan hepatik progenitör farklılaşma kültürlerinin karakterizasyonu
- 5. günde, immünostaining kullanarak kesin endoderm spesifik belirteçlerin ekspresyonunun saptanır.
- 10. günde, immünostaining kullanarak hepatik progenitöre özgü belirteçlerin ekspresyonunun tespitini edin.
- 10. günde, üreticinin talimatlarını takip eden bir kit kullanarak ELISA aracılığıyla AFP ve ALB salgılarını ölçün ve bicinchoninic acid (BCA) protein tahlili ile belirlenen mg protein başına normalleştirin.
- Kuyu başına HNF4α pozitif hücre yüzdesini ölçerek 96 kuyu plakasının hepatik progenitör değişkenliğini değerlendirin.
5. İmmünostokimya ve görüntü edinimi
- Farklılaşmanın 5 ve 10. günlerinde, hücreleri 1x DPBS ile 3x, 24 kuyu plakasının kuyusu başına 0,5 mL ve 96 kuyu plakasının kuyusu başına 0,1 mL ile yıkayın. RT'de 2-5 dakika hafif sallanarak plakayı kuluçkaya yatırın.
NOT: İmmünostokimya için CA2+/Mg2+ olmadan DPSB kullanın. - 24 kuyu plakası için kuyu başına 0,3 mL PFA ve 96 kuyu plakasının kuyusu başına 0,1 mL ekleyerek RT'de %4 paraformaldehit (PFA) içeren hücreleri 15-30 dakika sabitleyin.
- 5.1 adımında açıklandığı gibi 3x'i 1x DPBS ile yıkayın.
- Membranı PBST ile %0,1 Ara, 1x DPBS kullanarak permeabilize edin ve 24 kuyu plakasının kuyusu başına 0,3 mL PBST ve 96 kuyu plakasının kuyusu başına 0,1 mL ekleyerek RT'de 20 dakika kuluçkaya yatırın.
- PBST'de %10 BSA'ya sahip hücreleri 1 saat boyunca inkübe ederek, 24 kuyu plakasının kuyusu başına 0,3 mL BSA ve 96 kuyu plakasının kuyusu başına 0,1 mL BSA ekleyerek, bir plaka çalkalayıcı kullanarak hafifçe sallayarak protein bloğunu gerçekleştirin.
- Protein blokajdan sonra, blokaj çözeltisini PBST'de% 1 BSA'da seyreltilmiş birincil antikorla değiştirin ve bir gecede hafifçe sallanarak 4 °C'de kuluçkaya yatırın.
NOT: Protein bloğu ve antikor ilavesi arasında yıkama yapmayın. - 24 saat sonra PBST ile 3x kuyuları yıkayın.
- PBST'de ikincil antikorun %1 BSA'sına ekleyin. Hafifçe sallanarak karanlıkta RT'de 1 saat kuluçkaya yaslanın.
- İkincil antikor inkübasyonundan sonra, kuyuları 1x DPBS ile 3x yıkayın ve hoechst lekesini üreticinin talimatlarına göre rt'de 10 dakika boyunca hafifçe sallayarak dağıtın.
- 1x DPBS ile 3x yıkayın. Plakalar görüntülemeye hazır.
NOT: Plakaları görüntülemeye kadar karanlıkta 4 °C'de saklayın. - İmmünohistokimitriden sonra yüksek içerikli bir görüntüleme mikroskobu kullanarak multiwell plakasını görüntüleyin. Kuyunun gerçek bir temsilini elde etmek için çeşitli görüş alanlarının görüntü alımı önerilir. Farklı belirteçlerin ifadesi, ticari yazılım kullanılarak hücre segmentasyon analizi ile değerlendirilmiş (bkz. Malzeme Tablosu)(Şekil 1).
NOT: Hücre segmentasyonu, CellProfiler veya Fiji20,21gibi bir görüntü analizi açık kaynaklı yazılım kullanılarak da gerçekleştirilebilir.
Sonuçlar
Şekil 2'deaçıklanan adım adım protokolün ardından hem hESC (H9) hem de hiPSC (P106) çizgilerinden hepatik progenitör farklılaşması gerçekleştirildi. Burada pluripotent kök hücreler, farklılaşma başlamadan önce LN-521 kaplı plakalara tek hücre olarak tohumlandı. Hücre konflüensi, sağlam ve tekrarlanabilir bir farklılaşmanın anahtarıdır. Doğru izdiah sağlandıktan sonra (Şekil 2), farklılaşma başlatılmıştır. 5. günde, kesin endoderm spesifikasyonu Sox17 ifadesi ile değerlendirildi. Her iki hücre hattında da Sox17, H9 ve P106 için sırasıyla %80 ± %0,5 ve %87,8 ± Sox17 pozitif hücrelerin %0,5 SEM'i ile yüksek oranda ifade edildi (Şekil 3). 10. günde, hepatik progenitörler parke taşı benzeri bir morfoloji sergilediler (Şekil 2). Ek olarak, hepatik progenitör spesifikasyonu HNF4α, AFP, ALB ve sitokeratin-19 (CK19) ekspresyonlarının yanı sıra AFP ve ALB protein salgısı10,15,22 (Şekil 4)için değerlendirildi. Hem H9 hem de P106 hepatik progenitör kültürleri HNF4α (%91 ± %0,5 ve %90 ± %0,2), AFP (%89,7) gibi fetal hepatik belirteçleri ifade etti. ± %1,8 ve %86 ± %1,2) ve CK19 (%78,5 ± %3,2 ve 83,6 ± %1,8)(Şekil 4). Her iki hücre hattında da 10. günde AFP salgısı saptanmıştır (32.4 ± 1.6 ve 47.8 ± 5.9 ng/mL/mg/24 h) (Şekil 5). Albümin sentezi daha düşük seviyelerde gözlenmiştir (%30,7 ± %1,8 ve %27,2 ± %1,1) (Şekil 4) ve ELISA(Şekil 5)ile tespit edilmelidir.
Protokol, 24 kuyudan 96 kuyu plakasına kadar hepatik progenitörlerin standart üretimine izin verildi. Daha önceaçıklandığıgibi H9 ve P106 hücre hatlarından 96 kuyu plakası hepatik progenitör üretmek için yarı otomatik bir boru hattı kullanıldı. Hücre sayısı değişkenliği ve hepatik progenitör farklılaşma verimliliği HNF4α ekspresyonunun niceliği ile değerlendirildi. Yüksek içerikli bir görüntüleme cihazı kullanılarak immünofluoresans yoluyla protein nicelemesi için hücre segmentasyonu gerçekldir (Şekil 1). 10. günde, hepatik progenitörler, H9 için kuyu başına HNF4α pozitif hücrelerin% > 94'ü ve P106 için% 97 HNF4α pozitif hücrelerin% 94'ü ile satırlarda önemli bir değişkenlik göstermedi (Şekil 6).

Şekil 1: Hücre segmentasyon ardışık düzenine genel bakış. (A) Orijinal görüntü kullanılarak, (B) çekirdek segmentasyonu için nükleer boyama kullanılmıştır. (C) Sadece açıkça segmente edilmiş çekirdekleri ölçmek için şekil ve boyuta dayalı bir nükleer segmentasyon kalite kontrol adımı gerçekleştirildi. (D) Bundan sonra pozitif HNF4α lekeli çekirdekler ölçüldü. (E) Son olarak, HNF4α ekspresyoz hücrelerini tanımlamak için yoğunluğa dayalı bir eşik kullanıldı. C ve E'de yeşil çekirdekler seçili hücreleri temsil eder ve macenta çekirdekleri atılan hücreleri gösterir. Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Hepatik progenitör farklılaşması hPSC'lerden. (A) Hepatik progenitör farklılaşma protokolünün şematik gösterimi. (B) Farklılaşma sırasında morfolojik değişiklikleri vurgulayan temsili görüntüler. 0. günde (D0), hPSC'ler paketlenmiş bir hücre monolayer sundu. Bunu takiben, hPSC'ler 5. günde (D5) kesin endoderm haline getirildi. Bunu 10. günde hepatik progenitör farklılaşması izledi (D10). Hepatik progenitörler parke taşı benzeri bir hücre morfolojisisergilediler. Ölçek çubuğu = 75 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
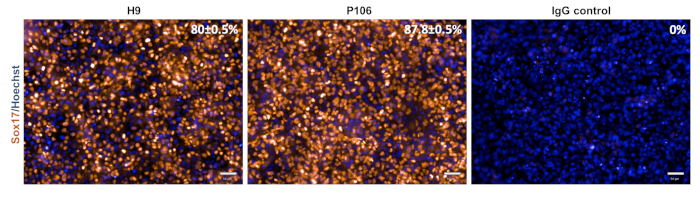
Şekil 3: Kesin endoderm spesifikasyonunun karakterizasyonu. 5. günde, hücreler kesin bir endoderm belirteci olan Sox17 için lekelendi. Sox17 pozitif hücrelerin yüzdesi H9 için %80 ± %0,5 ve P106 için %0,5 ± 87,8 idi. Yüzde nicelemesi, kuyu başına 6 görüş alanına sahip 10 ayrı kuyuya dayanıyordu. Veriler ortalama ± SEM olarak gösterilir. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Hepatik progenitör karakterizasyonu. 10. günde hepatik progenitörler hepatik belirteçler (A) HNF4α, (B) AFP ve (C) ALB için lekelendi. H9 için pozitif hücrelerin oranı sırasıyla %91 ± %0,4, %89,7 ± %1,8 ve %30,7 ± HNF4α, AFP ve ALB için %1,8 idi. P106 için pozitif hücrelerin yüzdesi sırasıyla %90 ± %0,2, %86 +/- %1,2 ve %27,2 ± HNF4α, AFP ve ALB için %1,1 idi. (D) Kolanjiosit soy potansiyeli CK19 ekspresyosu ile değerlendirildi; H9 türevi hepatik progenitörler %78,5 ± %3,2 CK19 pozitif hücre ifade ±, P106 hepatik progenitörler için ise %83,6 ± CK19 pozitif hücrelerin %1,8'i gözlenmiştir. İmmünoglobulin G (IgG) lekelenme, boyama kontrolü olarak kullanıldı. Yüzde nicelemesi, kuyu başına 6 görüş alanına sahip 10 ayrı kuyuya dayanıyordu. Veriler ortalama ± SEM olarak gösterilir. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Hepatik progenitör protein salgı analizi. Alfa fetoprotein (AFP) ve albümin (ALB) salgılanması H9 ve P109'da 10. Veriler üç biyolojik çoğalı temsil eder ve hata çubukları SD'yi temsil eder. Salgılanan proteinler, protein mg başına mL başına salgılanan protein nanogramı olarak 24 saat kültür ortamından ölçülür, n = 3; ND = algılanmadı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
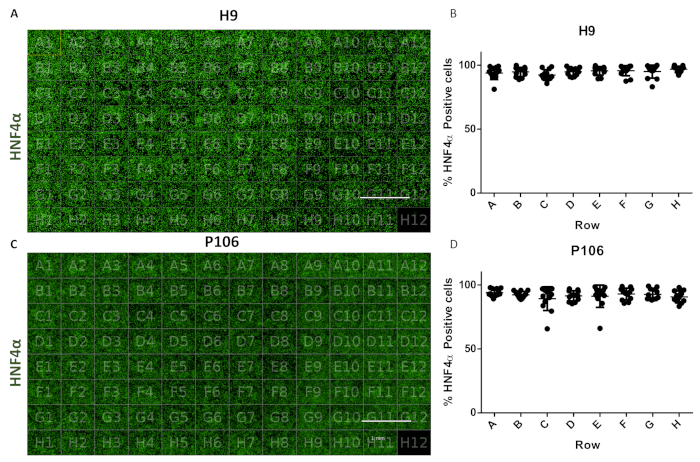
Şekil 6: 96 kuyu plakasında kuyudan kuyuya değişkenliğin değerlendirilmesi. (A) HNF4α ile boyanmış H9 türevi hepatik progenitörlerin 96 kuyu plakası görünümünün görselleştirilmesi. (B) HNF4α pozitif hücrelerin nicelemesi. İyi ölçülen her altı görünüm alanından satır başına hücre sayısı ortalaması. Plaka genelinde ortalama hücre sayısı kuyu başına 0.22 SEM HNF4α pozitif hücre ± %94.81 idi. Kuyular arasında istatistiksel olarak anlamlı bir fark gözlenmedi. (C) HNF4α ile boyanmış P106 türevi hepatik progenitörlerin 96 kuyu plakası görünümünün görselleştirilmesi. (D) HNF4α pozitif hücrelerin nicelemesi. Kuyu başına altı görünüm alanından satırlardaki kuyu başına ortalama hücre sayısı ve nicel. Plaka genelinde ortalama hücre sayısı kuyu başına 0.57 SEM HNF4α pozitif hücre ± %97.7 idi. Satırlar arasında istatistiksel olarak anlamlı bir fark gözlenmedi. H12, Immunoglobulin G (IgG) boyama kontrolü olarak kullanıldı. Ölçek çubuğu = 1 mm. Tukey'in post-hoc istatistiksel testleri ile tek yönlü ANOVA kullanıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Plaka biçimi | Yüzey alanı (cm2) | Cm2 başına hücreler | Kuyu başına toplam hücre sayısı | Dağıtım hacmi (mL) | Hücre konsantrasyonu (hücreler/ml) |
| 24 kuyulu tabak | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| 96 kuyu plakası | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
Tablo 1: Bu protokolde kullanılan hPSC hücre hatları için farklı plaka formatları için önerilen hücre yoğunluğu.
Tartışmalar
Pluripotent kök hücrelerden büyük ölçekte insan hepatik progenitör hücrelerin üretilmesi, kadavradan elde edilen malzemeye umut verici bir alternatifi temsil edebilir. Protokol standardizasyonu ve tekrarlanabilirliği, biyomedikal araştırmalar için teknoloji çevirisi ve etkisi sağlamak için anahtardır. Bunu ele almak için, önceki çalışmalar tanımlanmış katkı maddeleri ve matrisler 15 , 23 , 24 ,25,26,27,28kullanarak hESC ve iPSC'lerden adım adım bir farklılaşma protokolü geliştirmeye odaklanmıştır. Bunu yaparak, hepatosit fenotip ve tekrarlanabilirlik geliştirilmiştir, farklılaşma sürecinin yarı otomasyona izin verilir19. Sunulan sistem, raf dışı hücre kültürü ortamı ve facile hepatosit farklılaşma sistemi ile kombinasyonu ile güçlendirilmiştir.
Daha önce, farklılaşma protokolü başlamadan önce pluripotent hücre yoğunluğu, hepatik progenitör hücrelerin homojen popülasyonunu elde etmek için anahtar bir değişken olarak vurgulanmıştır26. Bu daha rafine prosedürü kullanarak, bir dizi başlangıç hücresi yoğunluğu kullanarak adım adım çok sayıda kök hücre türevi hepatik progenitör oluşturmak mümkündür (Tablo 1). 5. günde, kesin endoderm indüksiyonu Sox17 boyama ile doğrulandı (Şekil 3). Kesin endoderm içine verimli ve sağlam farklılaşma hem test esc hem de iPSC hatları ile elde edildi, fazla ifade 80% Sox17 (Şekil 3). 10. günde, hepatik progenitörler tek tip parke taşı benzeri bir morfoloji sergilediler ve karaciğer kök hücre belirteçleri hem AFP hem de HNF4α için oldukça zenginleştirilmişti (%>86, Şekil 4). Manuel ve yarı otomatik teknolojilerin bir kombinasyonunu kullanarak, birden fazla plaka formatında farklılaşma gerçekleştirmek mümkündü19.
Mevcut haliyle, hücre farklılaşması in vitro bazlı deneyler için uygundur. Bununla birlikte, homojen bir hepatik progenitör popülasyonunun doğuma hazır olduğundan emin olmak için klinik uygulamadan önce hücre zenginleştirmesi gerekecektir.
Sonuç olarak, burada açıklanan protokol, alana büyük ölçekte hepatik atalar üretmek için standart bir yaklaşım sağlar. Gelecekteki çalışmalar, sonraki HLC farklılaşması, olgunlaşması ve bakımı için yeni bir ortamın üretimine odaklanacaktır.
Açıklamalar
David C. Hay, Stemnovate Ltd.'nin kurucu ortağı ve hissedarıdır. Yazarların geri kalanı, bu makalede tartışılan konu veya materyaller hakkında herhangi bir çıkar çatışması olmadığını belgelemektedir.
Teşekkürler
Bu çalışma MRC Doktora Eğitim Ortaklığı (MR/K501293/1), İngiltere Rejeneratif Tıp Platformu (MRC MR/L022974/1 ve MR/K026666/1), Baş Bilim İnsanı Ofisi (TCS/16/37) ödülleri ile desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
Referanslar
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır