Method Article
Especificação progenitora hepática de células-tronco pluripotentes usando um sistema de diferenciação definido
Neste Artigo
Resumo
O objetivo deste artigo é fornecer uma abordagem padronizada para induzir a diferenciação de progenitor hepático humano das células-tronco pluripotentes. O desenvolvimento deste procedimento com formulações de mídia prontas para uso oferece ao usuário um sistema fácil de gerar células hepáticas humanas para pesquisa biomédica e tradução.
Resumo
A doença hepática é um problema de saúde global crescente. Embora o transplante hepático seja um modo eficaz de terapia, a mortalidade do paciente aumentou devido à escassez de disponibilidade de órgãos doadores. A escassez de órgãos também afeta a rotina de fornecimento de hepatócitos humanos para pesquisa básica e clínica. Portanto, o desenvolvimento de fontes renováveis de células progenitoras hepáticas humanas é desejável e é o objetivo deste estudo. Para ser capaz de gerar e implantar progenitores de fígado humano em larga escala, foi desenvolvido um sistema de diferenciação de progenitor hepático reprodutível. Este protocolo auxilia a reprodutibilidade experimental entre os usuários em uma variedade de formatos de material cultural celular e permite diferenciações usando linhas de células-tronco pluripotentes embrionárias humanas e induzidas. Essas são vantagens importantes em relação aos sistemas de diferenciação atuais que irão aprimorar a pesquisa básica e podem abrir caminho para o desenvolvimento de produtos clínicos.
Introdução
A doença hepática representa um desafio global à saúde, causando aproximadamente 2 milhões de mortes por ano em todo o mundo1. Embora existam vários sistemas modelo para estudar doenças hepáticas e intervir clinicamente, o uso rotineiro de sistemas baseados em células é limitado por desvantagens significativas (para uma revisão ver Szkolnicka et al.2). A cultura avançada de células-tronco pluripotentes humanas (hPSC) e os métodos de diferenciação de células somáticas representam tecnologias promissoras para desenvolver ferramentas para pesquisa biomédica básica e fontes renováveis de células diferenciadas para a clínica3,4.
Até o momento, foram desenvolvidos vários protocolos para diferenciação de células semelhantes a hepatócitos (HLC)5,6,7,8. Esses protocolos tentam recriar aspectos do desenvolvimento do fígado humano usando uma combinação de pequenas moléculas e fatores de crescimento9,10. A maioria dos protocolos consiste em um processo de diferenciação stepwise, onde os hPSCs são preparados para o endoderm definitivo, seguido pela especificação progenitora hepática11,12,13, e terminando com especificação HLC. Os HLCs produzidos por esses protocolos exibem uma mistura de fenótipos fetais e adultos. Isso inclui a expressão da fetoproteína alfa (AFP), como marcadores de hepatocitte como HNF4α e albumina (ALB), bem como capacidade metabolizadora de drogas14,15,16. Entre os laboratórios, a diferenciação do HLC pode variar; portanto, o desenvolvimento de protocolos padronizados é necessário. Isso permitirá que os pesquisadores gerem e apliquem HLCs derivados de células-tronco em larga escala para pesquisas básicas e clínicas.
Foi desenvolvido um sistema de diferenciação de progenitor hepático que pode ser aplicado tanto a linhas de células-tronco pluripotentes embrionárias humanas quanto induzidas usando diretrizes fáceis de seguir. Este procedimento produz populações homogêneas de progenitores hepáticos em diferentes formatos de cultura, que vão desde frascos de cultura celular até 96 placas de poços. Fornecido abaixo está o protocolo para produzir progenitores hepáticos derivados de células-tronco em formatos de poços 24 e 96.
A densidade celular utilizada no protocolo apresentado abaixo é especificada para um poço de uma placa de poço 24 e 96, respectivamente (ver Tabela 1). A otimização do número de célula inicial é necessária para os diferentes formatos de placas de cultura celular e linhas de células. A densidade celular inicial sugerida para otimização do protocolo é de 2 x 105 células/cm2. Para otimização da densidade, várias densidades celulares podem ser testadas adicionando ± 50.000 células/cm2 de cada vez.
Protocolo
1. Manutenção de células-tronco pluripotentes humanas (hPSC) em laminina-521
- Mantenha células pluripotentes humanas (hPSCs) a 37 °C e 5% de CO2 em uma placa de 6 poços em laminina-521 (LN-521). Alimente as células diariamente com 2 mL de meio de manutenção de células-tronco (ou seja, mTeSR1 médio) por poço de uma placa de 6 poços até o dia de semeadura escolhido para diferenciação (dia 0).
- Certifique-se de que a confluência celular desejada de 70-80% seja alcançada antes da colheita celular.
2. Preparação multiwell laminin-521 e semeadura hPSC para diferenciação
NOTA: Para hPSCs não mantidos na LN-521 (por exemplo, matrigel ou fibronectina), divida os hPSCs no LN-521 e cultura por 1 semana antes da aprovação e obtenção de diferenciação para melhorar a eficiência do processo15,17,18.
- Preparação de placa revestida de laminin
- Descongele um frasco de LN-521 recombinante (100 μg/mL) a 4 °C por 2h ou durante a noite.
- Prepare uma solução de 8 μg/mL diluindo o LN-521 descongelado no 1x DPBS gelado com Ca2+/Mg2+.
- Adicione 0,25 mL da solução LN-521 de 8 μg/mL a cada poço de uma placa de 24 poços ou 0,05 mL a cada poço de uma placa de 96 poços. Balance a placa suavemente de um lado para o outro para revestir uniformemente os poços com a solução LN-521.
NOTA: Para o formato de placa de 96 poços, a dispensação de volume, a semeadura de células e as alterações médias podem ser realizadas usando um pipeline semi-automatizado. Para mais detalhes, consulte Meseguer-Ripolles et al.19. - Sele as placas revestidas LN-521 com um filme semi-transparente e flexível e armazene a 4 °C durante a noite antes de usar.
NOTA: As placas revestidas LN-521 podem ser usadas por até 2 semanas quando armazenadas a 4 °C. Evite qualquer secagem dos poços revestidos de laminina.
- No dia da semeadura celular, aqueça as placas pré-revestidas em uma incubadora de cultura celular a 37 °C por 30-60 min.
- Aspire a solução LN-521.
NOTA: Evite contato direto do aspirador com a parte inferior do poço para evitar danos ao revestimento LN-521. - Dispense 0,5 mL de meio de manutenção de células-tronco com inibidor de quinase recém-suplementada de 10 μM (ROCK) Y27632 para cada poço de uma placa de 24 poços ou 0,05 mL para cada poço de uma placa de 96 poços. Coloque a placa na incubadora até ficar pronta para semeadura celular.
- No dia programado de semeadura (dia 0) e com uma confluência hPSC entre 70-80%, marcam quaisquer regiões de diferenciação espontânea na parte inferior dos poços da placa de 6 poços.
NOTA: A diferenciação espontânea pode ser visualizada por uma mudança grosseira no tamanho da célula e/ou pela presença de diferentes morfologias celulares usando microscopia de contraste de fase. - Aspirar e descartar as regiões marcadas de diferenciação e o meio gasto dos poços. Lave cada poço com 1 mL de DPBS sem Ca2+/Mg2+ em temperatura ambiente (RT).
- Adicione 1 mL de reagente de dissociação sem enzimas (ver Tabela de Materiais) a cada poço e incubar a 37 °C por 8-10 min até que as células visivelmente se desprendem da placa.
- Use um raspador de células para separar suavemente as células dos poços. Pipeta o conteúdo de cada poço para cima e para baixo 2-4x com uma pipeta P1000 para produzir uma suspensão de célula única. Para cada linha celular, as células da piscina de todos os poços de manutenção em um tubo estéril de 50 mL.
- Lave cada poço esvaziado com 1 mL do meio de manutenção de células-tronco. Adicione as lavagens ao tubo correspondente que contém as células agrupadas da linha celular apropriada.
- Para cada linha celular, realize três contagens de células viáveis nas amostras agrupadas. Calcule a contagem média de células vivas (células vivas/mL) para cada linha celular.
- Centrifugar as amostras agrupadas a 250 x g por 5 min na RT. Aspire o supernasal, depois resuspengue a pelota celular em 1-3 mL de meio de manutenção de células-tronco RT, recém-suplementado com 10 μM inibidor de ROCHA Y27632.
- Para cada linha celular, calcule o número de célula necessário pelo número de poços preparados na etapa 2.4 (ver Tabela 1). Resuspenda o número celular necessário com o meio de manutenção de células-tronco recém-suplementado com 10 μM inibidor de ROCHA Y27632.
- Adicione o volume calculado nos poços das placas preparadas e pré-revestidas da etapa 2.4 sem remover o volume adicionado anteriormente. O volume total por poço será de 1 mL para uma placa de 24 poços e 0,1 mL para uma placa de 96 poços. Balance suavemente as placas de um lado para o outro para frente e para trás para garantir uma dispersão celular uniforme em todo o poço.
NOTA: Uma distribuição de células uniforme em todo o poço é fundamental para garantir a semeadura de células homogêneas e a diferenciação bem sucedida. - Coloque as placas semeadas na incubadora e abale imediatamente as placas semeadas suavemente para frente e para trás e de um lado para o outro para distribuir uniformemente as células e manter culturas a 37 °C e 5% de CO2.
3. Diferenciando hPSCs para progenitores hepáticos em laminin-521
- Prepare a mídia para indução definitiva do endoderm (estágio 1) utilizando o Endoderm Basal Medium complementado com os aditivos corretos.
- No dia 0, descongele a garrafa do Endoderm Basal Medium durante a noite a 4 °C.
- Prepare o Estágio 1 Médio 1 (para uso no dia 1) conforme necessário.
- Degelo Suplemento MR e Suplemento CJ no gelo.
- Suplemento Diluído MR e Suplemento CJ 1:100 no Endoderm Basal Medium.
- Prepare o Estágio 1 Médio 2 para uso nos dias 2-4, conforme necessário.
- Suplemento diluído CJ 1:100 no Endoderm Basal Medium.
- Prepare a mídia para a subsequente especificação de célula progenitora hepática (Estágio 2) usando o Meio Progenitor Hepatic.
- No dia 4, descongele a garrafa do Hepatic Progenitor Medium durante a noite a 4 °C.
NOTA: 1% penicilina/estreptomicina (concentrações finais de 100 UI/mL e 100 μg/mL, respectivamente) foi utilizada para este experimento. Antibióticos não são necessários; o uso de antibióticos é a critério do usuário.
- No dia 4, descongele a garrafa do Hepatic Progenitor Medium durante a noite a 4 °C.
- No primeiro dia da diferenciação, remova o meio de manutenção de células-tronco gastas com 10 μM ROCKi Y-27632 médio dos poços e substitua por 0,5 mL de estágio 1 completo Médio 1 por poço de uma placa de 24 poços e 0,1 mL por poço de uma placa de 96 poços.
- Nos dias 2, 3 e 4, retire o meio gasto e alimente cada poço com 0,5 mL de Estágio 1 Médio 2 por poço para uma placa de 24 poços ou 0,1 mL por poço de uma placa de 96 poços.
- No dia 5, fixar os poços para análise definitiva de diferenciação de endoderm via imunocitoquímica. Para os demais poços, remova o meio gasto e alimente cada poço com 0,5 mL de Hepatic Progenitor Differentiation Medium por poço para uma placa de 24 poços ou 0,1 mL por poço de uma placa de 96 poços. Refrescar o meio novamente nos dias 6, 7 e 9.
- No dia 10, colhe poços para análise de diferenciação de progenitor hepático ou proceder com maior diferenciação celular semelhante ao hepatocito.
NOTA: Neste momento, as amostras foram fixadas com 4% de paraformaldeído (PFA) para análise imunocitoquímica ou sobrenascimento coletado para ELISA e foram coletadas células para quantificação proteica.
4. Caracterização das culturas de diferenciação de progenitor hepáticos geradas a partir de hPSCs em laminin-521
- No dia 5, detecte a expressão de marcadores específicos de endoderme definitivos usando imunostaining.
- No dia 10, detecte a expressão de marcadores específicos de progenitor hepático usando imunostaining.
- No dia 10, meça a secreção AFP e ALB via ELISA usando um kit seguindo as instruções do fabricante e normalize por proteína por mg, conforme determinado por um ensaio proteico de ácido bicinchonínico (BCA).
- Avalie a variabilidade hepática progenitora da placa de 96 poços quantificando o percentual de células positivas HNF4α por poço.
5. Imunocytoquímica e aquisição de imagens
- Nos dias 5 e 10 da diferenciação, lave as células 3x com 1x DPBS, com 0,5 mL por poço de uma placa de 24 poços e 0,1 mL por poço de uma placa de 96 poços. Incubar a placa com agitação suave por 2-5 min no RT.
NOTA: Use DPSB sem Ca2+/Mg2+ para imunocytoquímica. - Fixar as células com 4% de paraformaldeído (PFA) em RT por 15-30 min adicionando 0,3 mL de PFA por poço para uma placa de 24 poços e 0,1 mL por poço de uma placa de 96 poços.
- Lave 3x com 1x DPBS conforme descrito na etapa 5.1.
- Permeabilize a membrana com PBST utilizando 0,1% Tween, 1x DPBS e incubar por 20 min na RT adicionando 0,3 mL de PBST por poço de uma placa de 24 poços e 0,1 mL por poço de uma placa de 96 poços.
- Realize o bloco proteico incubando as células com 10% de BSA em PBST por 1h, adicionando 0,3 mL de BSA por poço de uma placa de 24 poços e 0,1 mL de BSA por poço de uma placa de 96 poços, suavemente tremendo usando um agitador de placas.
- Após o bloqueio de proteínas, substitua a solução de bloqueio pelo anticorpo primário diluído em 1% de BSA em PBST e incubar a 4 °C com agitação suave durante a noite.
NOTA: Não lave entre bloco de proteínas e adição de anticorpos. - Depois de 24 horas, lave os poços 3x com PBST.
- Adicione o anticorpo secundário em 1% BSA no PBST. Incubar 1 h no RT no escuro com agitação suave.
- Após a incubação de anticorpos secundários, lave os poços 3x com 1x DPBS e dispense a mancha de Hoechst de acordo com as instruções do fabricante para 10 min no RT no escuro com agitação suave.
- Lave 3x com 1x DPBS. As placas estão prontas para a imagem.
NOTA: Armazene as placas a 4 °C no escuro até a imagem. - Imagem da placa multiwell usando um microscópio de imagem de alto conteúdo após a imunohistoquímica. Recomenda-se a aquisição de imagens de vários campos de visão para obter uma verdadeira representação do poço. A expressão dos diferentes marcadores foi avaliada por meio da análise de segmentação celular utilizando software comercial (ver Tabela de Materiais) (Figura 1).
NOTA: A segmentação celular também pode ser realizada usando um software de código aberto de análise de imagem, como CellProfiler ou Fiji20,21.
Resultados
A diferenciação de progenitor hepático das linhas hESC (H9) e hiPSC (P106) foi realizada seguindo o protocolo stepwise descrito na Figura 2. Aqui, as células-tronco pluripotentes foram semeadas como células únicas em placas revestidas de LN-521 antes do início da diferenciação. A confluência celular é a chave para uma diferenciação robusta e reprodutível. Uma vez alcançada a confluência certa(Figura 2),a diferenciação foi iniciada. No dia 5, a especificação definitiva do endoderm foi avaliada via expressão Sox17. Em ambas as linhas celulares, sox17 foi altamente expresso com 80% ± 0,5% e 87,8% ± 0,5% SEM de células Sox17-positivas para H9 e P106, respectivamente (Figura 3). No dia 10, progenitores hepáticos exibiram uma morfologia semelhante a paralelepípedos(Figura 2). Além disso, foi avaliada a especificação progenitora hepática para a expressão HNF4α, AFP, ALB e citokeratin-19 (CK19), bem como a secreção de proteínas AFP e ALB10,15,22 (Figura 4). Tanto as culturas progenitoras hepáticas H9 quanto P106 expressaram marcadores hepáticos fetais como HNF4α (91% ± 0,5% e 90% ± 0,2%), AFP (89,7% ±1,8% e 86% ± 1,2%), e CK19 (78,5% ± 3,2% e 83,6± 1,8%)(Figura 4). A secreção da AFP foi detectada no dia 10 em ambas as linhas celulares (32,4 ± 1,6 e 47,8 ± 5,9 ng/mL/mg/24 h)(Figura 5). A síntese de albumina foi observada em níveis mais baixos (30,7% ± 1,8% e 27,2% ± 1,1%)(Figura 4) e não foi detectada via ELISA (Figura 5).
O protocolo permitiu a produção padronizada de progenitores hepáticos de 24 placas de poços para 96 poços. Um gasoduto semi-automatizado foi empregado para produzir 96 placas de poços de progenitores hepáticos das linhas celulares H9 e P106, como descrito anteriormente17. A variabilidade do número celular e a eficiência de diferenciação de progenitor hepático foi avaliada por meio da quantificação da expressão HNF4α. A segmentação celular foi realizada para quantificação proteica via imunofluorescência utilizando um instrumento de imagem de alto teor(Figura 1). No dia 10, progenitores hepáticos não apresentaram variabilidade significativa entre linhas com >94% das células HNF4α positivas por poço para H9 e 97% células HNF4α positivas para P106 (Figura 6).

Figura 1: Visão geral dogasoduto de segmentação celular. (A) Utilizando a imagem original, (B)a coloração nuclear foi utilizada para a segmentação de núcleos. (C) Uma etapa de controle de qualidade de segmentação nuclear baseada na forma e no tamanho foi realizada apenas para quantificar núcleos claramente segmentados. (D) Após isso, foram quantificados núcleos hnf4α-manchados positivos. (E) Finalmente, foi empregado um limiar baseado em intensidade para identificar células expressas hnf4α. Em C e E,núcleos verdes representam células selecionadas e núcleos magenta indicam células descartadas. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Diferenciação de progenitor hepático dos hPSCs. (A) Representação esquemática do protocolo de diferenciação de progenitor hepático. (B) Imagens representativas destacando as alterações morfológicas durante a diferenciação. No dia 0 (D0), os hPSCs apresentavam uma monocamada embalada de células. Na sequência, os hPSCs foram preparados para o endoderm definitivo no dia 5 (D5). Isso foi seguido pela diferenciação de progenitor hepático no dia 10 (D10). Progenitores hepáticos exibiram uma morfologia celular semelhante a paralelepípedos. Barra de escala = 75 μm. Clique aqui para ver uma versão maior desta figura.
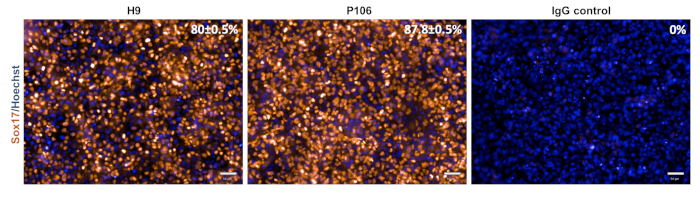
Figura 3: Caracterização da especificação definitiva do endoderm. No dia 5, as células foram manchadas para Sox17, um marcador definitivo de endoderme. O percentual de células sox17 positivas foi de 80 ± 0,5% para H9 e 87,8 ± 0,5% para P106. A quantificação percentual foi baseada em 10 poços separados com 6 campos de visão por poço. Os dados são mostrados como a barra média ± SEM. Escala = 50 μm. Por favor clique aqui para ver uma versão maior deste número.

Figura 4: Caracterização progenitora hepática. No dia 10, progenitores hepáticos foram manchados por marcadores hepáticos(A) HNF4α,(B) AFP e(C) ALB. Para o H9, o percentual de células positivas foi de 91% ± 0,4%, 89,7% ± 1,8%, e 30,7% ± 1,8% para HNF4α, AFP e ALB, respectivamente. Para P106, o percentual de células positivas foi de 90% ± 0,2%, 86% +/- 1,2%, e 27,2% ± 1,1% para HNF4α, AFP e ALB, respectivamente. (D) O potencial de linhagem de cólitos foi avaliado via expressão CK19; Progenitores hepáticos derivados do H9 expressaram 78,5% ± 3,2% células CK19 positivas, enquanto 83,6% ± 1,8% das células CK19 positivas foram observadas para progenitores hepáticos P106. A coloração da imunoglobulina G (IgG) foi usada como controle de coloração. A quantificação percentual foi baseada em 10 poços separados com 6 campos de visão por poço. Os dados são mostrados como a barra média ± SEM. Escala = 50 μm. Por favor clique aqui para ver uma versão maior deste número.

Figura 5: Análise de secreção de proteína progenitora hepática. A secreção de alfa fetoproteína (AFP) e albumina (ALB) foi analisada em culturas progenitoras hepáticas no dia 10 em H9 e P109. Os dados representam três réplicas biológicas e as barras de erro representam o SD. As proteínas secretadas foram quantificadas a partir do meio de cultura 24h como nanogramas de proteína secretada por mL por mg de proteína, n = 3; ND = não detectado. Clique aqui para ver uma versão maior desta figura.
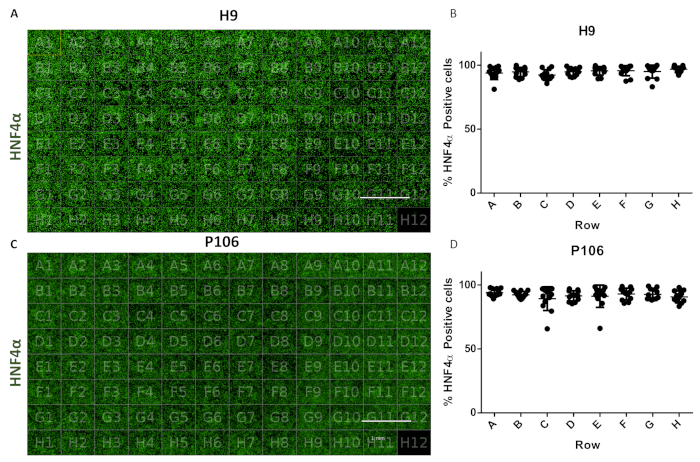
Figura 6: Avaliação da variabilidade bem-para-bem em placa de 96 poços. (A) Visualização de uma visão de placa de 96 poços de progenitores hepáticos derivados de H9 manchados com HNF4α. (B) Quantificação das células HNF4α-positivas. Média do número de células por poço em fileiras, de seis campos de visão por bem quantificado. O número médio de células em toda a placa foi de 94,81% ± 0,22 SEM HNF4α-positivas por poço. Não foram observadas diferenças estatisticamente significativas entre os poços. (C) Visualização de uma visão de placa de 96 poços de progenitores hepáticos derivados P106 manchados com HNF4α. (D) Quantificação de células HNF4α-positivas. O número médio de células por poços em fileiras, de seis campos de visão por poço e quantificado. O número médio de células em toda a placa foi de 97,7% ± 0,57 SEM HNF4α-positivas por poço. Não foram observadas diferenças estatisticamente significativas entre as linhas. Bem H12 foi usado como um controle de coloração imunoglobulina G (IgG). Barra de escala = 1 mm. Anova unidirecional com os testes estatísticos pós-hoc de Tukey foram empregados. Clique aqui para ver uma versão maior desta figura.
| Formato da placa | Área de superfície (cm2) | Células por cm2 | Células totais por poço | Volume de distribuição (mL) | Concentração celular (células/ml) |
| Placa de 24 poços | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| Placa de 96 poços | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
Tabela 1: Densidade celular recomendada para os diferentes formatos de placa para as linhas de células hPSC utilizadas neste protocolo.
Discussão
A geração de células progenitoras hepáticas humanas a partir de células-tronco pluripotentes em grande escala poderia representar uma alternativa promissora ao material derivado de cadáveres. A padronização e a reprodutibilidade do protocolo são fundamentais para garantir a tradução e o impacto da tecnologia para pesquisas biomédicas. Para lidar com isso, o trabalho anterior concentrou-se no desenvolvimento de um protocolo de diferenciação stepwise do hESC e iPSCs utilizando aditivos e matrizes definidos15,23,24,25,26,27,28. Ao fazer isso, o fenótipo hepatocito e a reprodutibilidade foram melhorados, permitindo a semiautorização do processo de diferenciação19. O sistema apresentado é reforçado por sua combinação com mídia de cultura celular fora da prateleira e um sistema de diferenciação de hepatócitos fáceis.
Anteriormente, a densidade celular pluripotente antes do início do protocolo de diferenciação foi destacada como variável-chave para alcançar uma população homogênea de células progenitoras hepáticas26. Usando este procedimento mais refinado, é possível gerar um grande número de progenitores hepáticos derivados de células-tronco de forma stepwise usando uma gama de densidades celulares iniciais(Tabela 1). No dia 5, a indução definitiva do endoderm foi validada pela coloração sox17(Figura 3). A diferenciação eficiente e robusta em endoderm definitivo foi alcançada com as linhas ESC e iPSC testadas, com mais de 80% expressando Sox17 (Figura 3). No dia 10, progenitores hepáticos exibiam uma morfologia uniforme em forma de paralelepípedo, e os marcadores de células-tronco hepáticas foram altamente enriquecidos tanto para a AFP quanto para HNF4α (>86%, Figura 4). Usando uma combinação de tecnologias manuais e semi-automatizadas foi possível realizar diferenciação em múltiplos formatos deplacas 19.
Em sua forma atual, a diferenciação celular é adequada para experimentação in vitro. No entanto, o enriquecimento celular provavelmente seria necessário antes da aplicação clínica para garantir que uma população homogênea de progenitores hepáticos esteja preparada para o parto.
Em conclusão, o protocolo aqui descrito fornece ao campo uma abordagem padronizada para produzir progenitores hepáticos em larga escala. O trabalho futuro se concentrará na produção de um novo meio para posterior diferenciação, maturação e manutenção do HLC.
Divulgações
David C. Hay é co-fundador e acionista da Stemnovate Ltd. O restante dos autores atesta que não há conflitos de interesse no assunto ou materiais discutidos neste artigo.
Agradecimentos
Este estudo foi apoiado com prêmios da MrC Doctoral Training Partnership (MR/K501293/1), da Uk Regenerative Medicine Platform (MRC MR/L022974/1 e MR/K02666/1), do Escritório De Cientista Chefe (TCS/16/37).
Materiais
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
Referências
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados