Method Article
定義された分化系を用いた多能性幹細胞からの肝前駆体仕様
要約
本稿の目的は、多能性幹細胞からのヒト肝前駆物質分化を誘導する標準化されたアプローチを提供することです。すぐに使用できるメディア製剤を用いたこの手順の開発は、生物医学の研究と翻訳のためのヒト肝細胞を生成する容易なシステムをユーザーに提供する。
要約
肝疾患は世界的な健康問題のエスカレートです。肝臓移植は効果的な治療法ですが、ドナー臓器の入手不足により患者の死亡率が増加しています。臓器不足は、基礎研究やクリニックのためのヒト肝細胞の日常的な供給にも影響を及ぼす。したがって、ヒト肝前駆細胞の再生可能な供給源の開発が望ましく、本研究の目標である。ヒト肝前駆物質を大規模に効果的に生成・展開できるように、再現性肝前駆物質分化システムを開発した。このプロトコルは、さまざまな細胞培養器形式のユーザー間の実験的再現を支援し、ヒト胚性幹細胞および人工多能性幹細胞株の両方を使用して分化を可能にする。これらは、基礎研究を強化し、臨床製品開発への道を開く可能性があり、現在の分化システムよりも重要な利点です。
概要
肝臓病は世界的な健康問題であり、世界で年間約200万人の死亡を引き起こしている。肝疾患を研究し、臨床的に介入するモデルシステムの数が存在するが、細胞系システムの日常的な使用は重大な欠点によって制限される(レビューのためにSzkolnickaらら2参照)。高度なヒト多能性幹細胞(hPSC)培養および体細胞分化法は、クリニック3,4の分化細胞の基礎生物医学研究および再生可能な分化源のためのツールを開発する有望な技術を表す。
現在までに、肝細胞様細胞(HLC)分化のための複数のプロトコルが5、6、7、8に開発されてきた。これらのプロトコルは、低分子と成長因子9,10を組み合わせて、ヒト肝臓の発達の側面を再現しようとします。ほとんどのプロトコルは段階的な分化プロセスで構成され、hPSCは決定的なエンドドームにプライミングされ、続いて肝前駆子仕様11、12、13がHLC仕様で終わる。これらのプロトコルによって生成されたHlcは、胎児と成人のフェノタイプの混合物を表示する。これには、HNF4αおよびアルブミン(ALB)などの肝細胞マーカー、ならびに薬物代謝容量14、15、16などのαフェトプロテイン(AFP)の発現が含まれる。研究所間で, HLC 分化は異なる場合があります。したがって、標準化されたプロトコルの開発が必要です。これにより、研究者は、幹細胞由来のHLCを大規模に生成し、基礎的および臨床的研究に効果的に適用することができます。
ヒト胚性幹細胞と誘導多能性幹細胞株の両方に適用できる肝前駆細胞分化システムが開発されました。この手順は、細胞培養フラスコから96ウェルプレートに至るまで、様々な培養器形式で肝前駆細胞の均質集団を生み出す。以下に提供されるプロトコルは、幹細胞由来の肝前駆物質を24および96のウェルフォーマットで生成する。
以下に示すプロトコルで使用されるセル密度は、それぞれ24および96ウェルプレートの1つのウェルに対して指定される( 表1を参照)。異なる細胞培養板フォーマットおよび細胞株に対しては、開始細胞数の最適化が必要である。プロトコル最適化の開始セル密度は、2 x 105 セル/cm2です。密度最適化のために、一度に50,000個のセル/cm2± を追加することで、複数のセル密度をテストできます。
プロトコル
1. ヒト多能性幹細胞(hPSC)のラミニン-521の維持
- ラミニン-521(LN-521)上の6ウェルプレートで37°Cおよび5%CO2でヒト多能性細胞(hPSC)を維持します。分化のために選択した播種日(0日目)までの6ウェルプレートのウェルあたり、幹細胞維持培地(すなわちmTeSR1培地)を毎日2mLで細胞に供給する。
- 細胞採取前に、70~80%の望ましい細胞合流を確実に達成してください。
2. ラミニン-521 マルチウェル製剤と分化のための hPSC シード
注:LN-521(例えば、マトリゲルまたはフィブロネクチン)上で維持されていないhPSCについては、継ぎ手化し、分化を引き出す前に1週間LN-521および培養物にhPSCを分割し、プロセス15、17、18の効率を向上させる。
- ラミニンコーティングプレート調製
- 組換えLN-521(100 μg/mL)のバイアルを4°Cで2時間または一晩解凍します。
- 解凍したLN-521をCa2+/Mg 2+で氷冷1x DPBSで希釈して8μg/mL溶液を調製します。
- 96ウェルプレートの各ウェルに、8 μg/mL LN-521溶液の0.25 mLを24ウェルプレートまたは0.05 mLの各ウェルに追加します。プレートを左右に軽く揺らし、LN-521溶液でウェルを均等にコーティングします。
注:96ウェルプレートフォーマットでは、ボリュームディスペンス、セルシード、および中程度の変更は、半自動化されたパイプラインを使用して行うことができます。詳細については、メセゲール・リポレスら19を参照してください。 - LN-521被覆プレートを半透明で柔軟なフィルムで密封し、使用前に一晩4°Cで保管してください。
注:LN-521コーティングされた版は4°Cで貯えられるとき2週間まで使用することができる。 ラミニンコーティングされた井戸の乾燥は避けてください。
- 細胞の播種の日に、細胞培養インキュベーターで、30~60分間、細胞培養インキュベーターでプレートを温め、30~60分間温める。
- LN-521溶液を吸引する。
注:LN-521コーティングの損傷を防ぐために、ウェルの底部に吸引器を直接接触しないようにしてください。 - 24ウェルプレートまたは0.05 mLの各ウェルに24ウェルプレートまたは0.05 mLの各ウェルに、新鮮な補充された10 μM Rho関連キナーゼ(ROCK)阻害剤Y27632を付けた幹細胞維持培地0.5 mLを96ウェルプレートの各ウェルに分配します。プレートをインキュベーターに入れ、細胞の播種の準備が整うまで置きます。
- スケジュールされたシード日(0日目)とhPSC合流率が70~80%の間で、6ウェルプレートの底部に自発的分化の領域をマークします。
注:自然分化は、位相差顕微鏡を用いた細胞サイズの大きな変化や異なる細胞形態の存在によって可視化することができます。 - 吸引し、分化のマークされた領域と井戸から使用済み培地を廃棄します。室温(RT)でCa2 +/Mg2+なしでDPBSの1 mLで各井戸を洗浄します。
- 各ウェルに酵素を含まない解離試薬1 mL ( 材料表を参照)を加え、細胞が目に見えてプレートから外れるまで、37 °Cで 8~10分間インキュベートします。
- セルスクレーパーを使用して、ウェルから細胞をそっと取り外します。ピペットは、P1000ピペットを使用して2~4倍の上下に各ウェルの内容物をピペットし、単一細胞懸濁液を生み出します。各細胞株について、すべての維持井戸から無菌50 mLチューブに細胞をプールする。
- 各々を1mLの幹細胞維持培地で洗浄します。適切な細胞株からプールされた細胞を含む対応するチューブに、そのスケを加えます。
- 各セルラインについて、プールされたサンプルに対して 3 つの実行可能セルカウントを実行します。各セルラインの平均ライブセル数(ライブセル/mL)を計算します。
- 250 x g のプールサンプルを RT で 5 分間遠心分離し、その後、RT 幹細胞維持培地の 1 ~ 3 mL で細胞ペレットを再中断し、10 μM ROCK 阻害剤 Y27632 を補充します。
- 各セルラインについて、ステップ2.4で用意したウェルの数に応じて必要なセル数を計算します( 表1を参照)。10 μM ROCK阻害剤 Y27632を補充したばかりの幹細胞維持培地で必要な細胞数を再中断します。
- 以前に追加したボリュームを取り除かずに、ステップ2.4から準備済みプレートとプレコーティングプレートのウェルに計算されたボリュームを追加します。ウェルあたりの総容積は、24ウェルプレートの場合は1mL、96ウェルプレートの場合は0.1mLになります。プレートを左右にそっと揺らし、ウェル全体にセル分散を確実にします。
注:ウェルを横切る偶数セル分布は、均質な細胞の播種と分化を確実に行う鍵となります。 - 播種したプレートをインキュベーターに入れ、シードプレートを優しく前後に左右に揺らし、細胞を均等に分配し、培養物を37°Cおよび5%CO2に維持します。
3. ラミニン-521上の肝前駆物質にhPSCを分化
- 正しい添加剤を添加したEndoderm Basal培地を使用して、決定的な内胚葉誘導(ステージ1)の培地を準備します。
- 0日目に、エンドデドルム基底培地のボトルを一晩4°Cで解凍します。
- 必要に応じて、ステージ 1 のミディアム 1 (1 日目に使用) を準備します。
- 氷の上のサプリメントMRとサプリメントCJを解凍します。
- 希薄サプリメントMRとサプリメント CJ 1:100 内皮基底培地.
- 必要に応じて、2~4日に使用するためにステージ1中2を準備します。
- 薄いサプリメント CJ 1:100 内皮基底培地.
- 肝前駆物質培地を用いて、その後の肝前駆細胞仕様(ステージ2)分化のための培地を準備する。
- 4日目、肝前駆媒のボトルを一晩4°Cで解凍する。
注:1%ペニシリン/ストレプトマイシン(最終濃度は100 IU/mL、100 μg/mL)を用いた。抗生物質は必要ありません。抗生物質の使用は、ユーザーの裁量で行われます。
- 4日目、肝前駆媒のボトルを一晩4°Cで解凍する。
- 分化の1日目に、10 μM ROCKi Y-27632培地を使用した使用済み幹細胞維持培地をウェルから取り出し、24ウェルプレートのウェルあたり0.5mLの完全なステージ1ミディアム1と96ウェルプレートのウェルあたり0.1 mLに置き換えます。
- 2日目、3日目、4日目に、使用済み培地を取り除き、96ウェルプレートのウェルあたり24ウェルプレートまたは0.1 mLの場合は、ステージ1ミディアム2の0.5mLをそれぞれ十分に供給します。
- 5日目に、免疫細胞化学を介して決定的な内胚分化分析のためにウェルを固定する。残りの井戸については、使用済み培地を取り除き、24ウェルプレートまたは96ウェルプレートのウェルあたり0.1 mLのウェルあたり0.5mLの肝前駆子分化培地で各井戸を供給します。6 日、7 日、9 日目にメディアを再び更新します。
- 10日目には、肝前駆細胞分化分析のためのウェルを収穫するか、または更なる肝細胞様細胞分化を進める。
注:この時点で、サンプルを免疫細胞化学分析のために4%パラホルムアルデヒド(PFA)で固定したか、ELISAのために上清を採取し、タンパク質定量のために細胞を採取した。
4. ラミニン-521上のhPSCから生成される肝前駆物質分化培養の特徴
- 5日目に、免疫染色を用いて決定的な内胚性マーカーの発現を検出する。
- 10日目に、免疫染色を用いて肝前駆物質特異的マーカーの発現を検出する。
- 10日目に、メーカーの指示に従ったキットを使用してELISA経由でAFPおよびALB分泌を測定し、バイチンチオン酸(BCA)タンパク質アッセイによって決定されるmgタンパク質当たりの正規化を行います。
- 1ウェル当たりHNF4α陽性細胞の割合を定量化することにより、96ウェルプレートの肝前駆細胞変動を評価する。
5. 免疫細胞化学と画像取得
- 分化の5日目と10日目に、細胞3xを1x DPBSで洗浄し、24ウェルプレートのウェルあたり0.5 mL、96ウェルプレートのウェルあたり0.1 mLで洗浄します。RTで2〜5分間穏やかな揺れでプレートをインキュベートします。
注:免疫細胞化学のためにCa2 +/Mg2+なしでDPSBを使用してください。 - 24ウェルプレートに対してウェルあたり0.3 mL、96ウェルプレートのウェルあたり0.1 mLを加えて、RTで4%パラホルムアルデヒド(PFA)を15〜30分間固定します。
- ステップ5.1で説明したように1x DPBSで3倍を洗浄します。
- 0.1%のトゥイーン、1x DPBSを使用してPBSTで膜を透過させ、96ウェルプレートのウェルあたり0.3 mLのPBSTを1ウェルあたり0.3 mL、96ウェルプレートあたり0.1 mLを加えることで、RTで20分間インキュベートします。
- 1時間PBSTで10%BSAで細胞をインキュベートし、96ウェルプレートのウェルあたり24ウェルプレートと0.1mLのBSAのウェルあたり0.3mLのBSAを加え、プレートシェーカーを使用して穏やかに振盪することによってタンパク質ブロックを実行します。
- タンパク質遮断後、ブロッキング溶液をPBSTで1%BSAで希釈した一次抗体に置き換え、一晩穏やかな揺れで4°Cでインキュベートします。
注:タンパク質ブロックと抗体の添加の間で洗浄しないでください。 - 24時間後、PBSTで3倍の井戸を洗浄します。
- 2次抗体をPBSTに1%BSAに添加します。穏やかな揺れで暗闇の中でRTで1時間インキュベート。
- 二次抗体インキュベーション後、1x DPBSでウェル3xを洗浄し、穏やかな揺れで暗闇の中でRTで10分間のメーカーの指示に従ってHoechst染色剤を分配します。
- 1x DPBSで3倍洗います。プレートはイメージングの準備が整いました。
メモ:イメージが作成されるまで暗闇の中で4°Cでプレートを保管してください。 - 免疫検査後の高含有イメージング顕微鏡を用いてマルチウェルプレートを画像化する。ウェルの真の表現を得るためには、いくつかの視野の画像取得が推奨される。異なるマーカーの発現は、市販ソフトウェアを用いた細胞セグメンテーション解析(表図)を用いて評価した( 図1)。
注: CellProfiler やフィジー20,21などの画像解析オープンソースソフトウェアを使用してセルセグメンテーションを実行することもできます。
結果
hESC(H9)とhiPSC(P106)の両方のラインからの肝前駆体分化は、図2に記載されたステップワイズプロトコルに従って行った。ここで、多能性幹細胞は、分化開始前に単一細胞としてLN-521コーティングプレートに播種した。細胞の合流性は、堅牢で再現性の高い分化の鍵となります。適切な合流性が達成されると(図2)、分化が開始された。5日目に、決定的なエンドオダーム仕様をSox17式で評価した。両方の細胞株において、Sox17はH9およびP1 ±06に対してそれぞれ0.5%および87.8%±0.5%のSEMで80%、87.8%で高発現した(図3)。10日目に、肝前駆物質は石畳のような形態を示した(図2)。また、肝前駆体の仕様は、HNF4α、AFP、ALB、およびサイトケラチン-19(CK19)発現、ならびにAFPおよびALBタンパク質分泌10、15、22(図4)について評価した。H9およびP106肝前駆物質培養物はいずれも、HNF4α(91%±0.5%、90%±0.2%)、AFP(89.7%±1.8%、1.2%±86%)、CK19(78.5%±3.2%、83.6±%)を示した。AFP の分泌は、10 日目に両方の細胞株で検出されました (32.4 ± 1.6 および 47.8 ± 5.9 ng/mL/mg/24 h) (図 5)。アルブミン合成は、より低いレベル(30.7%±1.8%および27.2%±1.1%)で観察され、ELISA(図5)を介して検出されなかった。
このプロトコルは、24ウェルから96ウェルプレートまでの肝前駆物質の標準化された生産を可能にした。半自動化されたパイプラインは、前述の17のようにH9およびP106細胞株から96の肝前駆細胞の井戸プレートを製造するために採用された。HNF4α発現の定量化を通じて細胞数変動性及び肝前駆腫分化効率を評価した。高含有イメージング装置を用いた免疫蛍光によるタンパク質定量に対して細胞セグメンテーションを行った(図1)。10日目の肝前駆細胞は、P106のH9および97%HNF4α陽性細胞に対して1ウェル当たり>94%のHNF4α陽性細胞を有する行間で有意な変動性を示さなかった(図6)。

図1:細胞セグメンテーションパイプラインの概要(A)元の画像を用いて、核のセグメンテーションに用いた核染色法を用いた。(C)形状と大きさに基づく核セグメンテーション品質管理ステップを、明確にセグメント化された核のみを定量化するために実施した。(D)これに続いて、正のHNF4α染色された核を定量した。(E)最後に、HNF4α発現細胞を同定するために強度ベースの閾値を採用した。CおよびEにおいて、緑色核は選択された細胞を表し、マゼンタ核は廃棄された細胞を示す。スケールバー= 50 μm.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:肝前駆子のhPSCからの分 化(A)肝前駆物質分化プロトコルの概略的表現(B) 分化中の形態学的変化を強調する代表的な画像。0日目(D0)では、hPSCは細胞のパックされた単層を提示した。これに続いて、hPSCは5日目(D5)に決定的な内胚葉にプライミングされました。その後、10日目に肝前駆物質分化(D10)が続いた。肝前駆物質は石畳のような細胞形態を示した。 スケールバー= 75 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
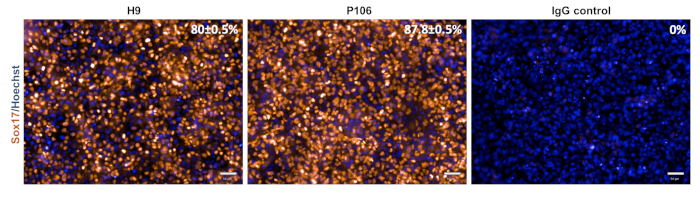
図3:決定的なエンドオダーム仕様の特性5日目に、細胞をSox17、決定的な内胚葉マーカーについて染色した。Sox17陽性細胞の割合は、H9では80±0.5%、P106では87.8±0.5%であった。パーセント定量は、井戸あたり6つの視野を持つ10の別々のウェルに基づいていました。データはSEMの平均±スケールバー= 50 μmとして表示されます。

図4: 肝前駆子の特徴付け10日目に、肝前駆物質(A)HNF4α、(B)AFP、および(C)ALBについて肝前駆物質を染色した。H9の場合、陽性細胞の割合は、HNF4α、AFP、ALBの±91%±0.4%、89.7%±1.8%、30.7%±1.8%であった。P106の場合、陽性細胞の割合は、HNF4α、AFP、ALBに対してそれぞれ90%±0.2%、+/- 1.2%、27.2%±1.1%であった。(D) 胆管球系統電位はCK19発現を介して評価された。H9由来肝前駆物質は、CK19陽性細胞±78.5%±、CK19陽性細胞の83.6%±1.8%がP106肝前駆細胞に対して観察された。免疫グロブリンG(IgG)染色は染色制御として用いた。パーセント定量は、井戸あたり6つの視野を持つ10の別々のウェルに基づいていました。データはSEMの平均±スケールバー= 50 μmとして表示されます。

図5:肝前駆物質タンパク質分泌解析 アルファフェトプロテイン(AFP)とアルブミン(ALB)の分泌は、H9およびP109の10日目に肝前駆体培養物で分析された。データは3つの生物学的複製を表し、誤差バーはSDを表す。ND = 検出されませんでした。 この図の大きなバージョンを表示するには、ここをクリックしてください。
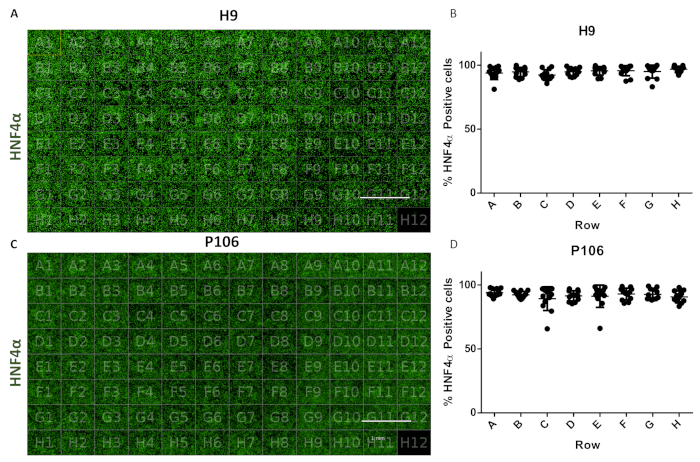
図6: 96ウェルプレートにおけるウェルウェル変動の評価(A)HNF4αで染色したH9由来肝前駆物質の96ウェルプレート図の可視化。(B)HNF4α陽性細胞の定量化。適切に定量化された 6 つの視野からの、行のウェルあたりのセル数の平均。プレート全体の平均細胞数は、1ウェル当たり0.22SEM HNF4α陽性細胞±94.81%であった。ウェル間に統計的に有意な差は認められない。(C)HNF4αで染色したP106由来肝前駆物質の96ウェルプレート図の可視化(D)HNF4α陽性細胞の定量化。行のウェルあたりの平均セル数は、ウェルあたり6つの視野から、定量化された。プレート全体の平均細胞数は、ウェル当たり0.57SEM HNF4α陽性細胞±97.7%であった。行間に統計的に有意な差は認められない。ウェルH12は免疫グロブリンG(IgG)染色制御として使用した。スケールバー= 1 mmTukeyのポストホック統計テストを用いた一方のANOVAが採用されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
| プレート形式 | 表面積 (cm2) | cm2 あたりのセル数 | ウェルあたりの合計セル数 | 分配量(mL) | 細胞濃度(細胞/ml) |
| 24ウェルプレート | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| 96ウェルプレート | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
表1:このプロトコルで使用されるhPSCセルラインの異なるプレートフォーマットに推奨されるセル密度。
ディスカッション
大規模に多能性幹細胞からヒト肝前駆細胞を生成することは、死体由来の物質に代わる有望な代替手段を表す可能性がある。プロトコルの標準化と再現性は、バイオメディカル研究における技術翻訳とインパクトを確保するための鍵です。これに対処するために、以前の研究では、定義された添加剤と行列15、23、24、25、26、27、28を使用して、hESCおよびiPSCからの段階的な差別化プロトコルの開発に焦点を当てていました。これを行うことにより、肝細胞表現型と再現性が向上し、分化プロセス19の半自動化が可能となった。提供されるシステムは、既製の細胞培養培地および容易な肝細胞分化システムとの組み合わせによって強化される。
以前は、分化プロトコルの開始前に多能性細胞密度が肝前駆細胞26の均質集団を達成するための重要な変数として強調された。このより洗練された手順を用いて、開始細胞密度の範囲を用いて段階的に多数の幹細胞由来肝前駆細胞を生成することができる(表1)。5日目に、Sox17染色法により決定的な内胚誘発が検証された(図3)。試験したESCとiPSCの両方のラインで、80%以上がSox17を発現することで、決定的な内胚葉への効率的かつ堅牢な分化が達成されました(図3)。10日目には、肝前駆物質は均一な石畳様の形態を示し、肝幹細胞マーカーはAFPとHNF4αの両方に対して高度に濃縮された(>86%、 図4)。手動技術と半自動技術を組み合わせて使用して、複数のプレートフォーマット19で分化を行うことが可能でした。
その現在の形態では、細胞分化は 、インビトロ ベースの実験に適している。しかし、肝前駆物質の均質な集団が送達のために準備されるようにするために、臨床応用の前に細胞濃縮が必要になる可能性が高い。
結論として、ここで説明するプロトコルは、大規模に肝前駆物質を生成するための標準化されたアプローチを分野に提供する。今後の作業は、HLCの分化、成熟、およびメンテナンスのための新しい媒体の生産に焦点を当てます。
開示事項
デビッド・C・ヘイは、ステムノベート株式会社の共同創設者兼株主です。残りの著者は、この記事で議論されている主題または資料に利益相反がないことを証明しています。
謝辞
この研究は、MRC博士研修パートナーシップ(MR/K501293/1)、英国再生医療プラットフォーム(MRC MR/L022974/1およびMR/K026666/1)、チーフサイエンティストオフィス(TCS/16/37)からの賞でサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
参考文献
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved