Method Article
정의된 분화 시스템을 사용하여 만능 줄기 세포에서 간 선조 사양
요약
이 문서의 목표는 만능 줄기 세포로부터 인간 간 선구분화를 유도하는 표준화된 접근법을 제공하는 것입니다. 즉시 사용 가능한 미디어 제형이 있는 이 절차의 개발은 사용자에게 생체 의학 연구 및 번역을 위한 인간 간 세포를 생성하는 촉진 시스템을 제공합니다.
초록
간 질환은 증가하는 글로벌 건강 문제입니다. 간 이식은 치료의 효과적인 모드인 동안, 기증자 기관 가용성에 있는 부족으로 인해 환자 사망률이 증가했습니다. 장기 부족은 또한 기본적인 연구 및 진료소를 위한 인간 간세포의 일상적인 공급에 영향을 미칩니다. 따라서 인간 간 전구 세포의 재생 가능한 소스의 개발이 바람직하며이 연구의 목표입니다. 인간 간 전구를 대규모로 효과적으로 생성및 배치할 수 있도록, 재현가능한 간 선조 분화 시스템이 개발되었다. 이 프로토콜은 다양한 세포 배양기 형식의 사용자 간의 실험 재현성을 돕고 인간 배아 및 유도된 만능 줄기 세포주를 사용하여 분화를 허용합니다. 이들은 기본적인 연구를 강화하고 임상 제품 개발을 향해 길을 열 수 있습니다 현재 분화 시스템에 비해 중요한 장점이다.
서문
간 질환은 전 세계적으로 연간 약 2백만 명의 사망을 초래하는 글로벌 건강 문제를 나타냅니다1. 많은 모델 시스템이 간 질환을 연구하고 임상적으로 개입하기 위해 존재하지만, 세포 기반 시스템의 일상적인 사용은 상당한 단점에 의해 제한됩니다 (검토를 위해 Szkolnicka 외.2참조). 첨단 인간 다능성 줄기세포(hPSC) 배양 및 체세포 분화 방법은 클리닉3,4를위한 분화세포의 기본 생체 의학 연구 및 재생 가능한 공급원을 위한 도구를 개발하는 유망한 기술을 나타낸다.
현재까지, 간세포형 세포(HLC)를 위한 다중 프로토콜이 개발되었다5,6,7,8. 이러한 프로토콜은 작은 분자와 성장 인자의 조합을 사용하여 인간 간 발달의 측면을 재현하려고9,10. 대부분의 프로토콜은 hPSC가 최종 종말에 준비되어 있는 단계별 분화 과정으로 구성되며, 그 다음으로 간 선조 사양11,12,13,HLC 사양으로 끝납니다. 이러한 프로토콜에 의해 생성된 HLCs는 태아와 성인용 표현형의 혼합물을 표시합니다. 여기에는 HNF4α 및 알부민(ALB)과 같은 간세포 마커와 같은 알파 페토프로틴(AFP)의 발현뿐만 아니라 약물 대사용량(14,15,16)이 포함됩니다. 실험실 간에 HLC 분화는 다를 수 있습니다. 따라서 표준화된 프로토콜의 개발이 필요합니다. 이를 통해 연구자들은 기본 및 임상 연구를 위해 줄기 세포 에서 파생된 HLC를 대규모로 효과적으로 생성하고 적용할 수 있습니다.
간 선구분화 시스템은 따르기 쉬운 지침을 사용하여 인간 배아 및 유도된 만능 줄기 세포주 모두에 적용될 수 있는 개발되었다. 이 절차는 세포 배양 플라스크에서 96 개의 웰 플레이트에 이르기까지 다양한 배양기 형식으로 간 선조의 균질한 인구를 산출합니다. 아래 제공된 프로토콜은 줄기 세포 유래 간 선조를 24 및 96 웰 포맷으로 생산하는 프로토콜이다.
아래에 제시된 프로토콜에 사용되는 세포 밀도는 각각 24 및 96 웰 플레이트의 한 웰에 대해 지정됩니다(표 1참조). 상이한 세포 배양 플레이트 포맷 및 세포주에 대해 시작 세포 수의 최적화가 요구된다. 프로토콜 최적화를 위한 제안된 시작 세포 밀도는 2 x 105 세포/cm2이다. 밀도 최적화를 위해, 한 번에 50,000개의 세포/cm2를 ± 추가하여 여러 세포 밀도를 테스트할 수 있습니다.
프로토콜
1. 라미닌-521에 인간 다능성 줄기 세포 (hPSC) 유지 보수
- 인간 다능성 세포(hPSC)를 라미닌-521(LN-521)에 6웰 플레이트에서 37°C 및 5%CO2로 유지한다. 줄기세포 유지보수 배지(즉, mTeSR1 배지)의 2mL로 매일 세포를 공급하여 6웰 플레이트당 분화를 위해 선택한 종자일(일 0)까지 공급한다.
- 세포 수확 전에 70-80%의 원하는 세포 합류가 달성되는지 확인하십시오.
2. 라민-521 멀티웰 준비 및 차별화를 위한 hPSC 시드
참고: HPSC의 경우 LN-521(예를 들어, 마트리겔 또는 섬유네틴)에 유지되지 않는 hPSC를 LN-521및 문화로 분할하여 1주 동안 의공정의효율을 향상시키기 위해 월화 및 분화를 유도한다15,17,18.
- 라미닌 코팅 플레이트 준비
- 재조합 LN-521(100 μg/mL)의 바이알을 4°C에서 2시간 또는 하룻밤 동안 해동한다.
- Ca2+/Mg2 +얼음 차가운 1x DPBS에서 해동 된 LN-521을 희석하여 8 μg / mL 솔루션을 준비하십시오.
- 8 μg/mL LN-521 용액의 0.25mL을 24웰 플레이트 또는 0.05 mL의 각 웰에 96웰 플레이트의 각 웰에 추가합니다. LN-521 용액으로 접시를 좌우로 부드럽게 흔들어 우물을 고르게 코팅합니다.
참고: 96웰 플레이트 형식의 경우, 반자동 파이프라인을 사용하여 볼륨 디스펜싱, 셀 파싱 및 중간 변화를 수행할 수 있습니다. 자세한 내용은 메세게르 리폴스 외19를참조하십시오. - LN-521 코팅 플레이트를 반투명하고 유연한 필름으로 밀봉하고 사용하기 전에 밤새 4 °C에 보관하십시오.
참고: LN-521 코팅 플레이트는 4°C에 보관할 때 최대 2주 동안 사용할 수 있습니다. 라미닌 코팅 된 우물의 건조를 피하십시오.
- 세포 파종 당일, 30-60분 동안 37°C에서 세포 배양 배양에서 미리 코팅된 플레이트를 예열한다.
- LN-521 솔루션을 흡인합니다.
참고: LN-521 코팅의 손상을 방지하기 위해 우물 바닥과 흡인기의 직접적인 접촉을 피하십시오. - 줄기세포 유지보수 배지0.5mL을 새로 보충하여 10μM Rho 관련 키나아제(ROCK) 억제제 Y27632를 각각 24웰 플레이트 또는 0.05mL의 각 웰에 96웰 플레이트의 각 웰에 분배한다. 세포 시드를 준비할 때까지 접시를 인큐베이터에 놓습니다.
- 예정된 시드일(0일)과 70~80%의 hPSC 합류로, 6웰 플레이트의 우물 바닥에 자발적인 분화 부위를 표시한다.
참고: 자연분화는 위상 조영 현미경을 사용하여 세포 크기 및/또는 상이 다른 세포 형태학의 존재에 있는 총 변화에 의해 시각화될 수 있습니다. - 흡인 및 차별화의 표시된 영역과 우물에서 소비 된 매체를 폐기합니다. 실온(RT)에서 Ca2+/Mg2+ 없이 DPBS 1mL로 각각 잘 씻으십시오.
- 효소가 없는 해리 시약 1mL(재료 표참조)를 각 우물에 넣고 37°C에서 8-10분 동안 배양하여 세포가 플레이트에서 눈에 띄게 분리될 때까지 배양합니다.
- 셀 스크레이퍼를 사용하여 우물에서 세포를 부드럽게 분리합니다. P1000 파이펫으로 각 웰의 내용내용이 2-4배 위아래로 피펫되어 단일 셀 서스펜션을 생성합니다. 각 세포주에 대해, 모든 유지 보수 우물에서 멸균 50 mL 튜브로 풀 셀.
- 줄기 세포 유지 보수 매체의 1 mL로 비워 각 세척. 적절한 세포주로부터 풀링된 세포를 포함하는 해당 튜브에 세체를 추가합니다.
- 각 세포주에 대해 풀로 풀린 샘플에서 3개의 실행 가능한 셀 카운트를 수행합니다. 각 세포주에 대한 평균 라이브 셀 수(라이브 셀/mL)를 계산합니다.
- 원심분리기는 RT에서 5분 동안 250 x g의 풀이 된 샘플을 흡인한 다음, 10 μM ROCK 억제제 Y27632로 새롭게 보충된 RT 줄기 세포 유지 보수 매체의 1-3mL에서 세포 펠릿을 재연합니다.
- 각 세포주에 대해, 2.4 단계에서 준비된 우물수당 필요한 셀 수를 계산한다(표 1참조). 10 μM ROCK 억제제 Y27632로 새롭게 보충된 줄기 세포 유지 보수 매체로 필요한 세포 번호를 다시 중단합니다.
- 이전에 추가된 볼륨을 제거하지 않고 2.4 단계에서 준비된 미리 코팅된 플레이트의 우물에 계산된 볼륨(들)을 추가합니다. 웰당 총 부피는 24웰 플레이트의 경우 1mL, 96웰 플레이트의 경우 0.1mL입니다. 접시를 좌우로 앞뒤로 부드럽게 흔들어 우물 전체에 세포 분산도 보장합니다.
참고: 우물 을 가로지르는 균등한 세포 분포는 균질성 세포 파종과 성공적인 분화를 보장하는 열쇠입니다. - 시드 플레이트를 인큐베이터에 넣고 시드 플레이트를 앞뒤로 부드럽게 흔들어 세포를 균등하게 분배하고 37°C 및 5% CO2에서배양을 유지한다.
3. 라미닌-521에 간 선조에 hPSC를 차별화
- 올바른 첨가물로 보충된 Endoderm 기저매체를 사용하여 최종 엔도름 유도(1단계)를 위한 미디어를 준비한다.
- 0일째에는 엔도름 기저형의 병을 4°C에서 하룻밤 동안 해동한다.
- 필요에 따라 1단계 중간 1단계(1일째 에 사용)를 준비합니다.
- 해동 보충 MR 및 얼음에 보충 CJ.
- 희석 보충 MR 및 보충 CJ 1:100 엔도름 기초 매체에.
- 필요에 따라 2-4일에 사용할 수 있는 1단계 중간 2단계를 준비합니다.
- 희석 보충 CJ 1:100 엔도름 기초 매체에.
- 후속 간 선조 세포 사양(2단계) 분화를 위한 배지를 준비하여 간 선조 배지를 이용하여 한다.
- 4일째에는 4°C에서 하룻밤 사이에 선조중의 병을 해동한다.
참고: 1% 페니실린/연쇄절제술(IU/mL 100μg/mL의 최종 농도)이 이 실험에 사용되었다. 항생제는 필요하지 않습니다; 항생제 사용은 사용자 재량에 따라 사용됩니다.
- 4일째에는 4°C에서 하룻밤 사이에 선조중의 병을 해동한다.
- 분화 첫날, 웰에서 10 μM ROCKi Y-27632 배지로 소비된 줄기세포 유지 보수 매체를 제거하고, 웰당 24개의 웰 플레이트당 0.5mL, 96웰 플레이트당 0.1mL로 대체한다.
- 2일, 3일, 4일에는, 소비된 매체를 제거하고 96웰 플레이트당 24웰 플레이트 또는 0.1mL당 잘 1단계 중간 2의 0.5mL로 각각 잘 공급한다.
- 5일째에, 면역 세포화학을 통한 최종 내분분 분석에 대한 우물을 수정한다. 나머지 우물의 경우, 소비된 배지를 제거하고 각각 0.5mL의 간 선조 분화 배지를 잘 공급하여 24웰 플레이트 또는 96웰 플레이트당 0.1mL에 대해 잘 한다. 6일, 7일, 9일에 다시 배지를 새로 고칩니다.
- 10일째에, 간 선조 분화 분석을 위한 우물을 수확하거나 추가 간세포 와 같은 세포 분화를 진행한다.
참고: 이 시점에서, 시료는 면역세포화학 분석을 위한 4% 파라포름알데히드(PFA)로 고정되거나, 엘리사및 세포를 위해 수집된 수퍼나일제는 단백질 정량화를 위해 수집되었다.
4. 라미닌-521에 hPSC에서 생성된 간 선조 분화 배양의 특성화
- 5일째에 면역스테인링을 사용하여 최종 엔도름 특이적 마커의 발현을 감지합니다.
- 10일째에 면역염색을 사용하여 간 선조 특이적 마커의 발현을 감지한다.
- 10일, 제조사의 지시에 따른 키트를 사용하여 ELISA를 통한 AFP 및 ALB 분비를 측정하고, 비신천산(BCA) 단백질 분석서에 의해 결정된 대로 mg 단백질당 정상화한다.
- 잘 결합된 HNF4α 양성세포의 백분율을 정량화하여 96웰 플레이트의 간 전구 가변성을 평가한다.
5. 면역 세포 화학 및 이미지 수집
- 5일과 10일, 1x DPBS로 3배, 웰당 0.5mL, 웰당 0.1mL로 96웰 플레이트. RT에서 2-5 분 동안 부드러운 흔들림으로 접시를 배양하십시오.
참고: 면역 세포화학에 대해 Ca2+/Mg2+ 없이 DPSB를 사용하십시오. - 15-30분 동안 RT에서 4%의 파라포름알데히드(PFA)로 세포를 고정하여 우물당 0.3mL의 PFA를 24웰 플레이트에 추가하고 96웰 플레이트당 0.1mL를 첨가한다.
- 5.1 단계에서 설명한 대로 1x DPBS로 3배 세척합니다.
- PBST로 멤브레인을 0.1% Tween, 1x DPBS를 사용하여 멤브레인을 20분 동안 배양하고, 96웰 플레이트당 24개의 웰 플레이트당 PBST0.3mL, 0.1mL를 추가하여 RT에서 20분 동안 배양합니다.
- 1 시간 동안 PBST에서 10% BSA로 세포를 배양하고, 우물당 0.3mL의 BSA를 추가하고 96웰 플레이트당 BSA의 0.1mL을 추가하여 플레이트 셰이커를 사용하여 부드럽게 흔들어 줍니다.
- 단백질 차단 후, 차단 용액을 PBST에서 1% BSA로 희석된 1차 항체로 대체하고 4°C에서 하룻밤 동안 부드러운 흔들림으로 배양한다.
참고: 단백질 블록과 항체 첨가 사이에 세척하지 마십시오. - 24 시간 후, PBST와 함께 3 배 우물을 씻으라.
- PBST에서 1% BSA에 이차 항체를 추가합니다. 부드러운 흔들림으로 어둠 속에서 RT에서 1 h를 배양하십시오.
- 이차 항체 인큐베이션 후, 1x DPBS로 우물 3배를 씻고, 부드러운 흔들림으로 어둠 속에서 RT에서 10분 동안 제조업체의 지시에 따라 Hoechst 얼룩을 분배하십시오.
- 1x DPBS로 3배 세척합니다. 플레이트는 이제 이미징을 할 준비가 되었습니다.
참고: 이미징까지 어두운 4°C에 접시를 저장합니다. - 면역 조직 화학 후 고함량 이미징 현미경을 사용하여 다중웰 플레이트를 이미지합니다. 여러 뷰 필드의 이미지 수집은 우물의 진정한 표현을 얻는 것이 좋습니다. 상이한 마커의 발현은 상용 소프트웨어를 이용한 세포 세분화 분석을 통해 평가하였다(재료표참조)(도 1).
참고: 셀 프로파일러 또는 피지20,21과같은 이미지 분석 오픈 소스 소프트웨어를 사용하여 셀 세분화도 수행할 수 있다.
결과
hESC(H9) 및 hiPSC(P106) 라인에서 간 선조 분화는 도 2에기재된 단계별 프로토콜에 따라 수행되었다. 여기서, 만능 줄기 세포는 분화의 개시 전에 LN-521 코팅 판으로 단하나 세포로 종자하였다. 세포 합류는 견고하고 재현 가능한 분화를 위한 핵심입니다. 일단 올바른 합류가 달성되면(그림 2),차별화가 시작되었다. 5일째에, 최종 엔도름 사양은 Sox17 발현을 통해 평가되었다. 두 세포주에서 Sox17은 H9 및 P106에 대해 Sox17 양성 세포의 0.5%± 0.5%와 87.8%로 각각 80%± 높게나타났다(그림 3). 10일째에, 간 선조는 조약돌 같이 모양체를 표시했습니다(그림 2). 또한, 간 선조 사양은 HNF4α, AFP, ALB 및 사이토케라틴-19(CK19) 발현뿐만 아니라 AFP 및 ALB 단백질 분비10,15,22(도 4)에대해 평가되었다. H9과 P106 간 배구모두 HNF4α(91% ± 0.5%, ± 0.2%), AFP(89.7% ± 1.8%, ± 1.2%), CK19(78.5%± 3.2%, 83.6%)±.8%)과 같은 태아간 마커를나타냈다. AFP 분비액은 10일째 에 두 세포주(32.4± 1.6 및 47.8 ± 5.9 ng/mL/mg/24h)에서 검출되었다(그림5). 알부민 합성은 낮은 수준(30.7% ± 1.8%, 27.2% ± 1.1%)으로 관찰되었으며ELISA(그림4)를통해 검출되지 않았다.
이 프로토콜은 24웰에서 96개의 웰 플레이트까지 간 선조의 표준화된 생산을 허용했습니다. 반자동 파이프라인은 H9 및 P106 세포주로부터 96개의 잘 플레이트를 생산하기 위해 이전에 설명된17과같이 사용되었다. 세포 수 가변성 및 간 선조 분화 효율은 HNF4α 발현의 정량화를 통해 평가되었다. 세포 세분화는 고함량 이미징기기(도 1)를이용하여 면역형광을 통한 단백질 정량화를 위해 수행되었다. 10일째에, 간 선조들은 H9에 대해 HNF4α 양성세포의 94% >94%, P106에 대한 HNF4α 양성세포 97%를 가진 행에 걸쳐 유의한 가변성을 나타내지않았다(그림 6).

도 1: 세포 세분화 파이프라인 개요. (A)원이미지를 사용하여(B)핵 염색이 핵 분할에 사용되었다. (C)형상 및 크기에 기초한 핵 세분화 품질 관리 단계는 명확하게 분할된 핵을 정량화하기 위해 수행되었다. (D)이에 따라 양성 HNF4α-스테인드 핵을 정량화하였다. (E)마지막으로, 강도 기반 임계값은 HNF4α-발현 세포를 식별하기 위해 사용되었다. C와 E에서,녹색 핵은 선택된 세포를 나타내고 마젠타 핵은 버려진 세포를 나타낸다. 스케일 바 = 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: hPSC로부터의 간 선조 분화. (A)간 선구 분화 프로토콜의 회로도 표현. (B)분화 시 형태학적 변화를 강조하는 대표적인 이미지. 0일째(D0)에서 hPSC는 셀의 포장된 단층층을 제시했습니다. 이에 따라 hPSC는 5일째(D5)에 최종 엔도드름으로 준비되었습니다. 이것은 10일째 (D10)에 간 선조 분화에 선행되었습니다. 간 선조는 조약돌 같은 세포 형태를표시했다. 스케일 바 = 75 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
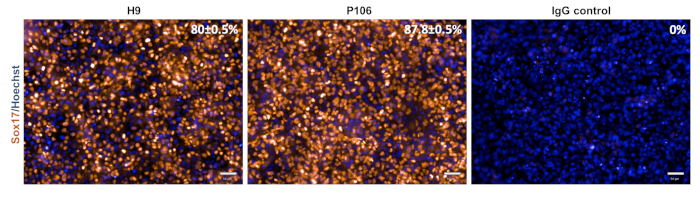
그림 3: 최종 엔데덤 사양의 특성화. 5일째에, 세포는 Sox17, 결정적인 엔도드름 마커를 위해 염색되었습니다. Sox17 양성 세포의 비율은 80 ± H9에 대 한 0.5% 및 87.8 p106에 대 한 0.5%±. 백분율 정량화는 10개의 개별 우물을 기반으로 하며, 6개의 필드가 잘 볼 수 있습니다. 데이터는 평균 ± SEM. Scale 막대 = 50 μm로 표시됩니다.

그림 4: 간 선조 특성. 10일째에, 간 선조들은 간마커(A)HNF4α,(B)AFP 및(C)ALB를 위해 염색되었다. H9의 경우, 양성세포의 비율은 각각 91%, ± 0.4%, 89.7%± 1.8%, 30.7%로 HNF4α, AFP, ALB의 경우 각각 1.8%±. P106의 경우, 양성 세포의 비율은 각각 HNF4α, AFP 및 ALB에 ± 대해 각각 0.2%, 86% +/- 1.2%, 27.2%± 90%였다. (D)Cholangiocyte 계보 잠재력은 CK19 발현을 통해 평가되었다; H9 유래 간 선조는 3.2% CK19 양성 세포를 ± 78.5%를 표현한 반면, 83.6%는 CK19 양성 세포의 ± 1.8%가 P106 간 선조인을 관찰하였다. 면역글로불린 G(IgG) 염색은 염색 제어로서 사용하였다. 백분율 정량화는 10개의 개별 우물을 기반으로 하며, 6개의 필드가 잘 볼 수 있습니다. 데이터는 평균 ± SEM. Scale 막대 = 50 μm로 표시됩니다.

그림 5: 간 선조 단백질 분비 분석. 알파 페토프로틴(AFP)과 알부민(ALB)의 분비액은 H9과 P109에서 10일째에 간 선조 배양에서 분석되었다. 데이터는 3개의 생물학적 복제를 나타내고 오류 바는 SD를 나타내고, 분비단백질은 단백질의 mg당 mL당 분비 단백질의 나노그램으로서 24h 배양 배지로부터 정량화되었다, n = 3; ND = 감지되지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
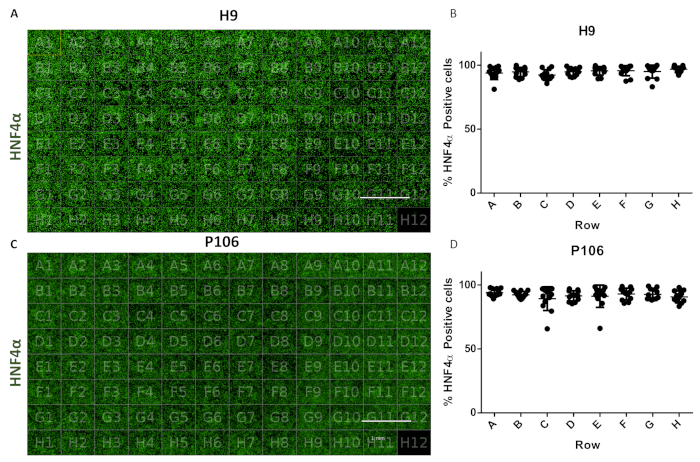
그림 6: 96 웰 플레이트에서 잘 가변성 평가. (A)HNF4α로 염색된 H9 유래 간 선조의 96웰 플레이트 뷰의 시각화. (b)HNF4α 양성 세포의 정량화. 잘 정량화 당 보기의 여섯 필드에서 행에서 잘 당 셀 수의 평균. 플레이트 전체의 평균 세포 수는 94.81%± 0.22 SEM HNF4α-양수 세포당 양수였다. 우물 사이에통계적으로 유의한 차이는 관찰되지 않았다. (C)HNF4α로 염색된 P106 유래 간 선조의 96웰 플레이트 뷰의 시각화. (D)HNF4α 양성 세포의 정량화. 우물당 평균 셀 수( 잘 및 정량화된 6개의 시야 필드)에서 행의 평균 셀 수입니다. 플레이트 전체의 평균 세포 수는 97.7%± 0.57 SEM HNF4α-양수 세포당 양수였다. 행 간에 통계적으로 유의한 차이가 관찰되지 않았습니다. 웰 H12는 면역글로불린 G(IgG) 염색 제어로 사용되었다. 스케일 바 = 1mm. 투키의 포스트 혹 이후 통계 시험을 통해 일방적인 ANOVA가 채택되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 플레이트 형식 | 표면적(cm2) | cm2당 세포 | 우물당 총 세포 | 디스펜싱 볼륨(mL) | 세포 농도(세포/ml) |
| 24웰 플레이트 | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| 96웰 플레이트 | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
표 1: 이 프로토콜에 사용되는 hPSC 세포주상이 다른 플레이트 포맷에 대해 권장되는 세포 밀도.
토론
대규모로 만능 줄기 세포로부터 인간 간 전구 세포의 생성은 시체 유래 물질에 대한 유망한 대안을 나타낼 수 있습니다. 프로토콜 표준화 및 재현성은 생체 의학 연구에 대한 기술 번역 및 영향을 보장하는 데 핵심적입니다. 이를 해결하기 위해, 이전 작품은 정의된 첨가제 및 매트릭스 15,23,24,25,26,27,28을사용하여 hESC 및 iPSC로부터 단계적 차별화 프로토콜을 개발하는 데주력하고 있다. 이를 통해, 간세포 표현형 및 재현성이 개선되어 분화공정(19)의반자동화를 허용한다. 제시된 시스템은 기성 세포 배양 매체 및 촉진 간세포 분화 시스템과의 조합으로 강화됩니다.
이전에는 분화 프로토콜이 시작되기 전에 만능 세포 밀도가 간 선조 세포의 균질한 집단을 달성하기 위한 핵심 변수로강조되었다(26). 이러한 보다 정제된 절차를 이용하여, 다양한 세포밀도(표 1)를이용하여 단계적으로 줄기세포 유래 간 전구체를 단계적으로 생성할 수 있다. 5일째, 최종 엔도름 유도는 Sox17염색(도 3)에의해 검증되었다. 최종 엔도름으로 효율적이고 견고한 분화는 테스트된 ESC 및 iPSC 라인 모두에서 달성되었으며, 80% 이상이 Sox17(그림3)을발현했습니다. 10일째에, 간 선조들은 균일한 조약돌 같이 형태를 보였고, 간 줄기세포 마커는 AFP와 HNF4α(>86%, 도 4)에대해 높게 농축되었다. 수동 및 반자동 기술의 조합을 사용하여 다중 플레이트포맷(19)에서차별화를 수행할 수 있었다.
현재 의 형태로, 세포 분화는 시험관 내 실험에 적합합니다. 그러나, 세포 농축은 간 선조의 균질한 인구가 납품을 위해 준비된다는 것을 확인하기 위하여 임상 신청 의 앞에 요구될 것입니다.
결론적으로, 여기서 설명된 프로토콜은 대규모로 간 선조를 생성하는 표준화된 접근법을 필드에 제공한다. 향후 작업은 후속 HLC 차별화, 성숙 및 유지 보수를 위한 새로운 매체의 생산에 초점을 맞출 것입니다.
공개
데이비드 C. 헤이는 스템노바테 주식회사의 공동 창립자이자 주주입니다. 나머지 저자는 이 문서에서 논의된 주제나 자료에 대한 이해상충이 없음을 증명합니다.
감사의 말
이 연구는 MRC 박사 훈련 파트너십 (MR /K501293/1), 영국 재생 의학 플랫폼 (MRC MR /L022974/1 및 MR/K02666/1), 수석 과학자 사무소 (TCS/16/37)의 수상으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
참고문헌
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유