Method Article
Specifica del progenitore epatico da cellule staminali pluripotenti utilizzando un sistema di differenziazione definito
In questo articolo
Riepilogo
L'obiettivo di questo articolo è quello di fornire un approccio standardizzato per indurre la differenziazione del progenitore epatico umano dalle cellule staminali pluripotenti. Lo sviluppo di questa procedura con formulazioni di media pronti all'uso offre all'utente un sistema facile per generare cellule epatiche umane per la ricerca e la traduzione biomedica.
Abstract
La malattia del fegato è un problema di salute globale in aumento. Mentre il trapianto di fegato è una modalità efficace di terapia, la mortalità dei pazienti è aumentata a causa della carenza di disponibilità di organi donatori. La scarsità di organi influisce anche sulla fornitura di routine di epatociti umani per la ricerca di base e la clinica. Pertanto, lo sviluppo di fonti rinnovabili di cellule progenitrici del fegato umano è auspicabile ed è l'obiettivo di questo studio. Per essere in grado di generare e distribuire efficacemente progenitori epatici umani su larga scala, è stato sviluppato un sistema di differenziazione dei progenitori epatici riproducibili. Questo protocollo aiuta la riproducibilità sperimentale tra gli utenti in una gamma di formati di coltura cellulare e consente differenziazioni utilizzando linee di cellule staminali embrionali umane e pluripotenti indotte. Si tratta di importanti vantaggi rispetto agli attuali sistemi di differenziazione che miglioreranno la ricerca di base e potrebbero aprire la strada allo sviluppo clinico del prodotto.
Introduzione
Le malattie del fegato rappresentano una sfida per la salute globale, causando circa 2 milioni di morti all'anno in tutto il mondo1. Sebbene esistano numerosi sistemi modello per studiare le malattie epatiche e intervenire clinicamente, l'uso di routine dei sistemi basati su cellule è limitato da inconvenienti significativi (per una revisione vedi Szkolnicka et al.2). La coltura avanzata di cellule staminali pluripotenti umane (hPSC) e i metodi di differenziazione delle cellule somatiche rappresentano tecnologie promettenti per sviluppare strumenti per la ricerca biomedica di base e fonti rinnovabili di cellule differenziate per la clinica3,4.
Ad oggi, sono stati sviluppati protocolli multipli per la differenziazione delle cellule epatocitarie (HLC)5,6,7,8. Questi protocolli tentano di ricreare aspetti dello sviluppo del fegato umano utilizzando una combinazione di piccole molecole e fattori dicrescita 9,10. La maggior parte dei protocolli consiste in un processo di differenziazione graduale, in cui le hPSC sono innescate all'endoderma definitivo, seguito dalla specifica progenitriceepatica 11,12,13e termina con la specifica HLC. Gli HLC prodotti da questi protocolli mostrano una miscela di fenotipi fetali e adulti. Ciò include l'espressione di alfa fetoproteina (AFP), come i marcatori epatocitici come HNF4α e albumina (ALB), nonché la capacità di metabolizzare i farmaci14,15,16. Tra i laboratori, la differenziazione HLC può variare; pertanto, è necessario lo sviluppo di protocolli standardizzati. Ciò consentirà ai ricercatori di generare e applicare efficacemente HLC derivati da cellule staminali su larga scala per la ricerca di base e clinica.
È stato sviluppato un sistema di differenziazione progenitrice epatica che può essere applicato sia a linee di cellule staminali embrionali umane che a linee di cellule staminali pluripotenti indotte utilizzando linee guida facili da seguire. Questa procedura produce popolazioni omogenee di progenitori epatici in vari formati di coltura, che vanno dai palloni di coltura cellulare a 96 piastre di pozzo. Di seguito è riportato il protocollo per produrre progenitori epatici derivati da cellule staminali in formati di pozzo 24 e 96.
La densità cellulare utilizzata nel protocollo presentato di seguito è specificata per un pozzetti di una piastra da 24 e 96 pozzetti rispettivamente (vedere Tabella 1). L'ottimizzazione del numero di cellule di partenza è necessaria per i diversi formati di piastre di coltura cellulare e linee cellulari. La densità della cella iniziale suggerita per l'ottimizzazione del protocollo è 2 x10 5 celle/ cm2. Per l'ottimizzazione della densità, è possibile testare diverse densità di cella aggiungendo ± 50.000 celle/cm2 alla volta.
Protocollo
1. Mantenimento delle cellule staminali pluripotenti umane (hPSC) sulla laminina-521
- Mantenere le cellule pluripotenti umane (hPSC) a 37 °C e al 5% di CO2 in una piastra a 6 pozzetti sulla laminina-521 (LN-521). Nutrire le cellule ogni giorno con 2 mL di mezzo di mantenimento delle cellule staminali (cioè mTeSR1 medium) per pozzetti di una piastra di 6 pozzetti fino al giorno di semina scelto per la differenziazione (giorno 0).
- Assicurarsi che la confluenza cellulare desiderata del 70-80% sia raggiunta prima della raccolta delle cellule.
2. Preparazione multiwell Laminin-521 e semina hPSC per la differenziazione
NOTA: Per le hPSC non mantenute su LN-521 (ad esempio, matrigel o fibronectina), dividere le hPSC su LN-521 e la coltura per 1 settimana prima del passaggio e suscitare differenziazione per migliorare l'efficienza del processo15,17,18.
- Preparazione di lastre rivestite di laminina
- Scongelare un flaconcino di LN-521 ricombinante (100 μg/mL) a 4 °C per 2 ore o durante la notte.
- Preparare una soluzione da 8 μg/mL diluendo l'LN-521 scongelato in 1x DPBS ghiacciato con Ca2+/Mg2+.
- Aggiungere 0,25 mL della soluzione LN-521 da 8 μg/mL a ciascun pozzetti di una piastra da 24 pozzetti o 0,05 mL a ciascun pozzetti di una piastra da 96 pozzetti. Scuotere delicatamente la piastra da un lato all'altro per rivestire uniformemente i pozzi con la soluzione LN-521.
NOTA: per il formato a piastra a 96 pozzetti, l'erogazione del volume, la semina delle celle e le modifiche del mezzo possono essere eseguite utilizzando una tubazione semi-automatizzata. Per i dettagli vedi Meseguer-Ripolles et al.19. - Sigillare le piastre rivestite LN-521 con un film flessibile semitrasparente e conservare a 4 °C durante la notte prima dell'uso.
NOTA: le piastre rivestite LN-521 possono essere utilizzate fino a 2 settimane se conservate a 4 °C. Evitare qualsiasi asciugatura dei pozzi rivestiti di laminina.
- Il giorno della semina cellulare, riscaldare le piastre precoate in un incubatore di colture cellulari a 37 °C per 30-60 min.
- Aspirare la soluzione LN-521.
NOTA: Evitare il contatto diretto dell'aspiratore con il fondo del pozzo per evitare danni al rivestimento LN-521. - Erogare 0,5 mL di mezzo di mantenimento delle cellule staminali con l'inibitore Y27632 della chinasi associata rho (ROCK) da 10 μM appena integrato a ciascun pozzetti di una piastra a 24 pozzetti o 0,05 ml a ciascun pozzetti di una piastra da 96 pozzetti. Posizionare la piastra nell'incubatrice fino a quando non è pronta per la semina cellulare.
- Nel giorno di semina programmato (giorno 0) e con una confluenza hPSC compresa tra il 70-80%, contrassegnare eventuali regioni di differenziazione spontanea sul fondo dei pozzetti della piastra a 6 pozzi.
NOTA: La differenziazione spontanea può essere visualizzata da un cambiamento grossolano nella dimensione cellulare e/o dalla presenza di diverse morfologie cellulari utilizzando la microscopia a contrasto di fase. - Aspirare e scartare le regioni marcate di differenziazione e il mezzo speso dai pozzi. Lavare ogni pozzo con 1 mL di DPBS senza Ca2+/ Mg2+ a temperatura ambiente (RT).
- Aggiungere 1 mL di reagente di dissociazione privo di enzimi (vedere Tabella dei materiali)a ciascun pozzo e incubare a 37 °C per 8-10 minuti fino a quando le cellule si staccano visibilmente dalla piastra.
- Utilizzare un raschietto cellulare per staccare delicatamente le cellule dai pozzeli. Pipettare il contenuto di ciascun pozzetta su e giù 2-4 volte con una pipetta P1000 per ottenere una sospensione a cella singola. Per ogni linea cellulare, mettere in comune le celle di tutti i pozzetto di manutenzione in un tubo sterile da 50 ml.
- Lavare bene ogni svuotato con 1 mL del mezzo di mantenimento delle cellule staminali. Aggiungere i lavaggi al tubo corrispondente contenente le celle raggruppate dalla linea cellulare appropriata.
- Per ogni linea cellulare, eseguire tre conteggi cellulari vitali sui campioni raggruppati. Calcolare il conteggio medio delle cellule vive (cellule vive/mL) per ogni linea cellulare.
- Centrifugare i campioni raggruppati a 250 x g per 5 minuti a RT. Aspirare il surnatante, quindi risusemere il pellet cellulare in 1-3 ml di mezzo di mantenimento delle cellule staminali RT, appena integrato con l'inibitore ROCK Y27632 da 10 μM.
- Per ogni linea cellulare, calcolare il numero di celle necessario per il numero di pozzi preparati al punto 2.4 (vedere Tabella 1). Sospendare il numero di cellule richiesto con il mezzo di mantenimento delle cellule staminali appena integrato con l'inibitore ROCK Y27632 da 10 μM.
- Aggiungere i volumi calcolati nei forzi delle piastre preparate e precoate dal passaggio 2.4 senza rimuovere il volume aggiunto in precedenza. Il volume totale per pozzo sarà di 1 mL per una piastra da 24 pozzetti e di 0,1 ml per una piastra da 96 pozzetti. Oscillare delicatamente le piastre da un lato all'altro e avanti e indietro per garantire una dispersione uniforme delle cellule in tutto il pozzo.
NOTA: una distribuzione uniforme delle cellule attraverso il pozzo è la chiave per garantire una semina cellulare omogenea e una differenziazione di successo. - Posizionare le piastre seminate nell'incubatrice e scuotere immediatamente le piastre seminate delicatamente avanti e indietro e da un lato all'altro per distribuire uniformemente le cellule e mantenere le colture a 37 ° C e 5% CO2.
3. Differenziazione delle hPSC con i progenitori epatici sulla laminina-521
- Preparare il mezzo per l'induzione definitiva dell'endoderma (fase 1) utilizzando il mezzo basale Endoderm integrato con gli additivi corretti.
- Il giorno 0, scongelare la bottiglia dell'Endoderm Basal Medium durante la notte a 4 °C.
- Preparare la Fase 1 Media 1 (per l'uso il giorno 1) secondo necessità.
- Supplemento di scongelamento MR e supplemento CJ su ghiaccio.
- Integratore diluito MR e Supplemento CJ 1:100 nel mezzo basale endoderma.
- Preparare la Fase 1 Medium 2 per l'uso nei giorni 2-4, se necessario.
- Integratore diluito CJ 1:100 nel mezzo basale dell'endoderma.
- Preparare il mezzo per la successiva specifica delle cellule progenitrici epatiche (Stadio 2) differenziando il mezzo progenitore epatico.
- Il giorno 4, scongelare la bottiglia del Progenitor Hepatic Medium durante la notte a 4 °C.
NOTA: per questo esperimento è stato utilizzato l'1% di penicillina/streptomicina (concentrazioni finali di 100 UI/mL e 100 μg/mL) Gli antibiotici non sono necessari; l'uso di antibiotici è a discrezione dell'utente.
- Il giorno 4, scongelare la bottiglia del Progenitor Hepatic Medium durante la notte a 4 °C.
- Il giorno 1 della differenziazione, rimuovere il mezzo di mantenimento delle cellule staminali esaurite con 10 μM ROCKi Y-27632 mezzo dai pozzetti e sostituirlo con 0,5 mL di Stadio 1 Medio 1 completo per pozzetti di una piastra da 24 pozzetti e 0,1 mL per pozzetti di una piastra da 96 pozzetti.
- Nei giorni 2, 3 e 4, rimuovere il mezzo esaurito e alimentare ogni pozzetti con 0,5 mL di Stage 1 Medium 2 per pozzetti per una piastra da 24 pozzetti o 0,1 ml per pozzetti di una piastra da 96 pozzetti.
- Il giorno 5, fissare i pozzi per l'analisi definitiva della differenziazione dell'endoderma tramite immunocitochimica. Per i pozzetti rimanenti, rimuovere il mezzo esaurito e alimentare ogni pozzetti con 0,5 mL di mezzo di differenziazione del progenitore epatico per pozzetti per una piastra da 24 pozzetti o 0,1 ml per pozzetti di una piastra da 96 pozzetti. Aggiorna di nuovo il mezzo nei giorni 6, 7 e 9.
- Il giorno 10, raccogliere pozzi per l'analisi della differenziazione del progenitore epatico o procedere con un'ulteriore differenziazione cellulare simile agli epatociti.
NOTA: In questo momento, i campioni sono stati fissati con il 4% di paraformaldeide (PFA) per l'analisi immunocitochimica o è stato raccolto un surnatante per ELISA e le cellule sono state raccolte per la quantificazione delle proteine.
4. Caratterizzazione delle colture di differenziamento progenitore epatico generate da hPSC su laminina-521
- Il giorno 5, rilevare l'espressione di marcatori endodermi specifici definitivi utilizzando l'immuno colorazione.
- Il giorno 10, rilevare l'espressione di marcatori specifici del progenitore epatico utilizzando l'immunostaining.
- Il giorno 10, misurare la secrezione di AFP e ALB tramite ELISA utilizzando un kit seguendo le istruzioni del produttore e normalizzare per mg di proteina come determinato da un test proteico dell'acido bicinchoninico (BCA).
- Valutare la variabilità del progenitore epatico della piastra del pozzo 96 quantificando la percentuale di cellule HNF4α positive per pozzo.
5. Immunocitochimica e acquisizione di immagini
- Nei giorni 5 e 10 della differenziazione, lavare le celle 3x con 1x DPBS, con 0,5 mL per pozzetti di una piastra da 24 pozzetti e 0,1 mL per pozzetti di una piastra da 96 pozzetti. Incubare la piastra con un leggero scuotimento per 2-5 minuti a RT.
NOTA: Utilizzare DPSB senza Ca2+/Mg2+ per l'immunocitochimica. - Fissare le cellule con il 4% di paraformaldeide (PFA) a RT per 15-30 minuti aggiungendo 0,3 ml di PFA per pozzetto per una piastra da 24 pozzetti e 0,1 ml per pozzetto di una piastra da 96 pozzetti.
- Lavare 3x con 1x DPBS come descritto nel passaggio 5.1.
- Permeabilizzare la membrana con PBST usando 0,1% tween, 1x DPBS e incubare per 20 minuti a RT aggiungendo 0,3 mL di PBST per pozzetti di una piastra a 24 pozzetti e 0,1 ml per pozzetti di una piastra da 96 pozzetti.
- Eseguire il blocco proteico incubando le cellule con il 10% di BSA in PBST per 1 ora, aggiungendo 0,3 ml di BSA per pozzetto di una piastra da 24 pozzetti e 0,1 ml di BSA per pozzetto di una piastra da 96 pozzetti, agitando delicatamente usando uno shaker a piastra.
- Dopo il blocco delle proteine, sostituire la soluzione bloccante con l'anticorpo primario diluito in BSA all'1% in PBST e incubare a 4 °C con un leggero scuotimento durante la notte.
NOTA: Non lavare tra blocco proteico e aggiunta di anticorpi. - Dopo 24 ore, lavare i pozzi 3 volte con PBST.
- Aggiungere l'anticorpo secondario in 1% BSA in PBST. Incubare 1 ora a RT al buio con un leggero scuotimento.
- Dopo l'incubazione degli anticorpi secondari, lavare i fori 3x con 1x DPBS ed erogare la macchia di Hoechst secondo le istruzioni del produttore per 10 minuti a RT al buio con un leggero scuotimento.
- Lavare 3x con 1x DPBS. Le lastre sono ora pronte per l'imaging.
NOTA: Conservare le lastre a 4 °C al buio fino all'imaging. - Immagine della piastra multiwell utilizzando un microscopio di imaging ad alto contenuto dopo l'immunoistochimica. Si consiglia l'acquisizione di immagini di diversi campi di vista per ottenere una vera rappresentazione del pozzo. L'espressione dei diversi marcatori è stata valutata tramite analisi di segmentazione cellulare utilizzando software commerciali (vedi Tabella dei materiali)(Figura 1).
NOTA: La segmentazione cellulare può essere eseguita anche utilizzando un software open source di analisi delle immagini come CellProfiler o Fiji20,21.
Risultati
La differenziazione del progenitore epatico da entrambe le linee hESC (H9) e hiPSC (P106) è stata eseguita seguendo il protocollo graduale descritto nella Figura 2. Qui, le cellule staminali pluripotenti sono state seminate come singole cellule in piastre rivestite di LN-521 prima dell'inizio della differenziazione. La confluenza cellulare è la chiave per una differenziazione robusta e riproducibile. Una volta raggiunta la giusta confluenza (Figura 2), è stata avviata la differenziazione. Al giorno 5, la specifica definitiva dell'endoderma è stata valutata tramite l'espressione di Sox17. In entrambe le linee cellulari, Sox17 è stato altamente espresso con l'80% ± lo 0,5% e l'87,8% ± lo 0,5% seM di cellule Sox17-positive per H9 e P106, rispettivamente (Figura 3). Al giorno 10, i progenitori epatici mostravano una morfologia simile a un ciottolo (Figura 2). Inoltre, è stata valutata la specifica del progenitore epatico per l'espressione di HNF4α, AFP, ALB e citocheratina-19 (CK19), nonché per la secrezione di afp e ALB10,15,22 (Figura 4). Entrambe le colture progenitrici epatiche H9 e P106 esprimevano marcatori epatici fetali come HNF4α (91% ± 0,5% e 90% ± 0,2%), AFP (89,7% ± 1,8% e 86% ± 1,2%) e CK19 (78,5% ± 3,2% e 83,6 ± 1,8%) (Figura 4). La secrezione di AFP è stata rilevata al giorno 10 in entrambe le linee cellulari (32,4 ± 1,6 e 47,8 ± 5,9 ng/mL/mg/24 h) (Figura 5). La sintesi dell'albumina è stata osservata a livelli più bassi (30,7% ± 1,8% e 27,2% ± 1,1%) (Figura 4) e non è stata rilevata tramite ELISA (Figura 5).
Il protocollo ha permesso la produzione standardizzata di progenitori epatici da 24 pozzi a 96 piastre di pozzo. Una tubazione semi-automatizzata è stata impiegata per produrre 96 piastre di pozzo di progenitori epatici da linee cellulari H9 e P106 come precedentemente descritto17. La variabilità del numero cellulare e l'efficienza di differenziazione del progenitore epatico sono state valutate attraverso la quantificazione dell'espressione di HNF4α. La segmentazione cellulare è stata eseguita per la quantificazione delle proteine tramite immunofluorescenza utilizzando uno strumento di imaging ad alto contenuto (Figura 1). Al giorno 10, i progenitori epatici non hanno mostrato alcuna variabilità significativa tra le file con >94% delle cellule HNF4α-positive per pozzedo per H9 e il 97% di cellule HNF4α-positive per P106 (Figura 6).

Figura 1: Panoramica della pipeline di segmentazione cellulare. (A) Utilizzando l'immagine originale, (B) la colorazione nucleare è stata utilizzata per la segmentazione dei nuclei. (C) È stata eseguita una fase di controllo della qualità della segmentazione nucleare basata sulla forma e sulle dimensioni per quantificare solo nuclei chiaramente segmentati. (D) A seguito di ciò, sono stati quantificati nuclei positivi colorati con HNF4α. (E) Infine, è stata impiegata una soglia basata sull'intensità per identificare le cellule che esprimono HNF4α. In C ed E, i nuclei verdi rappresentano cellule selezionate e i nuclei magenta indicano le cellule scartate. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Differenziamento del progenitore epatico dalle hPSC. (A) Rappresentazione schematica del protocollo di differenziazione del progenitore epatico. (B) Immagini rappresentative che evidenziano i cambiamenti morfologici durante la differenziazione. Al giorno 0 (D0), le hPSC presentavano un monostrato di cellule imballato. Successivamente, le hPSC sono state innescate in endoderma definitivo il giorno 5 (D5). Questo è stato seguito dalla differenziazione del progenitore epatico il giorno 10 (D10). I progenitori epatici mostravano una morfologia cellulare simile a unciottolo. Barra della scala = 75 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
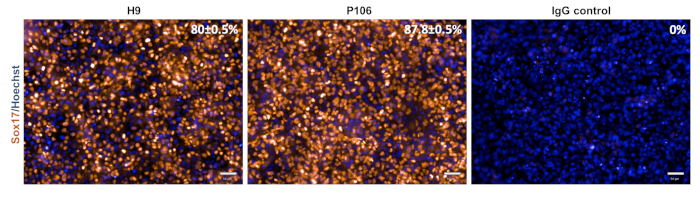
Figura 3: Caratterizzazione della specifica definitiva dell'endoderma. Al giorno 5, le cellule sono state colorate per Sox17, un marcatore endoderma definitivo. La percentuale di cellule Sox17-positive era dell'80± dello 0,5% per H9 e dell'87,8 ± dello 0,5% per P106. La quantificazione percentuale si è basata su 10 pozzi separati con 6 campi di vista per pozzo. I dati sono mostrati come la media ± SEM. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Caratterizzazione del progenitore epatico. Al giorno 10, i progenitori epatici sono stati colorati per i marcatori epatici (A) HNF4α, (B) AFP e (C) ALB. Per H9, la percentuale di cellule positive era del 91% ± dello 0,4%, dell'89,7% ± dell'1,8% e del 30,7% ± dell'1,8% rispettivamente per HNF4α, AFP e ALB. Per P106, la percentuale di cellule positive era del 90% ± 0,2%, 86% +/- 1,2% e 27,2% ± 1,1% rispettivamente per HNF4α, AFP e ALB. (D) Il potenziale di lignaggio dei colangiociti è stato valutato tramite l'espressione di CK19; I progenitori epatici derivati da H9 hanno espresso il 78,5% ± il 3,2% di cellule CK19-positive, mentre l'83,6% ± l'1,8% delle cellule CK19-positive sono state osservate per i progenitori epatici P106. La colorazione dell'immunoglobulina G (IgG) è stata utilizzata come controllo della colorazione. La quantificazione percentuale si è basata su 10 pozzi separati con 6 campi di vista per pozzo. I dati sono mostrati come la media ± SEM. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Analisi della secrezione di proteina progenitrice epatica. La secrezione di alfa fetoproteina (AFP) e albumina (ALB) è stata analizzata in colture progenitrici epatiche al giorno 10 in H9 e P109. I dati rappresentano tre repliche biologiche e le barre di errore rappresentano la SD. Le proteine secrete sono state quantificate dal terreno di coltura 24 ore su 24 come nanogrammi di proteina secreta per mL per mg di proteina, n = 3; ND = non rilevato. Fare clic qui per visualizzare una versione più grande di questa figura.
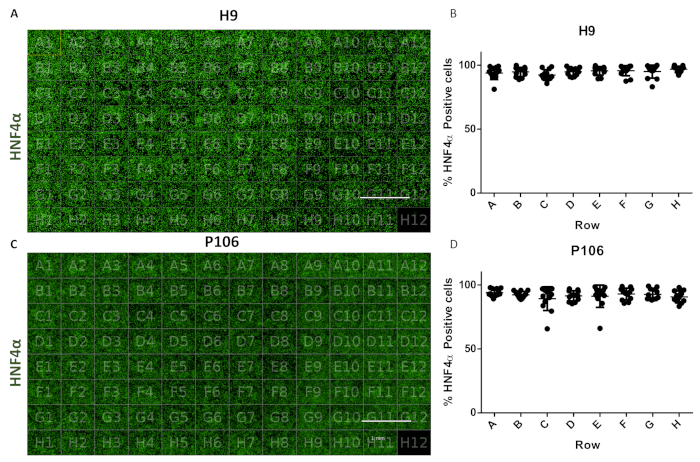
Figura 6: Valutazione della variabilità da pozzo a pozzo in 96 piastre di pozzo. (A) Visualizzazione di una vista a 96 piastre di pozzi di progenitori epatici derivati da H9 colorati con HNF4α. (B) Quantificazione delle cellule HNF4α-positive. Media del numero di celle per pozzo in righe, da sei campi di vista per pozzo quantificato. Il numero medio di cellule attraverso la piastra era del 94,81% ± 0,22 cellule SEM HNF4α-positive per pozzo. Non sono state osservate differenze statisticamente significative tra i pozzi. (C) Visualizzazione di una vista a 96 piastre di pozzo di progenitori epatici derivati da P106 colorati con HNF4α. (D) Quantificazione delle cellule HNF4α-positive. Il numero medio di celle per pozzi in righe, da sei campi di vista per pozzo e quantificato. Il numero medio di cellule attraverso la piastra era del 97,7% ± 0,57 cellule SEM HNF4α-positive per pozzo. Non sono state osservate differenze statisticamente significative tra le righe. Bene H12 è stato usato come controllo della colorazione dell'immunoglobulina G (IgG). Barra della scala = 1 mm. Sono stati impiegati ANOVA uninodi con i test statistici post-hoc di Tukey. Fare clic qui per visualizzare una versione più grande di questa figura.
| Formato piastra | Superficie (cm2) | Celle per cm2 | Celle totali per pozzo | Volume di erogazione (mL) | Concentrazione cellulare (cellule/ml) |
| Piastra a 24 pozzi | 1.9 | 210526 | 400000 | 0.5 | 800000 |
| Piastra a 96 pozzi | 0.32 | 187500 | 60000 | 0.05 | 1200000 |
Tabella 1: Densità cellulare raccomandata per i diversi formati di piastre per le linee cellulari hPSC utilizzate in questo protocollo.
Discussione
La generazione di cellule progenitrici epatiche umane da cellule staminali pluripotenti su larga scala potrebbe rappresentare un'alternativa promettente al materiale derivato dal cadavere. La standardizzazione e la riproducibilità del protocollo sono fondamentali per garantire la traduzione e l'impatto della tecnologia per la ricerca biomedica. Per affrontare questo problema, il lavoro precedente si è concentrato sullo sviluppo di un protocollo di differenziazione graduale da hESC e iPSC utilizzando additivi e matrici definiti15,23,24,25,26,27,28. In questo modo, il fenotipo e la riproducibilità degli epatociti sono stati migliorati, consentendo la semi-automazione del processo di differenziazione19. Il sistema presentato è rafforzato dalla sua combinazione con mezzi di coltura cellulare pronti all'uso e un facile sistema di differenziazione degli epatociti.
In precedenza, la densità cellulare pluripotente prima dell'inizio del protocollo di differenziazione era evidenziata come una variabile chiave per ottenere una popolazione omogenea di cellule progenitrici epatiche26. Utilizzando questa procedura più raffinata, è possibile generare un gran numero di progenitori epatici derivati da cellule staminali in modo graduale utilizzando una gamma di densità di cellule di partenza (Tabella 1). Al giorno 5, l'induzione definitiva dell'endoderma è stata convalidata dalla colorazione Sox17 (Figura 3). Una differenziazione efficiente e robusta in endoderma definitivo è stata ottenuta con entrambe le linee ESC e iPSC testate, con oltre l'80% che esprime Sox17 (Figura 3). Al giorno 10, i progenitori epatici mostravano una morfologia uniforme simile a un ciottolo e i marcatori delle cellule staminali epatiche erano altamente arricchiti sia per AFP che per HNF4α (>86%, Figura 4). Utilizzando una combinazione di tecnologie manuali e semi-automatizzate è stato possibile eseguire la differenziazione in più formati di piastra19.
Nella sua forma attuale, la differenziazione cellulare è adatta per la sperimentazione in vitro. Tuttavia, l'arricchimento cellulare sarebbe probabilmente necessario prima dell'applicazione clinica per garantire che una popolazione omogenea di progenitori epatici sia preparata per la consegna.
In conclusione, il protocollo qui descritto fornisce al campo un approccio standardizzato per produrre progenitori epatici su larga scala. Il lavoro futuro si concentrerà sulla produzione di un nuovo mezzo per la successiva differenziazione, maturazione e manutenzione HLC.
Divulgazioni
David C. Hay è co-fondatore e azionista di Stemnovate Ltd. Il resto degli autori certifica di non avere conflitti di interesse per l'argomento o i materiali discussi in questo articolo.
Riconoscimenti
Questo studio è stato supportato da premi dalla MRC Doctoral Training Partnership (MR / K501293 / 1), dalla piattaforma di medicina rigenerativa del Regno Unito (MRC MR / L022974 / 1 e MR / K026666 / 1), dall'ufficio chief scientist (TCS / 16/37).
Materiali
| Name | Company | Catalog Number | Comments |
| DPBS with Calcium and Magnesium | ThermoFisher | 14040133 | |
| Gentle cell dissociation reagent | STEMCELL Technologies | 7174 | |
| Hoechst 33342 Ready Flow Reagent | thermofisher | R37165 | |
| Human Recombinant Laminin 521 | BioLamina | LN521-02 | |
| Human Serum Albumin ELISA | Alpha Diagnostics | 1190 | |
| Human Serum Alpha Fetoprotein ELISA | Alpha Diagnostics | 500 | |
| mTeSR1 medium | STEMCELL Technologies | 5850 | |
| Operetta High-Content Imaging System | PerkinElmer | HH12000000 | |
| PBS, no calcium, no magnesium | ThermoFisher | 14190250 | |
| Penicillin-Streptomycin (10,000 U/mL) | Life Technologies | 15140122 | |
| Rho-associated kinase (ROCK)inhibitor Y27632 | Sigma-Aldrich | Y0503-1MG | |
| STEMdiff Definitive Endoderm Supplement CJ | STEMCELL Technologies | ||
| STEMdiff Definitive Endoderm Supplement MR | STEMCELL Technologies | ||
| STEMdiff Endoderm Basal Medium | STEMCELL Technologies | ||
| STEMdiff Hepatic Progenitor Medium | STEMCELL Technologies | ||
| TWEEN 20 | Sigma-Aldrich | P9416 | |
| Antibodies | |||
| Albumin | Sigma-Aldrich | A6684 | 1:200 (mouse) |
| Alpha-fetoprotein | Sigma-Aldrich | A8452 | 1:400 (mouse) |
| HNF-4α | Santa Cruz | sc-8987 | 1:400 (rabbit) |
| IgG | DAKO | 1:400 | |
| Sox17 | R&D Systems, Inc. | AF1924 | 1:200 (Goat) |
| Software | |||
| Columbus Image Data Storage and Analysis system | PerkinElmer |
Riferimenti
- Asrani, S. K., Devarbhavi, H., Eaton, J., Kamath, P. S. Burden of liver diseases in the world. Journal of Hepatology. 70 (1), 151-171 (2019).
- Szkolnicka, D., Hay, D. C. Concise Review: Advances in Generating Hepatocytes from Pluripotent Stem Cells for Translational Medicine. Stem Cells Dayton Ohio. 34 (6), 1421-1426 (2016).
- Heslop, J. A., Duncan, S. A. The Use of Human Pluripotent Stem Cells for Modeling Liver Development and Disease. Hepatology. 69 (3), 1306-1316 (2019).
- Alwahsh, S. M., Rashidi, H., Hay, D. C. Liver cell therapy: is this the end of the beginning. Cell and Molecular Life Sciences. 75 (8), 1307-1324 (2018).
- Hay, D. C., et al. Efficient differentiation of hepatocytes from human embryonic stem cells exhibiting markers recapitulating liver development in vivo. Stem Cells Dayton Ohio. 26 (4), 894-902 (2008).
- Si-Tayeb, K., et al. Highly efficient generation of human hepatocyte-like cells from induced pluripotent stem cells. Hepatology. 51 (1), 297-305 (2010).
- Hannan, N. R. F., Segeritz, C. -. P., Touboul, T., Vallier, L. Production of hepatocyte-like cells from human pluripotent stem cells. Nature Protocols. 8 (2), 430-437 (2013).
- Basma, H., et al. Differentiation and transplantation of human embryonic stem cell-derived hepatocytes. Gastroenterology. 136 (3), 990-999 (2009).
- Meseguer-Ripolles, J., Khetani, S. R., Blanco, J. G., Iredale, M., Hay, D. C. Pluripotent Stem Cell-Derived Human Tissue: Platforms to Evaluate Drug Metabolism and Safety. The AAPS Journal. 20 (1), 20 (2017).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Developmental Cell. 18 (2), 175-189 (2010).
- D'Amour, K. A., et al. Efficient differentiation of human embryonic stem cells to definitive endoderm. Nature Biotechnology. 23 (12), 1534-1541 (2005).
- Shin, D., et al. Bmp and Fgf signaling are essential for liver specification in zebrafish. Development Cambridge England. 134 (11), 2041-2050 (2007).
- DeLaForest, A., et al. HNF4A is essential for specification of hepatic progenitors from human pluripotent stem cells. Development Cambridge England. 138 (19), 4143-4153 (2011).
- Baxter, M., et al. Phenotypic and functional analyses show stem cell-derived hepatocyte-like cells better mimic fetal rather than adult hepatocytes. Journal of Hepatology. 62 (3), 581-589 (2015).
- Cameron, K., et al. Recombinant Laminins Drive the Differentiation and Self-Organization of hESC-Derived Hepatocytes. Stem Cell Reports. 5 (6), 1250-1262 (2015).
- Szkolnicka, D., et al. Reducing Hepatocyte Injury and Necrosis in Response to Paracetamol Using Noncoding RNAs. Stem Cells Translational Medicine. 5 (6), 764-772 (2016).
- Domogatskaya, A., Rodin, S., Boutaud, A., Tryggvason, K. Laminin-511 but Not -332, -111, or -411 Enables Mouse Embryonic Stem Cell Self-Renewal In Vitro. Stem Cells. 26 (11), 2800-2809 (2008).
- Kanninen, L. K., et al. Laminin-511 and laminin-521-based matrices for efficient hepatic specification of human pluripotent stem cells. Biomaterials. 103, 86-100 (2016).
- Meseguer-Ripolles, J., Lucendo-Villarin, B., Wang, Y., Hay, D. C. Semi-automated Production of Hepatocyte Like Cells from Pluripotent Stem Cells. Journal of Visualized Experiments. (137), e57995 (2018).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biology. 7, 100 (2006).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Raven, A., et al. Cholangiocytes act as Facultative Liver Stem Cells during Impaired Hepatocyte Regeneration. Nature. 547 (7663), 350-354 (2017).
- Hay, D. C., et al. Unbiased screening of polymer libraries to define novel substrates for functional hepatocytes with inducible drug metabolism. Stem Cell Research. 6 (2), 92-102 (2011).
- Medine, C. N., et al. Developing High-Fidelity Hepatotoxicity Models from Pluripotent Stem Cells. Stem Cells Translational Medicine. 2 (7), 505-509 (2013).
- Szkolnicka, D., et al. Accurate prediction of drug-induced liver injury using stem cell-derived populations. Stem Cells Translational Medicine. 3 (2), 141-148 (2014).
- Wang, Y., et al. Defined and Scalable Generation of Hepatocyte-like Cells from Human Pluripotent Stem Cells. Journal of Visualized Experiments. (121), e55355 (2017).
- Villarin, B. L., et al. Polymer Supported Directed Differentiation Reveals a Unique Gene Signature Predicting Stable Hepatocyte Performance. Advanced Healthcare Materials. 4 (12), 1820-1825 (2015).
- Wang, Y., et al. Multiomics Analyses of HNF4α Protein Domain Function during Human Pluripotent Stem Cell Differentiation. iScience. 16, 206-217 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon